Similar presentations:
Оксиды
1. Классификация и номенклатура неорганических веществ
-Простые и сложные вещества-Оксиды
-Основания
-Кислоты
-Соли
2. Простые вещества
вещества, образованныеатомами одного химического
элемента
например водород, кислород, аргон, бром,
магний, азот, золото.
3. Простые вещества делятся на
Простые вещества делятся наМеталлы
Неметаллы
4.
5. Сложные вещества
вещества, которые состоятиз атомов двух или
нескольких химических
элементов.
6. Сложные неорганические вещества обычно делят на четыре класса:
оксиды;основания (гидроксиды);
кислоты;
соли.
7.
Химические свойстваСпособы получения
900igr.net
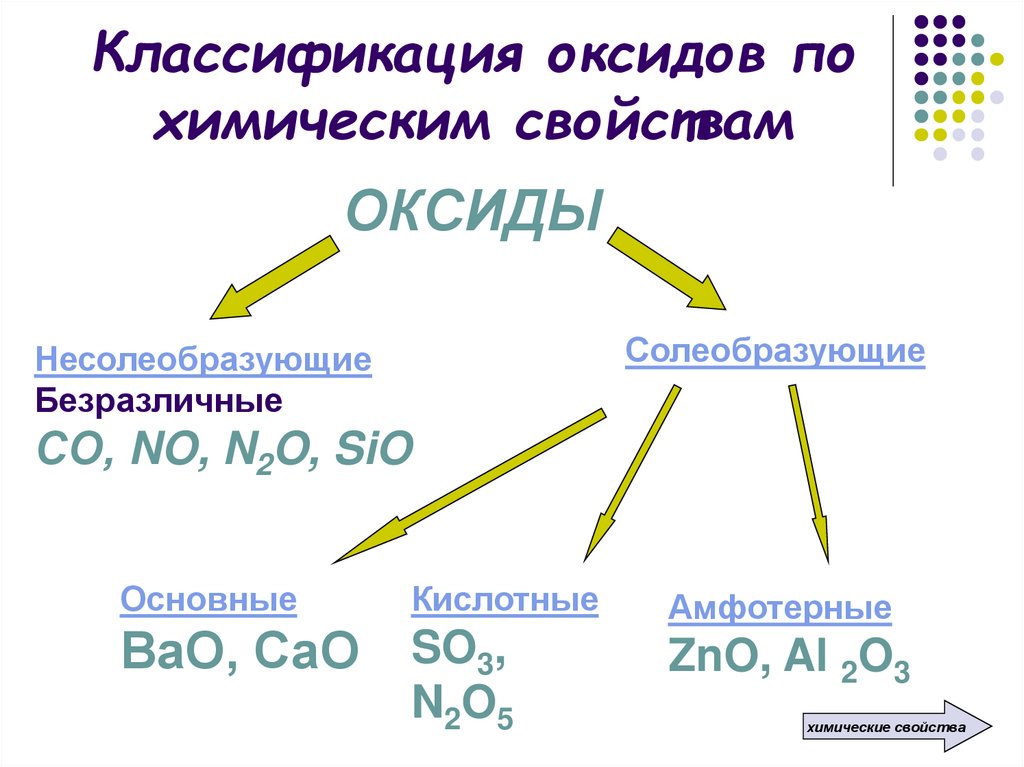
8. Классификация оксидов по химическим свойствам
ОКСИДЫСолеобразующие
Несолеобразующие
Безразличные
СО, NO, N2O, SiO
Основные
Кислотные
ВаО, СаО SO3,
N 2O 5
Амфотерные
ZnO, Al 2O3
химические свойства
9. Несолеобразующие оксиды – это оксиды, которые не взаимодействуют ни с кислотами, ни с основаниями и не образуют солей
СО, NO, N2O, SiO10. Солеобразующие оксиды – это оксиды, которые взаимодействуют с кислотами или со щелочами с образованием солей и воды
11. Основные оксиды – это оксиды, которым в качестве гидроксидов соответствуют основания
Образованы металлами встепени окисления +1, +2
К2О → КОН
MgO → Mg(OH)2
12. Кислотные оксиды – это оксиды, которым в качестве гидроксидов соответствуют кислоты
Образованы неметаллами и металлами встепени окисления +5 и выше
SО3 → Н2SО4
13. Амфотерные оксиды – это оксиды, которым соответствуют гидроксиды, проявляющие свойства как оснований, так и кислот
Образованы металлами в степениокисления +3, +4, а также оксиды
ВеО, ZnO, SnO, PbO
ZnO → Zn(OH)2 или Н2ZnО2
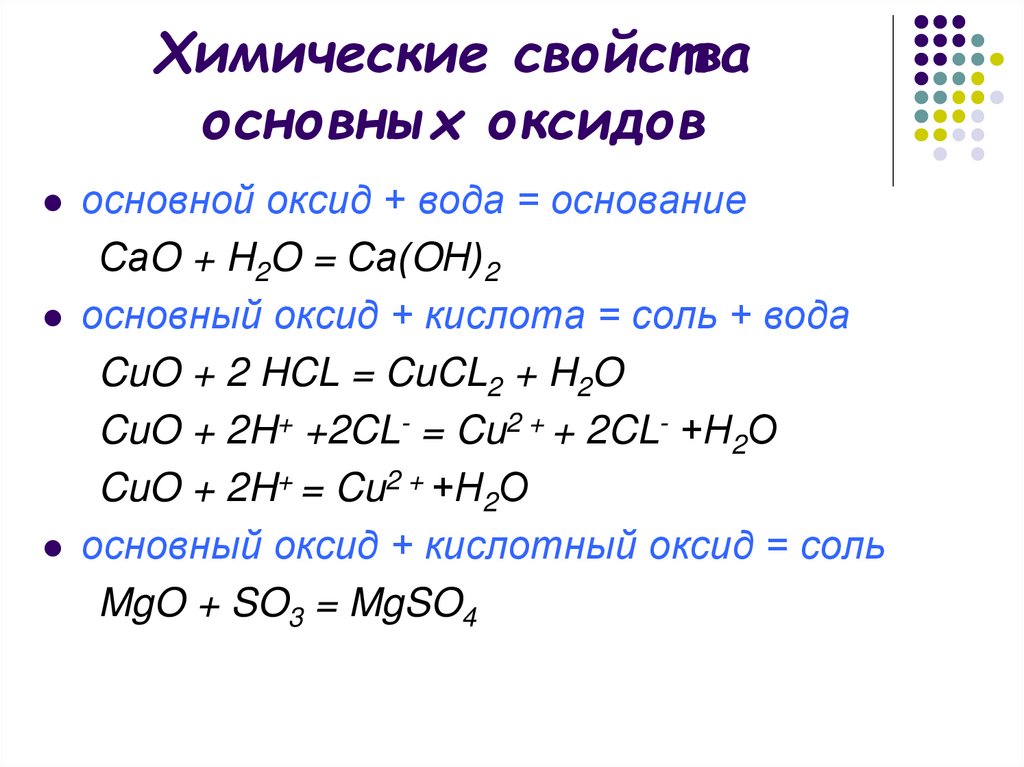
14. Химические свойства основных оксидов
основной оксид + вода = основаниеСаO + H2O = Са(OН)2
основный оксид + кислота = соль + вода
CuO + 2 HCL = CuCL2 + H2O
CuO + 2H+ +2CL- = Cu2 + + 2CL- +Н2О
CuO + 2H+ = Cu2 + +Н2О
основный оксид + кислотный оксид = соль
MgO + SO3 = MgSO4
15. Химические свойства кислотных оксидов
кислотный оксид + вода = кислотаР2O5 + 3H2O = 2H3РO4
кислотный оксид + основание = соль + вода
CO2 + Mg(OН)2= MgCO3 + H2O
CO2 + Mg+ +2OН- = MgCO3 + Н2О
кислотный оксид + основный оксид = соль
SO3 + MgO = MgSO4
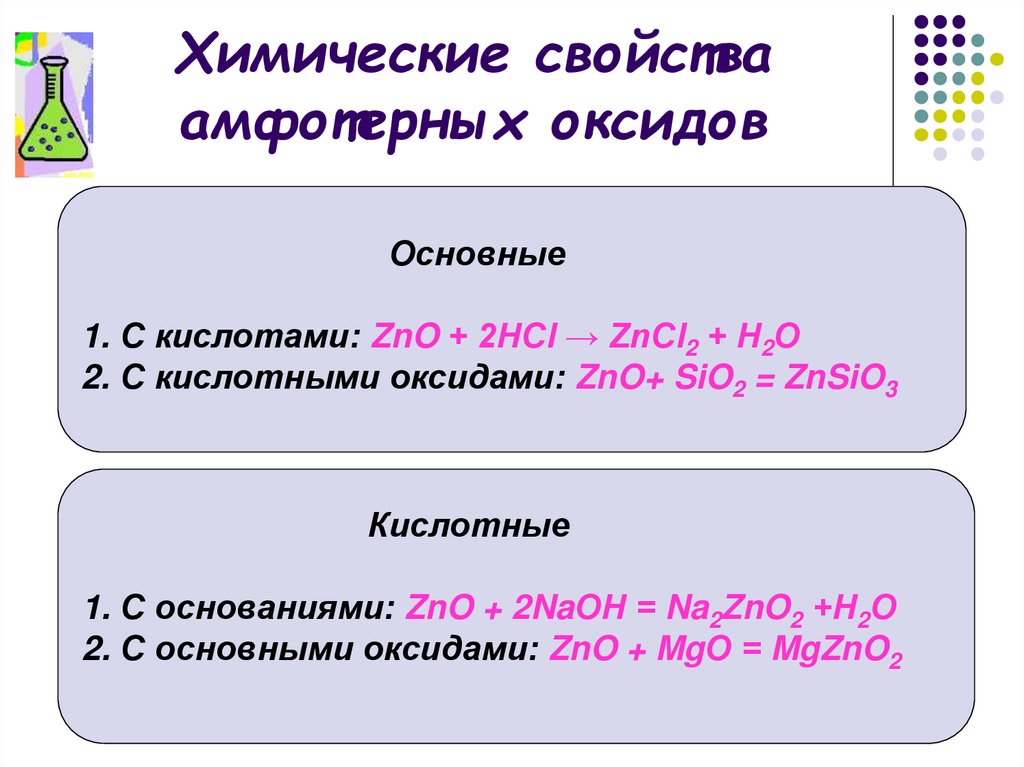
16. Химические свойства амфотерных оксидов
Основные1. С кислотами: ZnO + 2НСl → ZnСl2 + Н2О
2. С кислотными оксидами: ZnO+ SiO2 = ZnSiO3
Кислотные
1. С основаниями: ZnO + 2NaОН = Na2ZnO2 +Н2О
2. С основными оксидами: ZnO + MgО = MgZnO2
17. Способы получения оксидов
Горение сложных веществ:СН4 + 2О2 = СО2 + 2Н2О
Горение простых веществ:
2Mg + О2 = 2MgО
Разложение сложных веществ:
1. Нерастворимых оснований
Cu(OН)2=CuО + H2O
2. Некоторых кислот
H2SiO3 = SiO2 + H2O
3. Некоторых солей
СаСО3= СО2 + Н2О













 chemistry
chemistry








