Similar presentations:
Лекція_№13_Загальна_характеристика_металічних_елементів_та_металів
1.
Лекція № 13Тема: Загальна
характеристика металічних
елементів та металів.
2.
Тема: Загальна характеристика металічнихелементів та металів.
План викладання лекційного матеріалу:
1. Класифікація металів.
2. Розташування металічних елементів в періодичній системі.
3. Поширеність металічних елементів у природі.
4. Фізичні властивості металів.
5. Внутрішня будова металів.
6. Хімічні властивості металів.
7. Оксиди та гідроксиди металів.
8. Одержання металів із руд.
3.
Метали (від грец. métallon — шахта,кар'єр, добування з надр землі) —
клас хімічних елементів і речовин з
наступними хімічними і фізичними
властивостями:
добре проводять електрику і тепло,
непрозорі, але можуть відбивати
світло (мають металічний блиск);
ковкі, що дозволяє надавати
виробам з них потрібної форми і
розвальцьовувати у плоскі
пластинки,
пластичні, що дає можливість
витягати їх у тонкий дріт.
4.
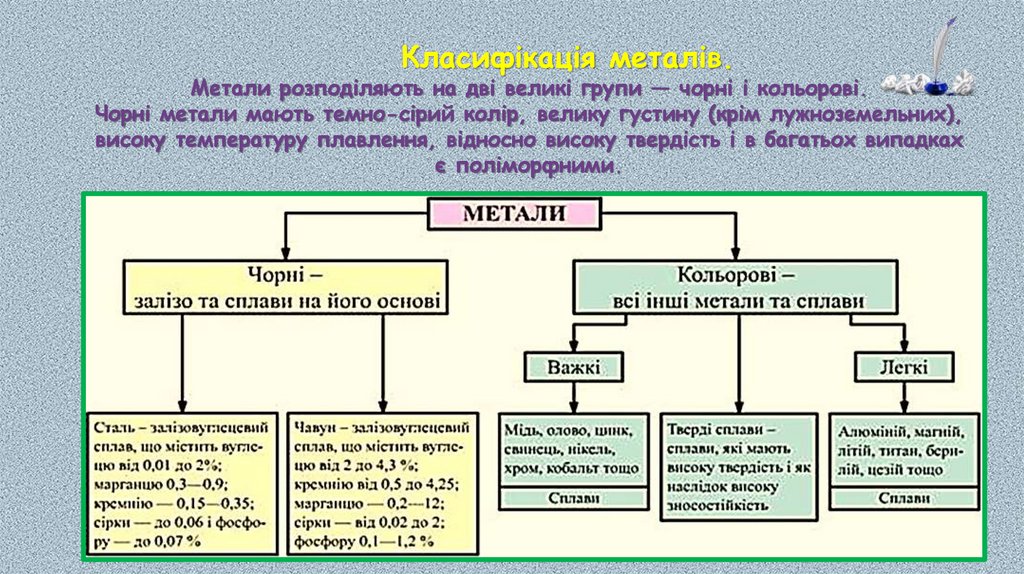
Класифікація металів.Метали розподіляють на дві великі групи — чорні і кольорові.
Чорні метали мають темно-сірий колір, велику густину (крім лужноземельних),
високу температуру плавлення, відносно високу твердість і в багатьох випадках
є поліморфними.
5.
1.Залізні метали —залізо, кобальт, нікель (феромагнетики) і близький
до них за властивостями марганець. Кобальт, нікель і марганець
використовують як додатки до сплавів заліза, а також як основи для
відповідних сплавів, які мають властивості високолегованих сталей.
2. Тугоплавкі метали — температура плавлення яких вища, за
температуру плавлення заліза (1536°С) (наприклад, молібден,
вольфрам). їх використовують як додатки до легованих сталей, а також
як основи для відповідних сплавів.
3. Уранові метали — актиноїди, використовують в сплавах для
атомної енергетики.
4. Рідкісноземельні метали - лантан, церій, неодим, празеодим та
інші лантаноїди, а також схожі на них за властивостями ітрій і скандій.
Ці метали мають близькі хімічні, але різні фізичні властивості.
Застосовуються як присадки до сплавів інших елементів.
5. Лужні та лужноземельні метали у вільному стані не
використовують, за виключенням спеціальних випадків (наприклад. як
теплоносії в атомних реакторах).
6.
Кольорові метали частіше всього мають характерне забарвлення:червоне, жовте, біле; значну пластичність, малу твердість, відносно
низьку температуру плавлення. Крім цього, у них відсутній
поліморфізм.
Кольорові метали поділяють на:
1. Легкі метали — берилій, магній,
алюміній, які мають малу густину.
2. Благородні метали — срібло, золото,
метали платинової групи (платина, паладій,
іридій, осмій, родій та рутеній). До них
можна віднести також «напівблагородну»
мідь. Усі ці метали стійкі до корозії.
3. Легкоплавкі метали — цинк, кадмій,
ртуть, олово, свинець, вісмут, калій, сурма
та елементи з ослабленими металічними
властивостями — галій, германій.
Пластинки, виготовлені
з різних металів:
а — міді;
б — алюмінію;
в — золота;
г — цинку
7.
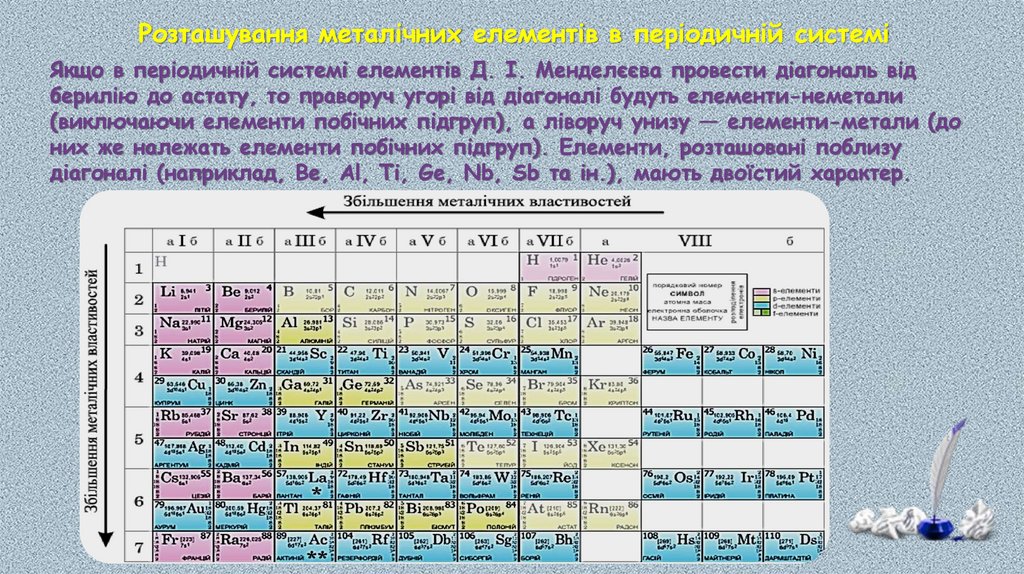
Розташування металічних елементів в періодичній системіЯкщо в періодичній системі елементів Д. І. Менделєєва провести діагональ від
берилію до астату, то праворуч угорі від діагоналі будуть елементи-неметали
(виключаючи елементи побічних підгруп), а ліворуч унизу — елементи-метали (до
них же належать елементи побічних підгруп). Елементи, розташовані поблизу
діагоналі (наприклад, Be, Аl, Ті, Ge, Nb, Sb та ін.), мають двоїстий характер.
8.
9.
Зі 118 хімічних елементів, відкритих на даний момент (з нихне все офіційно визнані), до металічних відносять:
6 елементів в групі лужних металів (Li, Na, K, Rb, Cs, Fr),
4 в групі лужноземельних металів (Ca, Sr, Ba, Ra),
40 в групі перехідних металів,
6 в групі легких металів (Al, Ga, In, Sn, Tl, Ti),
7 в групі напівметалів (B, Si, Ge, As, Sb, Te, Po),
14 в групі лантаноїди + лантан,
14 в групі актиноїди (фізичні властивості вивчені не у всіх елементів) +
актиній,
поза певних груп берилій і магній.
Таким чином, до металічних, можливо, відноситься 96 елементів з усіх
відкритих.
10.
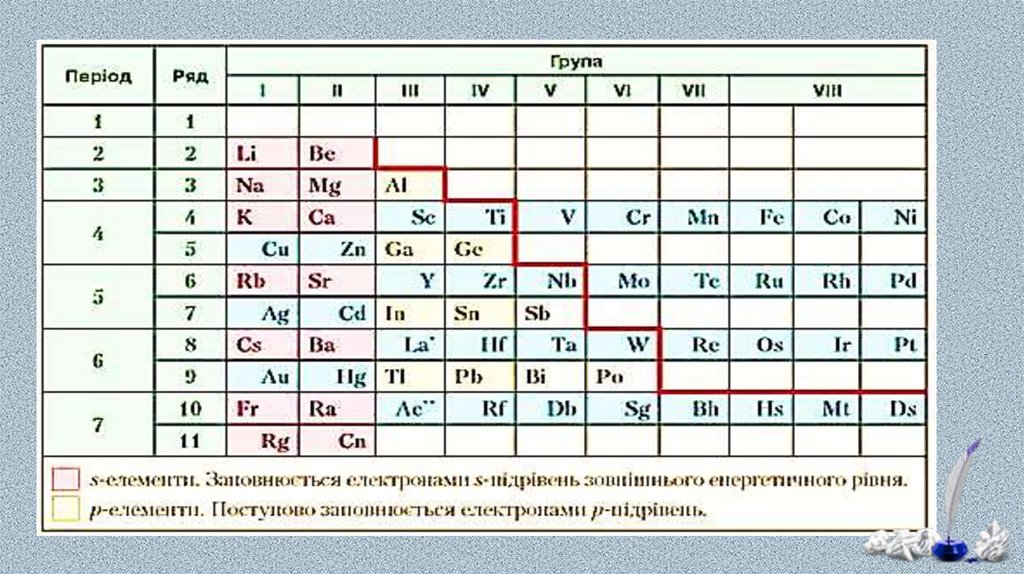
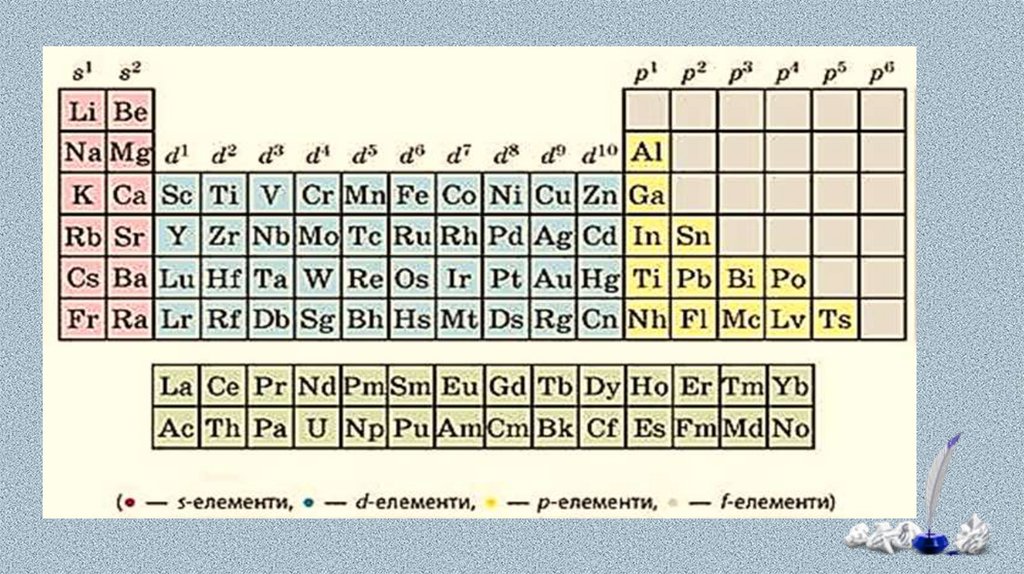
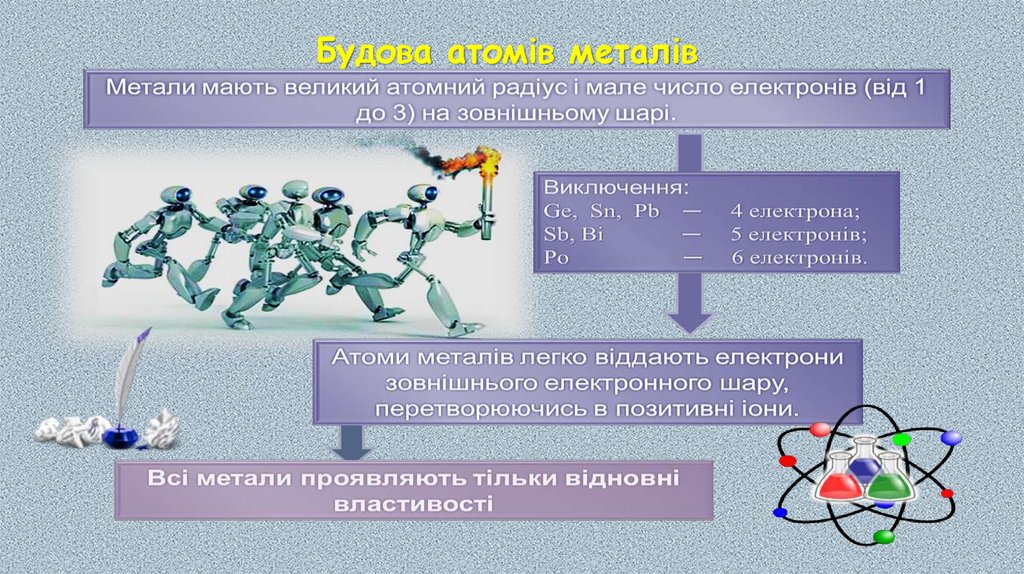
В атомів металічних елементів на зовнішньомуенергетичному рівні міститься невелике число електронів:
у s-елементів — один або два;
у p-елементів по-різному:
в елементів 3-5 періодів — по 3-4 електрони,
в елементів 6-7 періодів значно більше, але через значне
віддалення від ядра вони слабко притягуються до нього.
у d-елементів — два (як виняток — один);
Атоми металічних елементів у хімічних взаємодіях лише віддають
електрони та, як наслідок, набувають стійкої електронної
конфігурації атомів найближчого інертного елемента.
Отже, метали в хімічних реакціях є виключно відновниками.
У цьому полягає їх принципова відмінність від неметалів.
11.
12.
Будова атомів металів13.
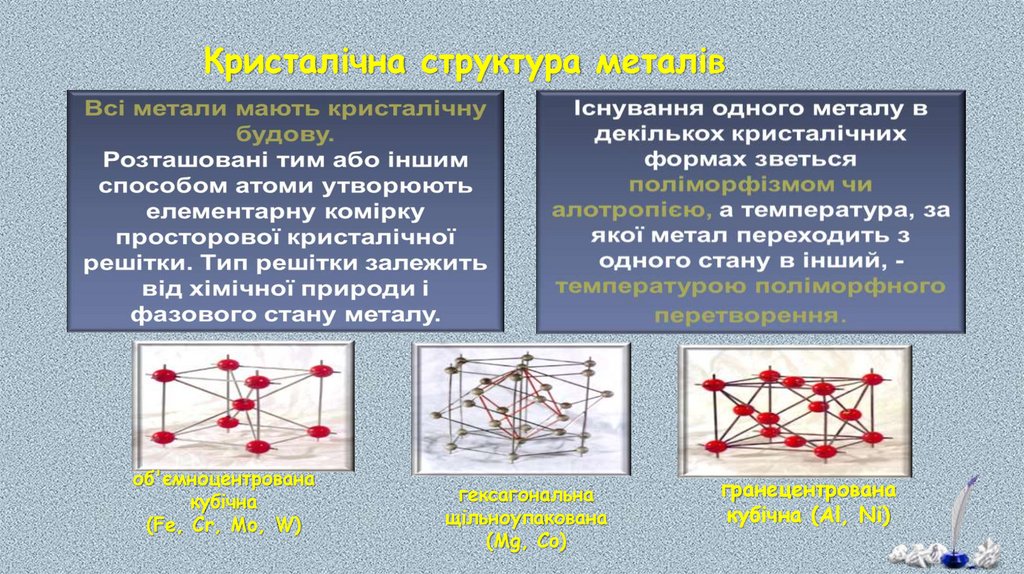
Кристалічна структура металівоб'ємноцентрована
кубічна
(Fe, Cr, Mo, W)
гексагональна
щільноупакована
(Mg, Co)
гранецентрована
кубічна (Al, Ni)
14.
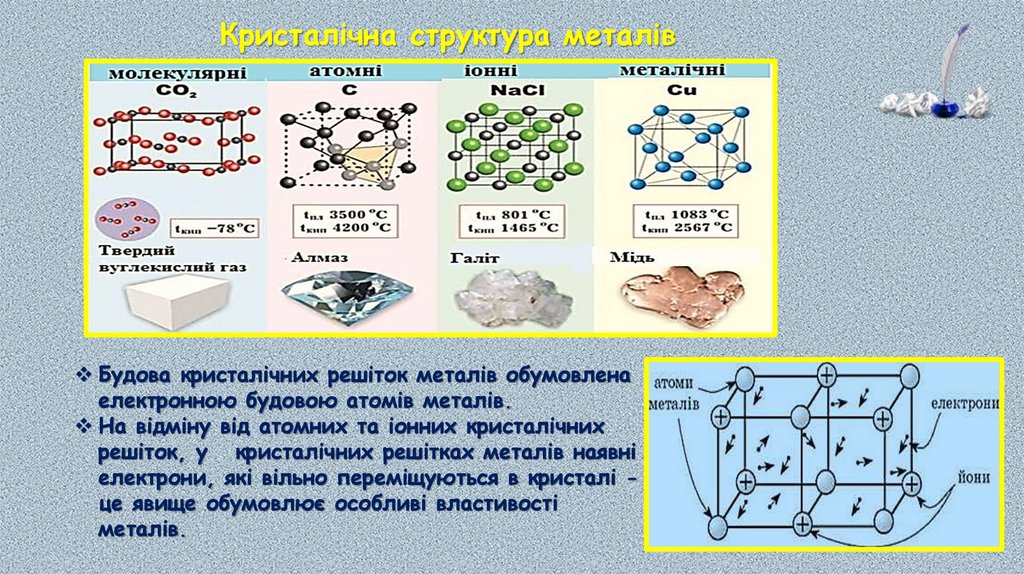
Кристалічна структура металівБудова кристалічних решіток металів обумовлена
електронною будовою атомів металів.
На відміну від атомних та іонних кристалічних
решіток, у кристалічних решітках металів наявні
електрони, які вільно переміщуються в кристалі це явище обумовлює особливі властивості
металів.
15.
Фізичні властивості металівВсі метали за звичайних умов тверді речовини, окрім ртуті.
Найм'якший - калій
Найтвердіший - хром
16.
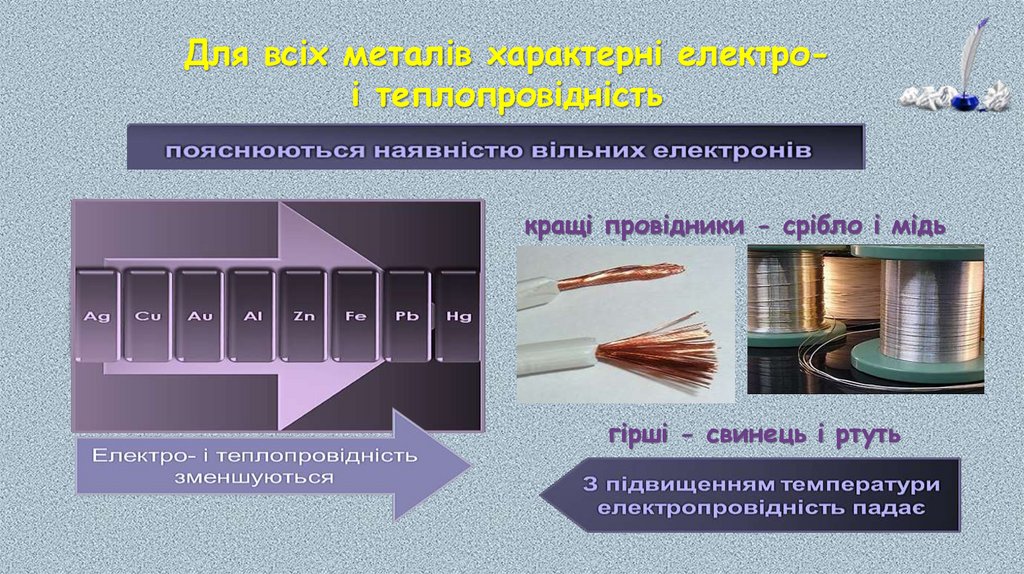
Для всіх металів характерні електроі теплопровідністькращі провідники - срібло і мідь
гірші - свинець і ртуть
17.
Для всіх металів характерний металічний блискобумовлюється їх здатністю
сильно відбивати промені світла;
спостерігається звичайно
тільки в тому випадку,
коли метал утворить
суцільну компактну масу;
магній і алюміній
зберігають свій блиск,
навіть будучи
перетвореними в порошок.
18.
Характерною властивістю металів є такожпластичність
Багато металів пластичні, тобто можуть змінювати форму без
руйнування, наприклад, розплющуватися від удару молотом.
Найбільш пластичними є золото, срібло, мідь, олово. Їх
можна розкатувати в тонку фольгу.
Прокаткою можна одержати шари золота завтовшки декілька
атомів. Саме такі золоті лусочки використав Резерфорд під
час дослідження будови атома. Зовні вони нагадують
напівпрозору зеленувату плівку, що пропускає світло.
Ще за часів Київської Русі найтоншу золоту
фольгу (сухозлітне золото) застосовували для
золочення виробів із деревини і кераміки.
Тонким золотом прикрашали рукописні книги
та ікони.
Зі злитка золота масою лише 1 г можна
витягнути дріт завдовжки майже 3 км або
виготовити лист фольги площею 1 м2.
19.
Густина металів змінюються в широких межахЛегкі:
густина менш як 5 г/см3
Найлегший - літій
Метали дуже різняться за густиною.
Найменша густина в лужних металів:
літію, натрію і калію.
Літій навіть спливає на поверхню гасу,
густина якого менша за густину води.
Наприклад, ртуть має густину 13,6
г/см3, тобто літрова банка, заповнена
ртуттю, важить 13,6 кг!
Важкі:
густина понад 5 г/см3
Найважчий - осмій
Осмій має густину в 42 рази більшу, ніж літій
20.
У великих інтервалах змінюються температуриплавлення металів.
Найбільша – у вольфраму (3420 °С)
Найменша — у ртуті (—38,9 °С)
21.
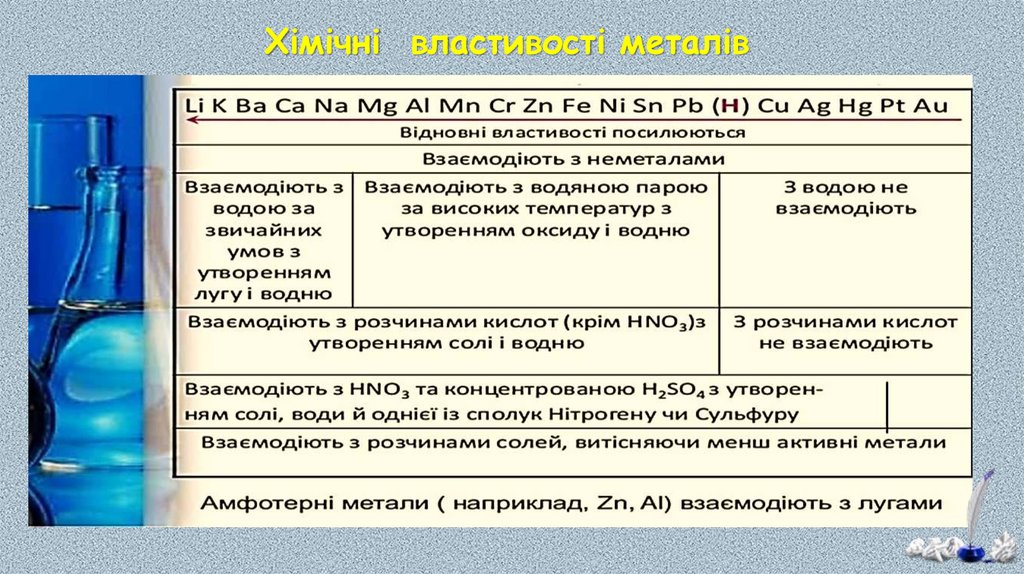
Хімічні властивості металів22.
Взаємодія металів з киснем:2Na + О2 = Na2О2
Naº-1е → Na⁺
O2 + 2е→ 2O‾1
2
2 відновник, п-с окислення
1 окисник, п-с відновлення
2Сu+ О2 = 2СuО
Сuº -2е → Cu+2
O2 + 4е→2O‾2
2
1 відновник, п-с окислення
2 окисник, п-с відновлення
23.
Взаємодія металів з водою:2Na + 2Н2О = 2NaОН + Н2
↑
2
2 відновник, п-с окислення
1 окисник, п-с відновлення
2Al + 3Н2О = AL2О3 + 3Н2↑
6
2 відновник, п-с окислення
3 окисник, п-с відновлення
24.
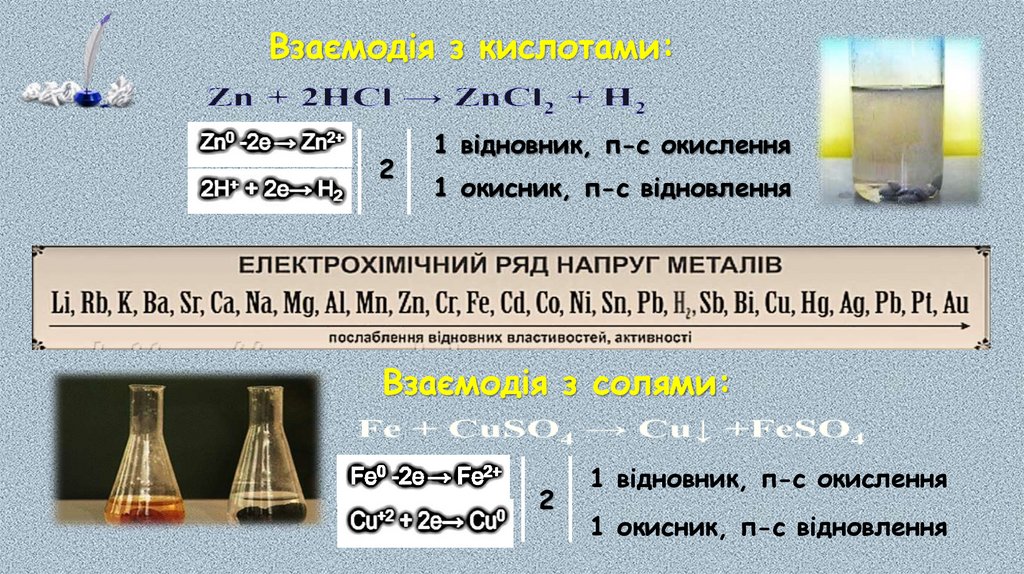
Взаємодія з кислотами:2
1 відновник, п-с окислення
1 окисник, п-с відновлення
Взаємодія з солями:
2
1 відновник, п-с окислення
1 окисник, п-с відновлення
25.
Оксиди та гідроксиди металівБільшість металів, за виключенням благородних, безпосередньо взаємодіють з
киснем із утворенням оксидів.
Хімічні властивості оксидів визначаються залежно від положення металу в
періодичній системі.
У головних підгрупах періодичної системи Д. І. Менделєєва із зростанням
порядкового номера елемента збільшується атомний радіус, посилюється
основний характер оксидів і гідроксидів.
У побічних підгрупах атомний радіус як правило зменшується, що призводить до
послаблення основних властивостей оксидів і гідроксидів.
У межах періоду посилюються їх кислотні властивості.
У металів, які проявляють у сполуках різні ступені окиснення, з їх збільшенням
посилюються кислотні властивості сполук.
Наприклад, СrО — основний, Сr2О3 — амфотерний, СrО3 — кислот ний оксид.
Хімічні зв'язки між металом і киснем в основних оксидах та гідроксидах іонні,
або ковалентні полярні, у кислотних — ковалентні
26.
Вміст металів у земній корі27.
Метали у природі:Платина
Метеоритне
залізо
Золото
Срібло
Мідь
Паладій
Осмій
Ртуть
28.
Руди металівХлорид натрію
Сульфідна руда
Червоний залізняк
Хромна руда
Халькопірит
Залізний
колчедан
Боксити
Нікелева руда
29.
Металургія наука про методи і процесивиробництва металів із їх руд.
Таку ж назву має галузь
важкої промисловості
30.
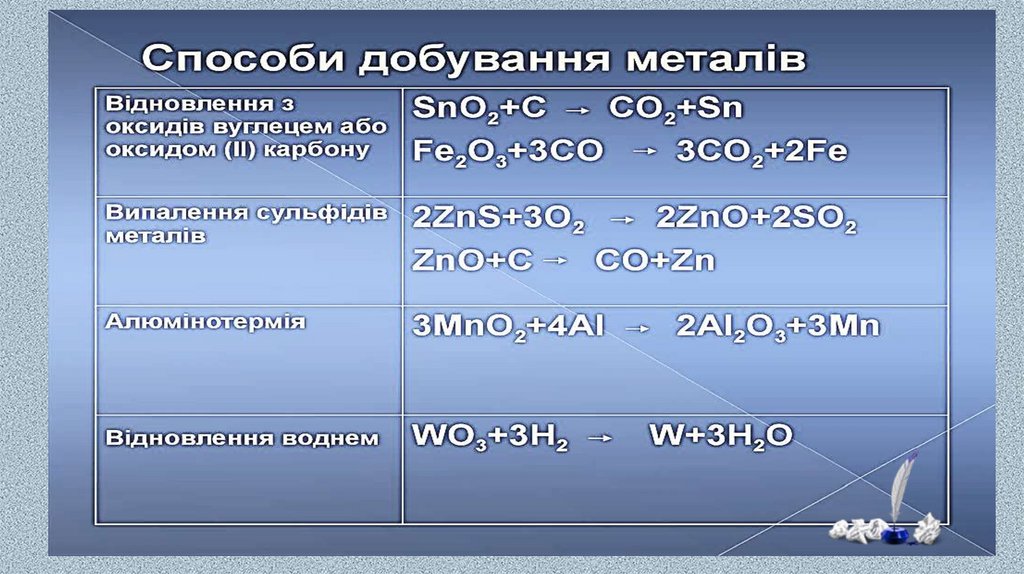
Процес відновлення металів із руди при високійтемпературі за допомогою відновників називається
пірометалургією.
Карботермія — відновлення оксидів металів вуглецем. За допомогою
цього методу одержують більшість металів електронного сімейства
(Fe, Cu, Zn, Mn, Co, Ni),
MeO + C = Me + CO
Незважаючи на те, що вуглець (у вигляді коксу) може бути
потенційним відновником оксидів майже усіх металів, існують причини,
які перешкоджають його широкому використанню.
Відновлення воднем.
Водень є порівняно м'яким відновником. За його допомогою
одержують такі метали як Mo, W, Re і т. п.
WО3 + 3Н2 = W + 3Н2О
При цьому метали найчастіше утворюються у дрібнодисперсному стані
та мають високу реакційну здатність.
31.
Металотермія — витиснення більш активними металами (А1, Mg) меншактивних з їх сполук (оксидів, галогенідів, сульфідів).
Процес відновлення оксидів цих металів алюмінієм, який
супроводжується виділенням великої кількості тепла, називають
алюмотермією:
Сr2О3 + 2Аl = 2Сr +А12О3
Гідрометалургія — вилучення металів із руд і концентратів за
допомогою хімічних реагентів з послідуючим виділенням металів з
розчинів. Наприклад, одержання золота або срібла ціанідним
способом:
4Au + 8KCN + О2 + 2Н2О = 4K[Au(CN)2] + 4KOH
2K[Au(CN)2] + Zn = 2Au + K2[Zn(CN)4]
Електрометалургія — катодне відновлення металів при електролізі
розчинів і розплавів їх солей. Найбільш активні метали ІА та ІІА
груп одержують електролізом розплавів солей або гідроксидів.
Малоактивні метали — електролізом водних розчинів солей
32.
33.
Література:Основна:
1.Попель П. П. Хімія: підруч. для 11 кл. закладів загальної середньої освіти
(рівень стандарту) / П. П. Попель, Л. С. Крикля. — Київ: ВЦ «Академія»,
2018.
2. Чернобельська Г.М., Чертков И.Н. Хімія – М.: Медицина, 19933. Сухан В.В.,
Табунська Т.В., ін. Хімія (посібник для вступників до ВУЗів) – К.: Либідь 1993.
3. Електронний підручник з хімії: https://sites.google.com/view/allhemi/ №40
(тест)
№40 (тест)
https://zno.osvita.ua/chemistry/tag-metalichni_elementi_ta_metali/
Додаткова:
1. Луцевич Д.Д., Березан О.В. Конспект – довідник з хімії. – К.: Вища школа
1997.
2. Ярошенко О.Г., Новицька В.І. Збірник задач і вправ з хімії. – К.: Станіца
1996.
3. Буринська Н.М. Основи загальної хімії. 11 клас. 1997.






















 chemistry
chemistry








