Similar presentations:
БИО_ХЕМИЛЮМ_ИНТЕРАКТИВ 20_10_25
1. Биолюминесценция и хемилюминесценция
1. Определение явления2. Механизмы биолюминесценции и
хемилюминесценции
3. Способы регистрации
4. Практическое значение
2.
БИОЛЮМИНЕСЦЕНЦИЯ видимое свечениенекоторых живых
организмов.
Озеро Гиппсленд в
Австралии
Это явление широко
распространено в природе и
наблюдается у бактерий,
грибов, некоторых животных
(жгутиконосцев,
кишечнополостных,
головоногих моллюсков,
ракообразных, оболочников,
насекомых, рыб).
3.
РАСПРОСТРАНЕННОСТЬБИОЛЮМИНЕСЦЕНЦИИ В ЖИВОЙ
ПРИРОДЕ
4.
ФУНКЦИОНАЛЬНАЯ РОЛЬБИОЛЮМИНЕСЦЕНЦИИ
защита
коммуникация
нападение
охота
5. БИОЛЮМИНЕСЦЕНЦИЯ СВЕТЛЯКОВ
6.
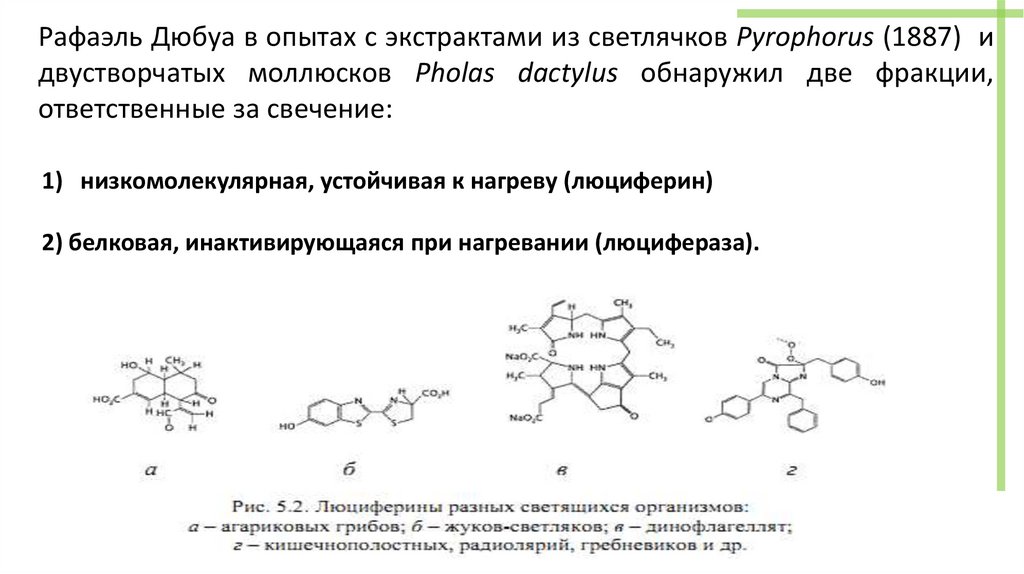
Рафаэль Дюбуа в опытах с экстрактами из светлячков Pyrophorus (1887) идвустворчатых моллюсков Pholas dactylus обнаружил две фракции,
ответственные за свечение:
1) низкомолекулярная, устойчивая к нагреву (люциферин)
2) белковая, инактивирующаяся при нагревании (люцифераза).
7.
Цикл преобразований в ходе биолюминесцентной реакции1.
Образование
промежуточных
комплексов (интермедиатов).
фермент-субстратных
2.
Элементарный акт возбуждения и переход интермедиата в
эмиттер.
3.
Испускание кванта света.
4.
Возвращение люциферазы в исходное состояние.
8.
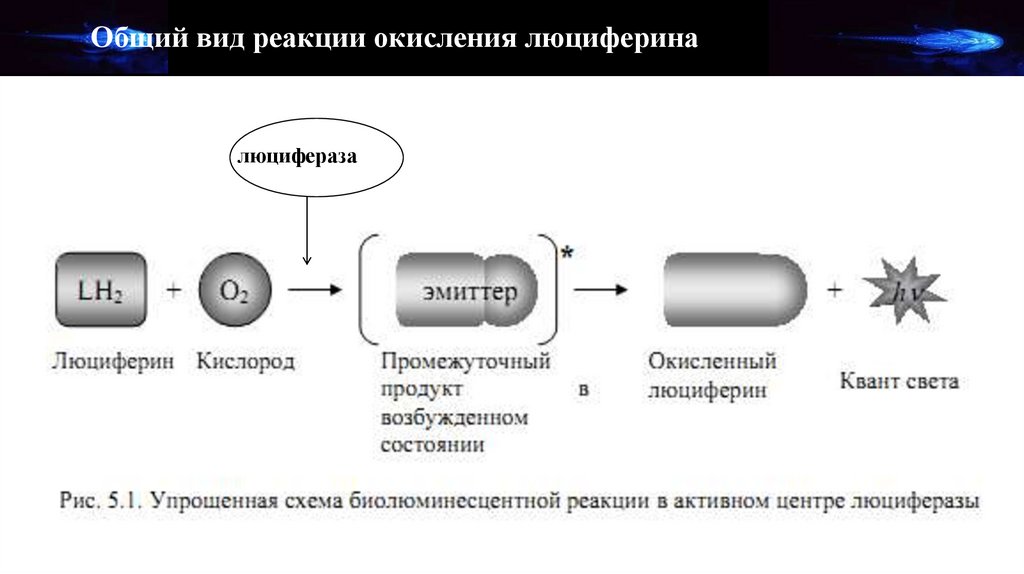
Общий вид реакции окисления люцифериналюцифераза
9.
В присутствииО2 и Mg2+
E + LH2 + ATP → E-LH2-AMP + ПФ
E-LH2-AMP → E + P + AMP + фотон
Здесь AMP - аденозинмонофосфат, ПФ - пирофосфат, E люцифераза, LH2 - люциферин, P - продукт реакции
(оксилюциферин) в основном состоянии.
10.
В процессе обмена веществосвобождённая энергия АТФ в
присутствии кислорода при наличии
Мg2+ и фермента люциферазы
активизирует люциферин, в котором
возникает электронное возбуждение с
излучением энергии в виде света.
11.
Особенности биолюминесцентных реакций:1. Для реакции необходим молекулярный кислород.
2. Люциферины - это хорошо флуоресцирующие соединения, которые
характеризуются
сходными
спектрально-люминесцентными
свойствами.
3. Протекают при участии люциферазы.
4. Излучение биолюминесценции происходит с возбужденного
промежуточного фермент-субстратного комплекса (эмиттера).
12.
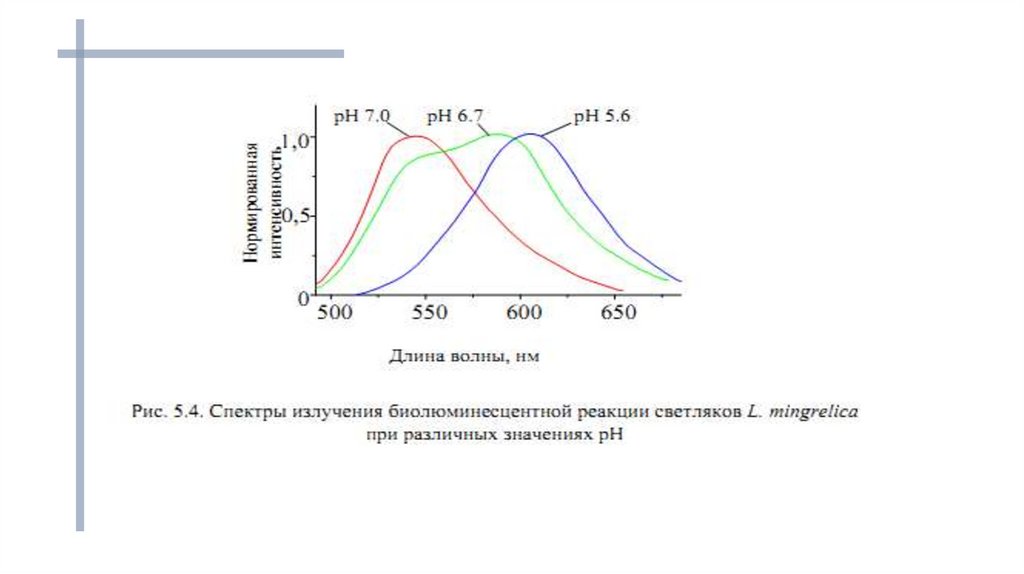
Максимум в спектре излучения в биолюминесцентныхпроцессах может изменяться в зависимости от условий
протекания реакции.
Например, несмотря на то, что химизм
биолюминесценции жуков-светляков одинаков и
структуры люциферина и оксилюциферина различных
видов идентичны, цвет свечения может варьировать от
зелёного до красного, то есть максимум в спектре
излучения может меняться от 490 до 622 нм.
13.
14.
Квантовые выходы биолюминесценцииочень высоки и достигают значений 0.1-1.
Длина волны света, излучаемого при биолюминесцентных
процессах, зависит от разности энергий основного и
возбуждённого состояний окислённых форм люциферинов
и связана с ней отношением ΔE = hν, полуширина полосы
излучения составляет обычно ~50 нм.
15.
Биолюминесценция светящихся бактерий.ФМН-Н2 + Е + О2 = Е-ФМН-Н2-ООН
Е-ФМН-Н2-ООН + RCHO = RСОН-Е-ФМН-Н2-ООН
RСОН-Е-ФМН-Н2-ООН = RCOOH + Е-ФМН-НОН*
RCOOH + Е-ФМН-НОН* = RCOOH + Е + ФМН + Н20 + hν (490 нм)
Е - люцифераза, ООН - гидроперекисная группа, RCOH - алифатический альдегид, RCOOH жирная кислота, образующаяся при окислении альдегида.
16.
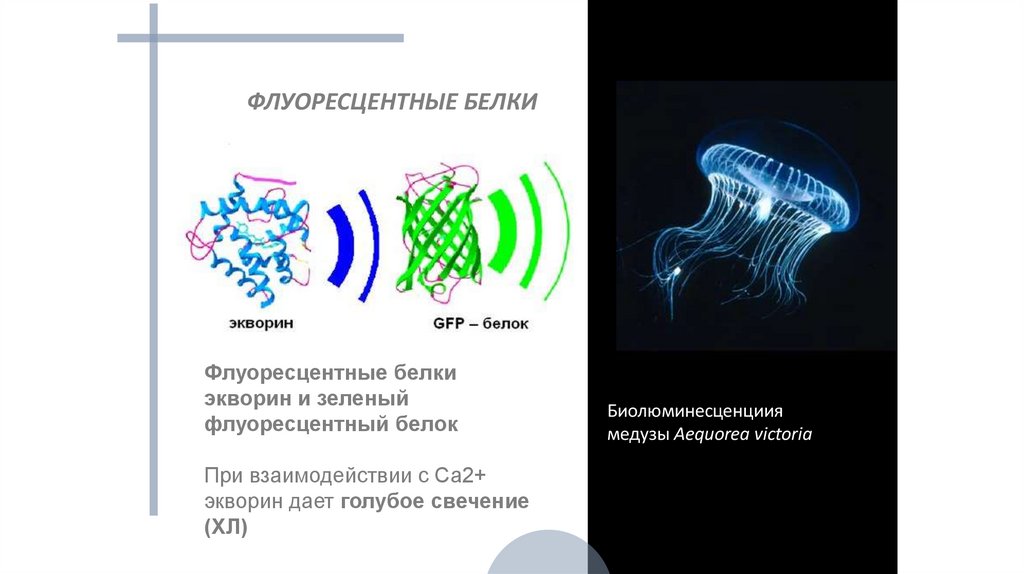
ФЛУОРЕСЦЕНТНЫЕ БЕЛКИФлуоресцентные белки
экворин и зеленый
флуоресцентный белок
При взаимодействии с Са2+
экворин дает голубое свечение
(ХЛ)
Биолюминесценциия
медузы Aequorea victoria
17.
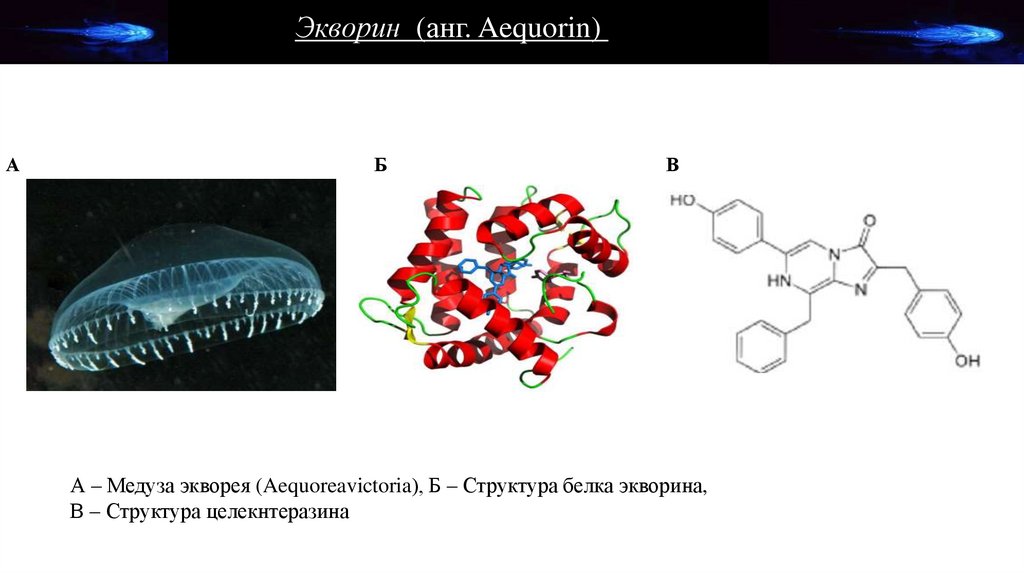
Экворин (анг. Aequorin)А
Б
В
А – Медуза экворея (Aequoreavictoria), Б – Структура белка экворина,
В – Структура целекнтеразина
18. ПРАКТИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ БИОЛЮМИНЕСЦЕНЦИИ
19.
Применение биохемилюминисцентных реакций:1. Анализ субстратов люцифераз.
2. Мониторинг АТФ.
3. Определение содержания ионов кальция.
4. Иммуноанализ.
5. Биолюминесцентные репортерные гены.
6. Биолюминесцентная визуализация.
20.
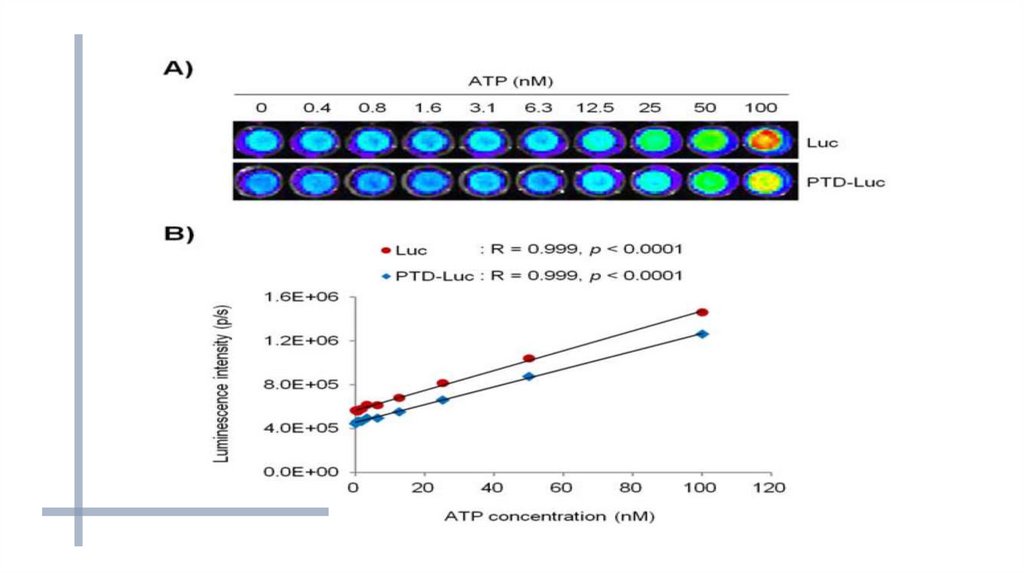
Определение концентрации АТФ с помощью люциферазы:-к изучаемому
люциферазы;
раствору
добавляют
смесь
люциферина
и
-при отсутствии АТФ биолюминесценции не наблюдается;
-возможно определение концентрации АТФ в образце от 10-17 моля
и выше.
21.
22.
Определение содержания ионов кальция:•При активации клетки [Ca2+]i возрастает со 100 нМ до 1000 нМ.
•Для обнаружения малых
концентраций Ca2+ используют
кишечнополостных (экворин):
фотопротеины
Преимущества:
•не требует возбуждения светом;
•не токсичен,
•не связывает другие двухвалентные катионы в физиологическом диапазоне
концентраций;
•не взаимодействует с внутриклеточными Са2+ буферными системами.
23.
С ИСПОЛЬЗОВАНИЕМ
БИОЛЮМИНЕСЦЕНЦИИ БАКТЕРИЙ
ОПРЕДЕЛЕНИЕ СОДЕРЖАНИЯ
ФМН (флавинмононуклеотид, является простетической
группой различных оксидоредуктаз)
ФАД (флавинадениндинуклеотид — кофермент,
принимающий участие во многих окислительновосстановительных биохимических процессах).
НИЗКИХ КОНЦЕНТРАЦИЙ КИСЛОРОДА,
АКТИВНОСТИ АНТИБИОТИКОВ
24.
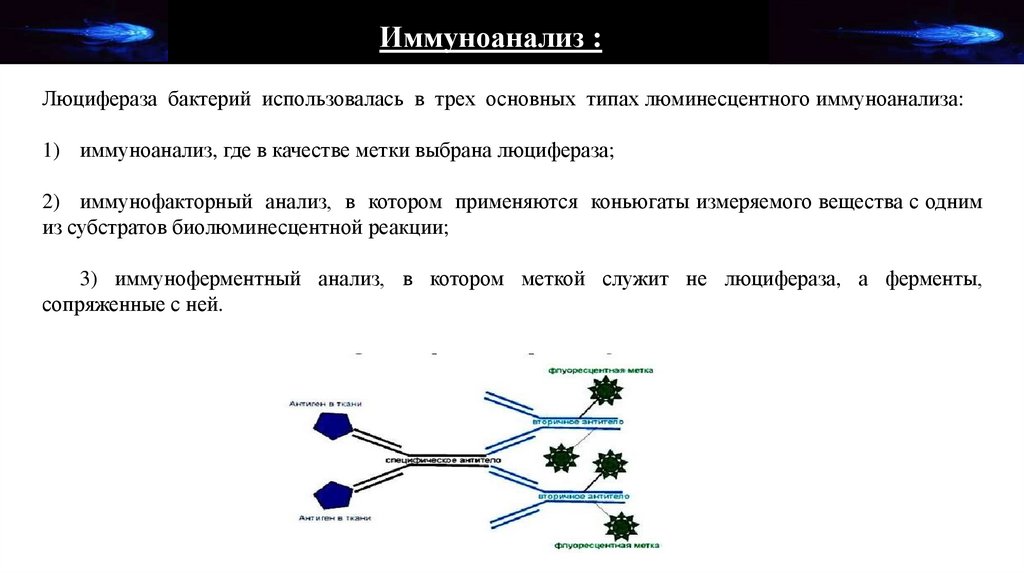
Иммуноанализ :Люцифераза бактерий использовалась в трех основных типах люминесцентного иммуноанализа:
1) иммуноанализ, где в качестве метки выбрана люцифераза;
2) иммунофакторный анализ, в котором применяются коньюгаты измеряемого вещества с одним
из субстратов биолюминесцентной реакции;
3) иммуноферментный анализ, в котором меткой служит не люцифераза, а ферменты,
сопряженные с ней.
25.
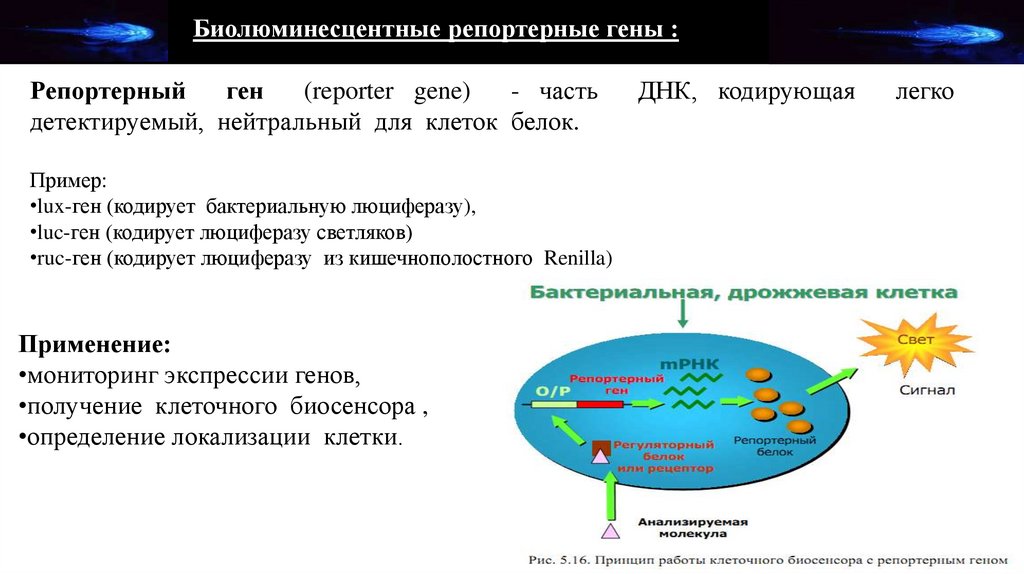
Биолюминесцентные репортерные гены :Репортерный
ген
(reporter gene)
- часть
детектируемый, нейтральный для клеток белок.
Пример:
•lux-ген (кодирует бактериальную люциферазу),
•luc-ген (кодирует люциферазу светляков)
•ruc-ген (кодирует люциферазу из кишечнополостного Renilla)
Применение:
•мониторинг экспрессии генов,
•получение клеточного биосенсора ,
•определение локализации клетки.
ДНК, кодирующая
легко
26.
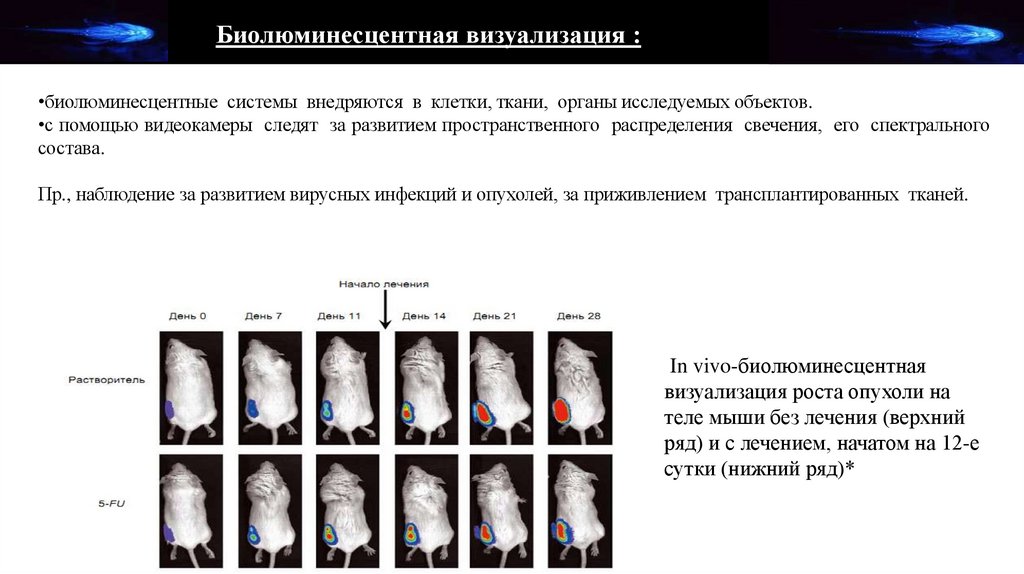
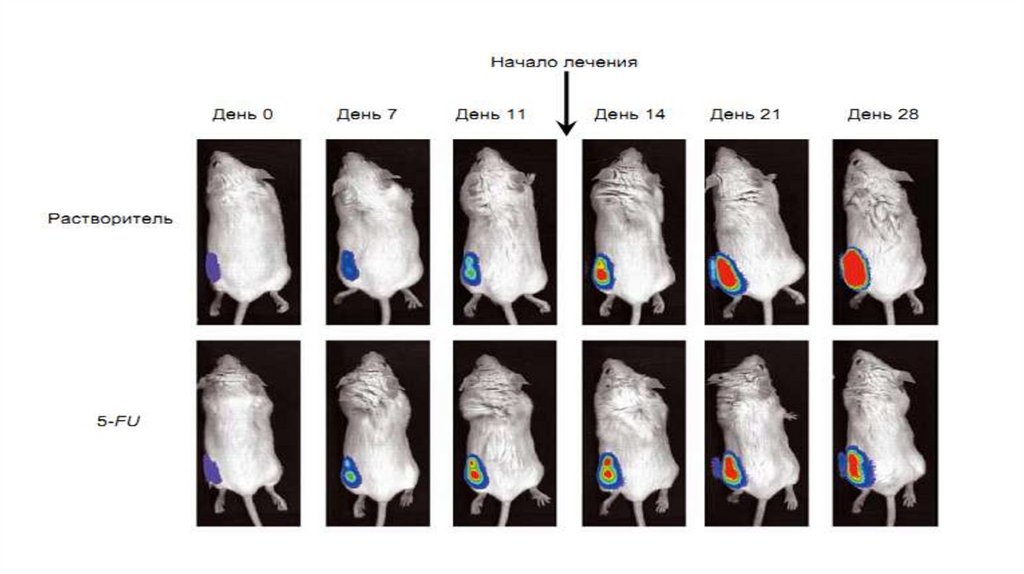
Биолюминесцентная визуализация :•биолюминесцентные системы внедряются в клетки, ткани, органы исследуемых объектов.
•с помощью видеокамеры следят за развитием пространственного распределения свечения, его спектрального
состава.
Пр., наблюдение за развитием вирусных инфекций и опухолей, за приживлением трансплантированных тканей.
In vivo-биолюминесцентная
визуализация роста опухоли на
теле мыши без лечения (верхний
ряд) и с лечением, начатом на 12-е
сутки (нижний ряд)*
27.
28.
СВЕРХСЛАБОЕ СВЕЧЕНИЕ(ХЕМИЛЮМИНЕСЦЕНЦИЯ)
НАЧАЛО ИЗУЧЕНИЯ – РАБОТЫ
А.Г.ГУРВИЧА. ОТКРЫТИЕ ИМ В
1923г. «МИТОГЕНЕТИЧЕСКИХ ЛУЧЕЙ»
Александр Гаврилович Гурвич
(1874 - 1954)
29.
30.
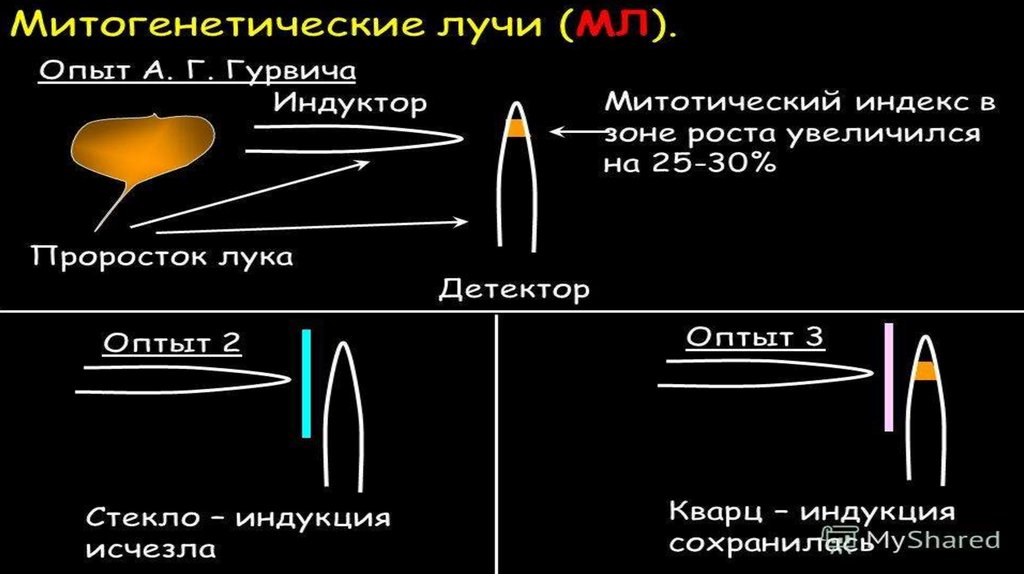
Митогенетические лучи Гурвича исверхслабое свечение
Митогенетические лучи - ультрафиолетовые лучи с длиной волны около 2 000 А (200 т/я),
продуцируемые самим организмом и вызывающие в нем клеточные деления (А.Г. Гурвич,
1923).
1933г. - В.В. Лепешкин обнаружил потемнение (засветку) фотопластинок, лежащих на
биопрепаратах. Он считал, что это УФ излучение возникает при гибели клеток и коагуляции их
протоплазмы, и называл его некробиотическим.
1961г.- Тарусов Б.Н. с сотрудниками открыли эндогенное спонтанное сверхслабое
прижизненное свечение – биохемилюминисценцию в области 360-1200 нм с поверхности
органов – мозга, мышц и печени крыс и кроликов.
31.
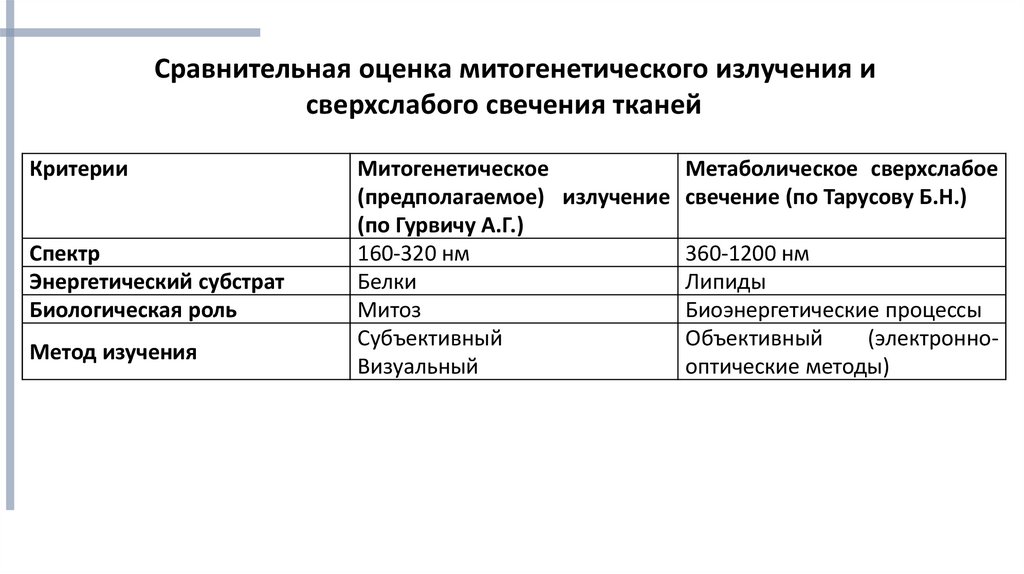
Сравнительная оценка митогенетического излучения исверхслабого свечения тканей
Критерии
Спектр
Энергетический субстрат
Биологическая роль
Метод изучения
Митогенетическое
Метаболическое сверхслабое
(предполагаемое) излучение свечение (по Тарусову Б.Н.)
(по Гурвичу А.Г.)
160-320 нм
360-1200 нм
Белки
Липиды
Митоз
Биоэнергетические процессы
Субъективный
Объективный
(электронноВизуальный
оптические методы)
32.
Причины сверхслабого свечения:1. Реакции активных форм кислорода;
2. Реакции цепного (перекисного) окисления липидов;
3. Реакции с участием окиси азота.
33.
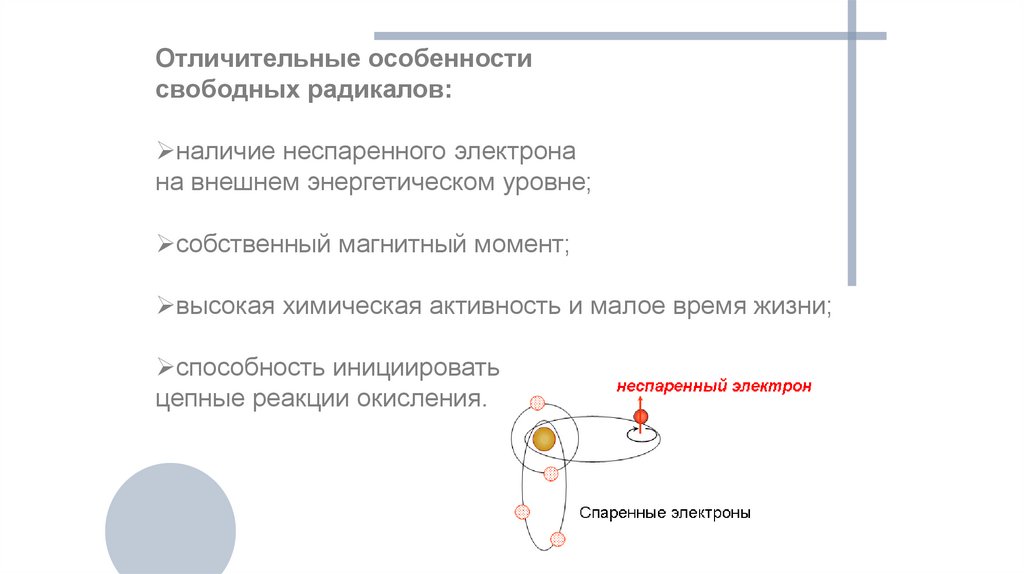
Отличительные особенностисвободных радикалов:
наличие неспаренного электрона
на внешнем энергетическом уровне;
собственный магнитный момент;
высокая химическая активность и малое время жизни;
способность инициировать
цепные реакции окисления.
34.
35.
Триплетный кислород, 3O2 – основное, наиболее стабильное состояние молекулярногокислорода. Содержит 2 неспаренных электрона.
Синглетный кислород, 1[O2] или 1O2 , радикал O=O – возбужденное, нестабильное
состояние молекулы кислорода, при котором все электроны находятся в спаренном
состоянии. Образуется при переходе электрона внутри молекулы между внешними
орбиталями.
36.
ПРИЧИНА ХЕМИЛЮМИНЕСЦЕНЦИИПЕРЕХОД КИСЛОРОДА В ВОЗБУЖДЕННОЕ СИНГЛЕТНОЕ
СОСТОЯНИЕ (O2*).
ВОЗБУЖДЕННЫЙ СИНГЛЕТНЫЙ КИСЛОРОД МОЖЕТ
ОБРАЗОВЫВАТЬСЯ ПРИ ВЗАИМОДЕЙСТВИИ КИСЛОРОДНЫХ
РАДИКАЛОВ.
ClO- + H2O2 Cl- + H2O + O2*
ПЕРЕХОД O2* В ОСНОВНОЕ СОСТОЯНИЕ СОПРОВОЖДАЕТСЯ
ВЫСВЕЧИВАНИЕМ КВАНТА
О2* O2 + фотон (ИК-область 1270 нм)
37.
МОЛЕКУЛЫ СИНГЛЕТНОГО КИСЛОРОДА ОБРАЗУЮТАКТИВНЫЕ ДИМЕРЫ (ЭКСИМЕРЫ), КОТОРЫЕ, ПЕРЕХОДЯ В
ОСНОВНОЕ СОСТОЯНИЕ, ИСПУСКАЮТ КВАНТЫ СВЕТА.
O2* + O2* [(O2)2]* (эксимер кислорода)
[(O2)2]* 2O2 + hn3 (480, 540, 640 нм)
38.
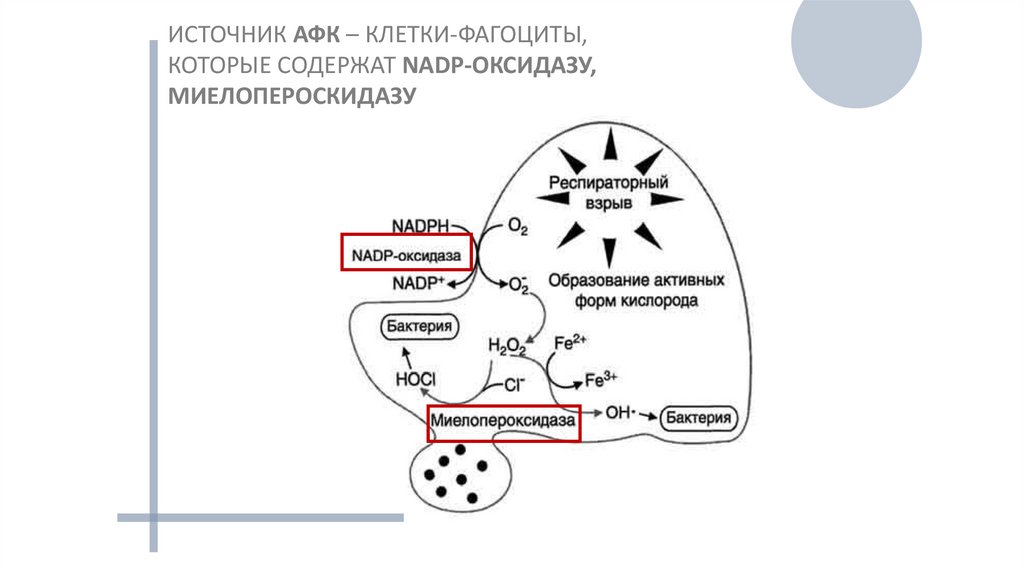
ИСТОЧНИК АФК – КЛЕТКИ-ФАГОЦИТЫ,КОТОРЫЕ СОДЕРЖАТ NADP-ОКСИДАЗУ,
МИЕЛОПЕРОСКИДАЗУ
39.
40.
41.
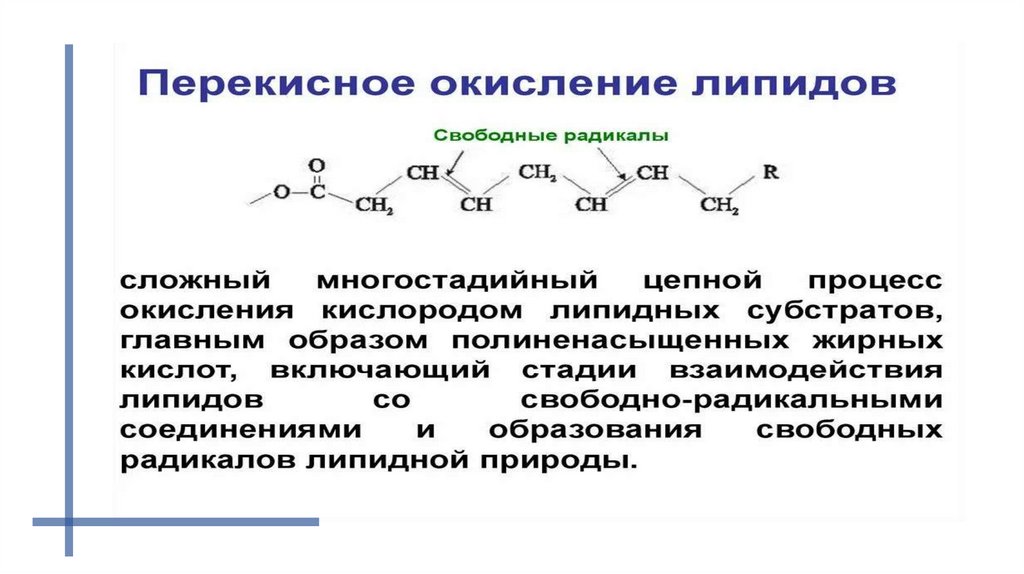
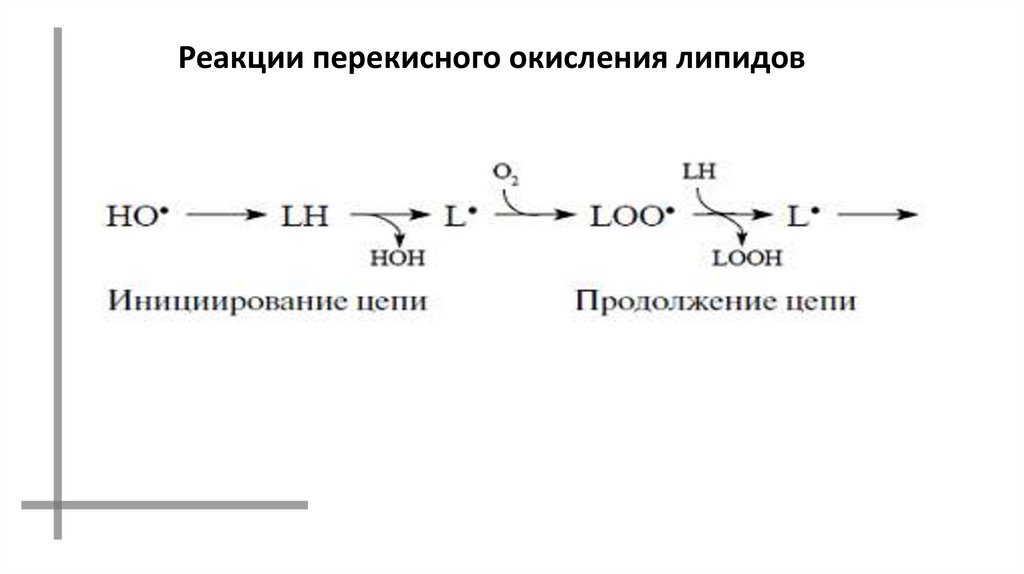
Реакции перекисного окисления липидов42.
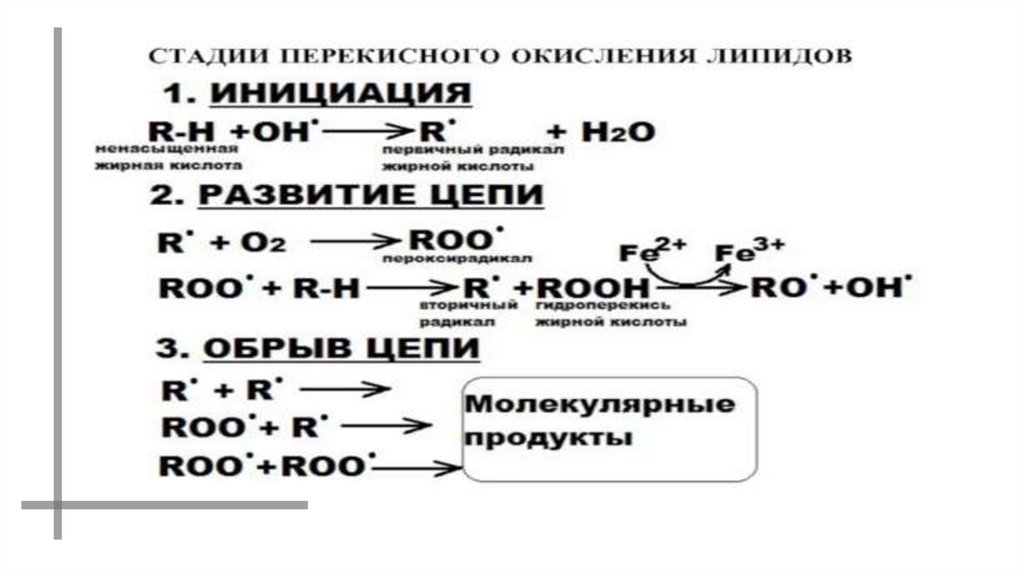
Прерывание цепи:43.
РАДИКАЛЫ МОГУТ ВЗАИМОДЕЙСТВОВАТЬ ДРУГ С ДРУГОМ.В ИТОГЕ ОБРАЗУЮТСЯ МОЛЕКУЛЫ КЕТОНА И КИСЛОРОДА В
ВОЗБУЖДЕННОМ СОСТОЯНИИ.
ПРИ ПЕРЕХОДЕ В ОСНОВНОЕ СОСТОЯНИЕ ОНИ ИСПУСКАЮТ КВАНТЫ
СВЕТА.
LOO· + LOO· LOH + L=O* + O2*
L=O* L=O + hn1 (420 - 520 нм)
O2* O2 + hn2 (1270 нм)
O2* + O2* [(O2)2]* (эксимер кислорода)
[(O2)2]* 2O2 + hn3 (480, 540, 640 нм)
44. ХЕМИЛЮМИНЕСЦЕНЦИЯ В РЕАКЦИЯХ С УЧАСТИЕМ NO
ОКСИД АЗОТА ВЫДЕЛЯЕТСЯ МНОГИМИ ТИПАМИ КЛЕТОК ИЯВЛЯЕТСЯ РЕГУЛЯТОРОМ ВНУТРИКЛЕТОЧНЫХ ПРОЦЕССОВ.
СВЕЧЕНИЕ НАБЛЮДАЛОСЬ В РАСТВОРАХ, СОДЕРЖАЩИХ
ОКСИД АЗОТА, СУПЕРОКСИД И БЕЛОК.
ОКСИД АЗОТА И СУПЕРОКСИД ДАЮТ ПЕРОКСИНИТРИТ
ON· + ·ОО- ® ONOO (пероксинитрит)
СВЕЧЕНИЕ НАБЛЮДАЕТСЯ ПРИ ВЗАИМОДЕЙСТВИИ
ПЕРОКСИНИТРИТА С БЕЛКОМ
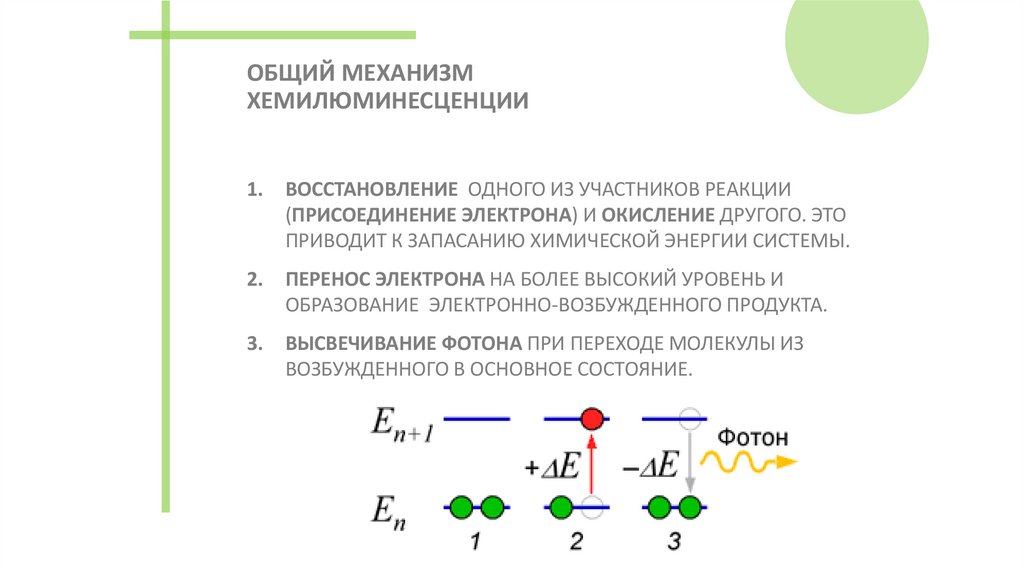
45. ОБЩИЙ МЕХАНИЗМ ХЕМИЛЮМИНЕСЦЕНЦИИ
1.ВОССТАНОВЛЕНИЕ ОДНОГО ИЗ УЧАСТНИКОВ РЕАКЦИИ
(ПРИСОЕДИНЕНИЕ ЭЛЕКТРОНА) И ОКИСЛЕНИЕ ДРУГОГО. ЭТО
ПРИВОДИТ К ЗАПАСАНИЮ ХИМИЧЕСКОЙ ЭНЕРГИИ СИСТЕМЫ.
2.
ПЕРЕНОС ЭЛЕКТРОНА НА БОЛЕЕ ВЫСОКИЙ УРОВЕНЬ И
ОБРАЗОВАНИЕ ЭЛЕКТРОННО-ВОЗБУЖДЕННОГО ПРОДУКТА.
3.
ВЫСВЕЧИВАНИЕ ФОТОНА ПРИ ПЕРЕХОДЕ МОЛЕКУЛЫ ИЗ
ВОЗБУЖДЕННОГО В ОСНОВНОЕ СОСТОЯНИЕ.
46.
ПРИЧИНЫНИЗКОЙ ИНТЕНСИВНОСТИ
ХЕМИЛЮМИНЕСЦЕНЦИИ
1. Низкая концентрация радикалов в биосистемах
из-за их высокой активности.
2. В большинстве окислительно-восстановительных
взаимодействий между радикалами и молекулами
электрон переносится на нижний основной уровень
и высвечивания кванта не происходит.
3. Низкая вероятность высвечивания кванта
несмотря на образование возбужденной молекулы.
47.
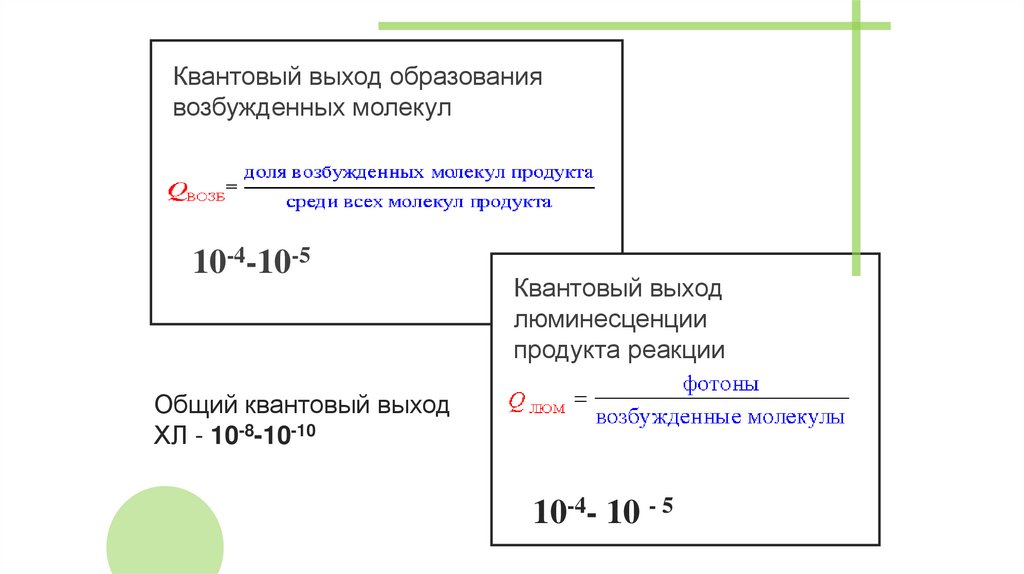
Квантовый выход образованиявозбужденных молекул
10-4-10-5
Квантовый выход
люминесценции
продукта реакции
Общий квантовый выход
ХЛ - 10-8-10-10
10-4- 10 - 5
48.
ХЕМИЛЮМИНЕСЦЕНЦИЯ КАК МЕТОДОБНАРУЖЕНИЯ РАДИКАЛОВ
Преимущества метода хемилюминесценции
(ХЛ)
во-первых, он обычно не связан с изменением хода
процессов в растворах, клетках или даже целых тканях,
где регистрируется свечение;
во-вторых, весьма чувствителен при обнаружении
именно высокореакционных радикалов.
Дело в том, что методом ХЛ непосредственно
определяется не концентрация радикалов,
а скорость реакции, в которой они образуются.
49.
A – внешний вид прибора: 1 – корпус, 2 – электромотор для мешалки,3 – мешалка, 4 – кювета, помещенная внутрь светоизолированного термостата,
5 – светоизолированная трубочка для добавки растворов по ходу измерения.
Приемное устройство расположено под кюветой.
Б – изображение экрана компьютера с записью кривой хемилюминесценции
фагоцитов, приготовленных из моноцитов здорового донора (слева) и больного
ишемической болезнью сердца (справа). Стрелками показаны моменты добавки люминола
(Л) и стимула ФМА (С). Запись и обработка кривых осуществлена с помощью программы
PowerGraph
50.
НЕДОСТАТКИ МЕТОДА РЕГИСТРАЦИИ СОБСТВЕННОЙХЕМИЛЮМИНЕСЦЕНЦИИ
Во-первых, из-за низкой интенсивности свечения
(общий квантовый выход ХЛ - 10-8-10-10)
измерение СХЛ требует не только применения весьма
чувствительной, а следовательно, дорогой
аппаратуры, но и большого количество материала для
анализа, что для биологии и медицины весьма
нежелательно, а часто просто невозможно.
Во-вторых, метод малоспецифичен, т.к. за сверхслабое
свечение в биологических объектах могут отвечать реакции
многих активных частиц: радикалов и пероксидов
51.
Выход заключается в использовании определенныхвеществ, получивших название активаторов ХЛ
(enhancers – усилителей).
По механизму действия активаторы распадаются на
две четко различающиеся группы, которые можно
назвать химическими и физическими активаторами.
52. ХИМИЧЕСКИЕ АКТИВАТОРЫ ХЕМИЛЮМИНЕСЦЕНЦИИ
АКТИВАТОРЫ + АФК ОБРАЗОВАНИЕ ПРОДУКТОВ ВВОЗБУЖДЕННОМ СОСТОЯНИИ.
СВЕЧЕНИЕ СВЯЗАНО С ПЕРЕХОДОМ ЭТИХ ПРОДУКТОВ В ОСНОВНОЕ
СОСТОЯНИЕ
ЗДЕСЬ R – РАДИКАЛ, А – ХИМИЧЕСКИЙ АКТИВАТОР,
Р – ОТВЕТСТВЕННЫЙ ЗА ХЕМИЛЮМИНЕСЦЕНЦИЮ ПРОДУКТ
ПРЕВРАЩЕНИЯ МОЛЕКУЛЫ АКТИВАТОРА В ВОЗБУЖДЕННОМ (РА*) И
ОСНОВНОМ ( РА) ЭЛЕКТРОННОМ СОСТОЯНИЯХ
53.
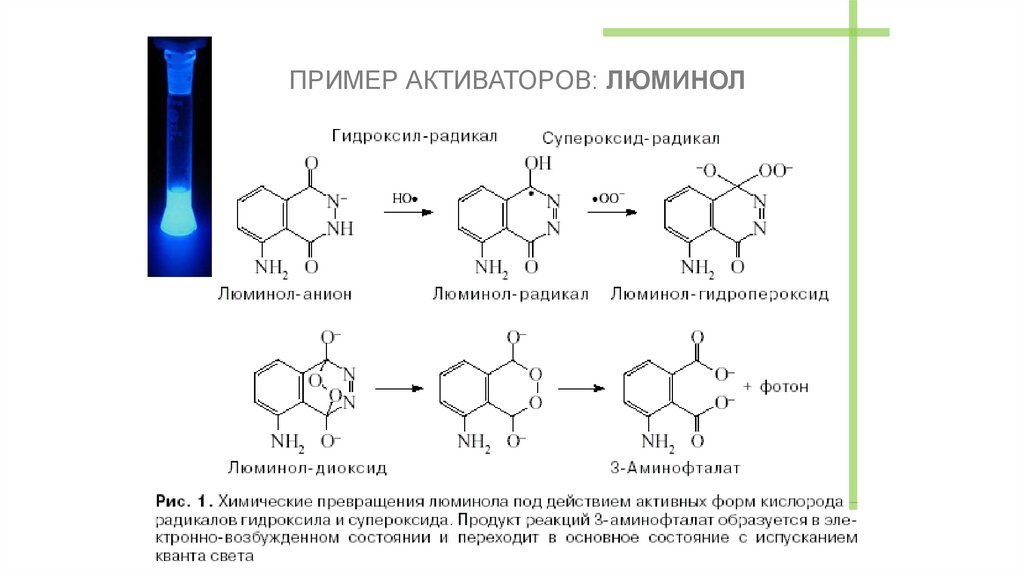
ПРИМЕР АКТИВАТОРОВ: ЛЮМИНОЛ54. ФИЗИЧЕСКИЕ АКТИВАТОРЫ ХЕМИЛЮМИНЕСЦЕНЦИИ
ФИЗИЧЕСКИЕ АКТИВАТОРЫ НЕ ВСТУПАЮТ В ХИМИЧЕСКИЕРЕАКЦИИ, НО МНОГОКРАТНО УСИЛИВАЮТ ИНТЕНСИВНОСТЬ
ХЕМИЛЮМИНЕСЦЕНЦИИ.
МЕХАНИЗМ: МИГРАЦИЯ ЭНЕРГИИ С МОЛЕКУЛЫ ПРОДУКТА
ХЕМИЛЮМИНЕСЦЕНТНОЙ РЕАКЦИИ НА АКТИВАТОР
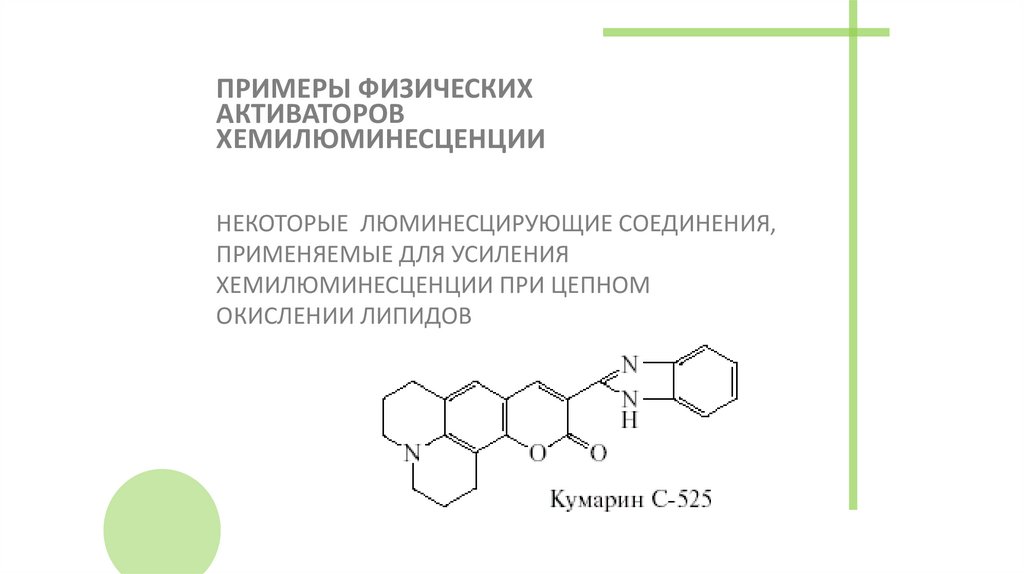
55. ПРИМЕРЫ ФИЗИЧЕСКИХ АКТИВАТОРОВ ХЕМИЛЮМИНЕСЦЕНЦИИ
НЕКОТОРЫЕ ЛЮМИНЕСЦИРУЮЩИЕ СОЕДИНЕНИЯ,ПРИМЕНЯЕМЫЕ ДЛЯ УСИЛЕНИЯ
ХЕМИЛЮМИНЕСЦЕНЦИИ ПРИ ЦЕПНОМ
ОКИСЛЕНИИ ЛИПИДОВ



































 physics
physics








