Similar presentations:
2 ЛЮМИНЕСЦЕНЦИЯ_ФЛ.МЕТОДЫ_13_10_25
1. ЛЮМИНЕСЦЕНЦИЯ: ВИДЫ, ХАРАКТЕРИСТИКИ И ЗАКОНЫ ФЛУОРЕСЦЕНТНЫЕ МЕТОДЫ ИСЛЕДОВАНИЯ
2.
ВИДЫ ЛЮМИНЕСЦЕНЦИИСОБСТВЕННО ЛЮМИНЕСЦЕНЦИЯ, вызванная действием света
ФЛУОРЕСЦЕНЦИЯ
ФОСФОРЕСЦЕНЦИЯ
ЛЮМИНЕСЦЕНЦИЯ, обусловленная химическими
процессами, протекающими в живых клетках
БИОЛЮМИНЕСЦЕНЦИЯ
Обнаруживается
визуально
ХЕМИЛЮМИНЕСЦЕНЦИЯ
Сверхслабое свечение
в инфракрасной или УФ-области
3.
СОБСТВЕННО ЛЮМИНЕСЦЕНЦИЯ1. Механизм и характеристики люминесценции.
2. Электронные переходы при люминесценции.
3. Законы люминесценции.
4. Методы обнаружения триплетных уровней.
4.
ЛЮМИНЕСЦЕНЦИЯФЛУОРЕСЦЕНЦИЯ
ФОСФОРЕСЦЕНЦИЯ
Определяется электронной
конфигурацией вещества
5.
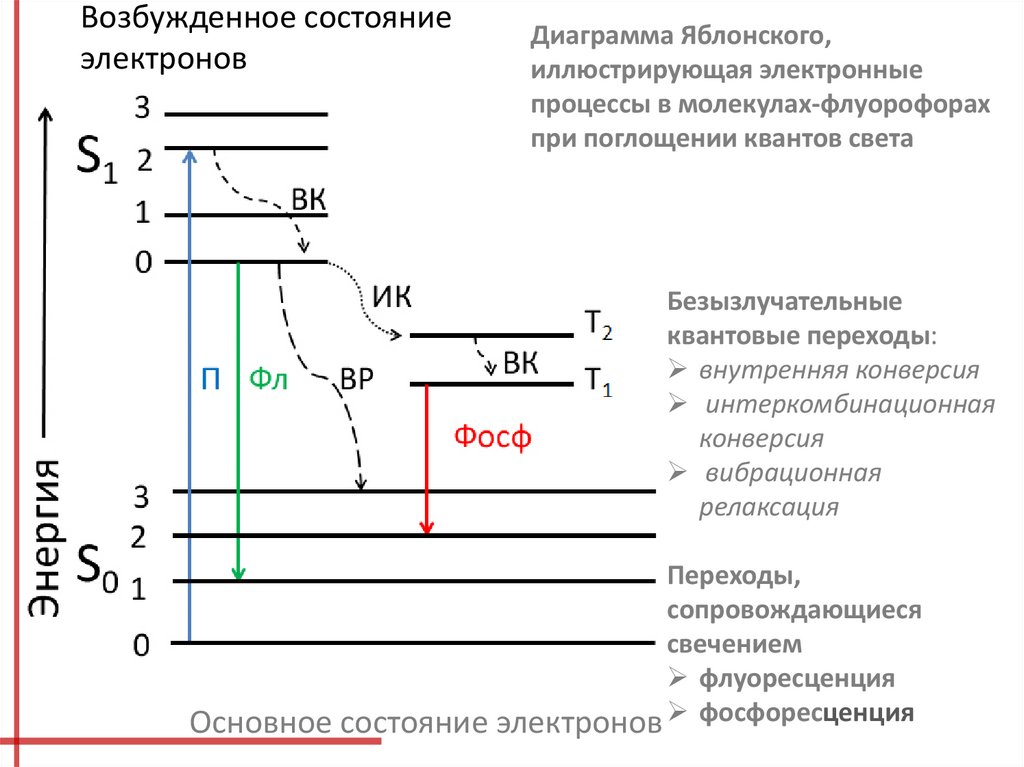
Возбужденное состояниеэлектронов
Диаграмма Яблонского,
иллюстрирующая электронные
процессы в молекулах-флуорофорах
при поглощении квантов света
Безызлучательные
квантовые переходы:
внутренняя конверсия
интеркомбинационная
конверсия
вибрационная
релаксация
Переходы,
сопровождающиеся
свечением
флуоресценция
Основное состояние электронов фосфоресценция
6.
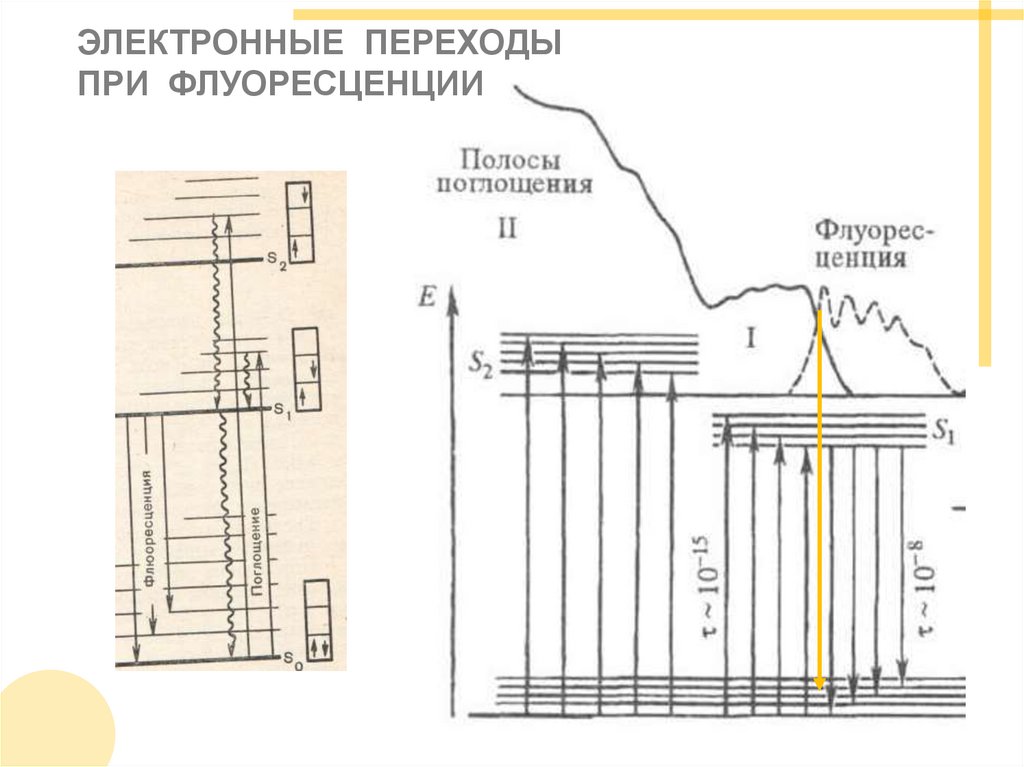
При внутренней конверсии энергия электрона уменьшаетсядо минимального возбужденного синглетного уровня.
В ходе вибрационной релаксации, которая вызвана
преимущественно взаимодействием с окружающими
молекулами, поглощенная энергия может «рассеяться» в виде
тепла до «основного» уровня.
Интеркомбинационная конверсия приводит к уменьшению
энергии электронов с изменением спина (триплетное
состояние).
Флуоресценция возникает при переходе с нижнего
возбужденного синглетного уровня в «основное» состояние,
а фосфоресценция — при переходе в «основное» состояние
с триплетного уровня.
7.
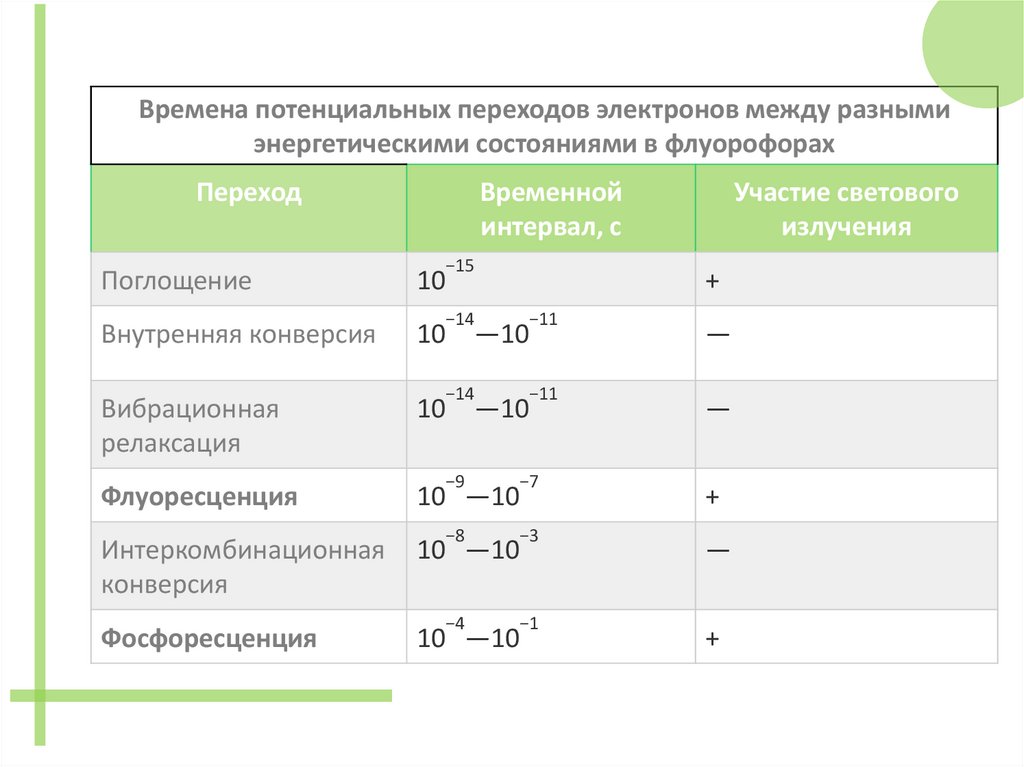
Времена потенциальных переходов электронов между разнымиэнергетическими состояниями в флуорофорах
Переход
Временной
интервал, с
−15
Поглощение
10
Внутренняя конверсия
10
Вибрационная
релаксация
10
Флуоресценция
10 —10
Интеркомбинационная
конверсия
10 —10
Фосфоресценция
10 —10
Участие светового
излучения
+
−14
−11
−14
−11
−9
−7
−8
−3
−4
−1
—10
—10
—
—
+
—
+
8.
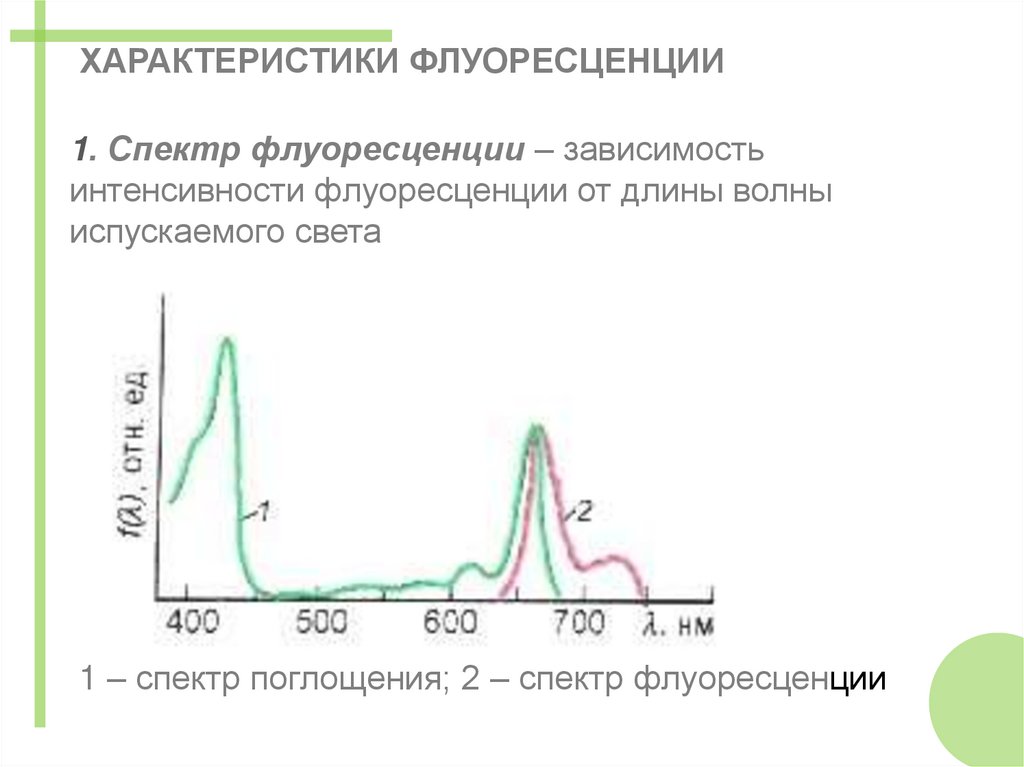
ХАРАКТЕРИСТИКИ ФЛУОРЕСЦЕНЦИИ1. Спектр флуоресценции – зависимость
интенсивности флуоресценции от длины волны
испускаемого света
1 – спектр поглощения; 2 – спектр флуоресценции
9.
2.Спектр возбуждения флуоресценции –зависимость интенсивности флуоресценции от длины
волны возбуждающего света.
3. Квантовый выход флуоресценции – отношение
количества испускаемых квантов к количеству
поглощенных.
4.При возбуждении молекул линейно поляризованным
светом наблюдается частичная поляризация
флуоресценции. В этом случае измеряют степень
поляризации флуоресценции.
10.
ЭЛЕКТРОННЫЕ ПЕРЕХОДЫПРИ ФЛУОРЕСЦЕНЦИИ
11.
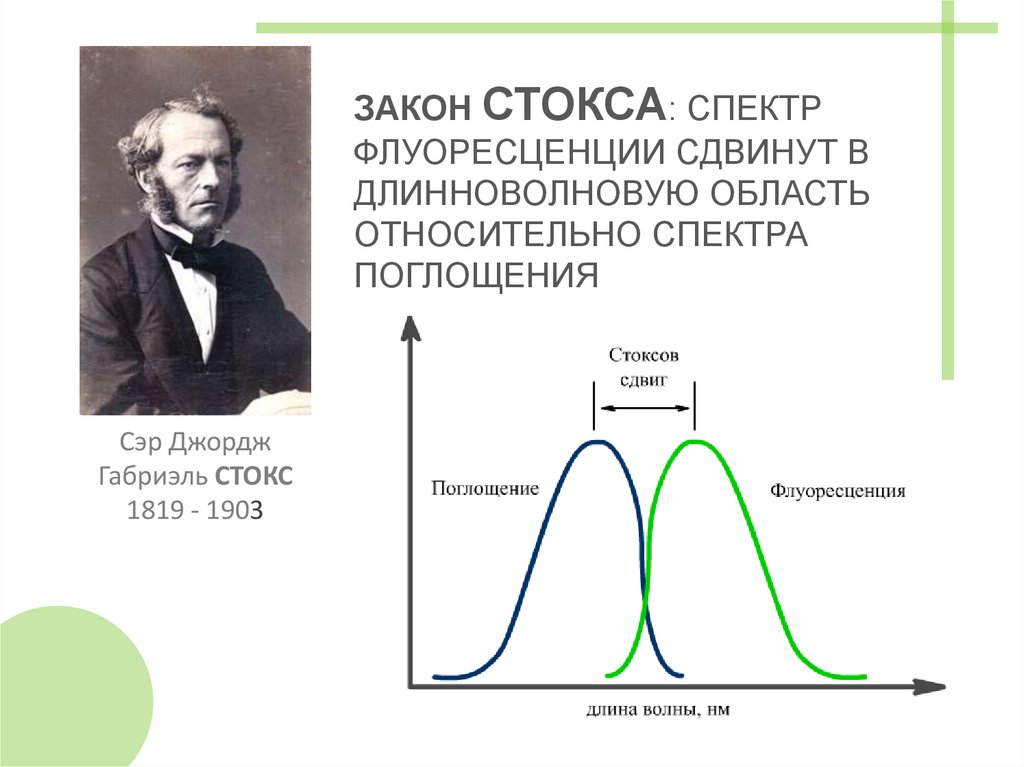
ЗАКОНЫ ФЛУОРЕСЦЕНЦИИЗАКОН
СТОКСА
ПРАВИЛО
ЛЕВШИНА
ПРАВИЛО
КАША
ЗАКОН
ВАВИЛОВА
12.
ЗАКОН СТОКСА: СПЕКТРФЛУОРЕСЦЕНЦИИ СДВИНУТ В
ДЛИННОВОЛНОВУЮ ОБЛАСТЬ
ОТНОСИТЕЛЬНО СПЕКТРА
ПОГЛОЩЕНИЯ
Сэр Джордж
Габриэль СТОКС
1819 - 1903
13.
ПРАВИЛО ЛЕВШИНА: СПЕКТРФЛУОРЕСЦЕНЦИИ СИММЕТРИЧЕН
ДЛИННОВОЛНОВОЙ ОБЛАСТИ СПЕКТРА
ПОГЛОЩЕНИЯ
В.Л.ЛЕВШИН
(1896 -1969)
14.
ПРАВИЛОМайкл КАША
1920 - 2013
ПРАВИЛО КАША: ПРИ
ОБЛУЧЕНИИ МОЛЕКУЛА
БУДЕТ ИЗЛУЧАТЬ ТОЛЬКО ЗА
СЧЕТ НИЗШЕГО ПО
ЭНЕРГИИ ВОЗБУЖДЕННОГО
СОСТОЯНИЯ.
КАША
15.
ПРАВИЛО ВАВИЛОВА:НЕЗАВИСИМОСТЬ КВАНТОВОГО
ВЫХОДА
ФЛУОРЕСЦЕНЦИИ ОТ
ДЛИНЫ ВОЛНЫ ВОЗБУЖДАЮЩЕГО
СВЕТА
С.И.ВАВИЛОВ
1891 - 1951
nисп
nпогл
16.
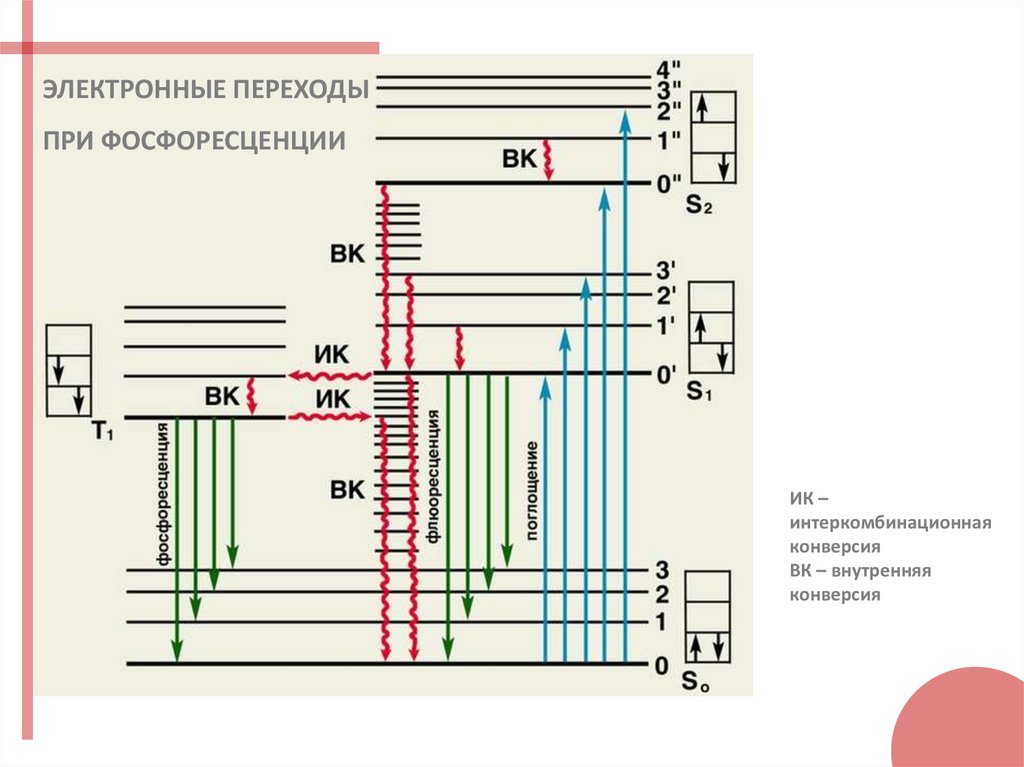
ЭЛЕКТРОННЫЕ ПЕРЕХОДЫПРИ ФОСФОРЕСЦЕНЦИИ
ИК –
интеркомбинационная
конверсия
ВК – внутренняя
конверсия
17.
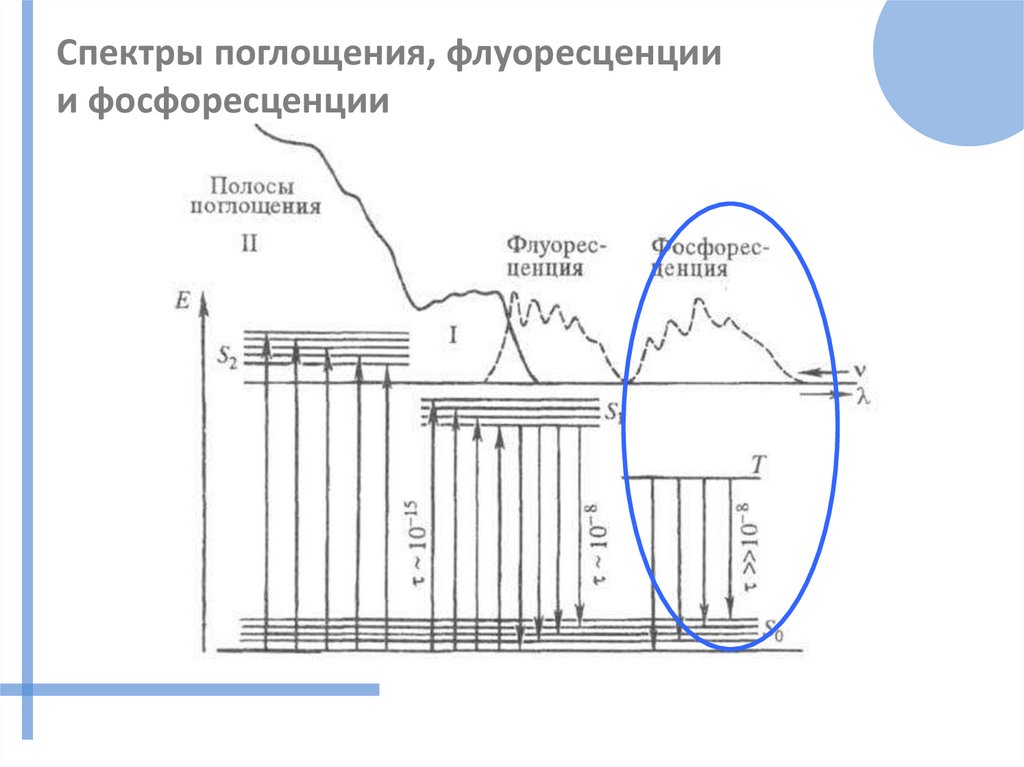
Спектры поглощения, флуоресценциии фосфоресценции
18.
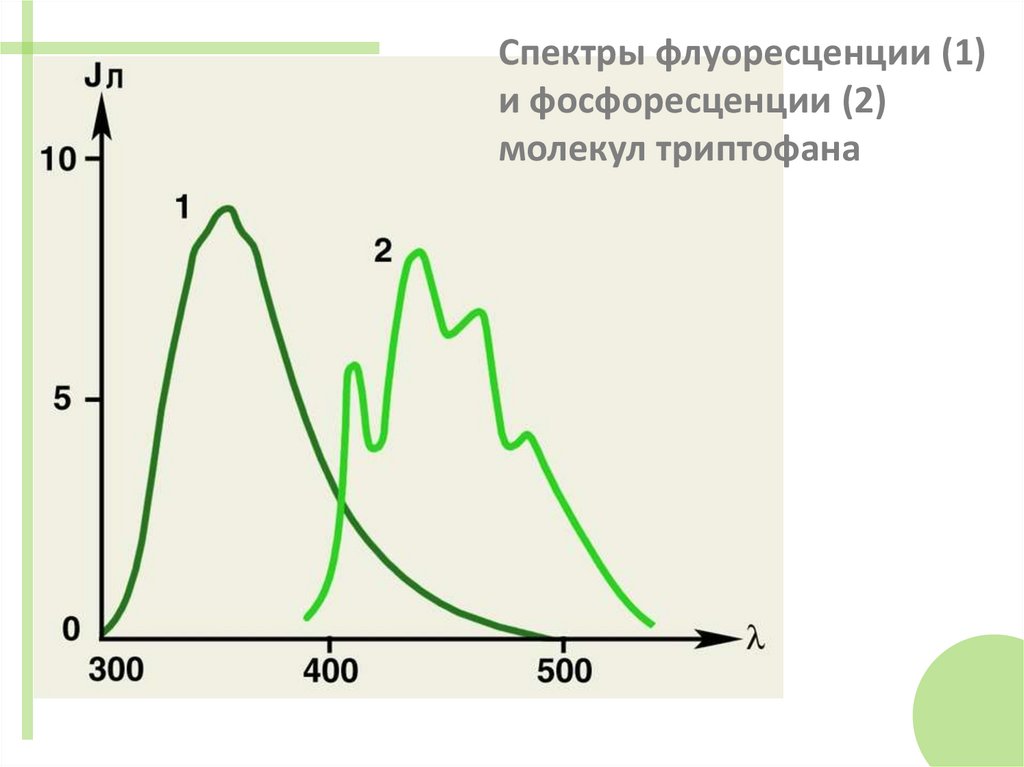
Спектры флуоресценции (1)и фосфоресценции (2)
молекул триптофана
19.
МЕТОДЫ ОБНАРУЖЕНИЯ ТРИПЛЕТНЫХУРОВНЕЙ
ЭПР
ИМПУЛЬСНЫЙ ФОТОЛИЗ
ТЕРМОЛЮМИНЕСЦЕНЦИЯ
ИНФРАКРАСНАЯ СПЕКТРОСКОПИЯ
20. ФЛУОРЕСЦЕНТНЫЕ МЕТОДЫ В ИССЛЕДОВАНИИ БИОСИСТЕМ
21.
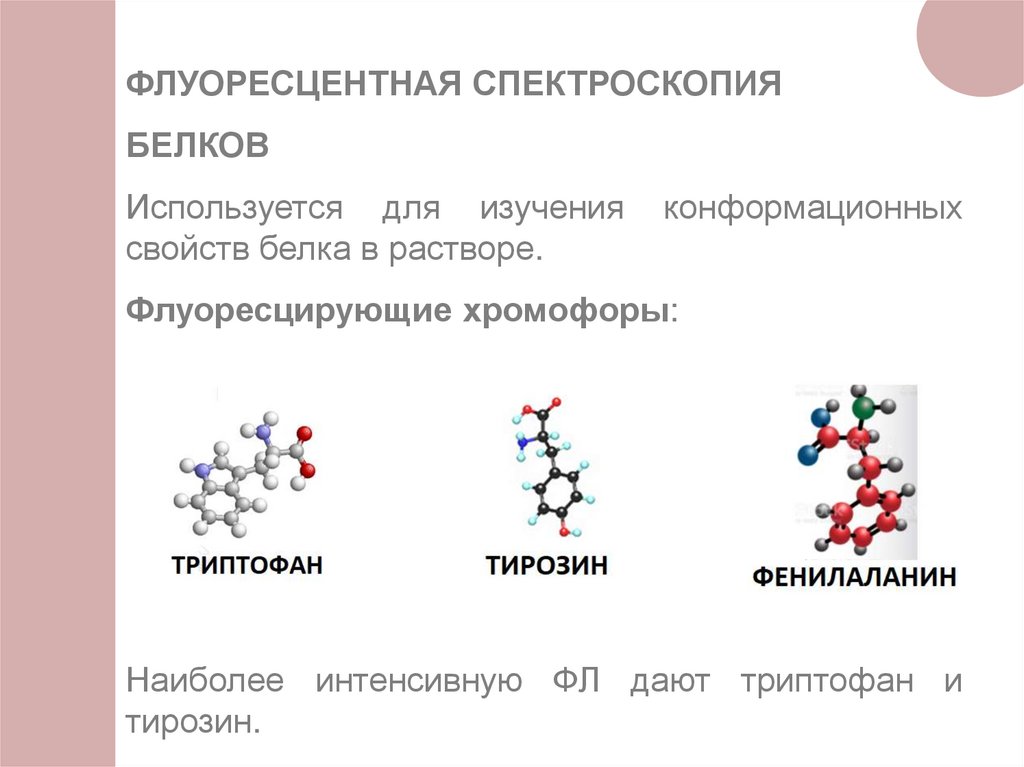
ФЛУОРЕСЦЕНТНАЯ СПЕКТРОСКОПИЯБЕЛКОВ
Используется для изучения
свойств белка в растворе.
конформационных
Флуоресцирующие хромофоры:
Наиболее интенсивную ФЛ дают триптофан и
тирозин.
22.
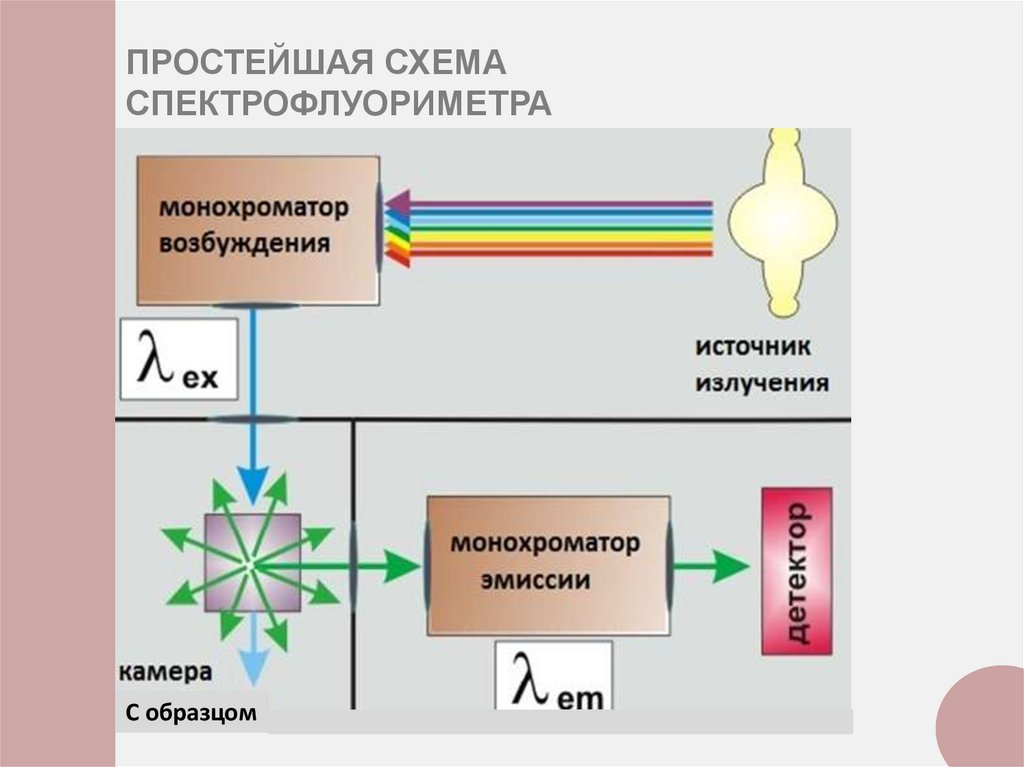
ПРОСТЕЙШАЯ СХЕМАСПЕКТРОФЛУОРИМЕТРА
С образцом
23.
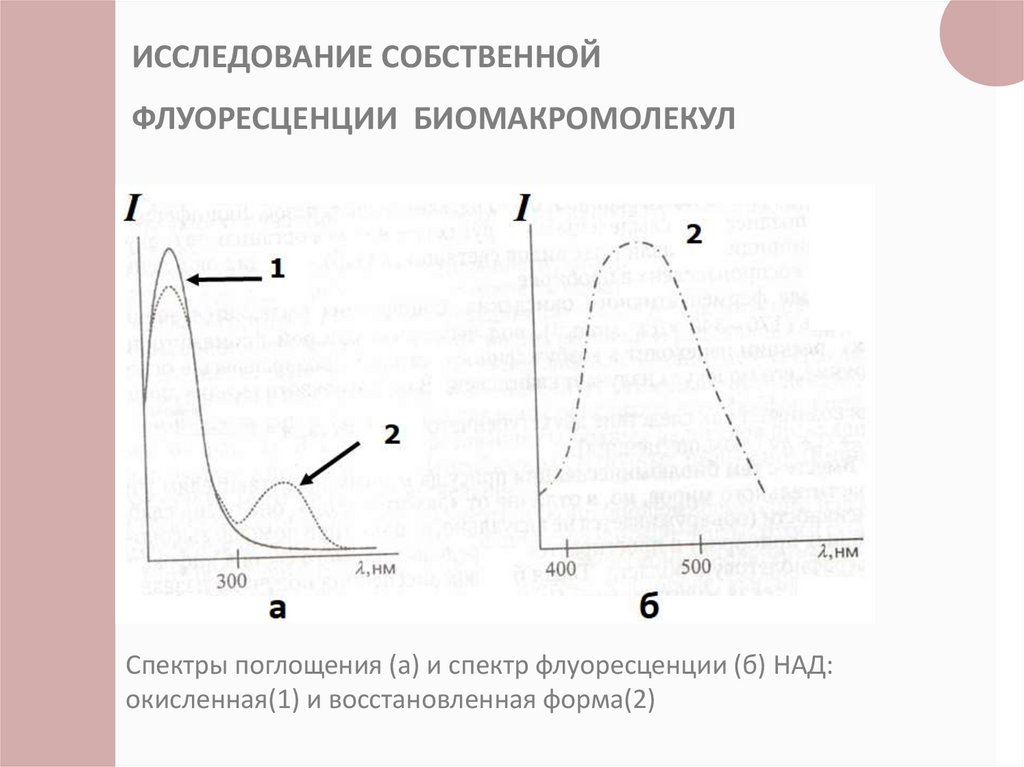
ИССЛЕДОВАНИЕ СОБСТВЕННОЙФЛУОРЕСЦЕНЦИИ БИОМАКРОМОЛЕКУЛ
Спектры поглощения (а) и спектр флуоресценции (б) НАД:
окисленная(1) и восстановленная форма(2)
24.
Наиболеечувствительной
к
изменению
конформации белка является ФЛ триптофановых
остатков. Положение максимума спектра ФЛ
триптофановых остатков зависит от свойств
микроокружения.
Триптофановые
остатки
находятся
на
поверхности глобулы в полярном окружении, или в
денатурированном белке: их спектр подобен
спектру триптофана в воде.
Спектр остатков триптофана внутри глобулы
смещен в более коротковолновую область, а его
максимум варьирует в широких пределах (от 442
до 320 нм).
25.
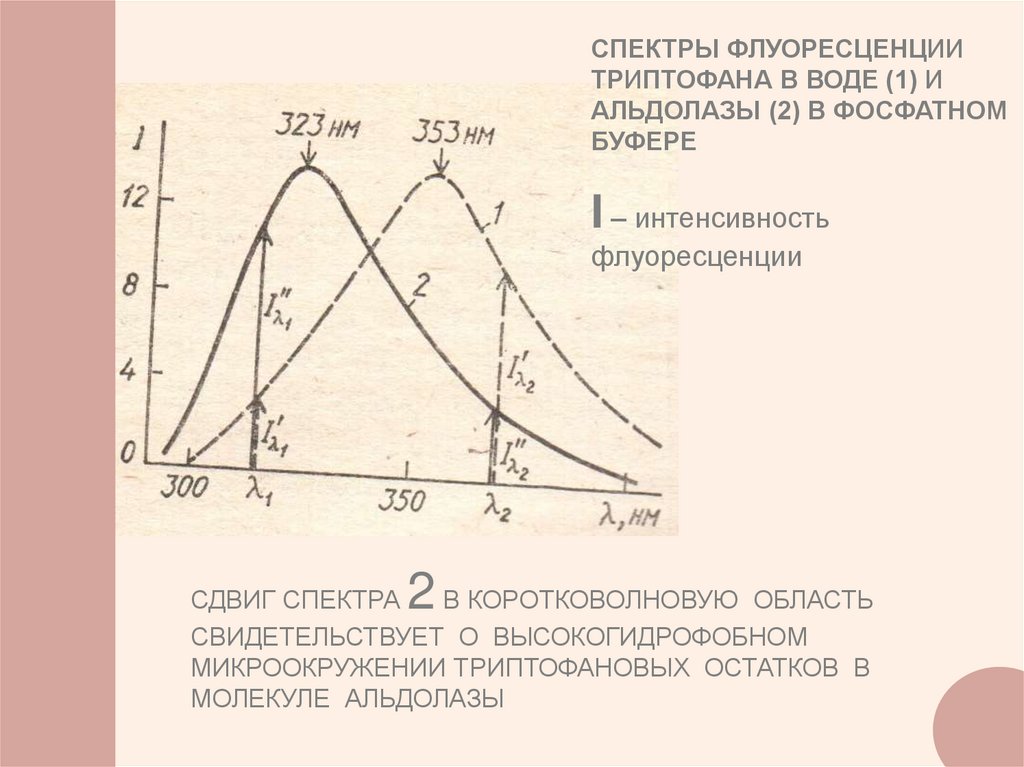
СПЕКТРЫ ФЛУОРЕСЦЕНЦИИТРИПТОФАНА В ВОДЕ (1) И
АЛЬДОЛАЗЫ (2) В ФОСФАТНОМ
БУФЕРЕ
I – интенсивность
флуоресценции
2
СДВИГ СПЕКТРА
В КОРОТКОВОЛНОВУЮ ОБЛАСТЬ
СВИДЕТЕЛЬСТВУЕТ О ВЫСОКОГИДРОФОБНОМ
МИКРООКРУЖЕНИИ ТРИПТОФАНОВЫХ ОСТАТКОВ В
МОЛЕКУЛЕ АЛЬДОЛАЗЫ
26.
Измеряя спектры триптофановой ФЛбелка, можно оценить конформационные
перестройки в белке при действии
факторов среды или в процессе
функционирования белка (ферментный
катализ, транспорт ионов и др.)
Кроме изучения собственной ФЛ широко
используют флуоресцентные репортеры.
27. ФЛУОРЕСЦЕНТНЫЕ РЕПОРТЕРЫ И ИХ ИСПОЛЬЗОВАНИЕ В БИОЛОГИЧЕСКИХ ИССЛЕДОВАНИЯХ
28.
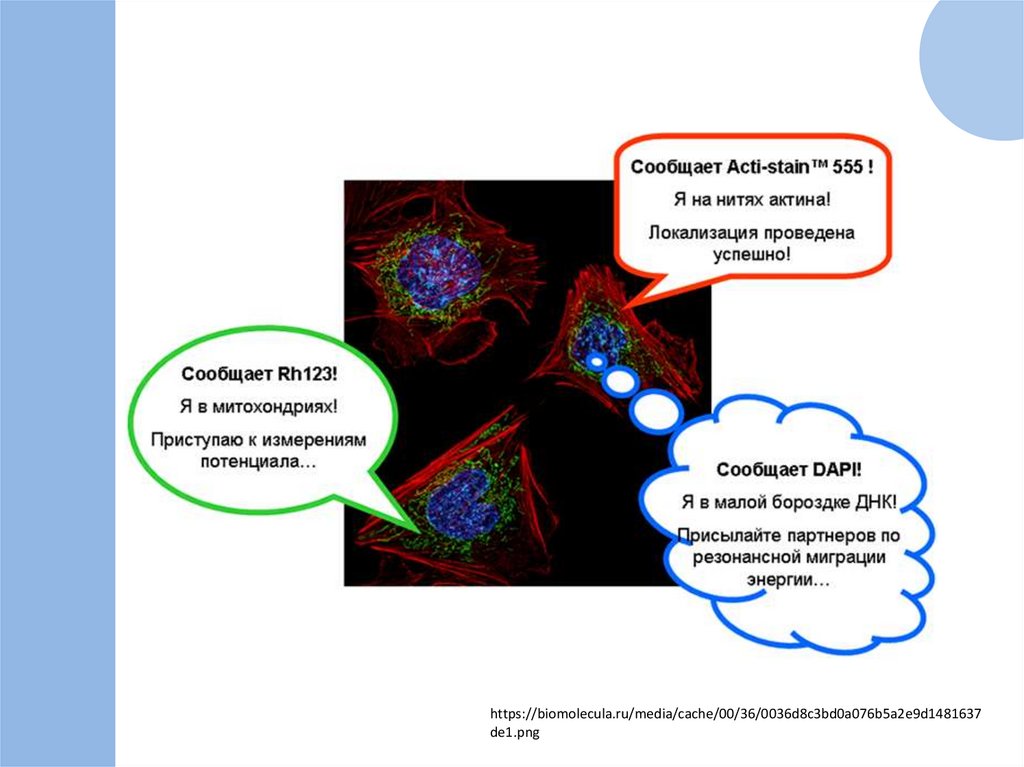
https://biomolecula.ru/media/cache/00/36/0036d8c3bd0a076b5a2e9d1481637de1.png
29.
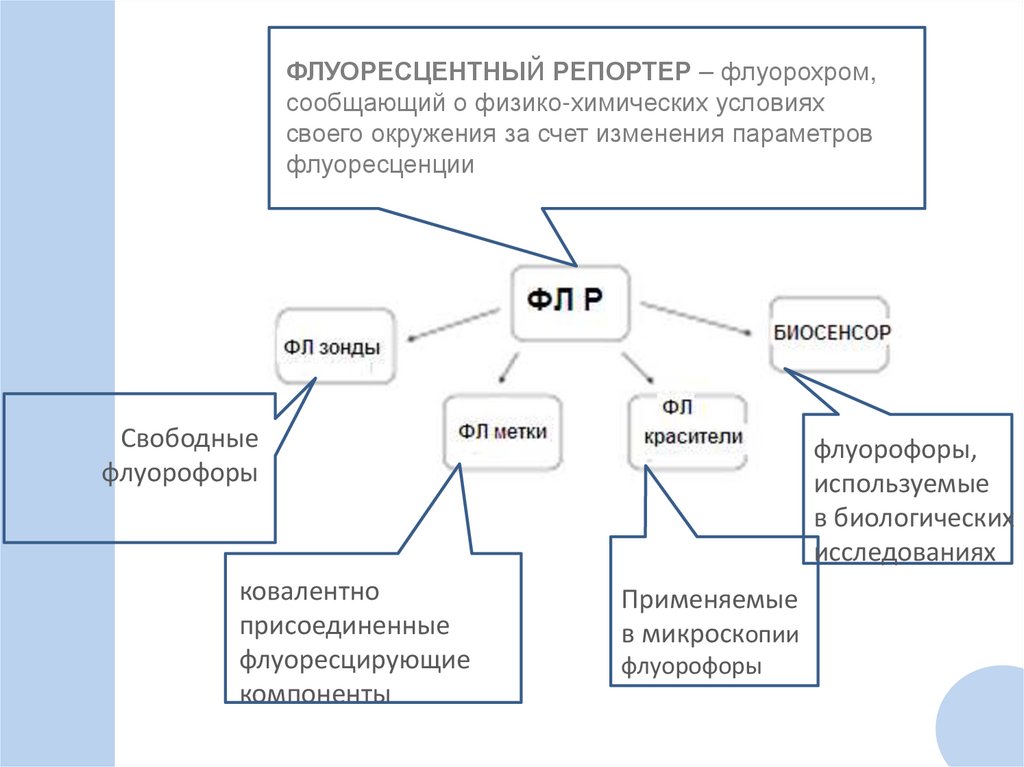
ФЛУОРЕСЦЕНТНЫЙ РЕПОРТЕР – флуорохром,сообщающий о физико-химических условиях
своего окружения за счет изменения параметров
флуоресценции
Свободные
флуорофоры
ковалентно
присоединенные
флуоресцирующие
компоненты
флуорофоры,
используемые
в биологических
исследованиях
Применяемые
в микроскопии
флуорофоры
30.
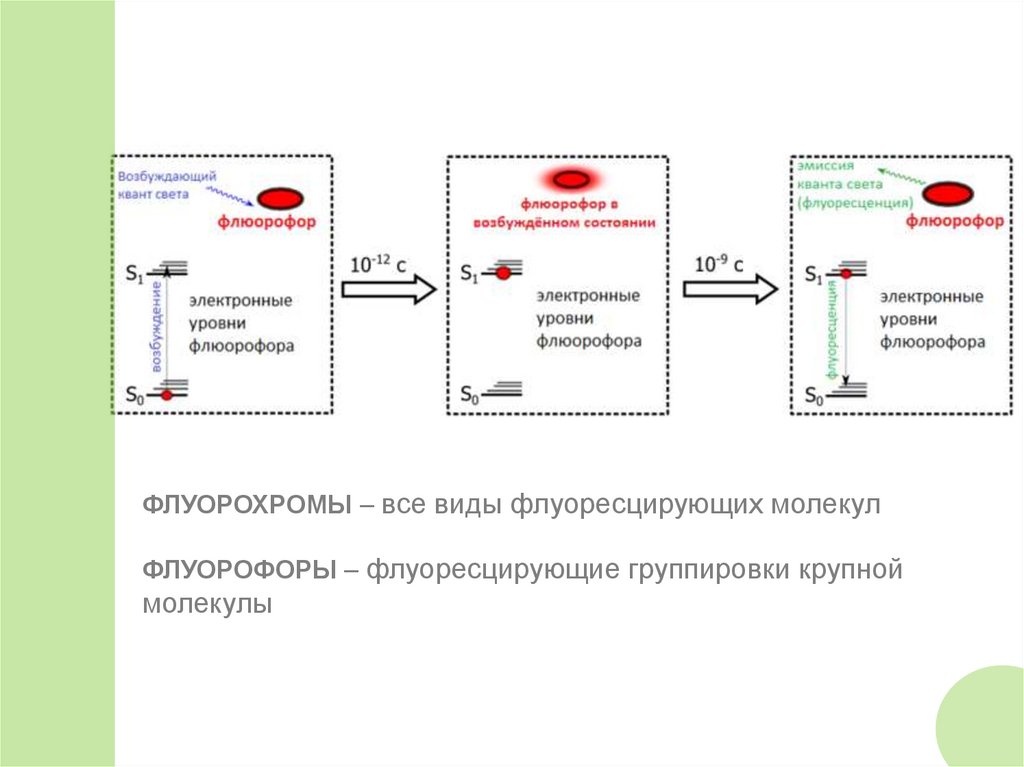
ФЛУОРОХРОМЫ – все виды флуоресцирующих молекулФЛУОРОФОРЫ – флуоресцирующие группировки крупной
молекулы
31.
Для количественной оценки флуоресценциииспользуют две методологии
1. Измерение различных характеристик флуоресценции в сравнительно
большой (макроскопической) области объекта
спектрофлуориметры (все основные характеристики
флуоресценции)
планшетные флуориметры — устройства для анализа большого
количества образцов (иногда более тысяч), но лишь по нескольким
фиксированным характеристикам
2. Измерение флуоресценции единичных микроскопических
объектов (клетки и субклеточные структуры)
измерение флуоресценции микрообъектов в потоке, при
прохождении через узкий капилляр специального прибора —
проточного цитометра
флуоресцентная микроскопия
32.
ФЛУОРЕСЦЕНТНЫЕ ЗОНДЫФлуоресцентный зонд – это молекулярная конструкция, которая
изменяет один из параметров флуоресценции (интенсивность, время
жизни, максимум спектра флуоресценции), когда связывается со своей
мишенью.
ФЛУОРЕСЦЕНТНЫЕ БЕЛКИ
МАЛЫЕ ОРГАНИЧЕСКИЕ МОЛЕКУЛЫ
КВАНТОВЫЕ ТОЧКИ
ИСПОЛЬЗОВАНИЕ ФЛУОРЕСЦЕНТНЫХ ЗОНДОВ ДАЕТ ВОЗМОЖНОСТЬ
ИССЛЕДОВАТЬ
Подвижность фосфолипидов и белков в мембране
Оценить микровязкость мембран
Реакции ассоциации (связывания) соединений с белками, ДНК,
мембранами
Взаимодействие фермент – субстрат
Иммунологические реакции
Определение рН и ВНУТРИКЛЕТОЧНОЙ концентрации Na+, Mg2+,
Ca2+ с помощью подходящих флуоресцентных зондов
33.
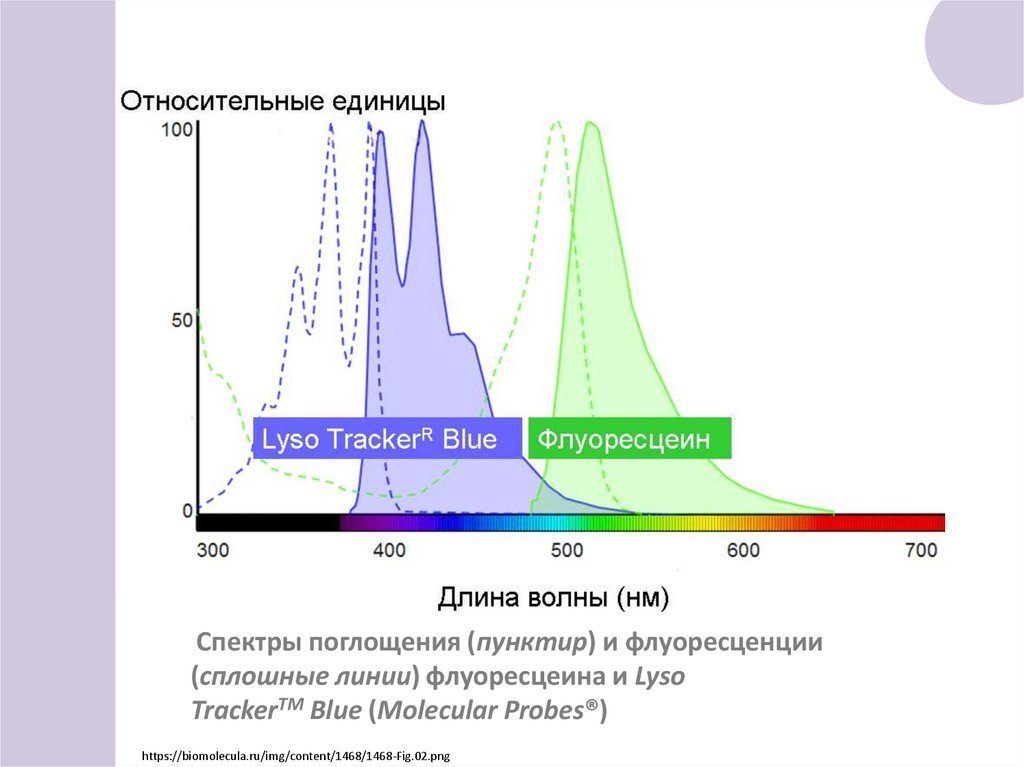
Спектры поглощения (пунктир) и флуоресценции(сплошные линии) флуоресцеина и Lyso
TrackerTM Blue (Molecular Probes®)
https://biomolecula.ru/img/content/1468/1468-Fig.02.png
34.
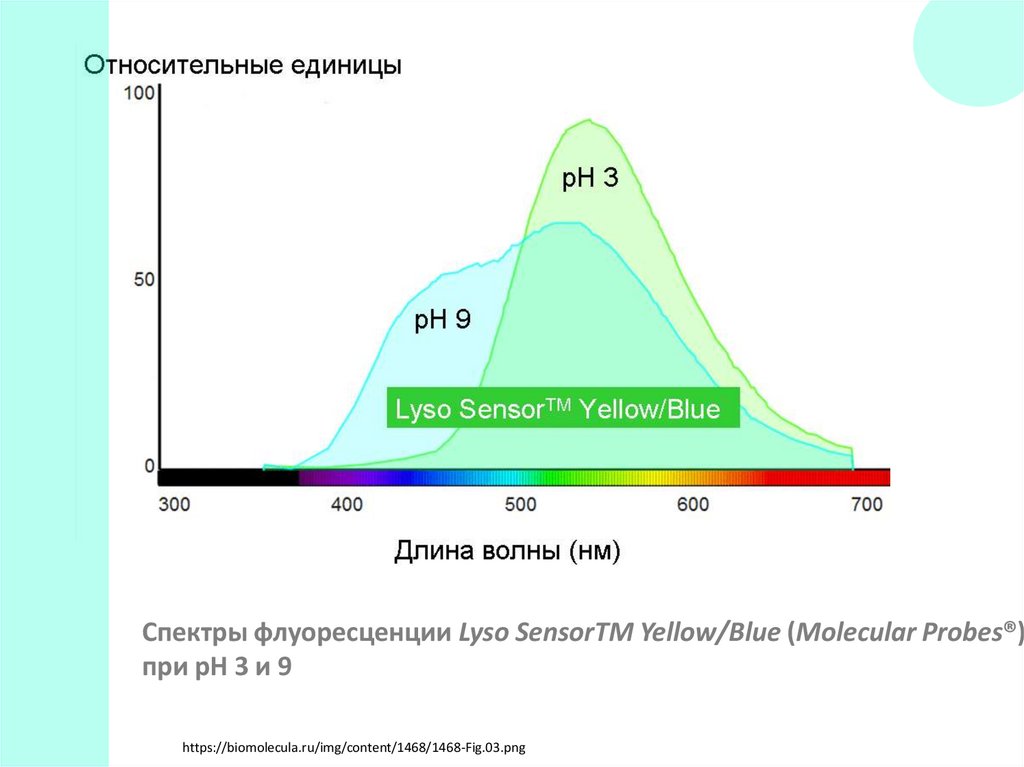
Спектры флуоресценции Lyso SensorTM Yellow/Blue (Molecular Probes®)при рН 3 и 9
https://biomolecula.ru/img/content/1468/1468-Fig.03.png
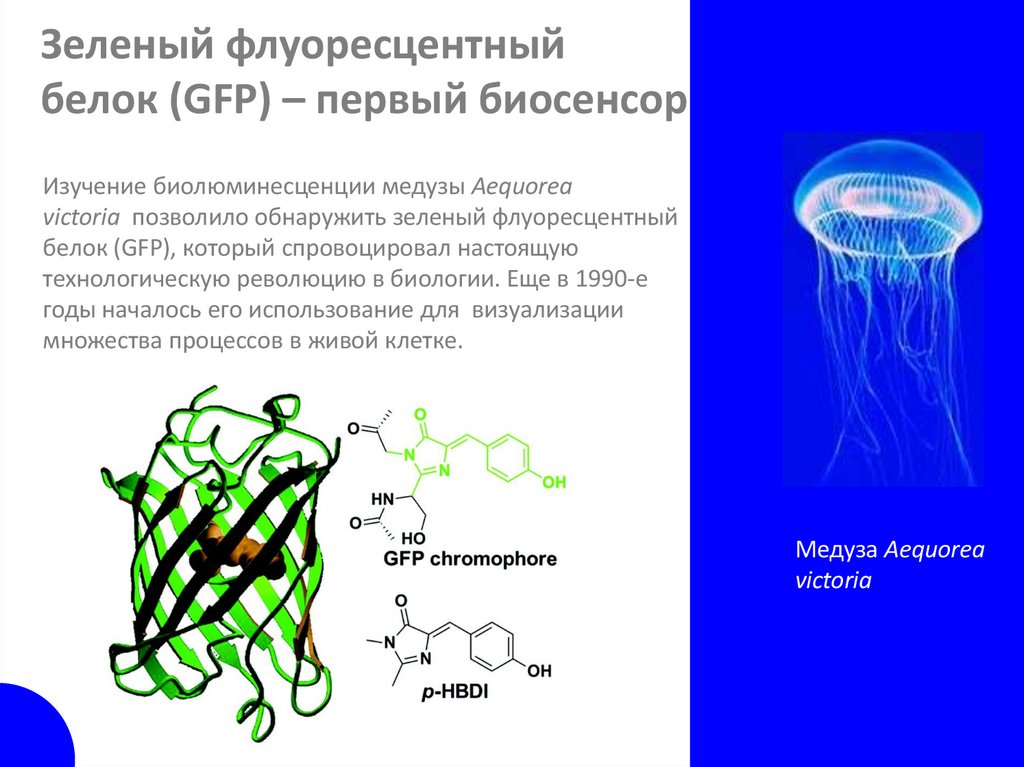
35. Зеленый флуоресцентный белок (GFP) – первый биосенсор
Изучение биолюминесценции медузы Aequoreavictoria позволило обнаружить зеленый флуоресцентный
белок (GFP), который спровоцировал настоящую
технологическую революцию в биологии. Еще в 1990-е
годы началось его использование для визуализации
множества процессов в живой клетке.
Медуза Aequorea
victoria
36.
Лауреаты Нобелевской премии по химии 2008 года«За открытие флуоресцентных белков и создание
исследовательских инструментов на их основе»
Осаму Шимомура
Мартин Челфи
Роджер Тсиен
37.
Ген клеточногобелка
Ген GFP
Химерный белок
Мыши, несущие ген
зеленого флуоресцентного
белка, и обычные мыши.
Использование зеленого
флуоресцентного белка
Разработана технология
использования GFP в качестве
маркерного протеина, который
можно присоединить к другому
внутриклеточному белку.
Если совместить ген GFP с геном,
кодирующим определённый белок,
после транскрипции и трансляции
образуется новый гибридный
(химерный) протеин, состоящий из
двух частей.
38.
Использованиефлуоресцентных белков
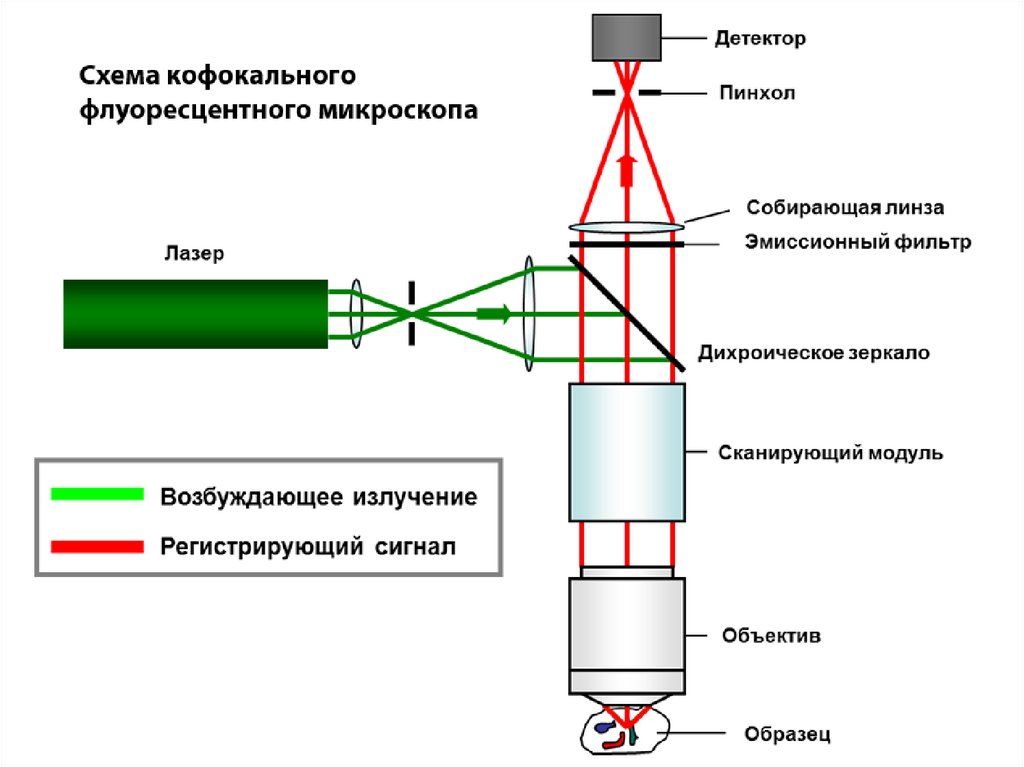
Благодаря конфокальной
флуоресцентной микроскопии
и разработке новых
флуоресцентных меток на базе
зеленого флуоресцентного
белка (GFP) и его аналогов
появилась возможность
получать специфически
контрастную окраску и делать
фотоснимки с высоким
разрешением многих
внутриклеточных белковых
структур.
39.
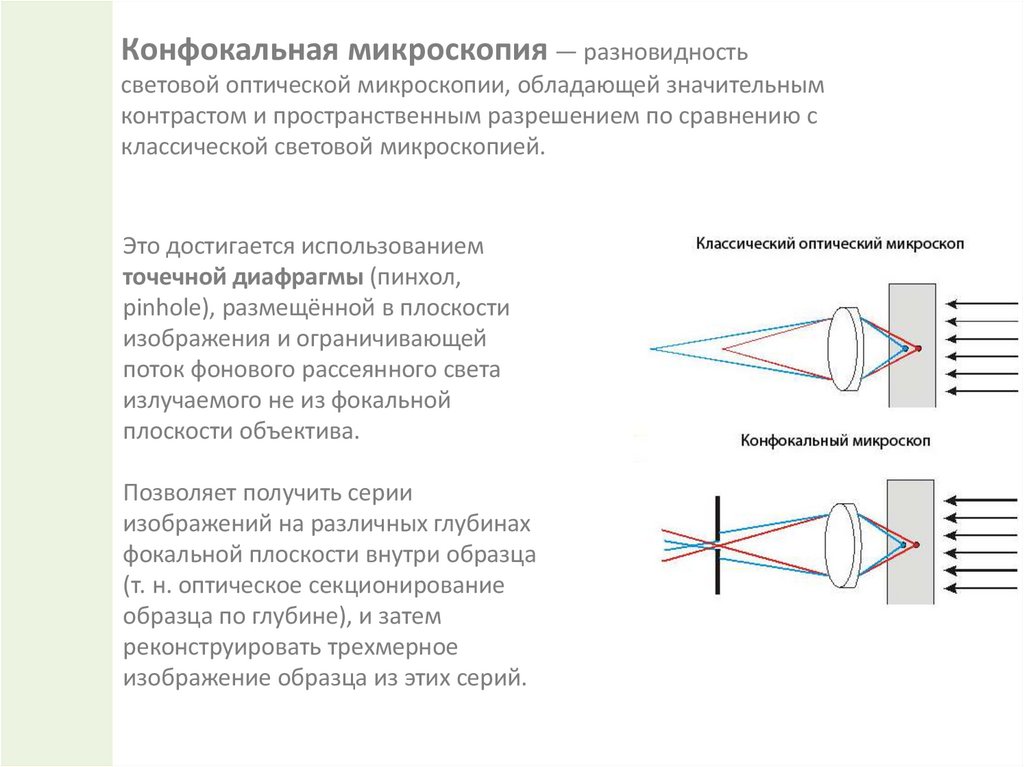
Конфокальная микроскопия — разновидностьсветовой оптической микроскопии, обладающей значительным
контрастом и пространственным разрешением по сравнению с
классической световой микроскопией.
Это достигается использованием
точечной диафрагмы (пинхол,
pinhole), размещённой в плоскости
изображения и ограничивающей
поток фонового рассеянного света
излучаемого не из фокальной
плоскости объектива.
Позволяет получить серии
изображений на различных глубинах
фокальной плоскости внутри образца
(т. н. оптическое секционирование
образца по глубине), и затем
реконструировать трехмерное
изображение образца из этих серий.
40.
41.
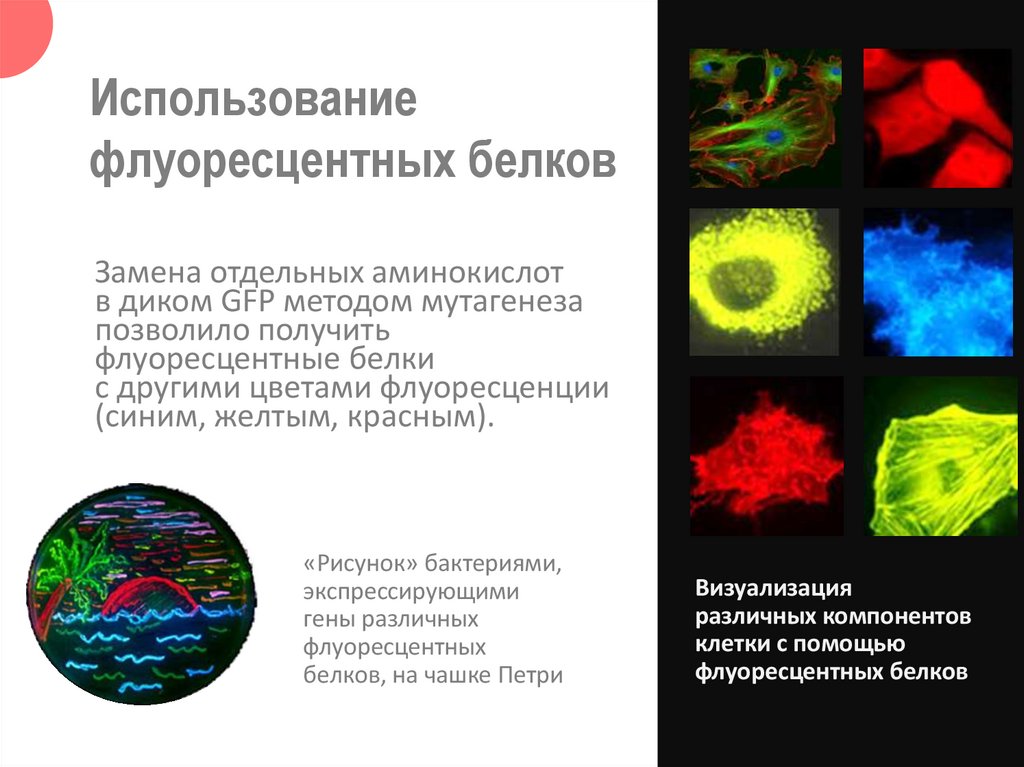
Использованиефлуоресцентных белков
Замена отдельных аминокислот
в диком GFP методом мутагенеза
позволило получить
флуоресцентные белки
с другими цветами флуоресценции
(синим, желтым, красным).
«Рисунок» бактериями,
экспрессирующими
гены различных
флуоресцентных
белков, на чашке Петри
Визуализация
различных компонентов
клетки с помощью
флуоресцентных белков
42.
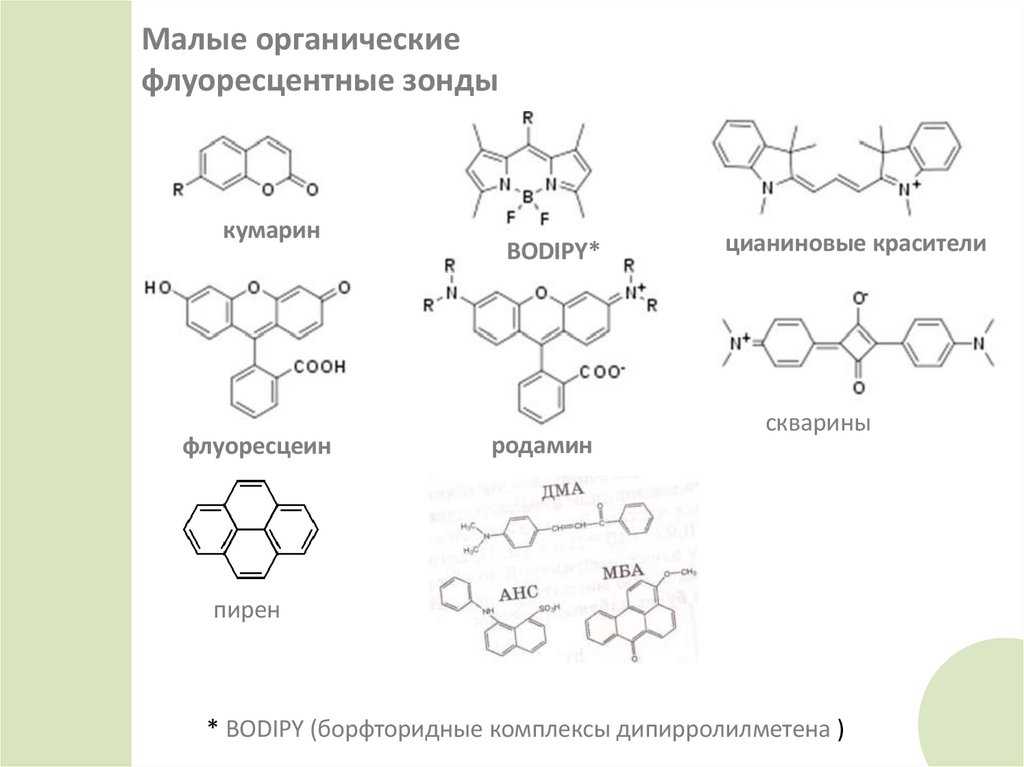
Малые органическиефлуоресцентные зонды
кумарин
флуоресцеин
BODIPY*
родамин
цианиновые красители
скварины
пирен
* BODIPY (борфторидные комплексы дипирролилметена )
43.
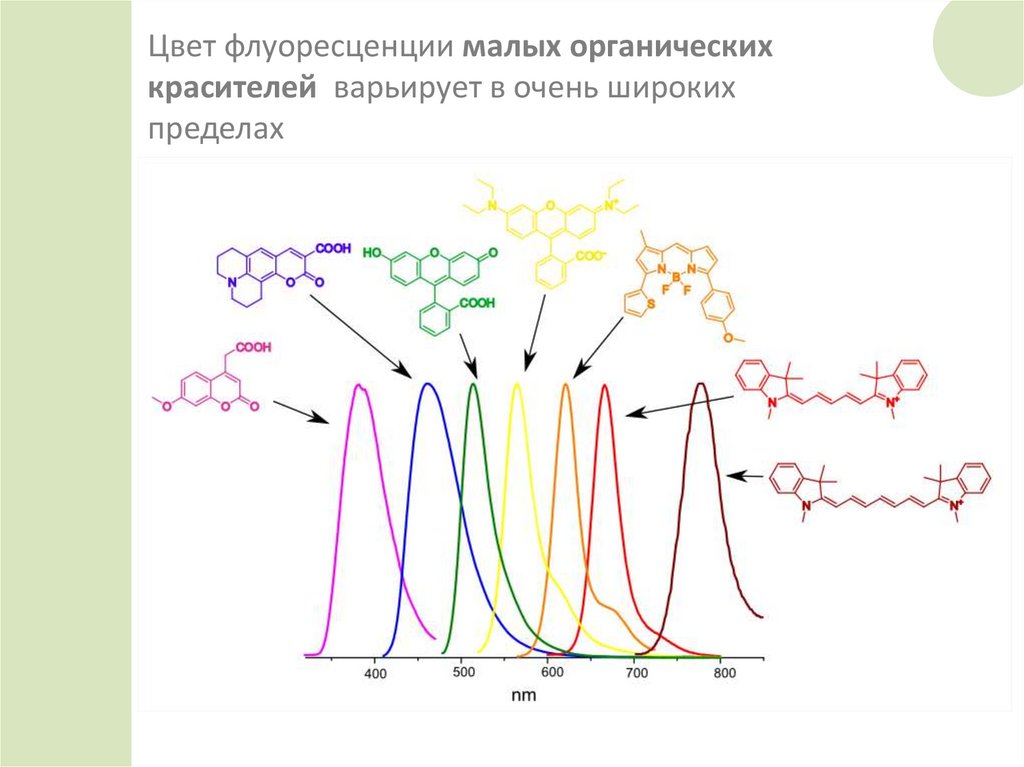
Цвет флуоресценции малых органическихкрасителей варьирует в очень широких
пределах
44.
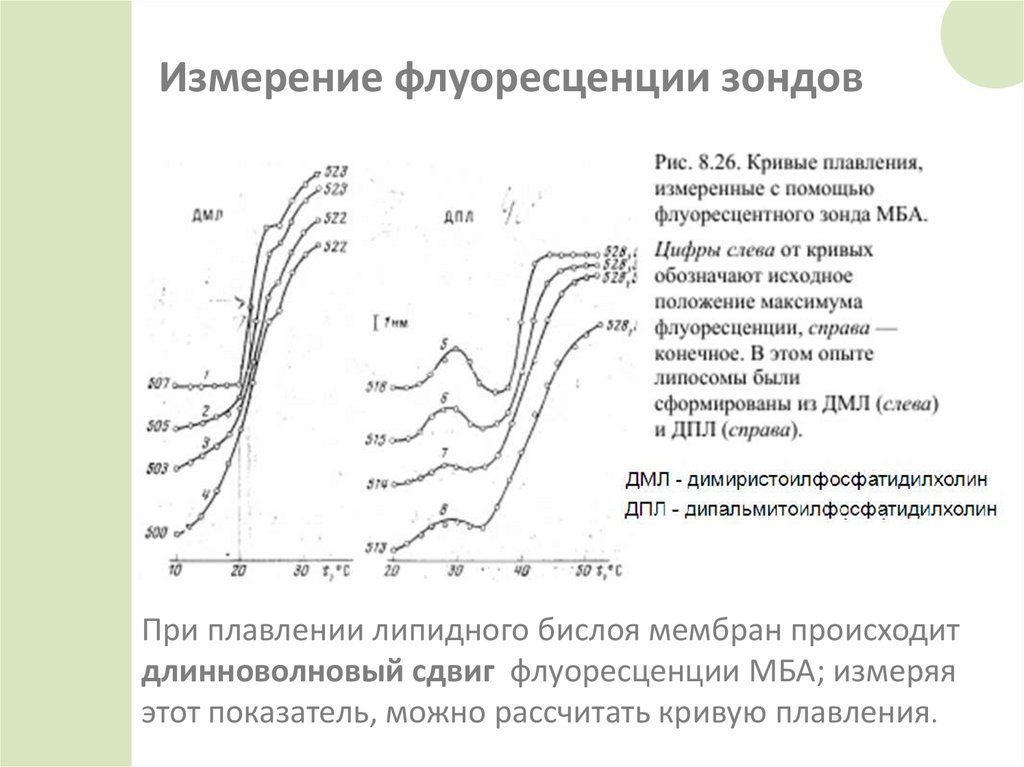
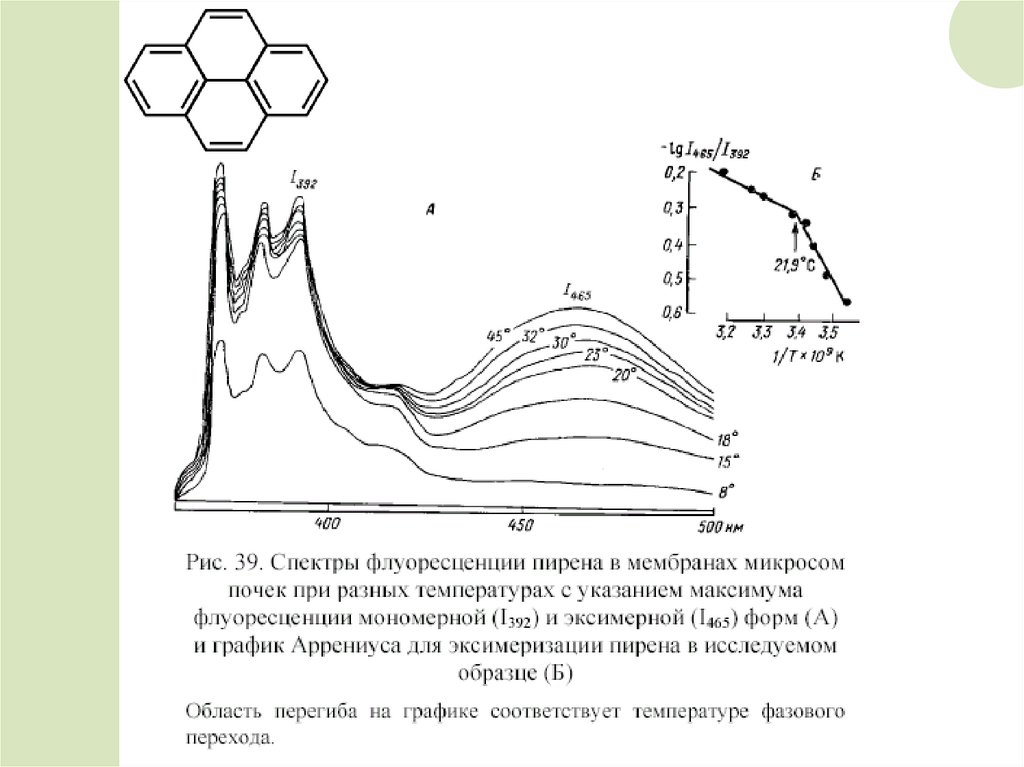
Измерение флуоресценции зондовПри плавлении липидного бислоя мембран происходит
длинноволновый сдвиг флуоресценции МБА; измеряя
этот показатель, можно рассчитать кривую плавления.
45.
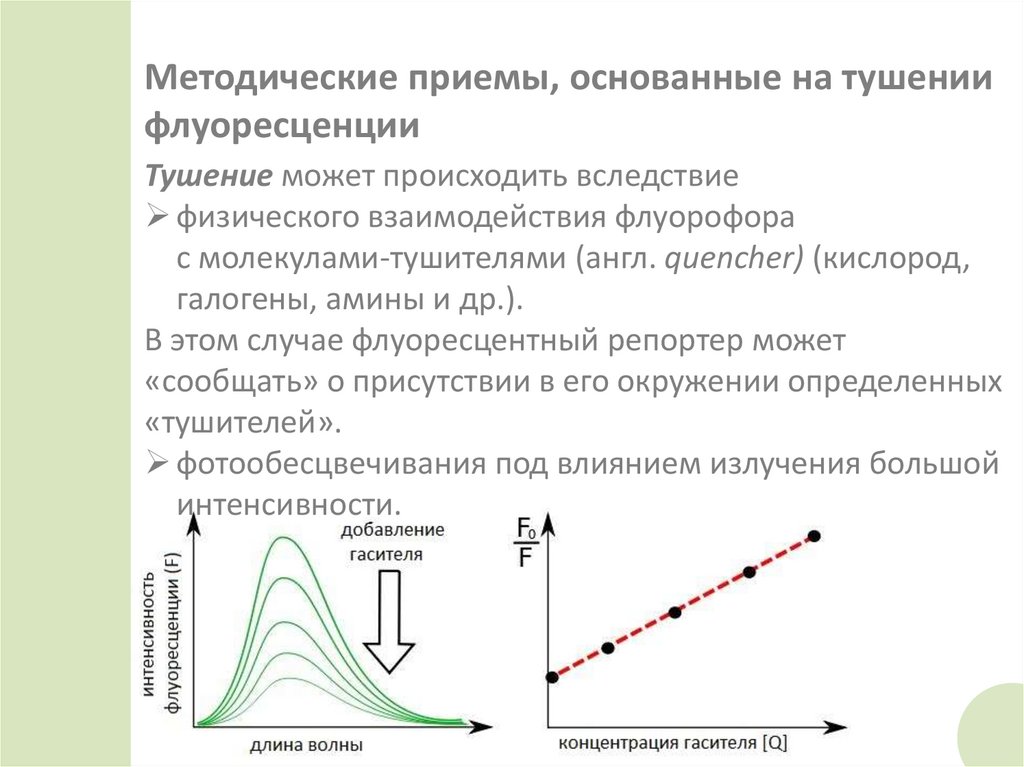
46. Методические приемы, основанные на тушении флуоресценции
Тушение может происходить вследствиефизического взаимодействия флуорофора
с молекулами-тушителями (англ. quencher) (кислород,
галогены, амины и др.).
В этом случае флуоресцентный репортер может
«сообщать» о присутствии в его окружении определенных
«тушителей».
фотообесцвечивания под влиянием излучения большой
интенсивности.
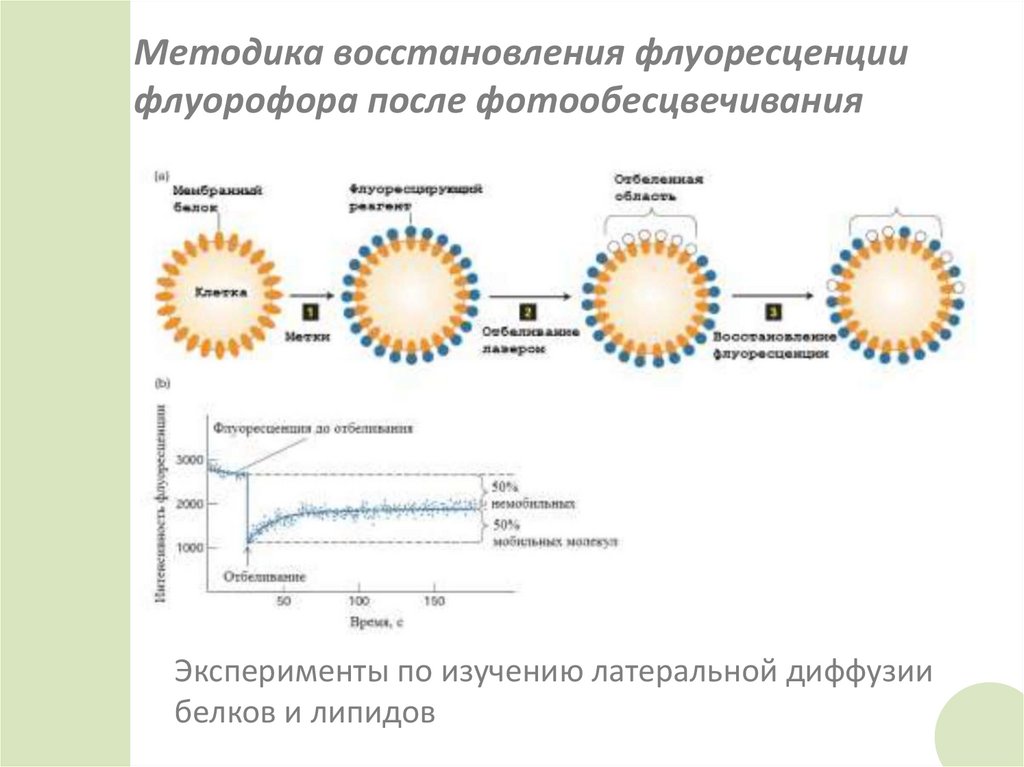
47. Методика восстановления флуоресценции флуорофора после фотообесцвечивания
Эксперименты по изучению латеральной диффузиибелков и липидов
48.
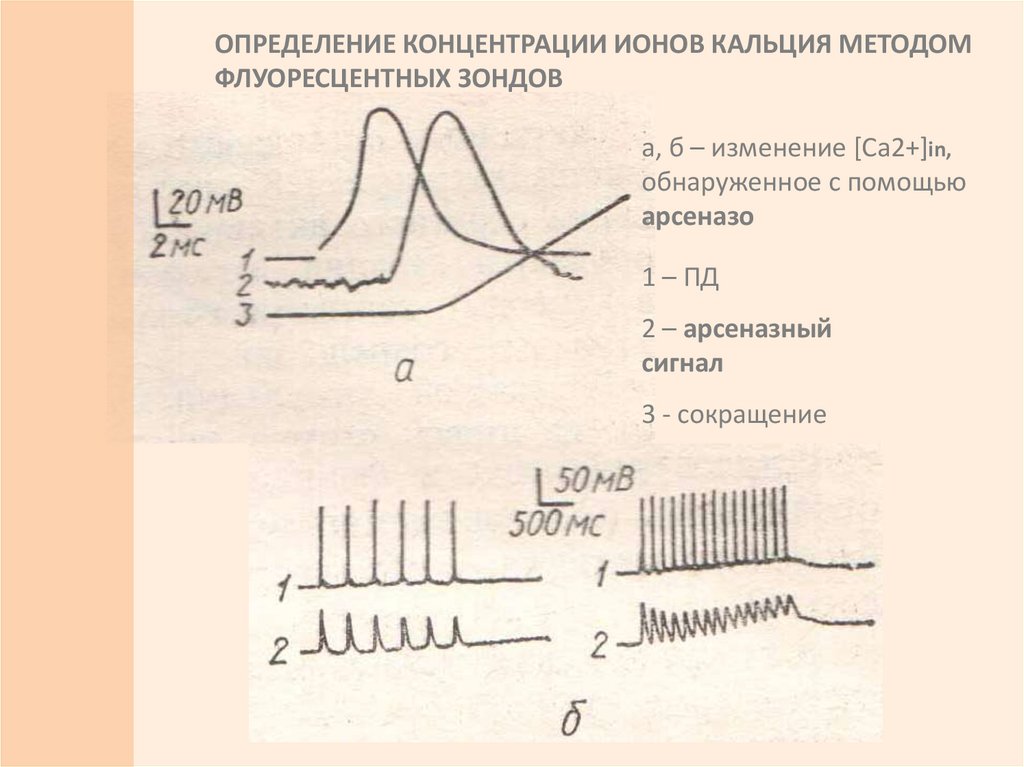
ОПРЕДЕЛЕНИЕ КОНЦЕНТРАЦИИ ИОНОВ КАЛЬЦИЯ МЕТОДОМФЛУОРЕСЦЕНТНЫХ ЗОНДОВ
а, б – изменение [Са2+]in,
обнаруженное с помощью
арсеназо
1 – ПД
2 – арсеназный
сигнал
3 - сокращение
49.
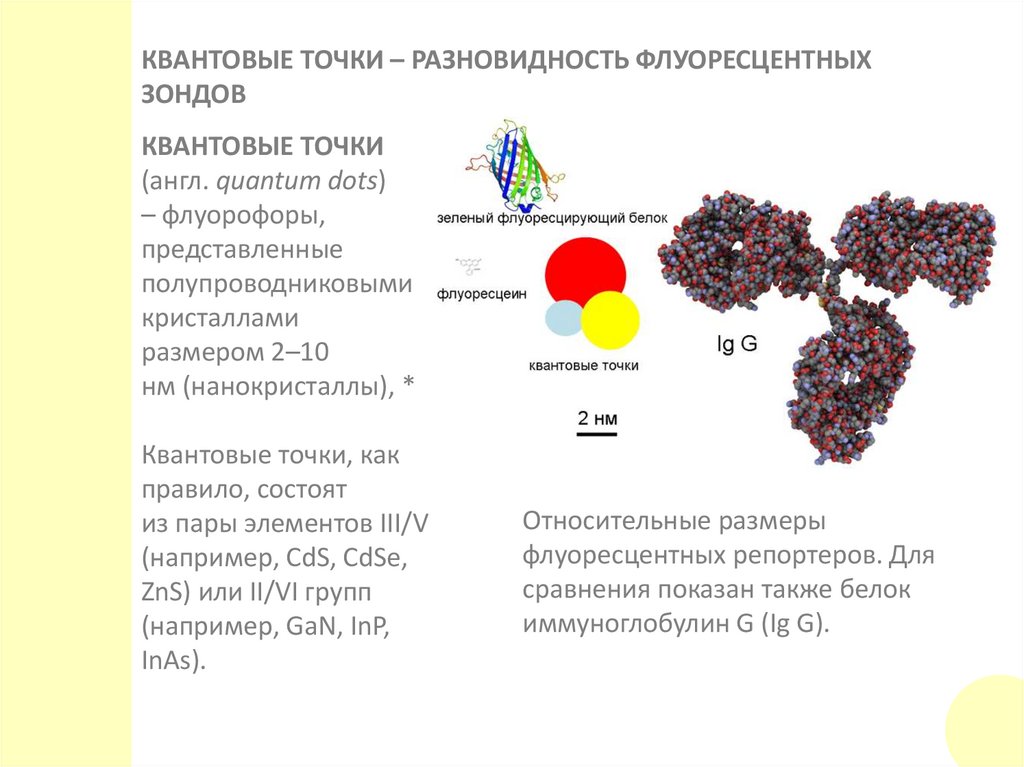
КВАНТОВЫЕ ТОЧКИ – РАЗНОВИДНОСТЬ ФЛУОРЕСЦЕНТНЫХЗОНДОВ
КВАНТОВЫЕ ТОЧКИ
(англ. quantum dots)
– флуорофоры,
представленные
полупроводниковыми
кристаллами
размером 2–10
нм (нанокристаллы), *
Квантовые точки, как
правило, состоят
из пары элементов III/V
(например, CdS, CdSe,
ZnS) или II/VI групп
(например, GaN, InP,
InAs).
Относительные размеры
флуоресцентных репортеров. Для
сравнения показан также белок
иммуноглобулин G (Ig G).
50.
Флуоресценцияколлоидных
растворов
квантовых
точек разного
размера
51.
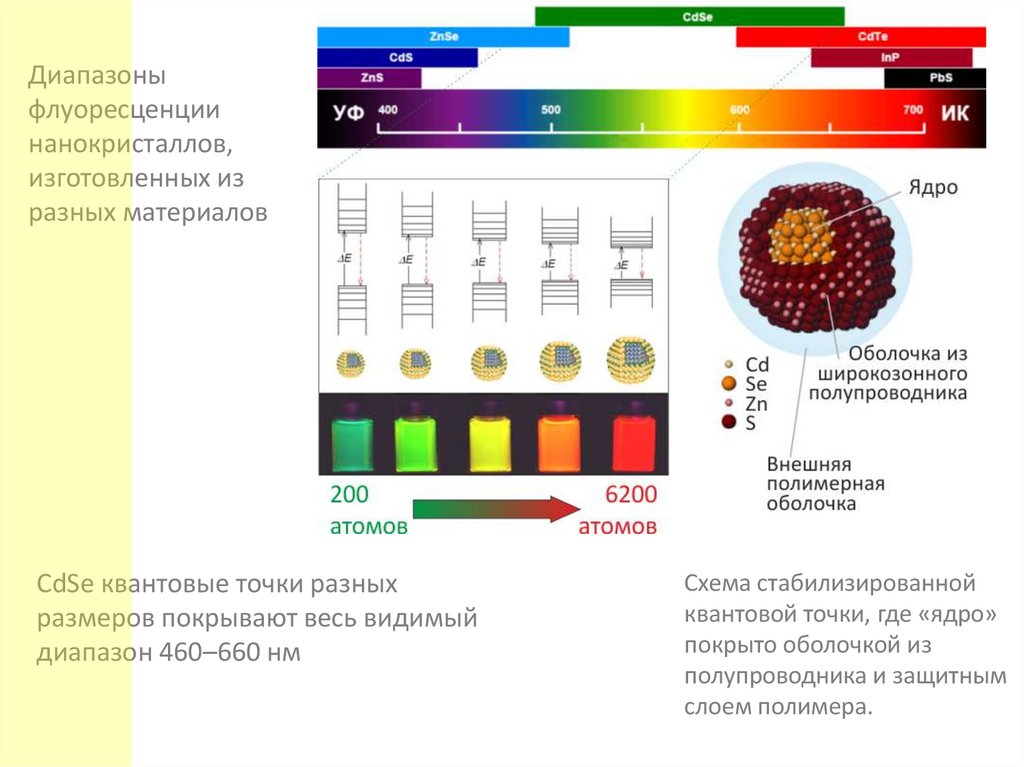
Диапазоныфлуоресценции
нанокристаллов,
изготовленных из
разных материалов
CdSe квантовые точки разных
размеров покрывают весь видимый
диапазон 460–660 нм
Схема стабилизированной
квантовой точки, где «ядро»
покрыто оболочкой из
полупроводника и защитным
слоем полимера.
52.
Для визуализации биологических объектов илипроцессов КВАНТОВЫЕ ТОЧКИ можно вводить в объект
непосредственно или с «пришитыми» распознающими
молекулами (обычно это антитела или
олигонуклеотиды).
Нанокристаллы проникают и распределяются по объекту
в соответствии со своими свойствами.
Например, нанокристаллы разных размеров по-разному
проникают сквозь биологические мембраны, а поскольку
размер определяет цвет флуоресценции, разные области
объекта оказываются окрашенными также по-разному.
53.
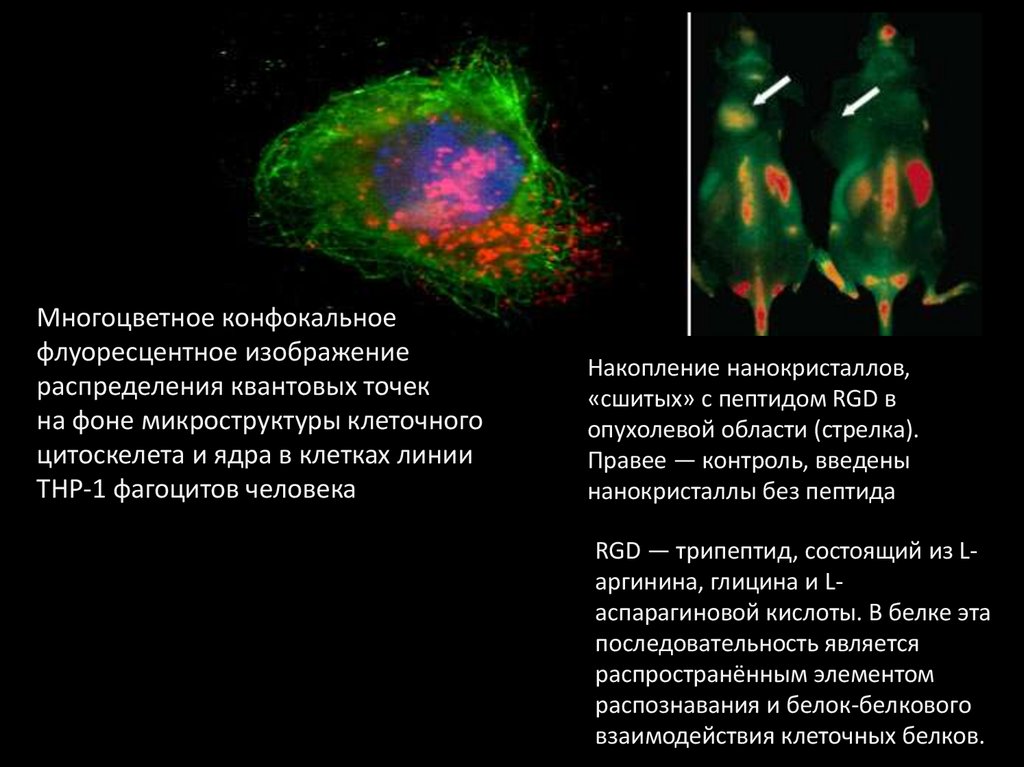
Многоцветное конфокальноефлуоресцентное изображение
распределения квантовых точек
на фоне микроструктуры клеточного
цитоскелета и ядра в клетках линии
THP-1 фагоцитов человека
Накопление нанокристаллов,
«сшитых» с пептидом RGD в
опухолевой области (стрелка).
Правее — контроль, введены
нанокристаллы без пептида
RGD — трипептид, состоящий из Lаргинина, глицина и Lаспарагиновой кислоты. В белке эта
последовательность является
распространённым элементом
распознавания и белок-белкового
взаимодействия клеточных белков.




















 physics
physics








