Similar presentations:
8 Изучение растворов солей. Составление реакций гидролиза pptx (1)
1. Изучение растворов солей. Составление реакций гидролиза солей.
2.
Гидролиз – реакция обмена междурастворимыми солей и водой
Сильные кислоты – кислоты, являющиеся сильными
электролитами (H2SO4, HCl, HNO3, HBr, HI, HClO4 и другие)
Слабые кислота – кислоты, являющиеся слабыми
электролитами (H2CO3, H2SO3, H2S, H2SiO3, H3PO4 и др)
Сильные основания – сильные электролиты щелочи (NaOH, KOH, Ca(OH)2 и другие)
Слабые основания – нерастворимые основания,
слабые электролиты (Cu(OH)2, Al(OH)3 и другие)
3.
Классификация солей,участвующих в гидролизе:
Соль образована
сильным основанием и слабой кислотой
Соль образована
слабым основанием и сильной кислотой
Соль образована
слабым основанием и слабой кислотой
Соль образована
сильным основанием и сильной кислотой –
гтдролизу НЕ подвергаются!!
4.
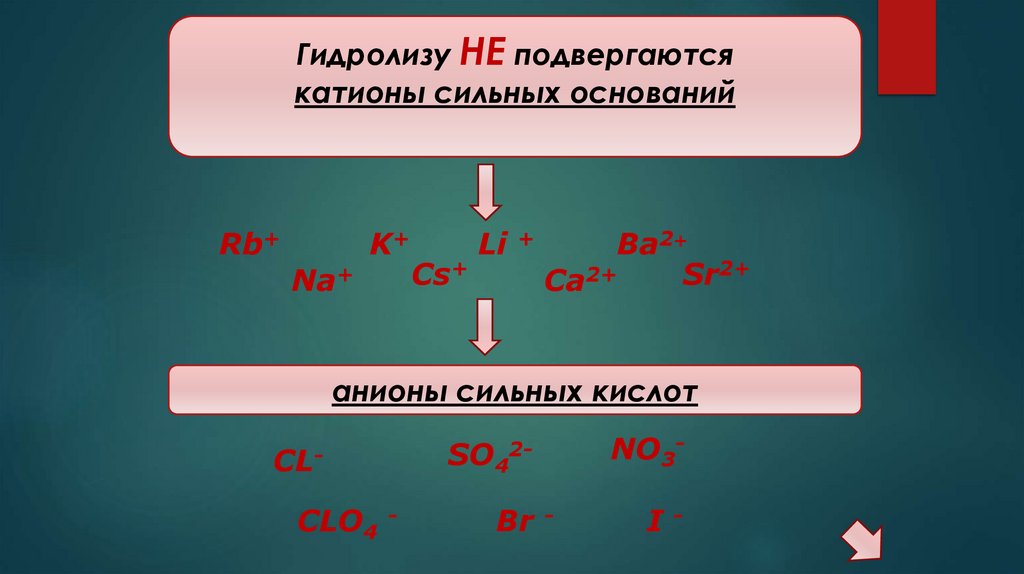
Гидролизу НЕ подвергаютсякатионы сильных оснований
Rb+
Na+
K+
Cs+
Li +
Ba2+
2+
2+
Sr
Ca
анионы сильных кислот
CLCLO4 -
SO4
2-
Br -
NO3I-
5.
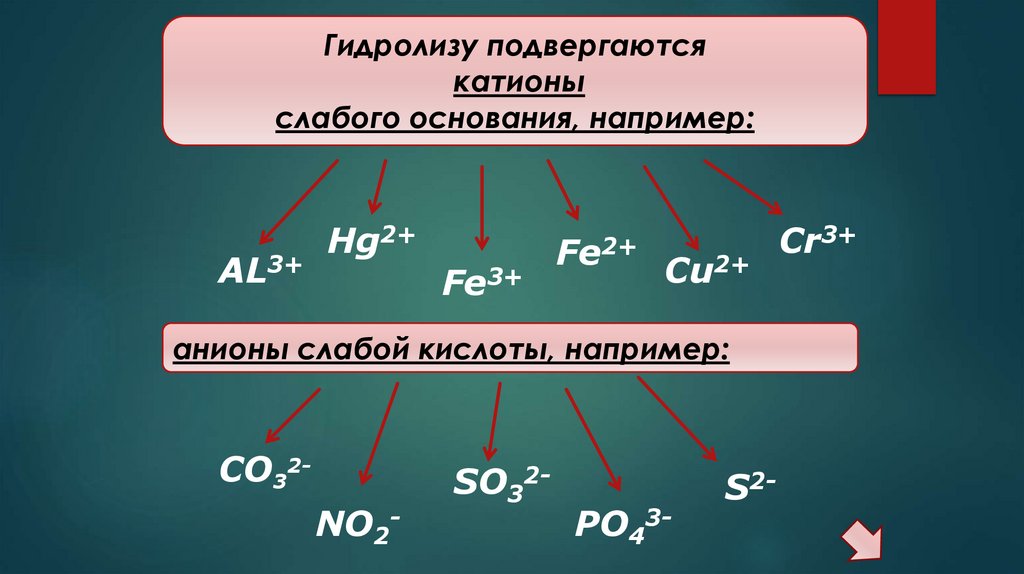
Гидролизу подвергаютсякатионы
слабого основания, например:
AL3+
Hg2+
Fe3+
Fe2+
Cu2+
анионы слабой кислоты, например:
CO32NO2-
SO32-
PO43-
S2-
Cr3+
6.
Алгоритм составленияуравнений гидролиза
Проверить растворимость соли.
Определить состав соли, т.е. указать, каким по
силе основанием и какой по силе кислотой
образована данная соль
Записать диссоциацию соли и подчеркнуть ион
слабого электролита
Записать уравнение взаимодействия иона слабого
электролита с водой
Определить среду раствора соли
Записать полное ионное уравнение
Записать молекулярное уравнение
7. Соли, образованные сильным основанием и слабой кислотой.
NaCN + Н2О ↔ NaOH + HCNNaCN ↔Na+ + CN‾
Н2О ↔ OH ‾ + H+
Полное ионное уравнение гидролиза:
Na+ + CN¯ + Н2О ↔ Na+ + OH¯ + HCN
Сокращённое уравнение гидролиза:
CN¯ + Н2О ↔ OH¯ + HCN
рн >7, среда щелочная, гидролиз по аниону.
8. Соли, образованные сильным основанием и слабой кислотой.
Гидролиз по аниону:1.
Обратимый процесс.
2.
Химическое равновесие смещено влево.
3.
Реакция среды - щелочная, рН>7.
4.
При гидролизе солей, образованных слабыми
многоосновными кислотами образуются кислые соли.
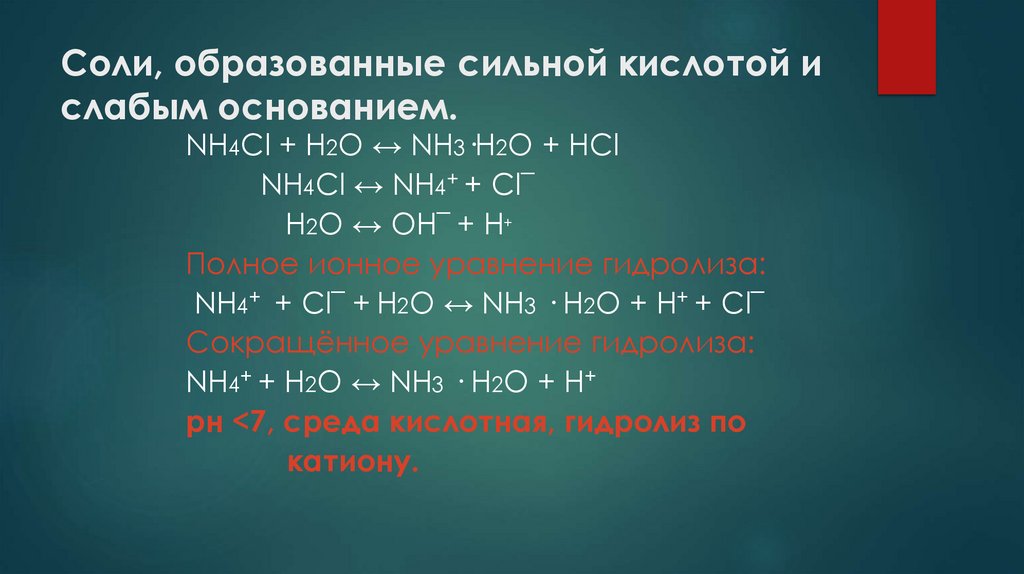
9. Соли, образованные сильной кислотой и слабым основанием.
NH4Cl + H2O ↔ NH3·H2О + НСlNH4Cl ↔ NH4+ + Cl¯
Н2О ↔ OH¯ + H+
Полное ионное уравнение гидролиза:
NH4+ + Cl¯ + Н2О ↔ NH3 · H2О + H+ + Cl¯
Сокращённое уравнение гидролиза:
NH4+ + Н2О ↔ NH3 · H2О + H+
рн <7, среда кислотная, гидролиз по
катиону.
10. Соли, образованные сильной кислотой и слабым основанием.
Гидролиз по катиону:1.
Обратимый процесс.
2.
Химическое равновесие смещено влево.
3.
Среда кислотная, рН<7.
11. Соли, образованные слабой кислотой и слабым основанием.
NH4СН3СОО + H2O ↔ СН3СООН + NH3 · H2ОNH4СН3СОО ↔ NH4 + + СН3СОО¯
Н2О ↔ OH¯ + H +
Ионное уравнение гидролиза:
NH4 + + СН3СОО¯ + Н2О ↔ NH3 · H2О + СН3СООН
рн = 7, среда нейтральная, гидролиз по
катиону и по аниону.
12. Соли, образованные слабой кислотой и слабым основанием.
Гидролиз по катиону и по аниону.1.
Химическое равновесие смещено вправо.
2.
Реакция среды или нейтральная, или
слабокислая, или слабощелочная, что
зависит от констант диссоциации кислоты и
основания.
3.
Гидролиз может быть необратимым, если
хотя бы один из продуктов реакции
гидролиза уходит из сферы реакции.
13. Соли, образованные сильной кислотой и сильным основанием.
КСl + H2O ↔КСl ↔ К + + Сl¯
Н2О ↔ OH¯ + H +
Все ионы остаются в растворе – гидролиз не
происходит. Среда нейтральная, рН =7, т.к.
концентрации катионов водорода и гидроксид анионов в растворе равны, как в чистой воде.










 chemistry
chemistry








