Similar presentations:
Гетерогенные равновесия в водных системах. ОВР. Лекция 7
1. Лекция 7 Гетерогенные равновесия в водных системах. ОВР.
Федеральное государственное бюджетноеобразовательное учреждение высшего образования
«Уральский государственный медицинский университет»
Минздрава России
Лекция 7
Гетерогенные равновесия в водных системах.
ОВР.
Вопросы:
1. Теория гетерогенных равновесий. ПР и ПК.
2. Гетерогенные и протолитические равновесия
3. ОВР. Особенности ОВР в организме.
Лектор – зав.кафедрой общей химии, Белоконова Надежда Анатольевна
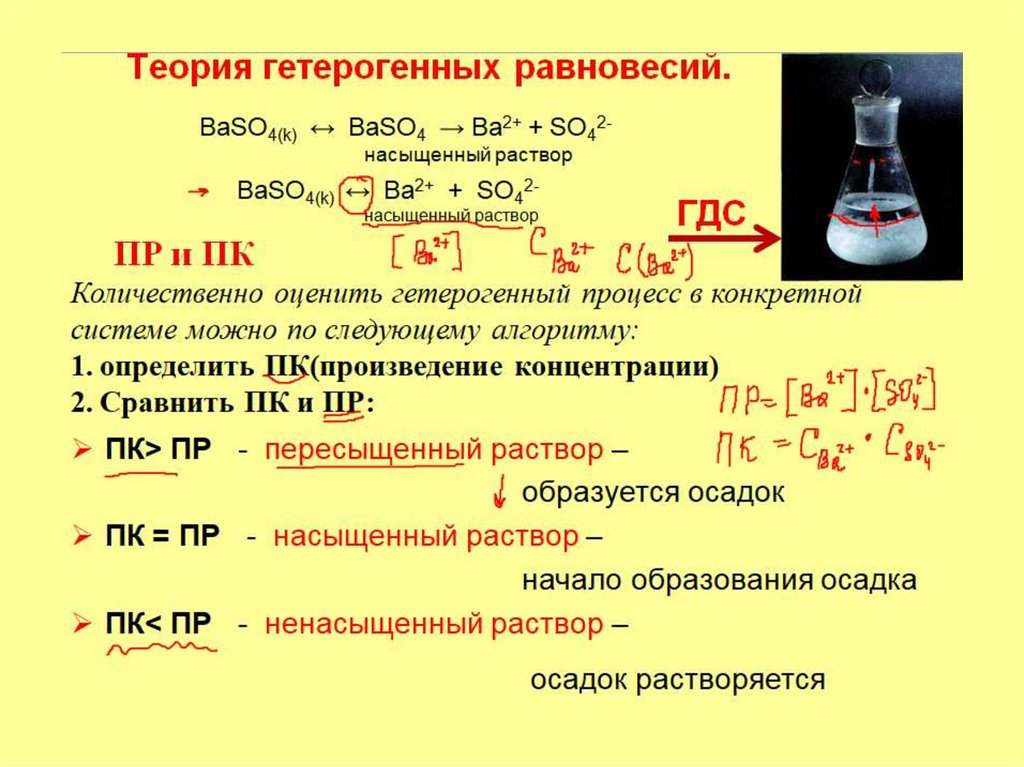
2. 1. Теория гетерогенных равновесий
Дисперсная система – это система, состоящая издисперсной фазы (ДФ) дисперсионной среды (ДС):
ДФ:
Размер частиц:
• Истинные растворы НМС
(М<5000г/моль): 10-10 – 1012м;
ВМС(М>5000г/моль): 107 – 10-9м
• ГДС: >10-7м,
• КДС: 10-7 – 10-9м
ГДС
ДФ+ДС:
Характер взаимодействия:
Лиофильное (греч. «филио»люблю) - сильное
взаимодействие, С. образуются
самопроизвольно,
термодинамически устойчивы,
стабилизатор не требуется
(растворы электролитов, белков,
полинуклеиновых кислот)
• Лиофобное (греч. «лиос» жидкость, «фобио»-ненавижу)слабое взаимодействие
(С.
термодинамически неустойчивы,
требуется стабилизатор),
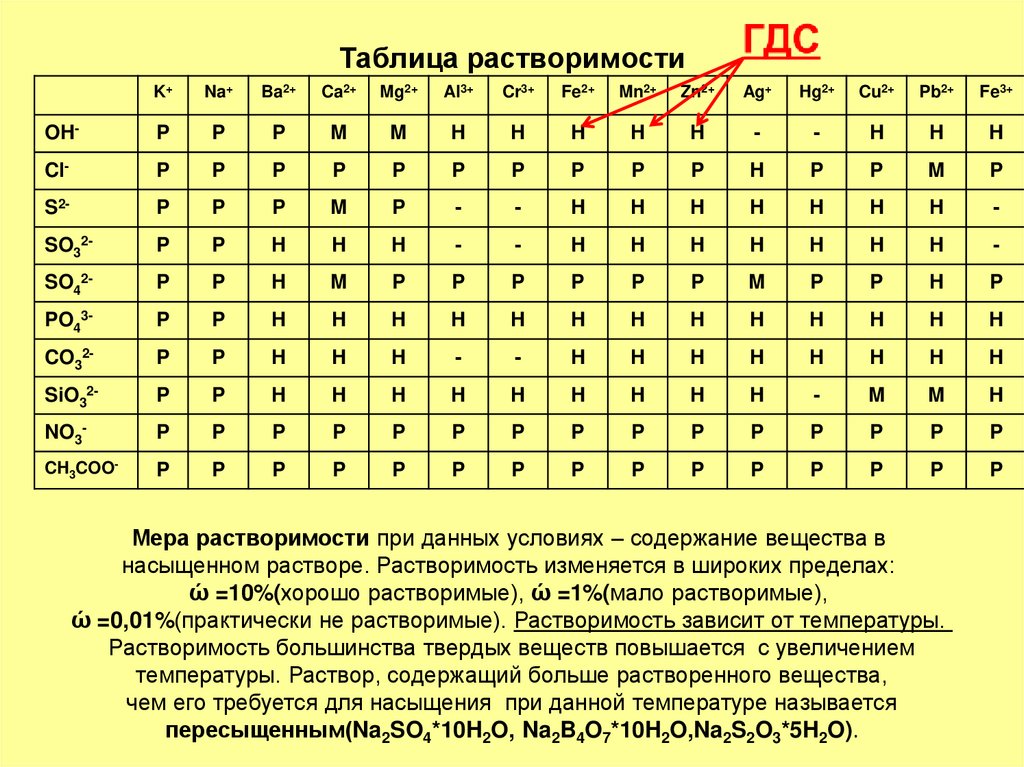
3. Таблица растворимости
K+Na+
Ba2+
Ca2+
Mg2+
Al3+
Cr3+
Fe2+
Mn2+
Zn2+
Ag+
Hg2+
Cu2+
Pb2+
Fe3+
OH-
P
P
P
M
M
H
H
H
H
H
-
-
H
H
H
Cl-
P
P
P
P
P
P
P
P
P
P
H
P
P
M
P
S2-
P
P
P
M
P
-
-
H
H
H
H
H
H
H
-
SO32-
P
P
H
H
H
-
-
H
H
H
H
H
H
H
-
SO42-
P
P
H
M
P
P
P
P
P
P
M
P
P
H
P
PO43-
P
P
H
H
H
H
H
H
H
H
H
H
H
H
H
CO32-
P
P
H
H
H
-
-
H
H
H
H
H
H
H
H
SiO32-
P
P
H
H
H
H
H
H
H
H
H
-
M
M
H
NO3-
P
P
P
P
P
P
P
P
P
P
P
P
P
P
P
CH3COO-
P
P
P
P
P
P
P
P
P
P
P
P
P
P
P
Мера растворимости при данных условиях – содержание вещества в
насыщенном растворе. Растворимость изменяется в широких пределах:
ώ =10%(хорошо растворимые), ώ =1%(мало растворимые),
ώ =0,01%(практически не растворимые). Растворимость зависит от температуры.
Растворимость большинства твердых веществ повышается с увеличением
температуры. Раствор, содержащий больше растворенного вещества,
чем его требуется для насыщения при данной температуре называется
пересыщенным(Na2SO4*10H2O, Na2B4O7*10H2O,Na2S2O3*5H2O).
4.
Теория гетерогенных равновесий.5. ПРОИЗВЕДЕНИЯ РАСТВОРИМОСТИ МАЛОРАСТВОРИМЫХ ВЕЩЕСТВ (25оС)
СоединениеAl(OH)3
AgCl
AgBr
AgCN
ПР
5,1·10-33
1,6·10-10
7,7·10-13
1,4·10-16
AgI
Ag2S
1,5·10-16
3,9·10-50
Ag2CrO4
BaCrO4
BaSO4
ВаСО3
Bi(OH)3
Bi2S3
Cr(OH)3
Со(ОН)2
CoS
СоСО3
CdS
CuS
Cu2S
CaF2
Са(ОН)2
CaCO3
CaSO4
СаС2О4
Ca5(PO4)3ОН
1,1·10-12
2,3·10-10
1,1·10-10
8,1·10-9
4,3·10-31
1,6·10-72
6,7·10-31
6,0·10-16
3,1·10-23
1,45·10-13
1,2·1028
4,0·10-38
2,5·10-50
4,0·10-7
5,47·10-6
4,8·10-9
6,1·10-5
2,3·10-9
1,6·10-58
Соединение
Ca3(PO4)2
Fe(OH)3
Fe(OH)2
FeS
MgCO3
MnS
Mn(OH)2
Ni(OH)2
NiCO3
NiS
Pb(OH)2
PbCl2
PbI2
PbCrO4
PbCO3
PbSO4
PbS
Sb2S3
Sn(OH)2
Sr(OH)2
SrSO4
Zn(OH)2
ZnS
ZnCO3
HgS
ПР
3,5·10-33
3,8·10-38
1,65·10-15
3,7·10-19
1,0·10-5
1,4·10-15
4,0·10-14
1,6·10-14
1,4·10-7
3,0·10-21
2,0·10-16
2,4·10-4
8,7·10-9
1,8·10-14
3,3·10-14
1,0·10-8
1,1·10-29
1,0·10-30
5,0·10-26
3,2·10-4
3,2·10-7
1,3·10-17
7,4·10-27
2,7·10-8
4,0·10-53
6.
7. Задача 1
Смешаны равные объемы 0,002 М растворахлорида бария и сульфата натрия.
Образуется ли осадок сульфата бария?
ПРВaSO4 = 1,1•10-10
Алгоритм решения:
1. Написать уравнение и выражение для ПР
2.определить ПК(произведение концентрации)
3. Сравнить ПК и ПР
8. Задача 1
Решение0,001 М + 0,001М
ВaCl2 + Na2SO4 = ВaSO4 + 2 NaCl
ПР = [Ba2+]*[SO42-]
BaSO4(k) ↔ Ba2+ + SO42-
насыщенный раствор
ПК = С(Ba2+)* С(SO42-) = (1*10-3) * (1*10-3) = 1*10-6
ПРВaSO4 = 1,1•10-10
ПК > ПР раствор пересыщенный. Осадок выпадет.
9. Задача 2
Определите концентрацию ионов свинцав насыщенном растворе.
Каким будет раствор иодида свинца, если
СPb2+ = 1,5∙10-3, CI- = 3∙10-3 моль ион/л,
ПР = 8,7∙10-9?
Алгоритм решения:
1. Написать уравнение и выражение для ПР
2.определить ПК(произведение концентрации)
3. Сравнить ПК и ПР
10.
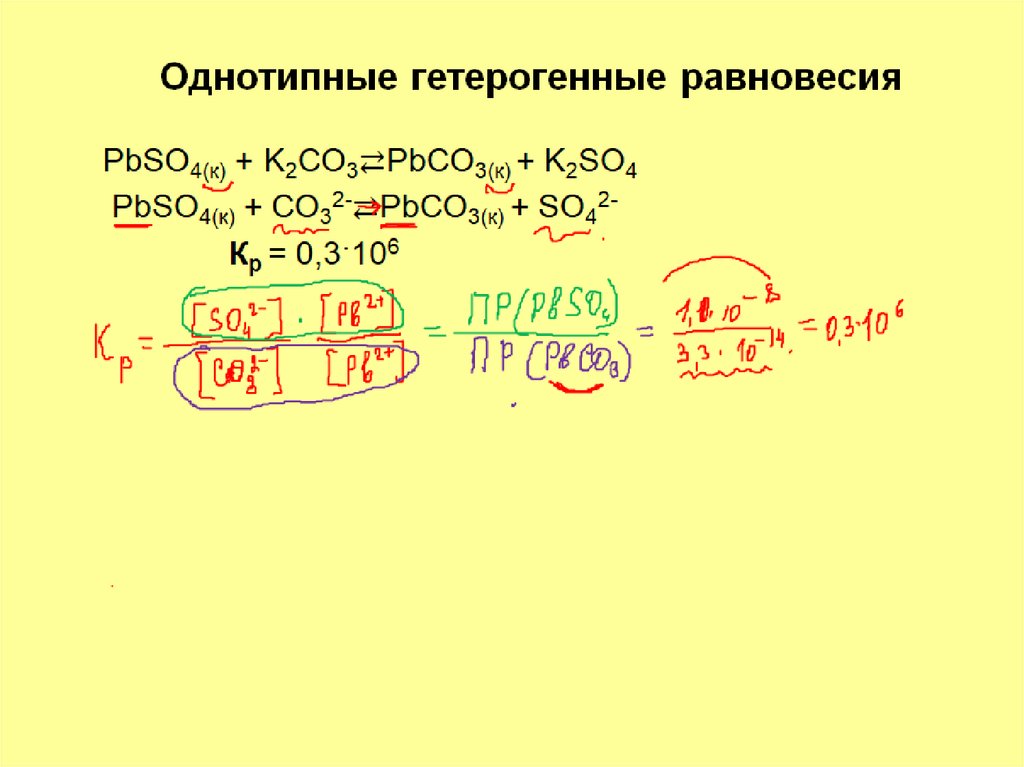
11. Типы гетерогенных равновесий:
2. Гетерогенные и протолитические равновесияОбратимыми являются реакции, если им
соответствуют значения Кравн, находящиеся в
диапазоне от 10–5 до 105. Реакции, Кравн> 1·105,
протекают только в прямом направлении. A реакции
с K < 1·10–5 идут только в обратном направлении.
Типы гетерогенных равновесий:
• Однотипные конкурирующие равновесия в
которых конкурирующие между собой частицы
принимают участие в однотипных процессах
• Конкурирующие равновесия разных типов, когда
конкурирующие между собой частицы принимают
участие в разнотипных процессах.
12.
13. Задача 3
Растворится ли осадок хлорида свинца врастворе иодида натрия? ПР(PbJ2) = 8,7∙10-9
ПР(PbCl2) = 2,4∙10-4
Решение
PbCl2(т)
+
2NaJ
PbCl2(т)
+
2J-
[Cl-]2 [Pb2+] =
K=
[ J-]2 [Pb2+]
= PbJ2 (т) + 2NaCl
=
ПР(PbCl2)
ПР (PbJ2) =
PbJ2(т)
2,4∙10-4
8,7∙10-9
Осадок растворится
+ 2Cl-
= 0,27*105
14.
15.
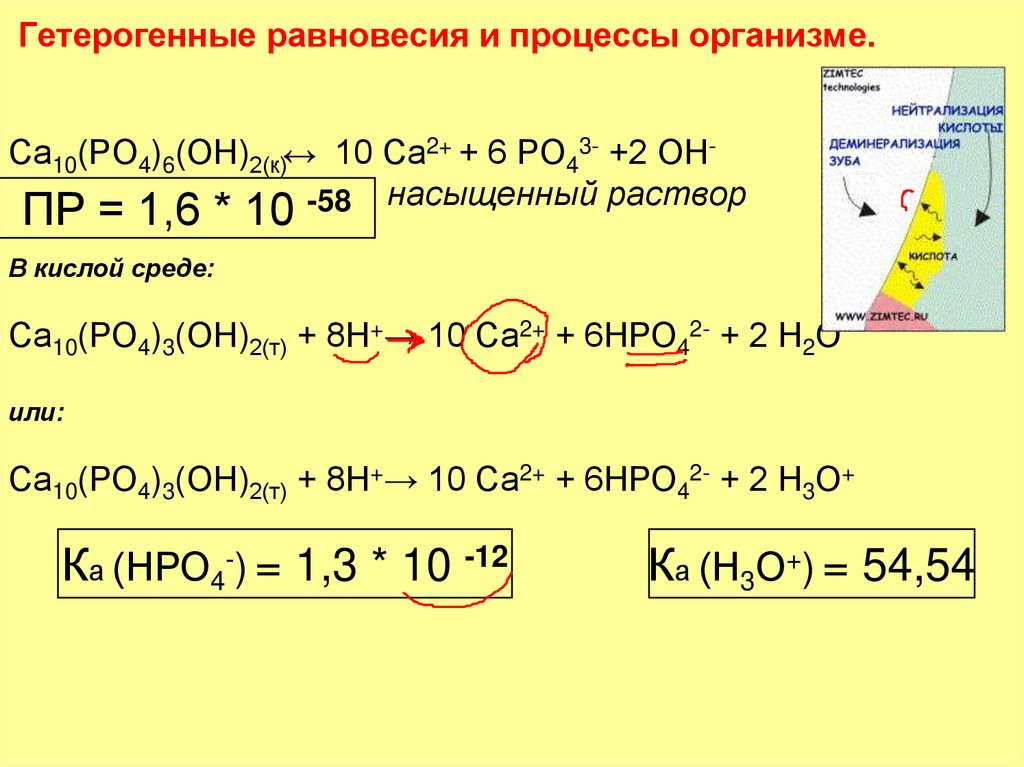
16. Гетерогенные равновесия и процессы организме.
Са10(РО4)6(ОН)2(к)↔ 10 Са2+ + 6 РО43- +2 ОН-58 насыщенный растворПР = 1,6 * 10
В кислой среде:
Са10(РО4)3(ОН)2(т) + 8Н+→ 10 Са2+ + 6НРО42- + 2 Н2О
или:
Са10(РО4)3(ОН)2(т) + 8Н+→ 10 Са2+ + 6НРО42- + 2 Н3О+
Ка (НРО4-) = 1,3 * 10 -12
Ка (Н3О+) = 54,54
17.
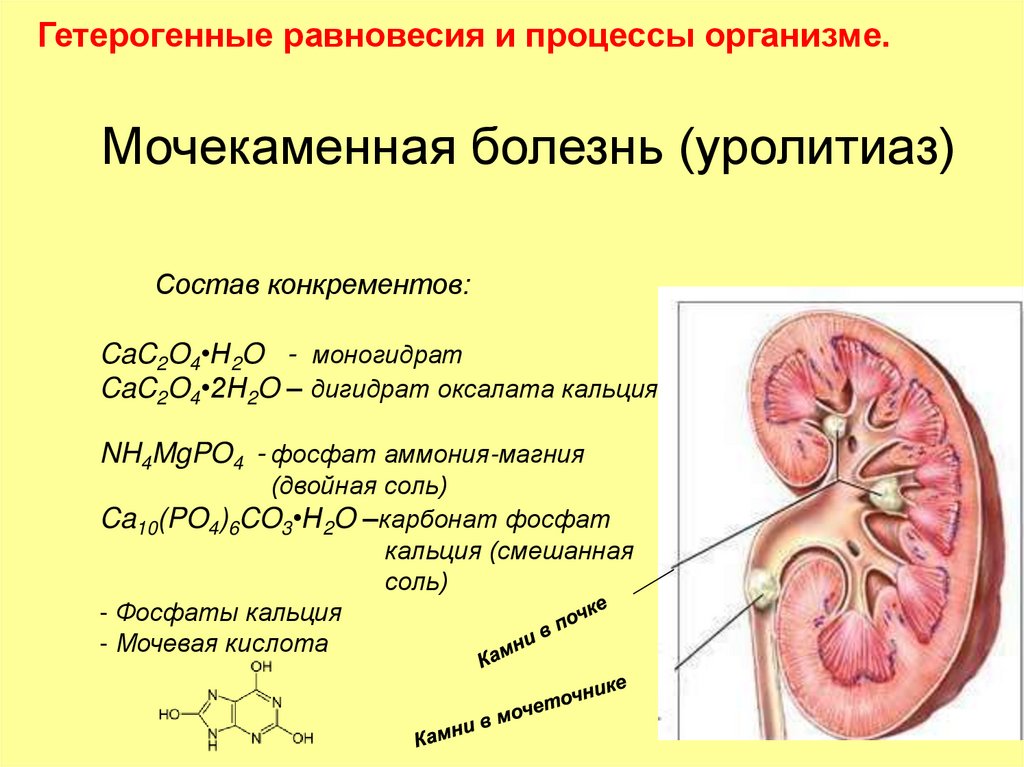
Гетерогенные равновесия и процессы организме.Мочекаменная болезнь (уролитиаз)
Состав конкрементов:
CaC2O4•H2O - моногидрат
CaC2O4•2H2O – дигидрат оксалата кальция
NH4MgPO4 - фосфат аммония-магния
(двойная соль)
Ca10(PO4)6CO3•H2O –карбонат фосфат
кальция (смешанная
соль)
- Фосфаты кальция
- Мочевая кислота
18. 3. Окислительно-восстановительные реакции - реакции, протекающие с изменением степени окисления атомов вследствие
3. Окислительно-восстановительныереакции реакции, протекающие с изменением степени
окисления атомов вследствие перераспределения
электронов между ними.
!!! всегда происходят отдача и присоединение электронов:
Окислитель – принимает электроны
Восстановитель – отдает электроны
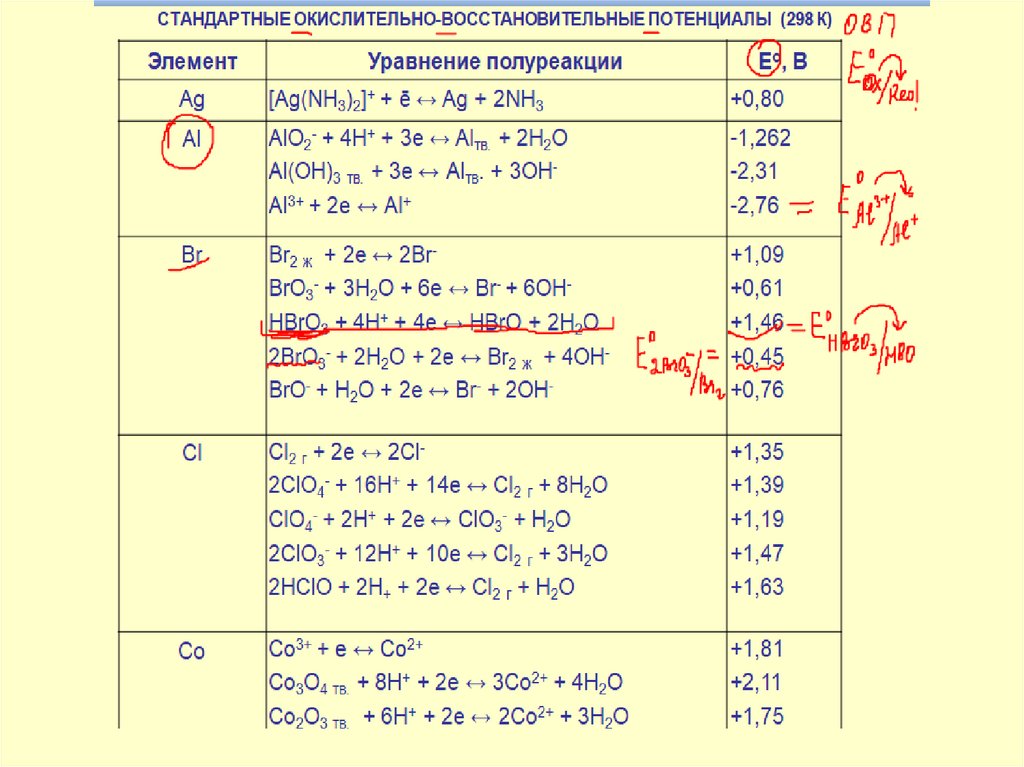
19. Количественной мерой окислительно-восстановительной способности сопряженной окислительно-восстановительной пары является
Количественной мерой окислительновосстановительной способностисопряженной окислительновосстановительной пары
является
величина стандартного окислительновосстановительного потенциала:
чем больше величина, тем выше
окислительная способность
20.
21.
22. Условием самопроизвольного протекания окислительно-восстановительной реакции является положительное значение ее ЭДС, т.е. Ео =
Еоок – Еовосст > 0.Еоок > Еовосст
Изменение стандартной энергии Гиббса связано с ЭДС
окислительно-восстановительной реакции:
ΔGo = -zFEo,
где: F = 96 500 Кл/моль;
z – число электронов,
принимающих участие в элементарном процессе.
23. Молярная масса эквивалента окислителя или восстановителя равна их молярной массе М(Х), умноженной на фактор их эквивалентности
1/z в даннойреакции
где:
z – число электронов, принятых или отданных
одной частицей (молекулой, атомом, ионом)
окислителя или восстановителя
24.
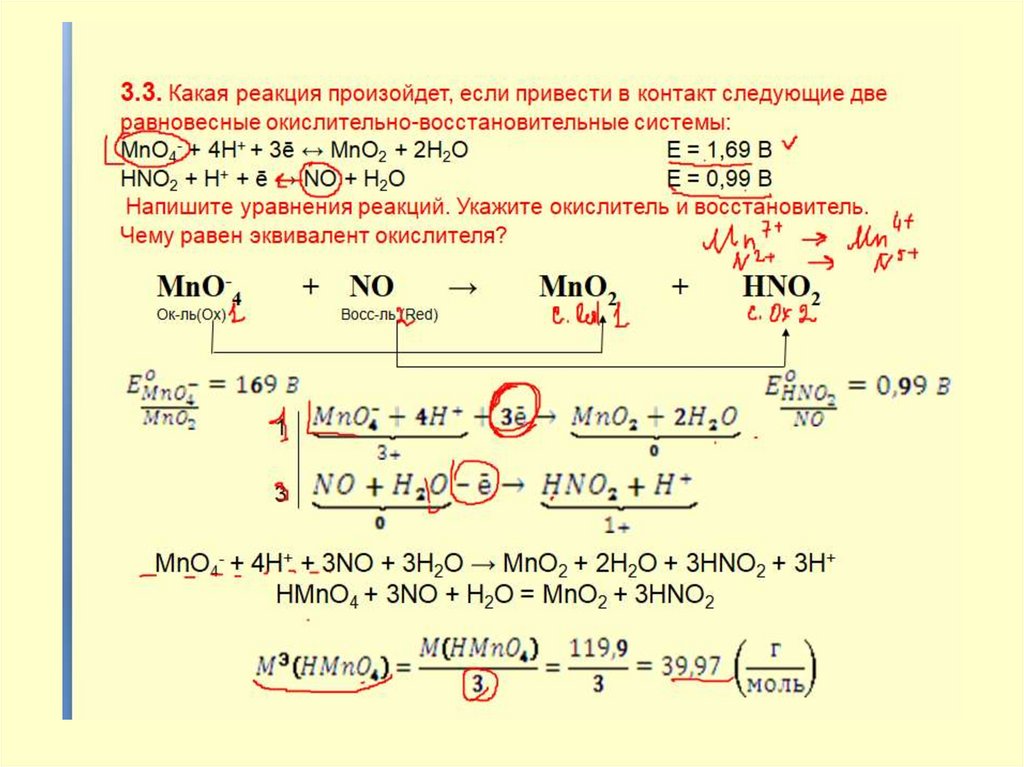
25. 3. 4. Какой из приведенных окислителей следует взять, чтобы осуществить превращение: Br2 → 2BrO- Eо = 0,45 B Окислители: Чему
3. 4. Какой из приведенных окислителей следует взять, чтобы осуществитьпревращение:
Br2 → 2BrOEо = 0,45 B
Окислители:
Чему равен эквивалент восстановителя?
NO3- + Br2 → NO + BrO2
3
Br2 + 2H2O -2е
0
=
2BrO- + 4H+
2+
2NO3- + 8H+ + 3Br2 + 6H2O = 2NO + 4H2O + 6BrO- + 12H+
2NaNO3 + 3Br2 + 2H2O = 2NO + 2NaBrO + 4HBrO
Мэ (Br2) = М (Br2)/2 = 159,8/2 = 79,9 (г/моль)
26. Факторы, влияющие на протекание ОВР: - химическая природа взаимодействующих веществ, - условия проведения реакций:
концентрация, температура, катализатор, рН27. ТИПЫ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ: - межмолекулярные - внутримолекулярные - диспропорционирования
28. ОВР в фармацевтическом и клиническом анализах :
Применяются в фармацевтическоманализе: идентификация лекарственных
веществ: анестезина, новокаина,
парацетамола и др.
Применяются в клиническом анализе :
определение мочевой кислоты, сахара,
холестерина, ферментов каталазы,
пероксидазы и т.д,
Санитарно-гигиенической практике:
определение эффективности
дезинфицирующих средств, остаточного
«хлора» и т.д,
29. Особенности ОВР в организме
1. Все биохимические окислительно-восстановительныепроцессы, скорость и глубина которых контролируется
организмом, совершаются в присутствии ферментов с
общим названием оксидоредуктазы.
2. Оксидоредуктазы проявляют окислительновосстановительные свойства за счет своих кофакторов и
коферментов, которые способны находиться в двух
формах: окисленной и восстановленной.
Кофакторами являются катионы переходных металлов
(железо и медь,марганец,молибден), образующие с
белком фермента соединение.
Коферменты – сложные органические соединения,
достаточно прочно связанные с белком фермента.
30. Оксидоредуктазами, содержащими кофакторы, являются различные цитохромы, железосеропротеины [FexSxProt] и т.д
,Оксидоредуктазами содержащими кофакторы,
являются различные цитохромы,
железосеропротеины [FexSxProt] и т.д
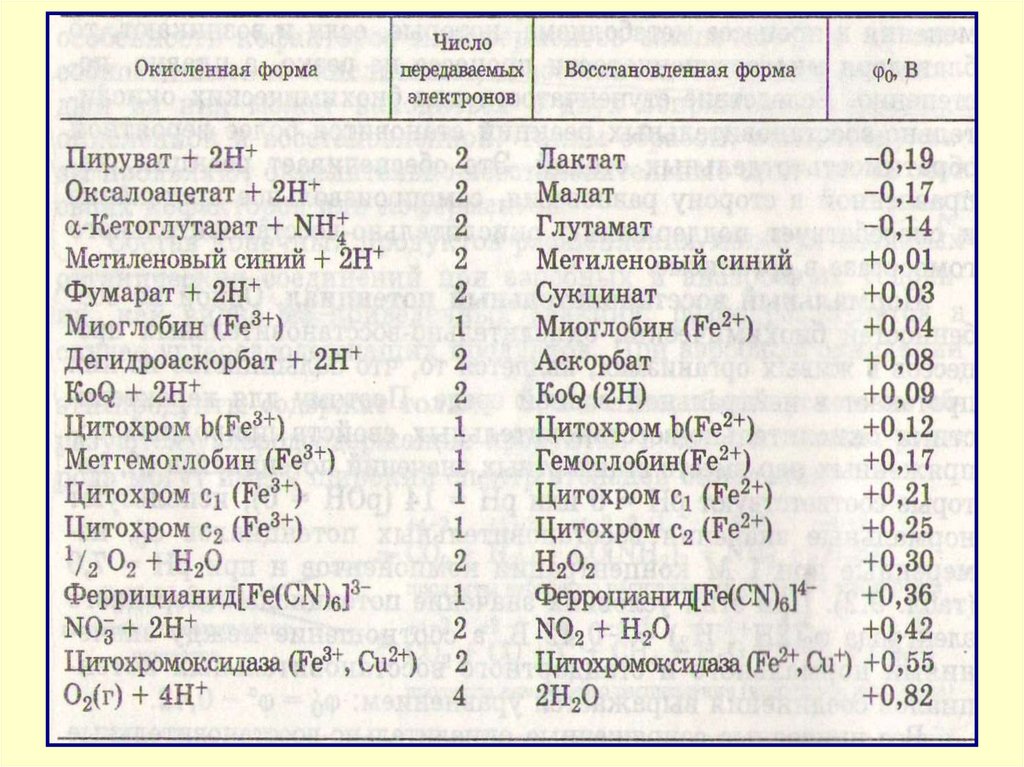
31. Особенности ОВР в организме
3.Протекаютступенчато
с
образованием
ряда
промежуточных соединений. Каждая стадия совершается
под действием определенных ферментов.
4.Реакции
биологического
окисления
являются
экзэргоническими и служат источниками энергии. Сопряжены
с реакциями восстановления, которые эндэргоничны.
5.Большинство из них протекает в нейтральной водной
среде. Сопряженные окислительно-восстановительные пары
имеют потенциалы в области значений -0,42 ÷ +0,82 В,
характеризующие электрохимическую устойчивость воды.
32.
33.
34.
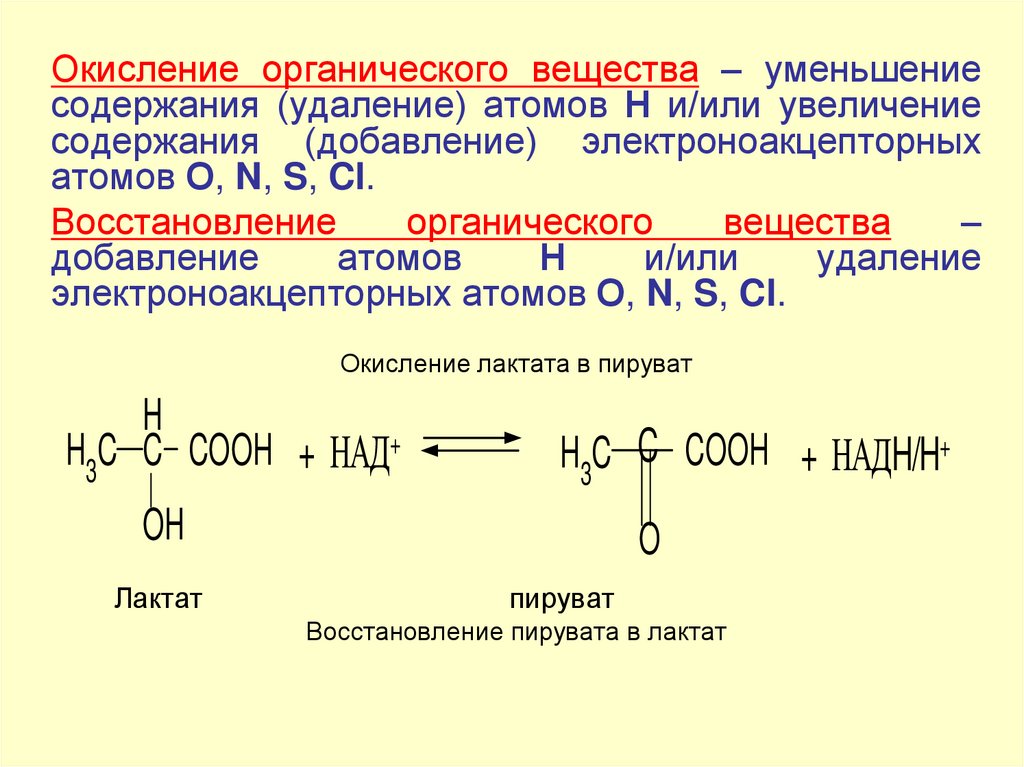
Окисление органического вещества – уменьшениесодержания (удаление) атомов Н и/или увеличение
содержания (добавление) электроноакцепторных
атомов О, N, S, Cl.
Восстановление
органического
вещества
–
добавление
атомов
Н
и/или
удаление
электроноакцепторных атомов О, N, S, Cl.
Окисление лактата в пируват
H
H3C C COOH + НАД+
H3C C COOH + НАДH/H+
OH
Лактат
O
пируват
Восстановление пирувата в лактат
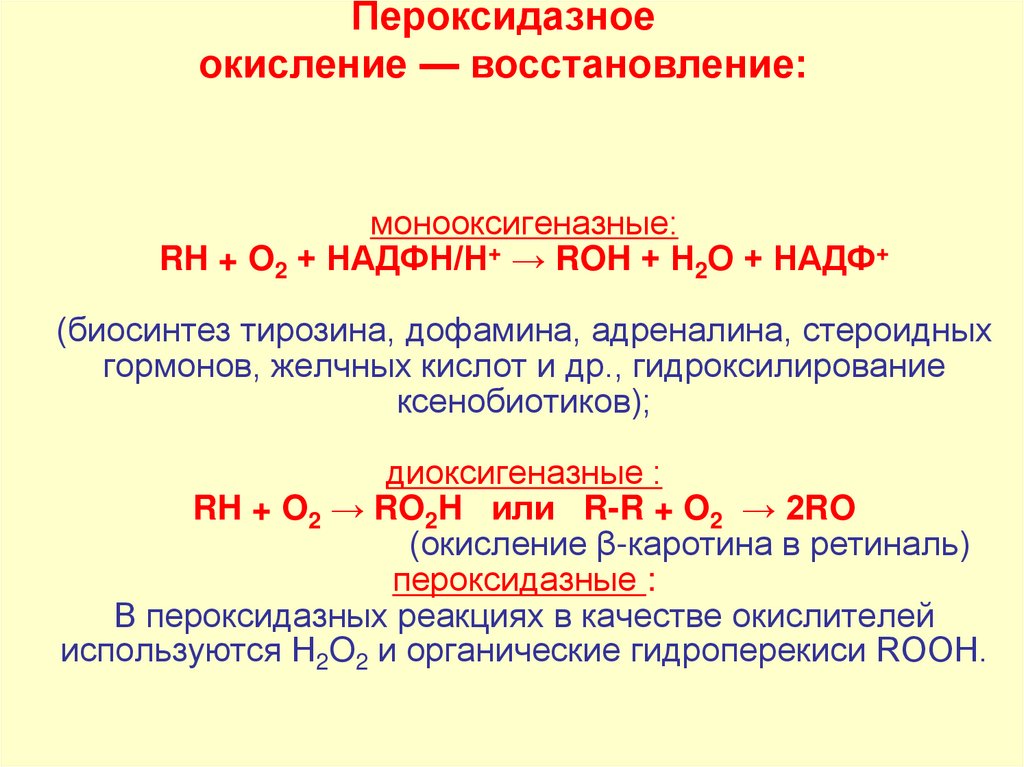
35. монооксигеназные: RH + O2 + НАДФН/Н+ → ROH + Н2O + НАДФ+ (биосинтез тирозина, дофамина, адреналина, стероидных гормонов,
Пероксидазноеокисление — восстановление:
монооксигеназные:
RH + O2 + НАДФН/Н+ → ROH + Н2O + НАДФ+
(биосинтез тирозина, дофамина, адреналина, стероидных
гормонов, желчных кислот и др., гидроксилирование
ксенобиотиков);
диоксигеназные :
RH + O2 → RO2H или R-R + O2 → 2RO
(окисление β-каротина в ретиналь)
пероксидазные :
В пероксидазных реакциях в качестве окислителей
используются Н2O2 и органические гидроперекиси ROOH.
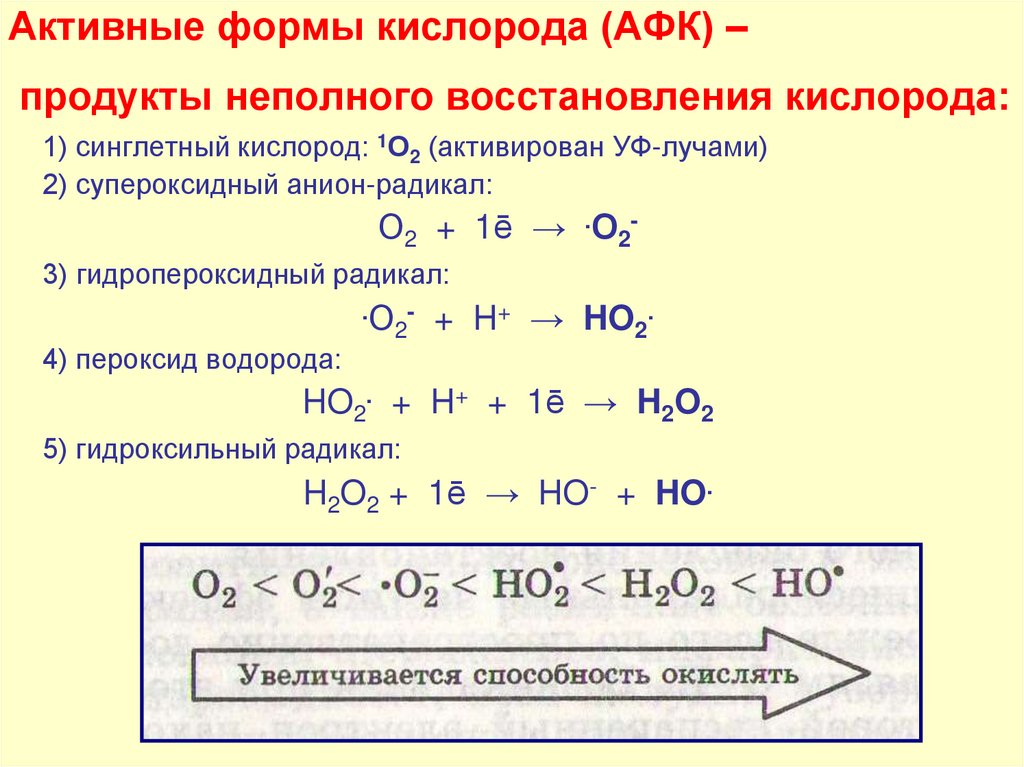
36. Активные формы кислорода (АФК) – продукты неполного восстановления кислорода:
1) синглетный кислород: 1О2 (активирован УФ-лучами)2) супероксидный анион-радикал:
О2 + 1ē → .О23) гидропероксидный радикал:
.О 2
+ H+ → HO2.
4) пероксид водорода:
HO2. + H+ + 1ē → H2O2
5) гидроксильный радикал:
H2O2 + 1ē → HO- + HO.
37. Процессы свободно-радикального окисления (СРО) и перекисного окисления липидов (ПОЛ), самопроизвольно протекающие в живых
клетках поддействием кислорода воздуха и катализируемые
радикалами - активными формами кислорода (АФК)
имеют
сложный
многоступенчатый
механизм.
Процессы СРО и ПОЛ активизируются при многих
заболеваниях и приводят к разрушению биомолекул,
клеточной смерти и сокращению продолжительности
жизни организма, и поэтому сдерживаются работой
систем антиоксидантной защиты (АОЗ) клетки.






















![Оксидоредуктазами, содержащими кофакторы, являются различные цитохромы, железосеропротеины [FexSxProt] и т.д Оксидоредуктазами, содержащими кофакторы, являются различные цитохромы, железосеропротеины [FexSxProt] и т.д](https://cf5.ppt-online.org/files5/slide/r/RYsCxtA61ZkjLob3racKBv5if7Hq9IzVSXuQ0l/slide-29.jpg)



 chemistry
chemistry








