Similar presentations:
алкены хим-е св-ва, получение, применение 10 кл базовый
1. Задание на урок:
1. Прочитайте п. 4 с. 26-29 в учебнике.2. Изучите презентацию по теме урока.
3. Запишите в тетради краткий конспект по теме – спишите
текст со слайдов №2, 6, 8, 9, 10, 11. 12, 13, 14.
4. Выполните задание по теме – слайд №17.
5. Выполненную работу – записи в тетради и задание
отправьте на проверку 13.45.
Домашнее задание: п. 4 изучить.
2. АЛКЕНЫ: способы получения, химические свойства, применение.
3.
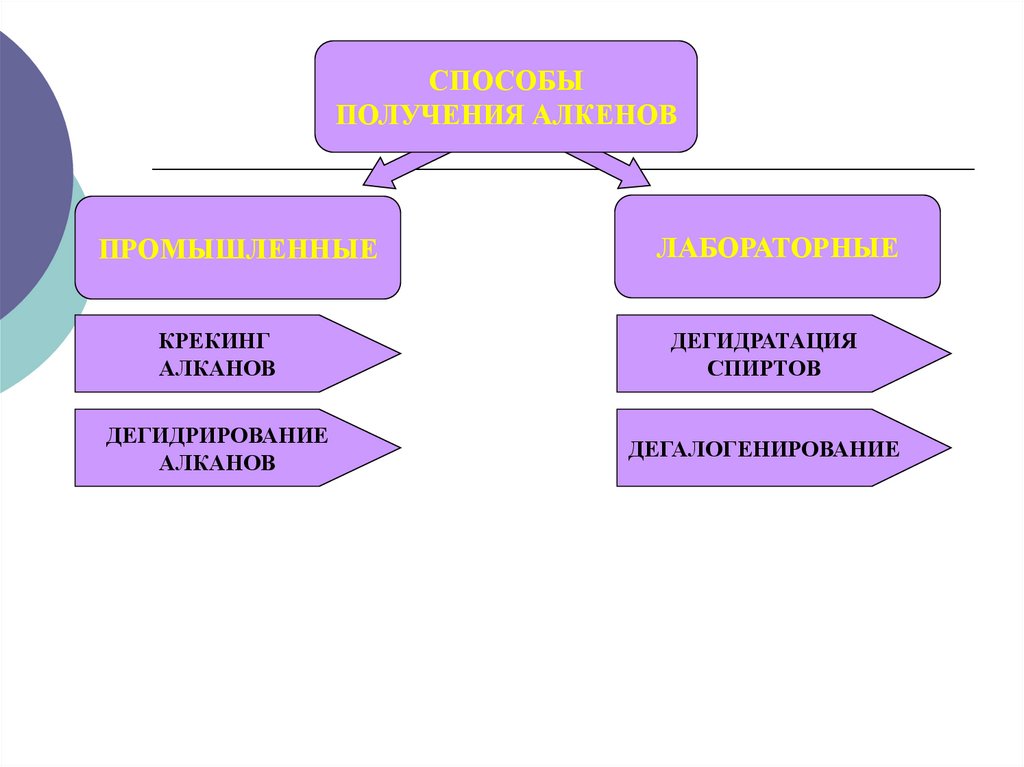
СПОСОБЫПОЛУЧЕНИЯ АЛКЕНОВ
ПРОМЫШЛЕННЫЕ
ЛАБОРАТОРНЫЕ
КРЕКИНГ
АЛКАНОВ
ДЕГИДРАТАЦИЯ
СПИРТОВ
ДЕГИДРИРОВАНИЕ
АЛКАНОВ
ДЕГАЛОГЕНИРОВАНИЕ
4. ПРОМЫШЛЕННЫЙ СПОСОБ ПОЛУЧЕНИЯ
КРЕКИНГ АЛКАНОВАЛКАН → АЛКАН + АЛКЕН
С БОЛЕЕ ДЛИННОЙ
УГЛЕРОДНОЙ
ЦЕПЬЮ
С МЕНЕЕ ДЛИНОЙ
УГЛЕРОДНОЙ
ЦЕПЬЮ
t=400-700ºC
С10Н22 →
C5H12 + C5H10
декан
пентан пентен
5. ПРОМЫШЛЕННЫЙ СПОСОБ ПОЛУЧЕНИЯ
ДЕГИДРИРОВАНИЕ АЛКАНОВАЛКАН → АЛКЕН + ВОДОРОД
Ni, t=500ºC
Н3С - СН3 → Н2С = СН2 + Н2
этан
этен
(этилен)
6. ЛАБОРАТОРНЫЙ СПОСОБ ПОЛУЧЕНИЯ
ДЕГИДРАТАЦИЯ СПИРТОВСПИРТ → АЛКЕН + ВОДА
Н Н Н2t≥140ºC,
SO4(конц.)
Н-С – С-Н → Н2С = СН2 + Н2О
Н ОН
этен (этилен)
7. ЛАБОРАТОРНЫЙ СПОСОБ ПОЛУЧЕНИЯ
ДЕГАЛОГЕНИРОВАНИЕtº
Н2С – СН2 + Zn → Н2С = СН2 + ZnBr2
Br Br
этен
1,2-дибромэтан
(этилен)
8. РЕАКЦИИ ПРИСОЕДИНЕНИЯ
1. Гидрирование:CH2=CH2 + H—H → CH3—СH3
(под действием Ni)
этан
2. Гидрогалогенирование:
CH2=CH2 + HСl → CH3—CH2Cl
хлорэтан
Реакция подчиняется правилу Марковникова
9. Правило В.В. Марковникова
При присоединении галогеноводорода калкену водород присоединяется к атому
углерода, при котором находится больше
атомов водорода, а галоген – к менее
гидрированному.
10. РЕАКЦИИ ПРИСОЕДИНЕНИЯ
3. Галогенирование:CH2=CH2 + Br2 → CH2Br—CH2Br
1,2-дибромэтан
Происходит обесцвечивание бромной воды.
!Это качественная реакция на непредельные
соединения.
11. РЕАКЦИИ ПРИСОЕДИНЕНИЯ
4. Гидратация:CH2=CH2 + HOH → CH3-CH2-OH
этиловый спирт
(под действием катализатора)
Эту реакцию открыл A.M. Бутлеров, и
она используется для промышленного
получения этилового спирта.
12. РЕАКЦИЯ ПОЛИМЕРИЗАЦИИ
Это процесс соединения одинаковых молекул вболее крупные.
n CH2=CH2 → (-CH2-CH2-)n
этилен
полиэтилен
(мономер)
(полимер)
n – степень полимеризации, показывает число
молекул, вступивших в реакцию
-CH2-CH2- структурное звено
13. РЕАКЦИИ ОКИСЛЕНИЯ
ГОРЕНИЕ АЛКЕНОВС2Н4 + 3О2 → 2СО2 + 2Н2О
14. РЕАКЦИИ ОКИСЛЕНИЯ
МЯГКОЕ ОКИСЛЕНИЕ – ВЗАИМОДЕЙСТВИЕС РАСТВОРОМ ПЕРМАНАГАНАТА КАЛИЯ
(реакция Е.Е.Вагнера)
KMnO
Н2С=СН2 + [O] + H2O
H2C - CH2
OH OH
4
этиленгликоль
(этандиол-1,2)
!Качественная
реакция
на
непредельность
углеводорода – на кратную связь.
15. Применение этилена
СвойствоПрименение
1. Полимеризация
Производство
полиэтилена, пластмасс
2. Галогенирование
Получение
растворителей
3. Гидрогалогенирование
Для местной анестезии,
получения растворителей, в
с/х для обеззараживания
зернохранилищ
Пример
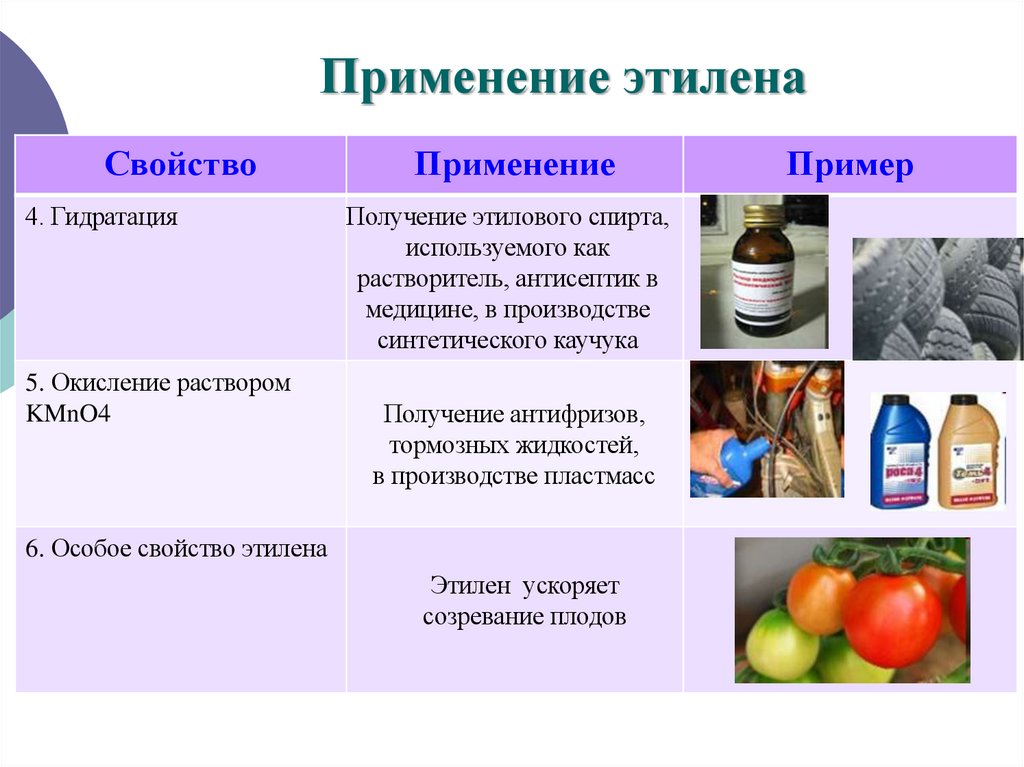
16. Применение этилена
Свойство4. Гидратация
5. Окисление раствором
KMnO4
Применение
Получение этилового спирта,
используемого как
растворитель, антисептик в
медицине, в производстве
синтетического каучука
Получение антифризов,
тормозных жидкостей,
в производстве пластмасс
6. Особое свойство этилена
Этилен ускоряет
созревание плодов
Пример
17. Задание:
Составьте уравнения реакций на примере пропена:1. Горение пропена
2. Гидрирование пропена (использовать структурную формулу)
3. Присоединение галогеноводорода
(использовать структурную формулу)
4. Присоединение воды (использовать структурную формулу)
5. Реакция полимеризации (использовать структурную формулу)















 chemistry
chemistry








