Similar presentations:
Ковалентний зв’язок: полярний, неполярний, механізми його утворення
1.
КОВАЛЕНТНИЙ ЗВ’ЯЗОК: ПОЛЯРНИЙ,НЕПОЛЯРНИЙ, МЕХАНІЗМИ ЙОГО
УТВОРЕННЯ.
КОВАЛЕНТНИЙ
ЗВ’ЯЗОК
ВОДНЕВИЙ
ЗВ’ЯЗОК
2.
Основна причина утворення зв'язку між атомами — їхпрагнення утворити стійку електронну конфігурацію
зовнішнього енергетичного рівня.
Таким рівнем можна вважати восьмиелектронний завершений рівень ns2np6,
наприклад у інертних елементів(Не, Ne, Ar, Kr, Xe,
Rn). Молекули цих речовин є одноатомними.
Завершений рівень характеризується високою
міцністю і стійкістю
У процесі хімічної взаємодії атоми
прагнуть перетворити зовнішній
енергетичний рівень так,
щоб він став завершеним
3.
У атомів неметалів електрони зовнішньогоенергетичного рівня пов'язані з ядром більш міцно,
тому атоми таких елементів в хімічних реакціях
приєднують електрони.
Зовнішній енергетичний рівень атома Флуору,
наприклад, містить сім електронів і, приймаючи в
хімічних реакціях електрон, поповнюється восьмим
електроном.
Властивість атома одного елемента притягувати
електрони атомів іншого елемента називається
електронегативністю.
Атом Флуору
Йон Флуору
4.
Вперше ковалентний хімічний зв’язок буввиявлений в далекому 1916 році американським
хіміком Дж. Льюїсом і деякий час існував у
вигляді гіпотези, ідеї. Лише згодом був
підтверджений експериментально.
Що електронегативність
неметалів буває досить
великою і при хімічній
взаємодії двох атомів
перенесення електронів від
одного до іншого може бути
неможливим. Саме в цей
момент і відбувається
об’єднання електронів обох
атомів, між ними виникає
справжній ковалентний зв’язок
атомів.
Що ж з’ясували хіміки з цього
приводу?
5.
Ковалентний зв’язок – визначення, характеристика.Що таке ковалентний зв’язок?
Сам термін «ковалентний зв’язок» походить від двох латинських
слів: «со» – спільно і «vales» – той, що має силу, так як цей зв’язок
відбувається за рахунок пари електронів, що належать одночасно
обом атомам.
Кажучи більш звичною
мовою, зв’язок між
атомами за рахунок пари
електронів, які є
загальними для них
Утворення ковалентного зв’язку відбувається
виключно серед атомів неметалів, причому
з’являтися він може як в атомах молекул, так і
кристалів.
6.
Типи ковалентного зв’язкуВ цілому є два типи утворення ковалентного
зв’язку:
Обмінний
Донорно-акцептний
Обмінний тип ковалентного зв’язку:
між атомами кожен з
пов’язаних атомів представляє
на утворення електронного
зв’язку по одному неспареному
електрону. При цьому
електрони ці повинні мати
протилежні спіни
7.
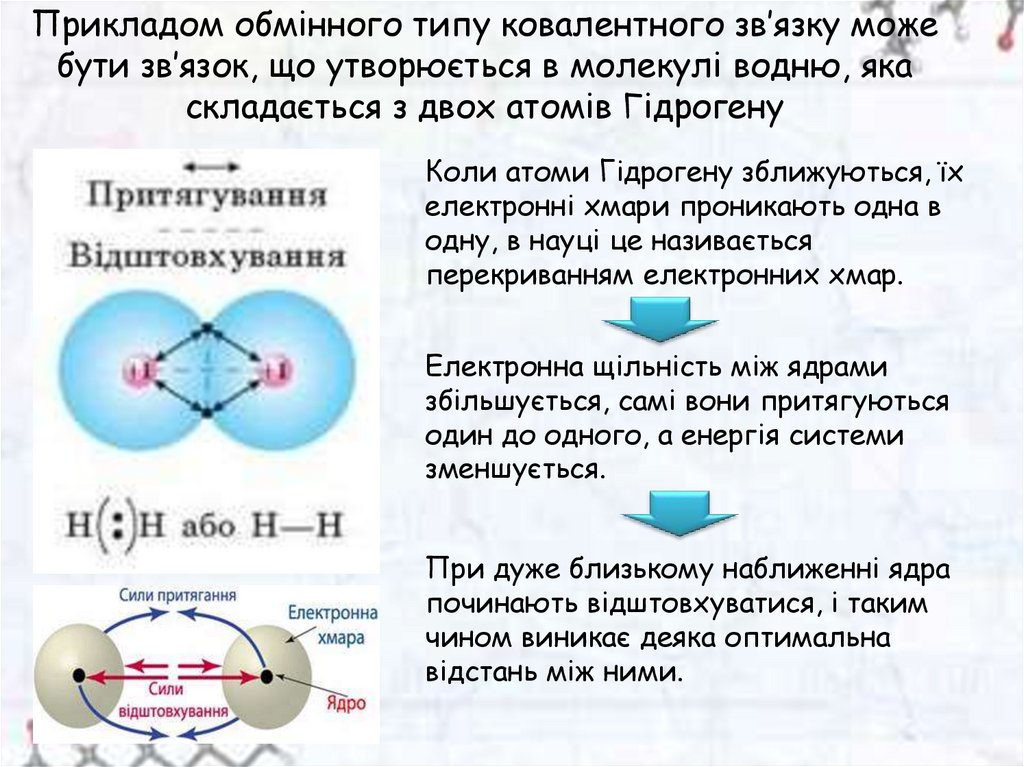
Прикладом обмінного типу ковалентного зв’язку можебути зв’язок, що утворюється в молекулі водню, яка
складається з двох атомів Гідрогену
Коли атоми Гідрогену зближуються, їх
електронні хмари проникають одна в
одну, в науці це називається
перекриванням електронних хмар.
Електронна щільність між ядрами
збільшується, самі вони притягуються
один до одного, а енергія системи
зменшується.
При дуже близькому наближенні ядра
починають відштовхуватися, і таким
чином виникає деяка оптимальна
відстань між ними.
8.
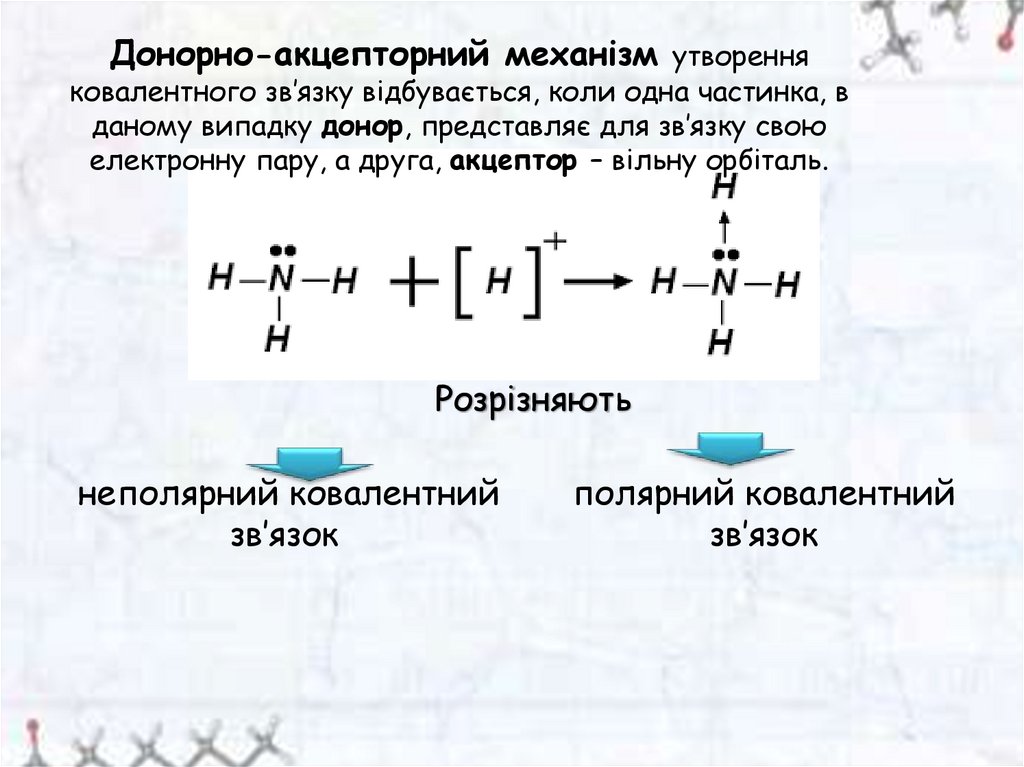
Донорно-акцепторний механізм утворенняковалентного зв’язку відбувається, коли одна частинка, в
даному випадку донор, представляє для зв’язку свою
електронну пару, а друга, акцептор – вільну орбіталь.
Розрізняють
неполярний ковалентний
зв’язок
полярний ковалентний
зв’язок
9.
Ковалентний неполярний зв’язокЦе зв’язок, який утворюється між двома однаковими
атомами неметалічних елементів
У молекулах при
ковалентному
неполярному зв’язку
загальні електронні
пари розташовуються
на однаковій відстані
від ядер атомів.
Речовинами з ковалентним
неполярним зв’язком зазвичай є
гази, рідини або порівняно
низькоплавні тверді речовини.
10.
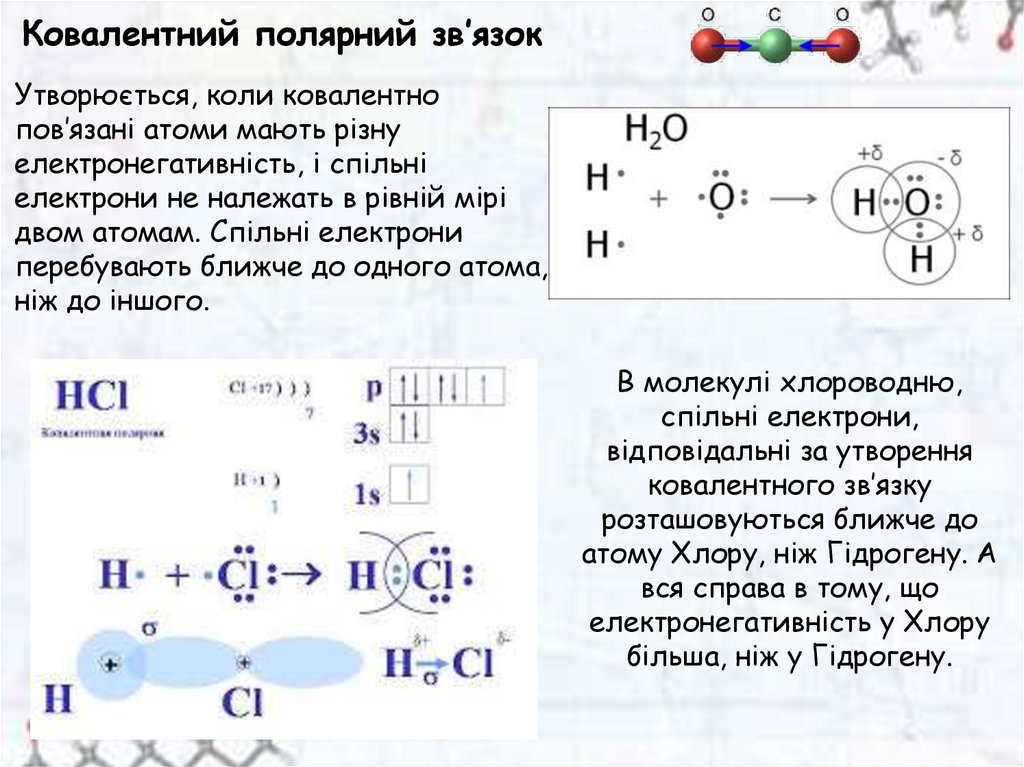
Ковалентний полярний зв’язокУтворюється, коли ковалентно
пов’язані атоми мають різну
електронегативність, і спільні
електрони не належать в рівній мірі
двом атомам. Спільні електрони
перебувають ближче до одного атома,
ніж до іншого.
В молекулі хлороводню,
спільні електрони,
відповідальні за утворення
ковалентного зв’язку
розташовуються ближче до
атому Хлору, ніж Гідрогену. А
вся справа в тому, що
електронегативність у Хлору
більша, ніж у Гідрогену.
11.
молекулярноїРечовини
атомної будови.
Існує невелика кількість простих і
Ковалентним зв’язком
складних речовин атомної будови; у
сполучаються атоми в
них усі атоми сполучені
молекулах неметалів, кислотних
ковалентним зв’язком, і часточка
оксидів, кислот, сполук
(кристалик) такої речовини є ніби
неметалічних елементів з
однією гігантською молекулою.
Гідрогеном, органічних речовин
Таку будову мають, зокрема, графіт,
— вуглеводнів, спиртів,
алмаз, червоний фосфор,
альдегідів, амінів, білків…
силіцій(ІV) оксид
мають запах, досить низькі
температури плавлення і кипіння.
не розчиняються у воді, органічних
розчинниках, плавляться переважно
при дуже високих температурах.
12.
Практикум1. Вкажіть вид хімічного зв’язку і механізм його утворення
в сполуках: H , O , N , Cl , J , F , Br .
2. Вкажіть тип хімічного зв’язку і механізм його утворення
в сполуках: H O, HCl, NH , CH , CO , SO2, P O , N O .
2
2
2
2
2
2
3
2
2
4
2
2
5
2
3
3 Серед запропонованих формул знайдіть формули
сполук з ковалентним неполярним зв’язком: KCl, HCl, Cl ,
Br , PH .
4. Серед зазначених формул знайдіть формули сполук з
ковалентним полярним зв’язком: NH , H , NO, SO , H S, O ,
N , AlCl . Вкажіть механізм його утворення.
5. Серед наведених формул знайдіть речовини: а) з
ковалентним полярним і б) ковалентним неполярним
зв’язком: NH , J , CH , SiH , O , H O, HJ, N . Вкажіть тип
хімічного зв’язку і механізм його утворення
2
2
3
3
2
2
3
3
3
2
4
4
2
2
2
2
2
13.
Домашнє завдання:1) Опрацювати матеріал §
6
і конспект;
2) Виконати завдання зі
слайду 12 .









 chemistry
chemistry