Similar presentations:
Относительные атомная и молекулярная массы. Массовая доля химического элемента в соединении
1. Задание к уроку:
1. Прочитайте п. 6 с. 37-38, п. 7 с. 40-41.2. Посмотрите презентацию по теме урока.
3. Запишите в тетради текст со слайдов: 5, 14.
4. Выполните задания по теме – задания в отдельном файле.
5. Выполненные задания отправьте на проверку:
8в кл. до 9.00, 8б кл. до 10.00, 8а кл. до 11.00
Домашнее задание: п. 6 с. 37-38, п. 7 с. 40-41 изучить,
определения выучить.
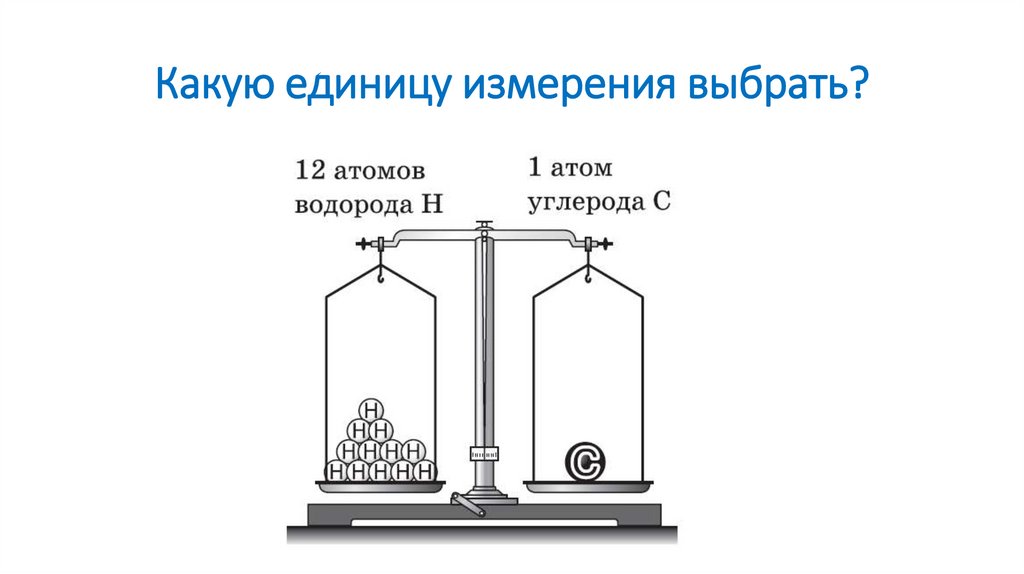
2. Как измерить массу атомов и молекул? Какие единицы измерения массы будут удобны?
3. Масса атома водорода
0,000 000 000 000 000 000 000 001 674 гУдобно ли пользоваться таким числом?
4. Какую единицу измерения выбрать?
5. Тема урока:
Относительные атомнаяи молекулярная массы.
Массовая доля химического
элемента в соединении
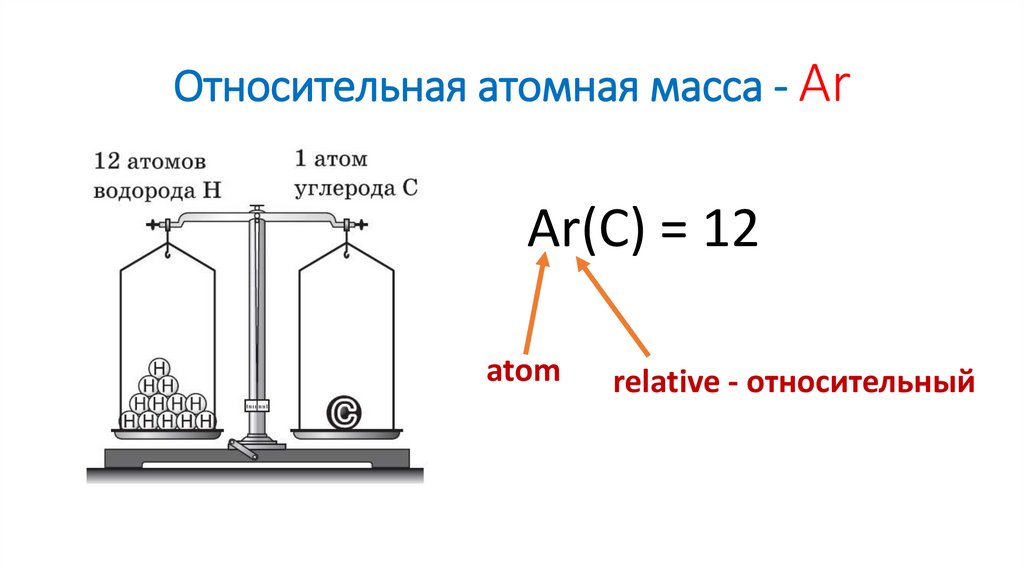
6. Относительная атомная масса - Ar
Ar(C) = 12atom
relative - относительный
7. Как узнать относительную атомную массу?
8. Определите относительные атомные массы элементов. По Периодической таблице химических элементов – обложка учебника. Значения Ar
округляют по правилам математическогоокругления.
Ar (N)=
Ar(Al) =
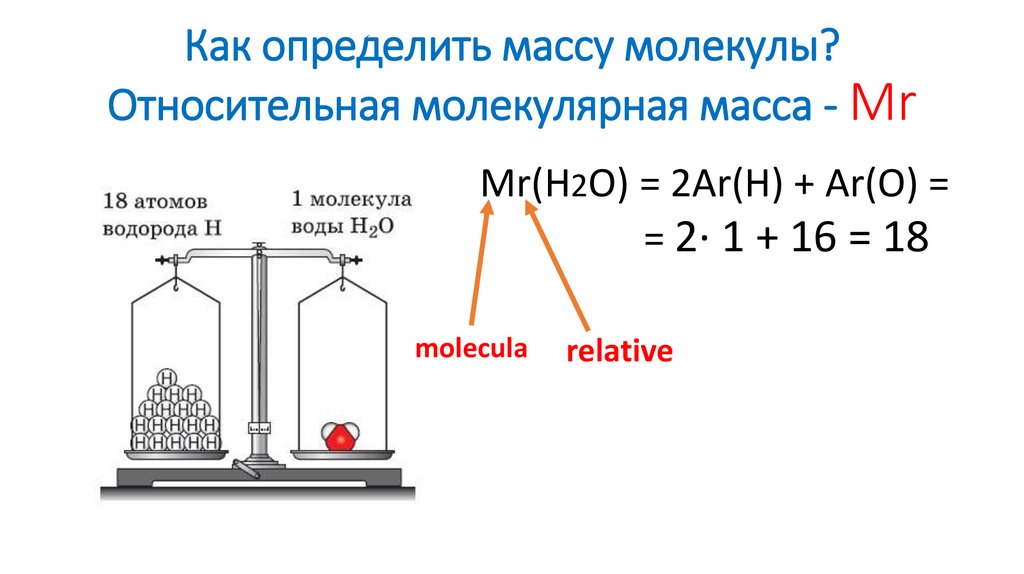
9. Как определить массу молекулы? Относительная молекулярная масса - Mr
Mr(H2O) = 2Ar(H) + Ar(O) == 2∙ 1 + 16 = 18
molecula
relative
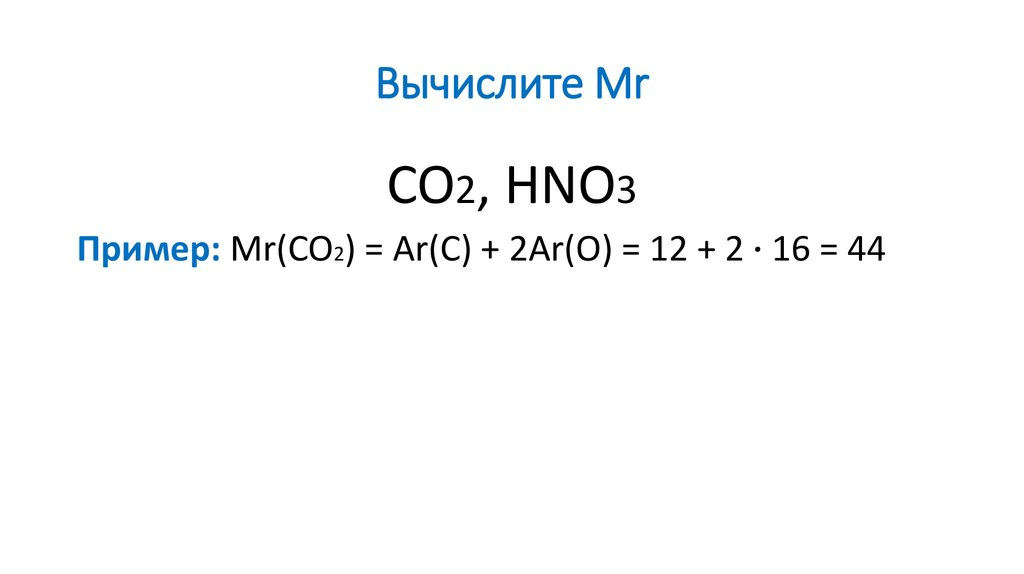
10. Вычислите Mr
CO2, HNO3Пример: Mr(CO2) = Ar(C) + 2Ar(O) = 12 + 2 ∙ 16 = 44
11. Массовая доля элемента в соединении
1. Что такое процент?2. Что такое доля?
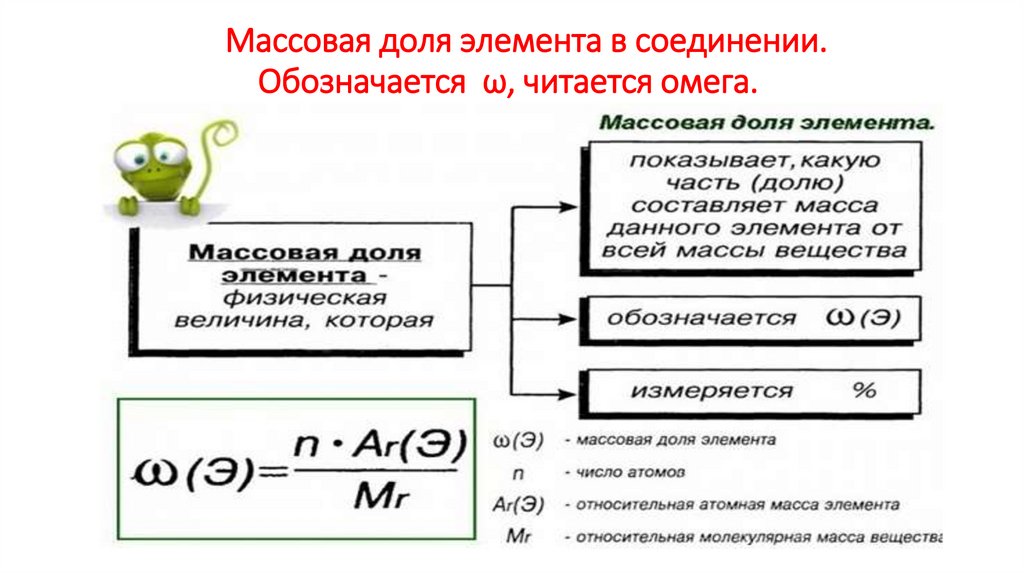
12. Массовая доля элемента в соединении. Обозначается ω, читается омега.
Массовая доля элемента в соединении.Обозначается ω, читается омега.
13. Пример: рассчитайте массовые доли элементов: углерода и кислорода в углекислом газе СО2
14. Подведем итоги
По химической формуле можно определить:1) Какое это вещество ( дать название);
2) Тип вещества (простое или сложное);
3) Состав вещества ( качественный и количественный);
4) Относительную молекулярную массу;
5) Массовые доли элементов в соединении.









 chemistry
chemistry








