Similar presentations:
Протолитическая теория. Лекция 4
1. Лекция 4 Вопросы:
Федеральное государственное бюджетноеобразовательное учреждение высшего образования
«Уральский государственный медицинский университет»
Минздрава России
Лекция 4
Вопросы:
1. Протолитическая теория.
2. Буферные системы: расчет рН, буферная
емкость
Лектор – зав.кафедрой общей химии, Белоконова Надежда Анатольевна
2. Свойства растворов
Теория электролитическойдиссоциации
Протолитическая теория
3. Теория электролитической диссоциации
HCI=
H+
+ Cl-
NaOH
=
Na+
+ OH-
NaCI
=
Na+ + Cl-
4. 1. Протолитическая теория (1923г. И Бренстед, Т.Лори)
Йоханнес Николаус Бронстед22.02.1879-17.12.1947
Thomas Martin Lowry
(26.10 1874 – 2.111936)
КИСЛОТА – вещество, молекулярные частицы которого ( в т.ч. и ионы)
способны отдавать протон, т.е. быть донором протона:
H2SO4; CH3COOH; H3PO4; [Zn(H2O)4]2+; NH4+;
ОСНОВАНИЕ – вещество, молекулярные частицы которого (в т.ч. и
ионы) способные присоединять протон, т.е. быть акцептором протона:
NH3;
CH3 NH CH3; CH3COO-; OH-; [Zn(OH)(H2O)3]+;
АМФОЛИТ – вещество, молекулярные частицы которого могут быть и
донором и акцептором протона:
H2O; HS-; HCO3-;
NH2 R COOH;
NH2 Pt COOH .
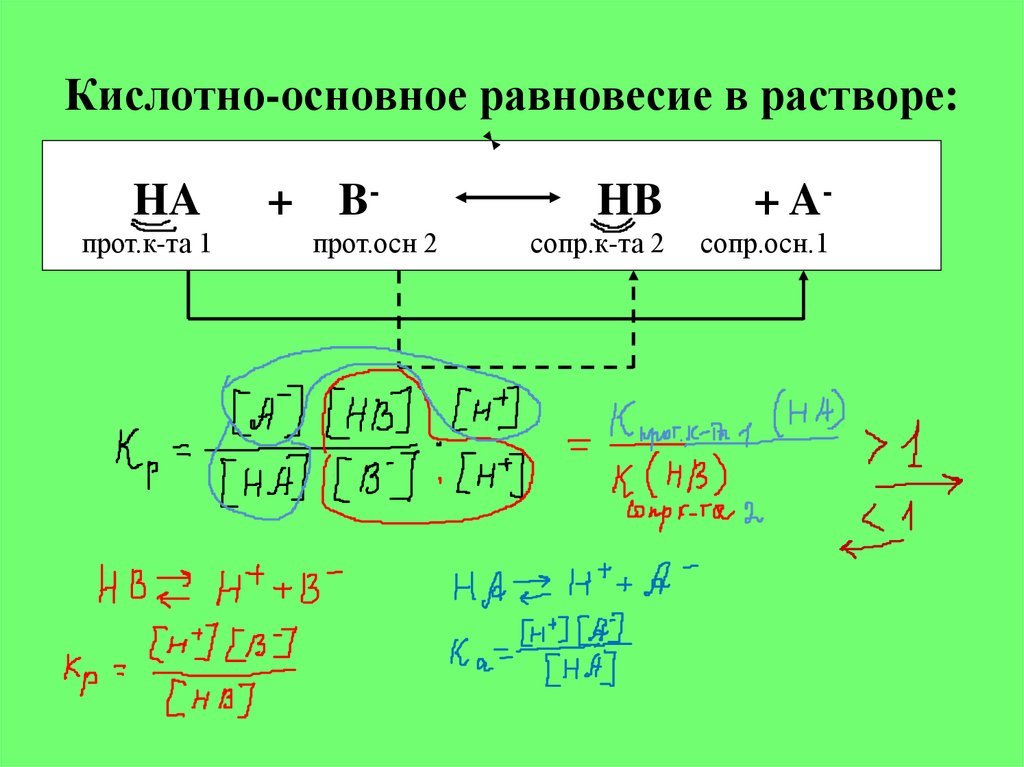
5. Кислотно-основное равновесие в растворе:
HAпрот.к-та 1
+ Bпрот.осн 2
HB
+ A-
сопр.к-та 2
сопр.осн.1
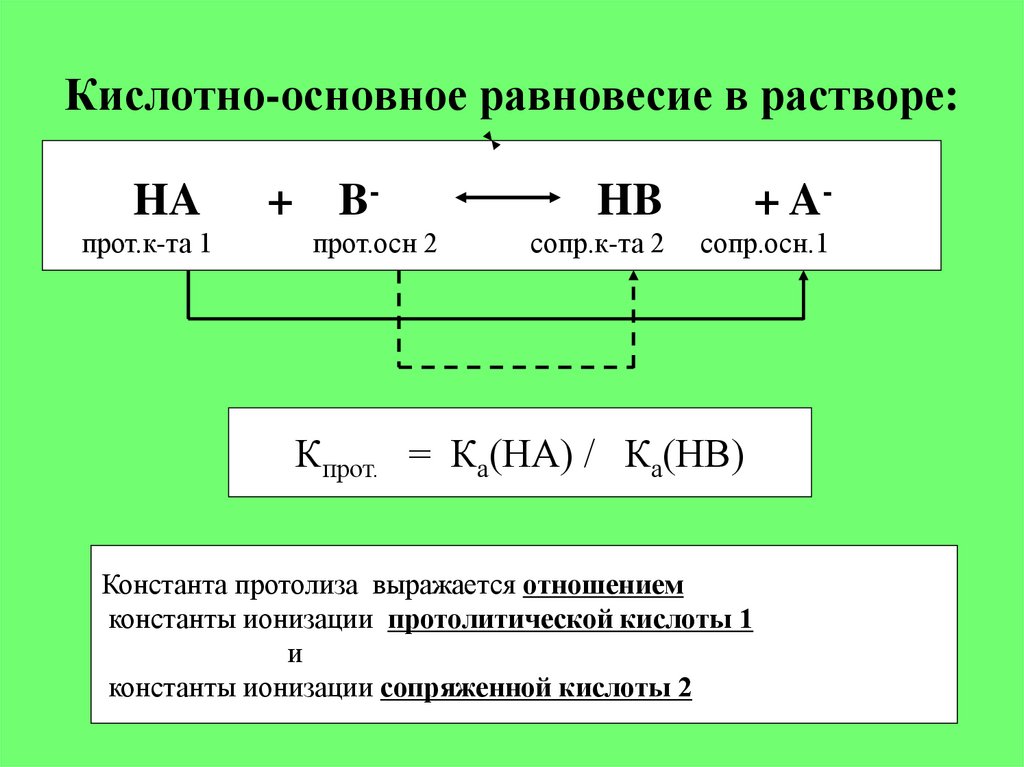
6. Кислотно-основное равновесие в растворе:
HAпрот.к-та 1
+ Bпрот.осн 2
HB
+ A-
сопр.к-та 2
сопр.осн.1
Кпрот. = Ка(НА) / Ка(НВ)
Константа протолиза выражается отношением
константы ионизации протолитической кислоты 1
и
константы ионизации сопряженной кислоты 2
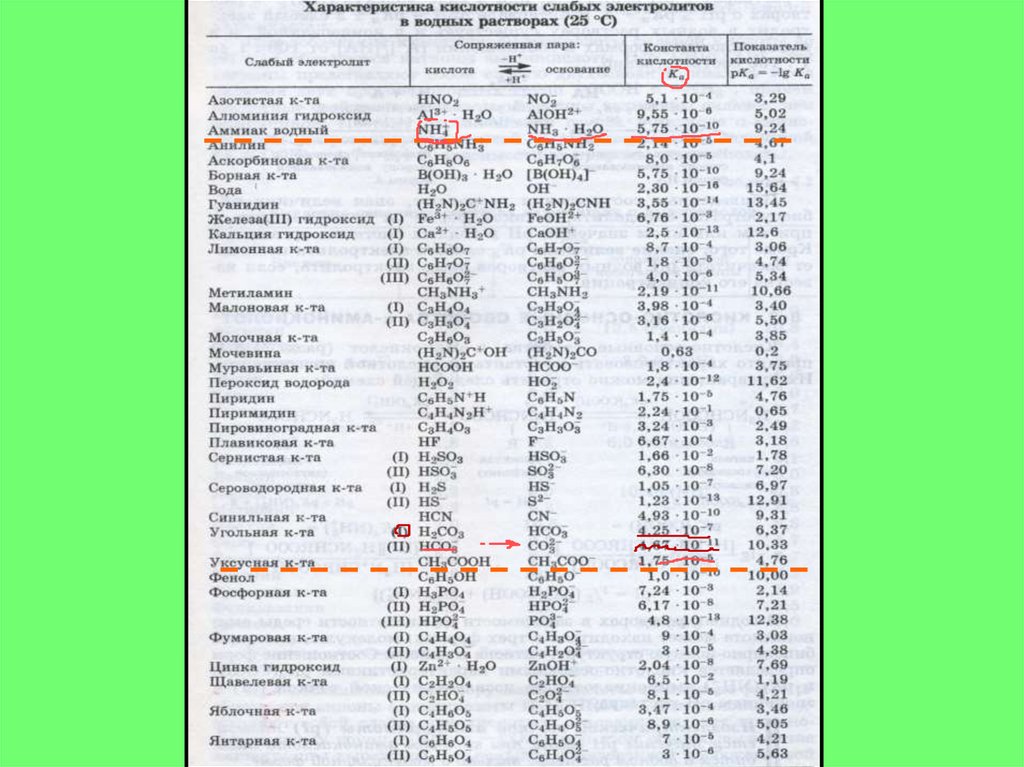
7.
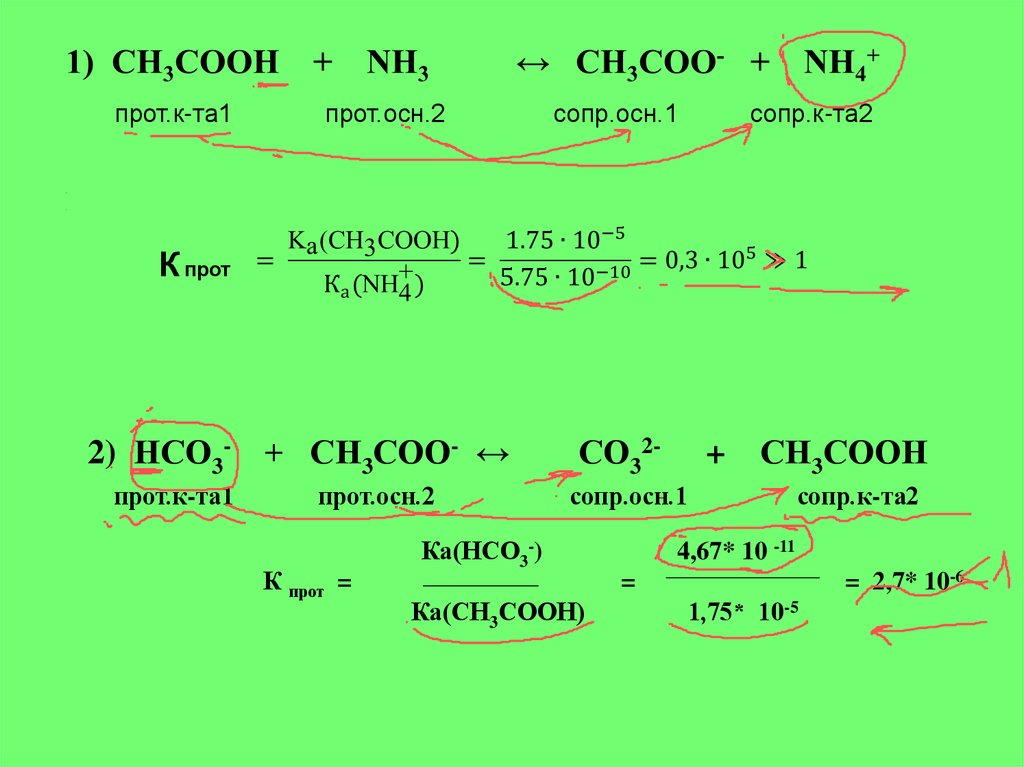
8.
прот.к-та1прот.осн.2
сопр.осн.1
сопр.к-та2
К прот
2) НСО3- + СН3СОО- ↔
прот.к-та1
прот.осн.2
К прот =
СО32-
+
СН3СООН
сопр.осн.1
Ка(НСО3-)
сопр.к-та2
4,67* 10 -11
= 2,7* 10-6
=
Ка(СН3СООН)
1,75* 10-5
9. 2. Буферные системы (или буферы) – - это растворы, обладающие свойством сохранять постоянство концентрации водородных ионов
(рН) придобавлении небольших количеств кислот, щелочей или
при разбавлении.
I тип
- растворы, содержащие слабую
кислоту(донор протона) и соль этой
кислоты(акцептор протона)
II тип - растворы, содержащие слабое
основание(акцептор протона) и соль этого
основания(донор протона)
10.
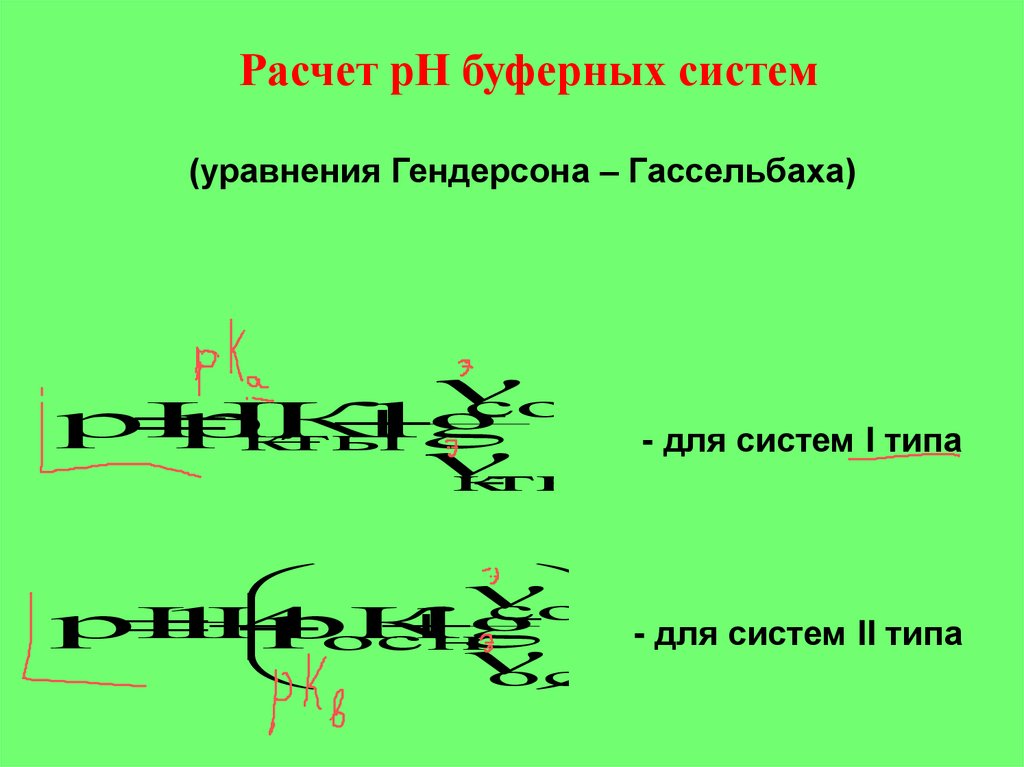
Расчет рН буферных систем(уравнения Гендерсона – Гассельбаха)
сол
рН
рК
lg
к
ты
- для систем I типа
к
ты
сол
рН
14
рК
lg
- для систем II типа
осн
осн
11. Буферная емкость – величина, характеризующая способность буферного раствора противодействовать смещению реакции среды при
добавлении кислот и щелочейэ
к
ты
В
к
э
осн
.
В
о
рН
V
рН
V
(моль/л, ммоль/л)
12.
Буферные системы(БС) I типа- растворы,
содержащие слабую кислоту(донор протона) и соль
этой кислоты(акцептор протона)
Ацетатная БС
CH3COOH CH3COONa
Гидрокарбонатная БС
H 2 CO3 NaHCO3
13. Ацетатная буферная система: состоит из уксусной кислоты и ее соли Протолитическая кислота протолитическое основание
Ацетатная буферная система: состоит изуксусной кислоты
Протолитическая кислота
и ее соли
протолитическое основание
CH3COOH CH3COONa
э СэV
э СэV
Количество вещества в составе БС выражается в
моль-эквивалентах (νэ) и рассчитывается по
формуле:
э СэV
νс
νк
где:
буферное соотношение
V- объем раствора кислоты или соли в составе
буфера,мл(л);
VБС = Vк + Vс
Cэ –молярная концентрация эквивалента, моль-экв./л
Cэ = С (для одноосновных кислот)
С – молярная концентрация, моль/л
14.
ЗАДАЧА 1 Рассчитайте рН буферной системы, состоящей из 100 мл 0,1Мраствора СH3COONa и 10 мл 0,1 М раствора СH3СООН рКа= 4,75.
Изменится ли рН при разбавлении в 10 раз?
сол
рН
рК
lg
к
ты
к
ты
10мл, 0,1М
100мл, 0,1М
CH3COOH CH3COONa
прот.к-та
прот.основание (соль)
νэ = 10* 10-3 *0,1= 1*10-3 νэ = 100* 10-3 *0,1= 10*10-3
моль
моль
15.
Буферная емкость – величина, характеризующаяспособность буферного раствора противодействовать
смещению реакции среды при добавлении кислот и щелочей
э
э
осн
.
к
ты
В
В
к
о
рН
V
рН
V
(моль/л, ммоль/л)
ЗАДАЧА 2 (по условиям задачи № 1)
Как изменится рН при добавлении к 110 мл буфера:
а) 5 мл 0,1М HCL
или
б) 5 мл 0,1М NaOH
Рассчитайте буферную емкость системы по основанию и кислоте. Оцените
буферную емкость системы по кислоте и по основанию. Напишите
механизм буферного действия.
С какими значениями рН можно приготовить ацетатные буферные системы
16.
10мл, 0,1М100мл, 0,1М
CH3COOH CH3COONa
прот.к-та
прот.основание (соль)
νэ = 1*10-3
νэ = 10*10-3
CH3COOH ↔ CH3COO- + H+
CH3COONa → CH3COO- + Na+
Механизм буферного действия по кислоте:
+ + Н О ↔ Н О+
5 мл∙0,1М
Н
2
3
νэ =5*10-3*0,1
Н3О+
+ СН3СОО↔ Н2О + СН3СООН
прот.к-та1
прот.осн.2
ΔрН = 5,75- 5,55 = 0,20
сопр.осн.1
сопр.к-та2
17.
10мл, 0,1М100мл, 0,1М
CH3COOH CH3COONa
прот.к-та
νэ = 1*10-3
CH3COOH ↔ CH3COO- + H+
прот.основание (соль)
νэ = 10*10-3
CH3COONa → CH3COO- + Na+
5 мл∙0,1М
νэ =5*10-3*0,1
Механизм буферного действия по основанию:
ОН+ СН3СООН ↔ Н2О
+ СН3СОО-
прот.осн.1
прот.к-та2
ΔрН = 6,07 - 5,75 = 0,32
сопр.к-та1
сопр.осн.2
18.
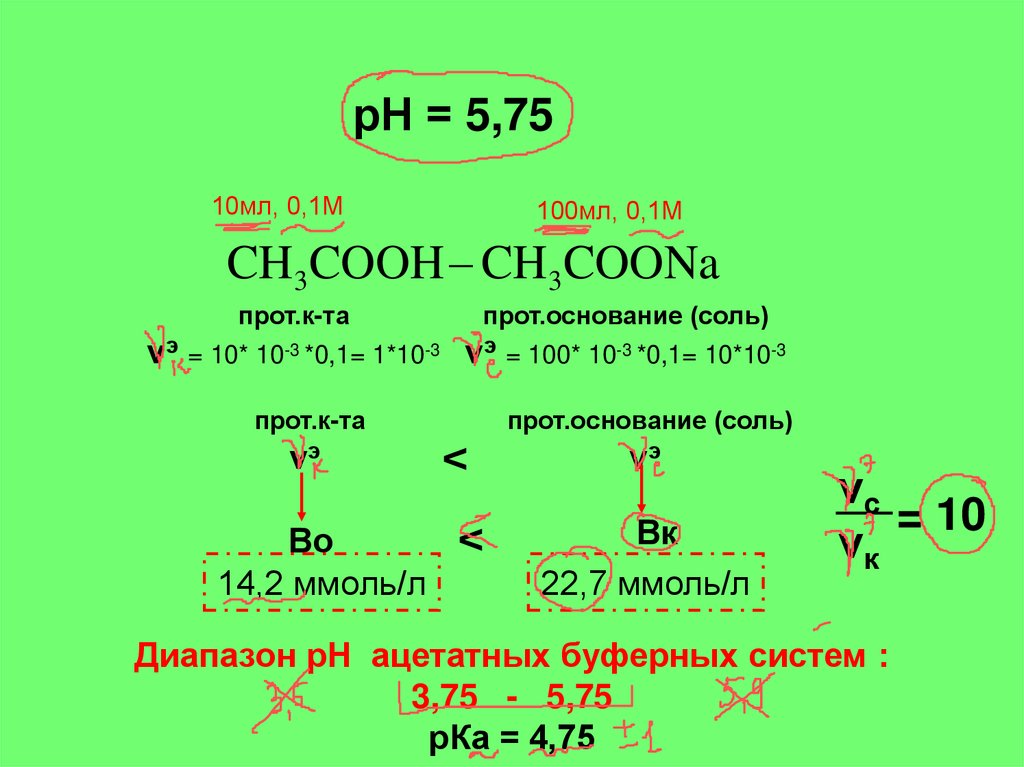
рН = 5,7510мл, 0,1М
100мл, 0,1М
CH3COOH CH3COONa
прот.к-та
прот.основание (соль)
νэ = 10* 10-3 *0,1= 1*10-3 νэ = 100* 10-3 *0,1= 10*10-3
прот.к-та
прот.основание (соль)
νэ
<
νэ
Во
14,2 ммоль/л
<
Вк
22,7 ммоль/л
νс
= 10
νк
Диапазон рН ацетатных буферных систем :
3,75 - 5,75
рКа = 4,75
19. Буферная емкость и состав буфера (Iтипа)
• если с = к,• если с > к,
• если с < к,
Во = Вк
Вк > Во
Во > Вк
(рН = рКа)
сол
рН
рК
lg
к
ты
к
ты
20.
Буферные системы II типа- растворы,содержащие слабое основание(акцептор протона)
и соль этого основания(донор протона)
Аммиачная буферная система
NH3 H 2 O NH4 Cl
Пиридиновая буферная система
C5 H 5 N H 2 O C5 H 5 NHCl
21. Аммиачная буферная система: состоит из аммиака и хлорида аммония прот основание прот. кислота(соль)
NH3 H 2 O NH4 ClС V
э
э
С V
э
э
Количество вещества в составе БС
выражается в моль-эквивалентах (νэ) и
рассчитывается по формуле:
э
э
С V
где:
V- объем раствора соли или снования в составе
буфера,мл(л);
VБС = Vс + Vо
Cэ –молярная концентрация эквивалента, мольэкв./л
νс буферное соотношение
νo
22.
Расчет рН буферных систем II типасо
рН
14
рК
lg
осн
ос
рКосн = рКb = (14 - рКа)
νс
νo
- буферное соотношение
Зона буферного действия
рН = рКа ± 1
Зона буферного действия –
диапазон рН, в котором системы
проявляют буферные свойства
23.
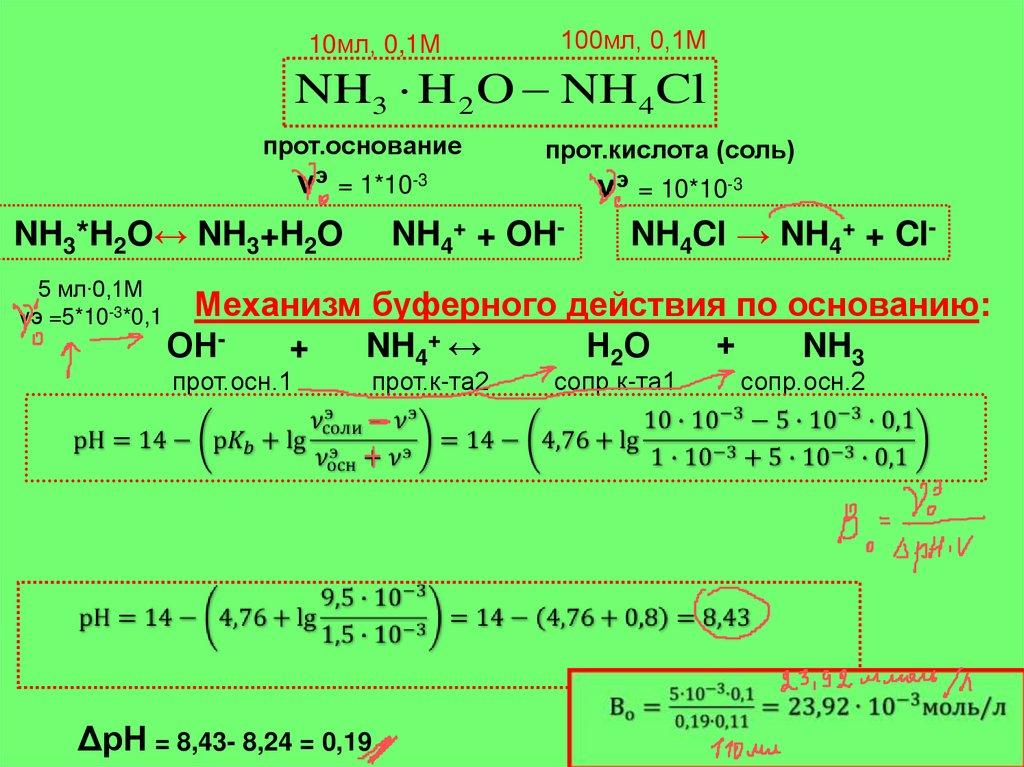
ЗАДАЧА 1 Рассчитайте рН буферной системы, состоящей из 100 мл 0,1Мраствора хлорида аммония и 10 мл 0,1 М раствора аммиака рКа = 9,24.
Изменится ли рН при разбавлении в 10 раз?
Расчет рН буферных систем II типа
сол
рН
14
рК
lg
осн
осн
10мл, 0,1М
100мл, 0,1М
NH3 H 2 O NH4 Cl
прот.основание
прот.кислота (соль)
νэ = 10* 10-3 *0,1= 1*10-3 νэ = 100* 10-3 *0,1= 10*10-3
24. Буферная емкость – величина, характеризующая способность буферного раствора противодействовать смещению реакции среды при
добавлении кислот и щелочейэ
к
ты
В
к
э
осн
.
В
о
рН
V
рН
V
(моль/л, ммоль/л)
ЗАДАЧА 2 (по условиям задачи № 1)
Как изменится рН при добавлении к 110мл БС:
а) 5 мл 0,1М NaOH
б) 5 мл 0,1М HCL
Рассчитайте буферную емкость системы по основанию и
кислоте. Оцените буферную емкость системы по основанию и
по кислоте. Напишите механизм буферного действия.
25.
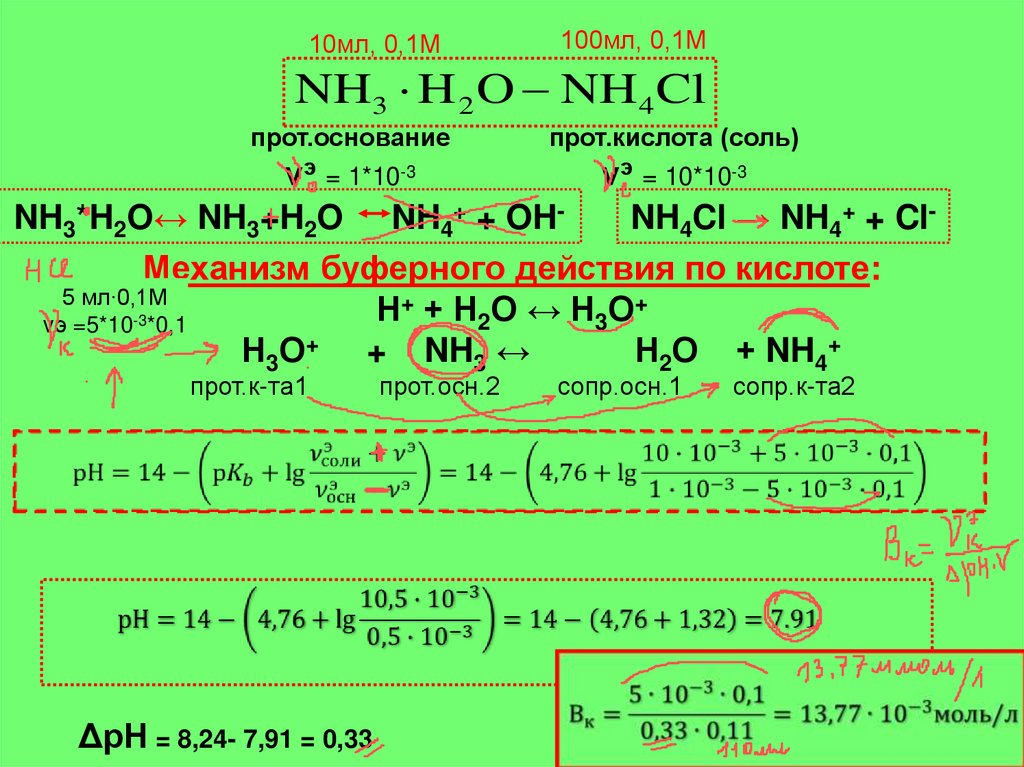
10мл, 0,1М100мл, 0,1М
NH3 H 2 O NH4 Cl
прот.основание
прот.кислота (соль)
νэ = 1*10-3
νэ = 10*10-3
NH3*H2O↔ NH3+H2O NH4+ + OHNH4Cl → NH4+ + ClМеханизм буферного действия по кислоте:
5 мл∙0,1М
+ + Н О ↔ Н О+
Н
-3
2
3
νэ =5*10 *0,1
+
Н3О
+ NH3 ↔
Н2О + NH4+
прот.к-та1
ΔрН = 8,24- 7,91 = 0,33
прот.осн.2
сопр.осн.1
сопр.к-та2
26.
10мл, 0,1М100мл, 0,1М
NH3 H 2 O NH4 Cl
прот.основание
νэ = 1*10-3
NH4+ + OH-
NH3*H2O↔ NH3+H2O
5 мл∙0,1М
νэ =5*10-3*0,1
прот.кислота (соль)
νэ = 10*10-3
NH4Cl → NH4+ + Cl-
Механизм буферного действия по основанию:
ОН+
NH4+ ↔
Н 2О
+
NH3
прот.осн.1
прот.к-та2
ΔрН = 8,43- 8,24 = 0,19
сопр.к-та1
сопр.осн.2
27.
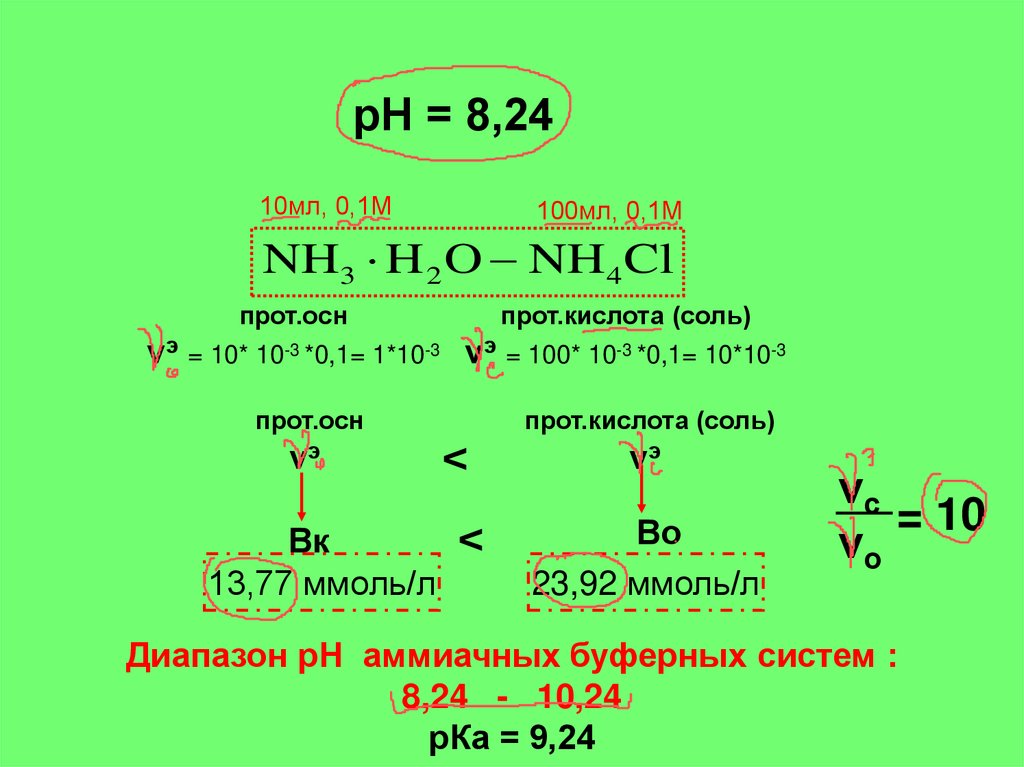
рН = 8,2410мл, 0,1М
100мл, 0,1М
NH3 H 2 O NH4 Cl
прот.осн
прот.кислота (соль)
νэ = 10* 10-3 *0,1= 1*10-3 νэ = 100* 10-3 *0,1= 10*10-3
прот.осн
νэ
прот.кислота (соль)
<
<
Вк
13,77 ммоль/л
νэ
Во
23,92 ммоль/л
νс
= 10
νо
Диапазон рН аммиачных буферных систем :
8,24 - 10,24
рКа = 9,24
28. Буферная емкость и состав буфера (IIтипа)
• если с = о,Во = Вк
• если с > о,
Во > Вк
• если с < о,
Вк > Во
(рН = 14- рКв)
Зона буферного действия рН = (14-рКв) ± 1
сол
рН
14
рК
lg
осн
осн
29.
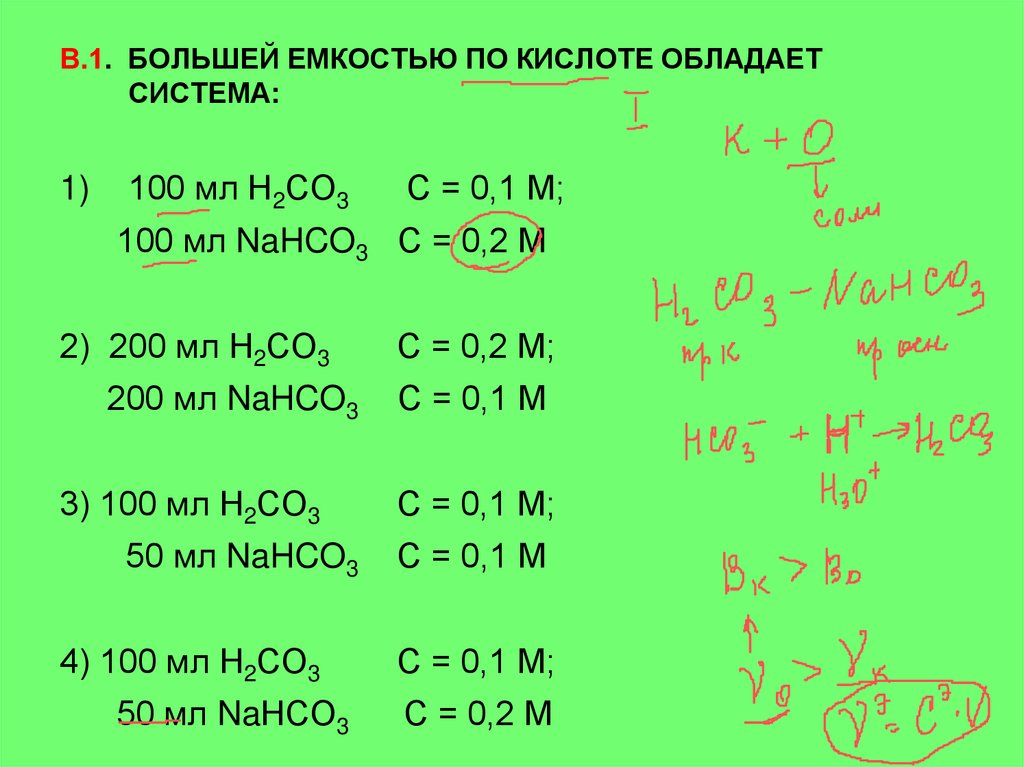
В.1. БОЛЬШЕЙ ЕМКОСТЬЮ ПО КИСЛОТЕ ОБЛАДАЕТСИСТЕМА:
1)
100 мл Н2СО3
С = 0,1 М;
100 мл NaHCO3 С = 0,2 М
2) 200 мл Н2СО3
200 мл NaHCO3
3) 100 мл Н2СО3
50 мл NaHCO3
4) 100 мл Н2СО3
50 мл NaНСО3
С = 0,2 М;
С = 0,1 М
С = 0,1 М;
С = 0,1 М
С = 0,1 М;
С = 0,2 М
30.
В.2.ДЛЯ ГИДРОКАРБОНАТНОЙ БУФЕРНОЙ СИСТЕМЫ,
ОБЛАДАЮЩЕЙ БОЛЬШЕЙ ЕМКОСТЬЮ ПО
ОСНОВАНИЮ, ЧЕМ ПО КИСЛОТЕ СПРАВЕДЛИВО
СООТНОШЕНИЕ:
1) с/ к > 1
2) c/ o > 1
3) c/ к < 1
4) c/ к = 1
31.
В.3.БУФЕРНОЕ ОТНОШЕНИЕ ДЛЯ АММИАЧНОЙ
БУФЕРНОЙ СИСТЕМЫ, ЕСЛИ ОНА ОБЛАДАЕТ БОЛЬШЕЙ
БУФЕРНОЙ ЕМКОСТЬЮ ПО КИСЛОТЕ
1) с/ о > 1
2) c/ о < 1
4) c/ к = 1




















 chemistry
chemistry








