Similar presentations:
Молярна маса речовини
1. Фронтальне опитування
1.Дайте визначенняречовини“.
поняттю
”кількість
2. В яких одиницях вимірюється кількість
речовини?
3. Скільки структурних частинок міститься в
одному молі речовини?
4. Яку розмірність має стала Авогадро?
2. Самостійна робота
1. Замість крапок вставте пропущені цифри:Варіант №1
У 3 моль води H 2O
міститься … моль молекул,
… моль атомів Гідрогену,
… моль атомів Оксигену.
Варіант №2
У 2 моль сульфатної кислоти
H 2SO4 міститься … моль
Гідрогену, … моль Сульфуру,
… моль Оксигену.
Варіант №3
Варіант №4
У 2 моль йонної сполуки
Ca 3 ( PO4 ) 2 міститься …
моль частинок,
2
тобто … моль йонів Ca
і … моль йонів PO 4 3 .
У 5 моль кварцу SiO 2
(сполука атомної будови)
міститься … моль частинок,
тобто … моль атомів
Силіцію і
… моль атомів Оксигену.
3.
2. Розв’яжіть задачу:Варіант №1
Скільки атомів Купруму
міститься в металі міді,
взятому кількістю речовини
1,5 моль?
9,03 1023 атомів
Варіант №3
Скільки молекул міститься
в 0,85 моль амоніаку
NH3 ?
Варіант №2
Розрахувати кількість
речовини елементів у
фосфор(V) оксиді взятому
кількістю речовини 3 моль.
n(P) 6 моль
n(O) 15 моль
Варіант №4
Скільки атомів міститься в
1,25 моль алюмінію?
7,52 1023 атомів
5,12 1023 молекул
4.
5. Поняття молярної маси речовини
Молярна маса речовини – цефізична величина, що дорівнює
відношенню маси речовини до
відповідної кількості речовини:
m
M
n
де m – маса речовини, кг; n –
кількість речовини, моль.
6. Одиниця молярної маси – кілограм на моль(кг/моль) або грам на моль(г/моль). Виходить, що маса 1моль речовини і є її молярною
масою. Приклади, якіпояснюють залежність між масою і кількістю
речовини, наведено в таблиці.
Порція води
Молярна маса
Маса
Кількість речовини
18 г
1 моль
36 г
2 моль
М
36 г
18г / моль
2 моль
9г
0,5 моль
М
9г
18г / моль
0,5 моль
М
18г
18г / моль
1моль
7.
Отже, молярна маса – це важлива істала характеристика кожної окремої
речовини. Вона виражає залежність між
масою і кількістю речовини, а тому дає
змогу визначати одну величину за
відомою іншою (масу за кількістю
речовини і навпаки, кількість речовини
за масою).
8. Розв’язування задач
Обчисленняза
хімічною
формулою молярної маси, кількості
і маси речовини.
9. Обчисліть молярну масу сульфатної кислоти .
Обчислітьмолярну
масу
сульфатної кислоти H2 SO4 .
Розв’язання:
Знаходимо відносну молекулярну масу сульфатної кислоти:
M r (H 2 SO4 ) 2 A r H A r (S) 4 A r (O) 2 1 32 4 16 98
Молярна маса чисельно дорівнює відносній молекулярній масі, отже:
M(H 2 SO4 ) 98г / моль
Відповідь: M(H SO ) 98г / моль
2
4
10. Яка кількість речовини міститься у воді масою 2кг?
Дано:m(H 2O) 2кг 2000г
n(H 2O) ?
n
m
M
Розв’язання:
Знаходимо молярну масу води:
M(H 2O) 2 1 16 18( г / моль)
n(H 2O)
m(H 2O ) 2000
111( моль)
M(H 2O )
18
Відповідь: n(H 2O) 111моль
11. Яка маса заліза відповідає кількості речовини 1,5 моль?
Дано:n(Fe ) 1,5 моль
m(Fe ) ?
Розв’язання:
m n M
Знаходимо молярну масу заліза:
M(Fe) 56г / моль
m(Fe ) n(Fe ) M(Fe) 1,5 56 84 г
Відповідь: m(Fe ) 84 г
12. Обчисліть число атомів Сульфуру у зразку сірки масою 16г.
Дано:Розв’язання:
m(S ) 16 г
Спочатку обчислюємо кількість речовини в
даному зразку сірки:
N(S) ?
16г
m(S )
0,5 моль
n(S )
M(S) 32 г моль
Виходячи
з
кількості
речовини
обчислимо число атомів Сульфуру:
N(S) n(S ) N A 0,5 моль 6 1023 моль 1 3 10 23
Відповідь: N(S) 3 1023
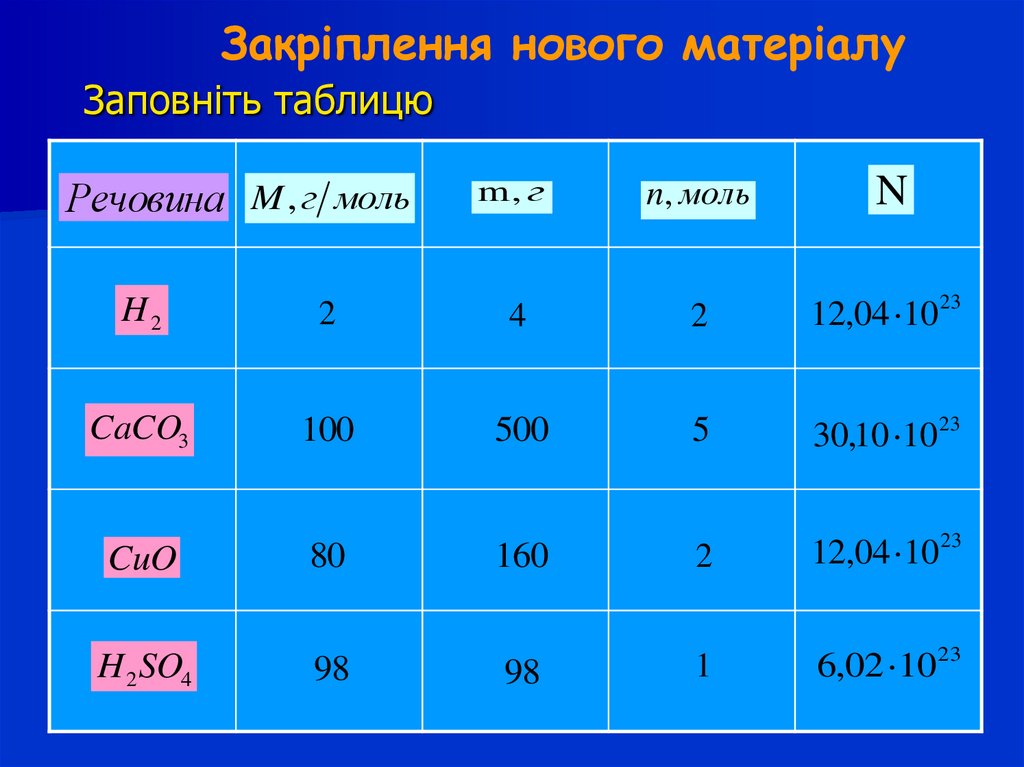
13. Закріплення нового матеріалу
Заповніть таблицюРечовина M, г моль
m, г
n, моль
N
H2
2
4
2
12,04 10 23
CaCO3
100
500
5
30,10 10 23
CuO
80
160
2
12,04 10 23
H 2 SO4
98
98
1
6,02 10 23













 chemistry
chemistry








