Similar presentations:
ОВР. Задание №1
1. ОВР
2. Задание №1
Определите степени окисления атомовхимических элементов по формулам их
соединений:
H2S, O2, NH3, HNO3, Fe, K2Cr2O7
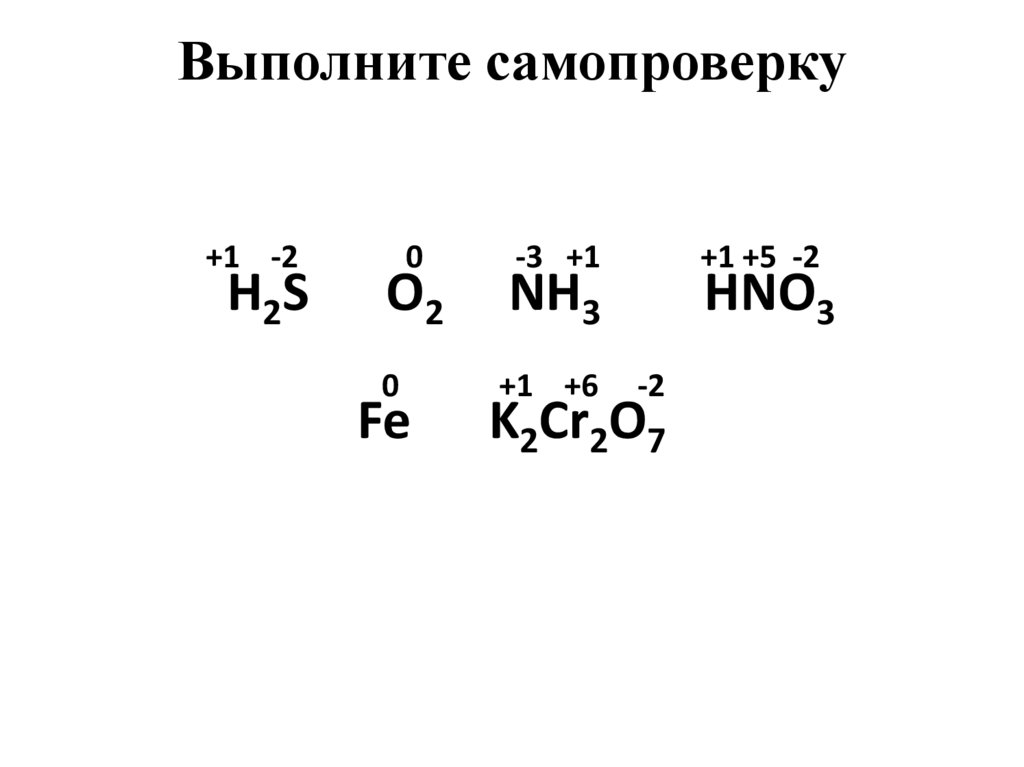
3. Выполните самопроверку
+1 -2H2S
0
-3 +1
O2
NH3
0
+1 +6
Fe
+1 +5 -2
HNO3
-2
K2Cr2O7
4.
Окисление – процесс отдачи электронов.Восстановление – процесс присоединения
электронов.
Окислитель – элемент, принимающий
электроны.
Восстановитель – элемент, отдающий
электроны.
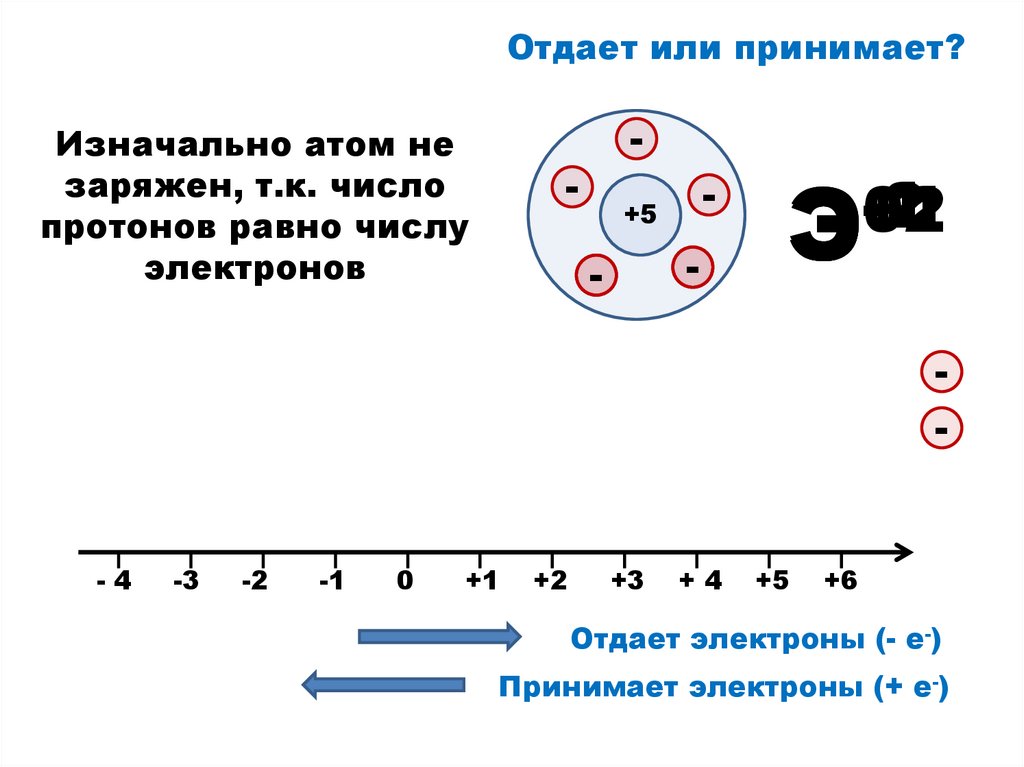
5.
Отдает или принимает?Изначально атом не
заряжен, т.к. число
протонов равно числу
электронов
-
-
-
+5
-
-
-2
-1
+1
+2
0
Э
-
-4
-3
-2
-1
0
+1
+2
+3
+4
+5
+6
Отдает электроны (- е-)
Принимает электроны (+ е-)
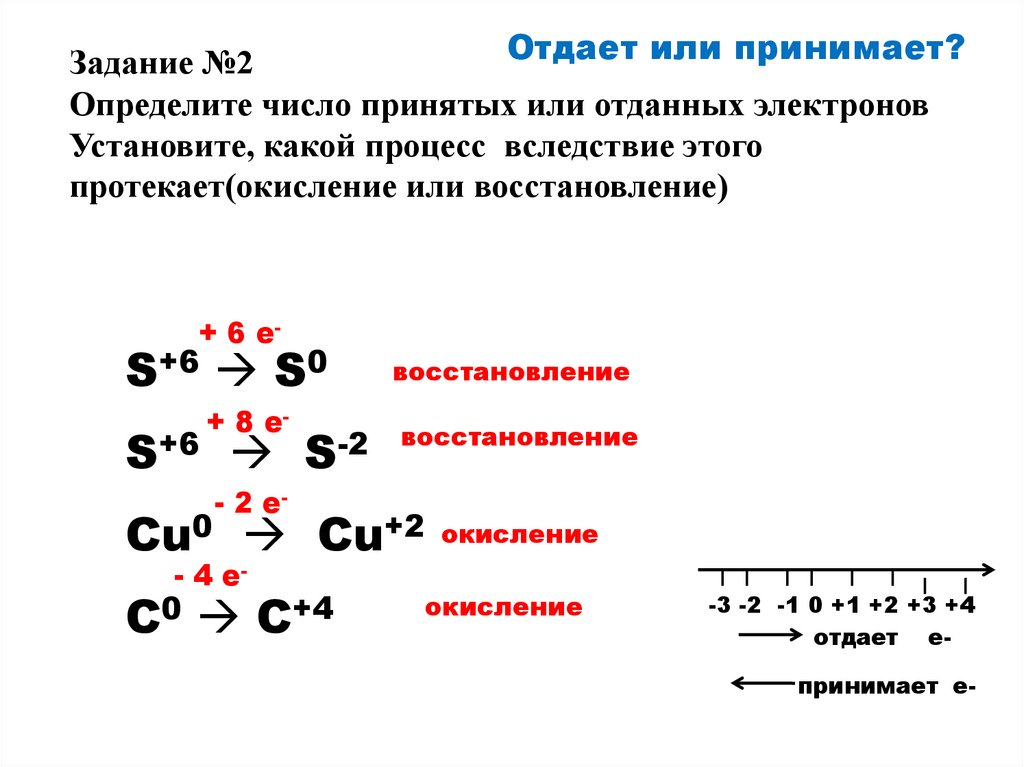
6.
Отдает или принимает?Задание №2
Определите число принятых или отданных электронов
Установите, какой процесс вследствие этого
протекает(окисление или восстановление)
+ 6 e-
S+6 S0
S+6
+ 8 e-
S-2
восстановление
восстановление
- 2 e-
Cu0 Cu+2 окисление
- 4 e-
C0 C+4
окисление
-3 -2 -1 0 +1 +2 +3 +4
отдает е-
принимает е-
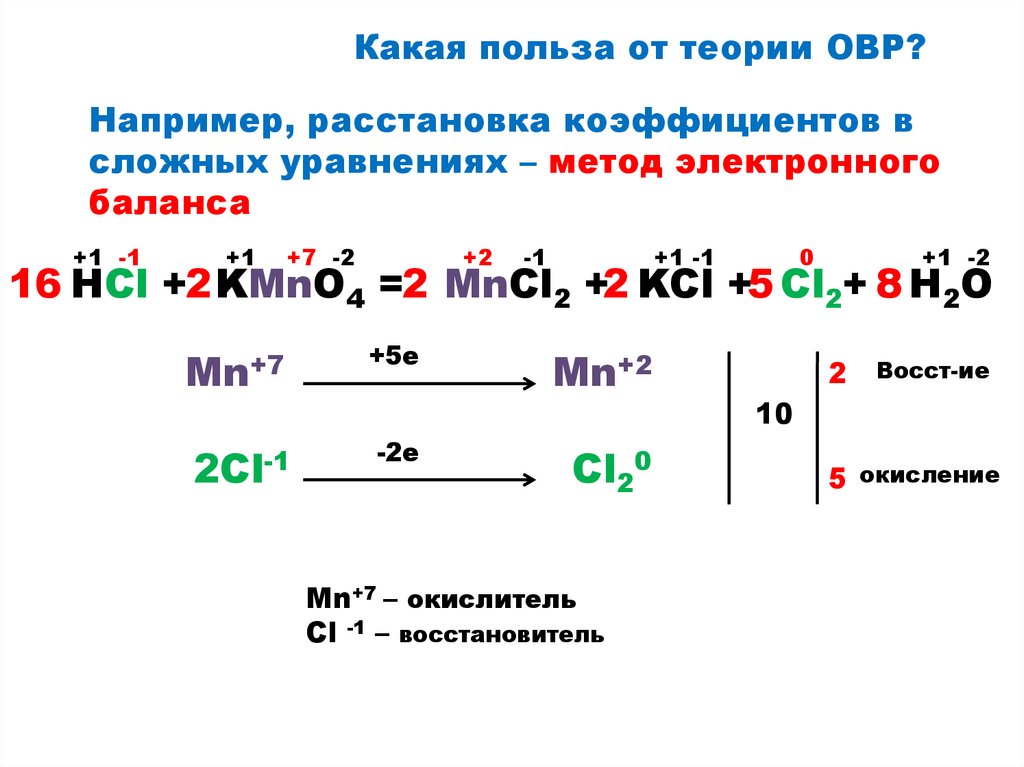
7.
Какая польза от теории ОВР?Например, расстановка коэффициентов в
сложных уравнениях – метод электронного
баланса
+1 -1
+1
+7 -2
+2
-1
+1 -1
0
+1 -2
16 HCl +2 KMnO4 =2 MnCl2 +2 KCl +5 Cl2+ 8 H2O
Mn+7
+5е
2Cl-1
-2е
Mn+2
Cl20
Mn+7 – окислитель
Сl -1 – восстановитель
2
Восст-ие
10
5 окисление
8.
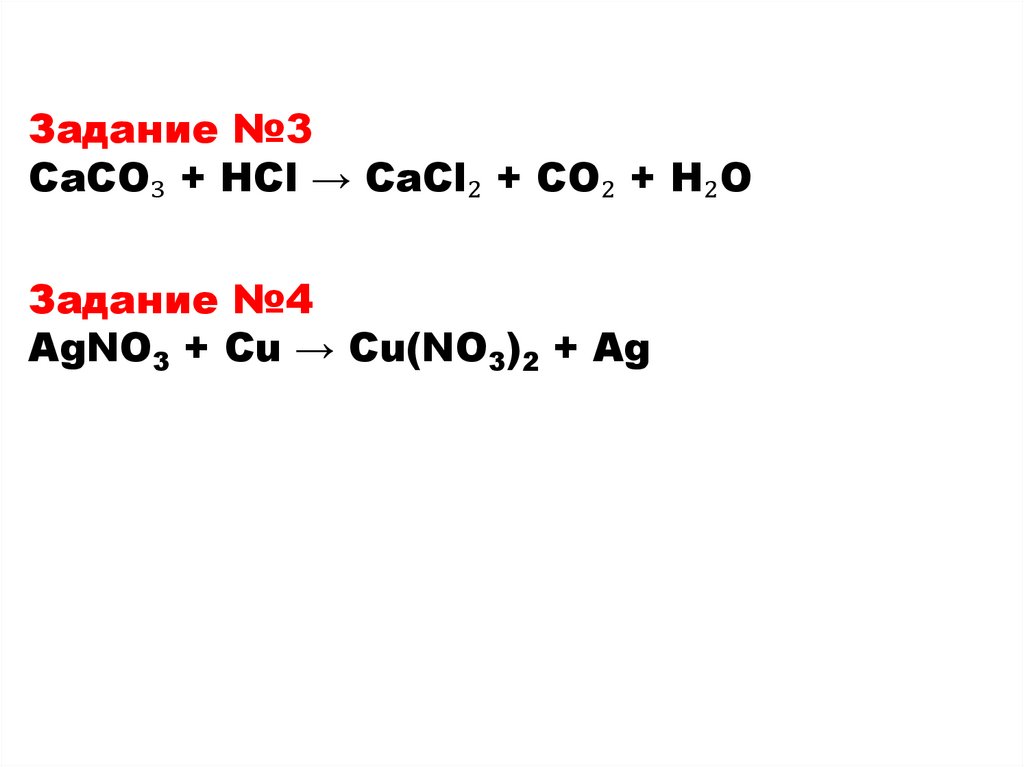
Задание №3CaCO₃ + HCl → CaCl₂ + CO₂ + H₂O
Задание №4
AgNO3 + Cu → Cu(NO3)2 + Ag
9.
ОВР в быту10.
Горение газа на кухнеГаз метан горит бесцветным пламенем с образованием
воды и углекислого газа
СН4+2О2=СО2+2Н2О
11.
Отбеливание тканиПри обработке персолью отбеливание
происходит за счет окисления
загрязнений
2H2O2=2H2O+O2.
Для того чтобы образующийся
кислород не улетучивался
из емкости, лучше
держать ее
закрытой.
12.
Коррозия металлаПри взаимодействии железа и кислорода
образуется ржавчина.
4Fe+ 2O2= 2Fe2O3







 chemistry
chemistry








