Similar presentations:
§1. Характеристика химического элемента на основании его положения в ПСХЭ
1.
§1. Характеристика химическогоэлемента на основании его
положения в ПСХЭ.
2.
Цель урока:Формирование умений характеризовать химические элементы и их
соединения исходя из положения элементов в периодической таблице
Д. И. Менделеева.
Проблемный вопрос урока:
Какую информацию можно получить о свойствах химического
элемента и его соединений исходя из положения элемента в
Периодической системе химических элементов Д. И. Менделеева?
3.
Этап -I. Актуализация знаний обучающихся о строении атома иПериодическом законе Д. И. Менделеева
Вспомните, какая взаимосвязь существует между
строением атома химического элемента и его
положением в Периодической системе Д. И. Менделеева
4.
Этап -I. Актуализация знаний обучающихся о строении атома иПериодическом законе Д. И. Менделеева
Как изменяются свойства атомов, простых веществ и
соединений, образованных химическими
элементами, в пределах главных подгрупп и
периодов Периодической системы Д. И. Менделеева?
Мотивируйте свой ответ.
5.
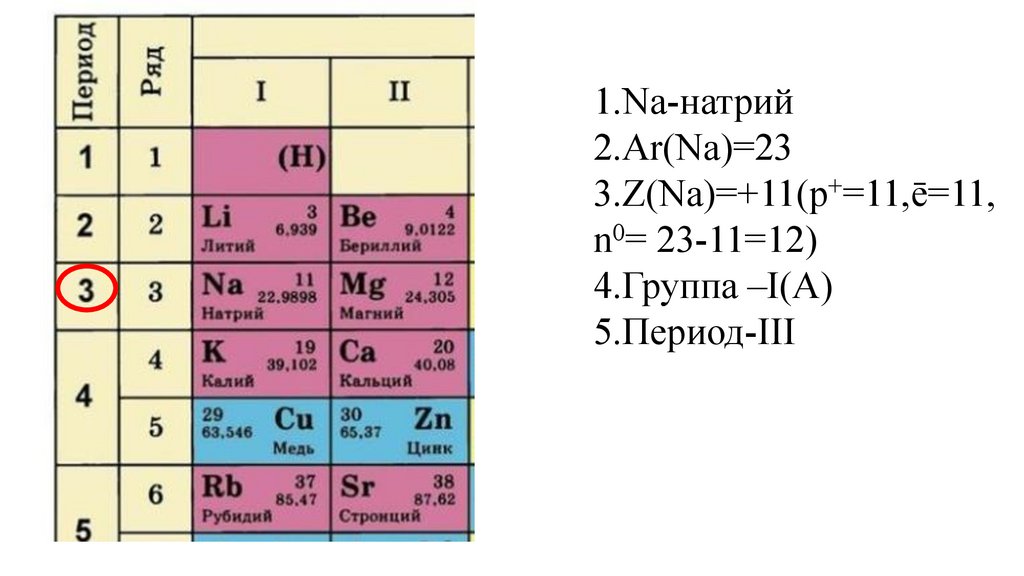
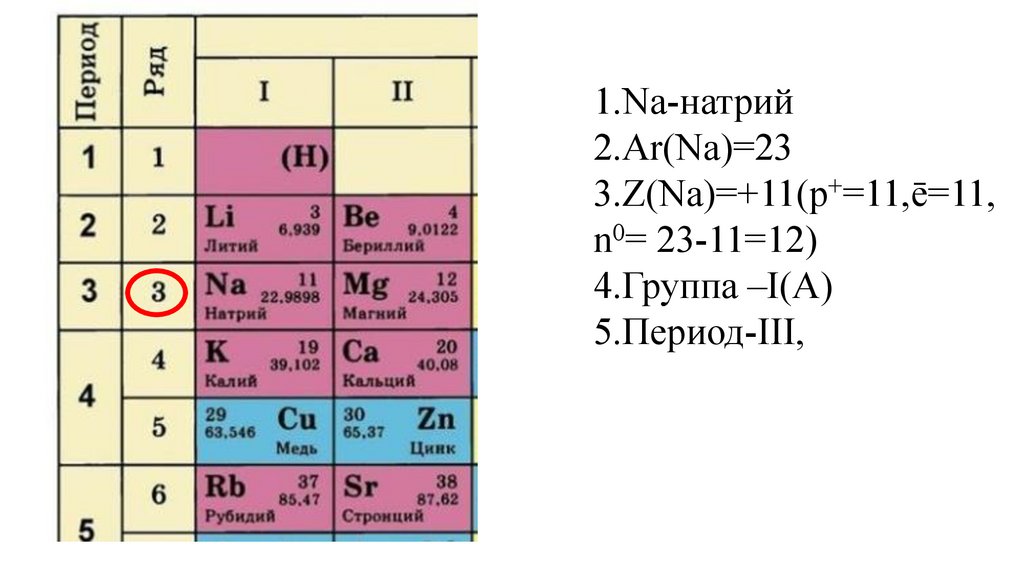
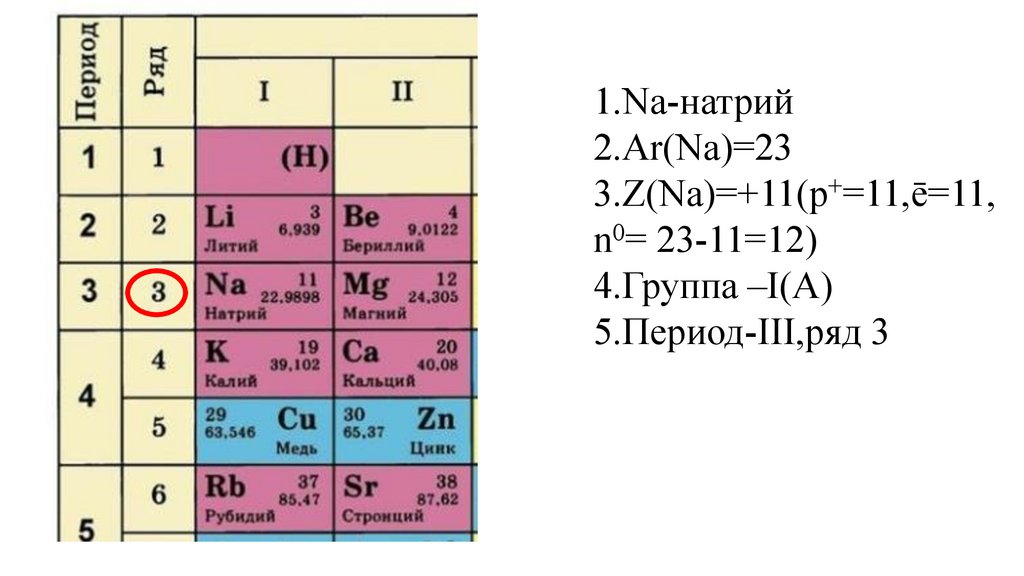
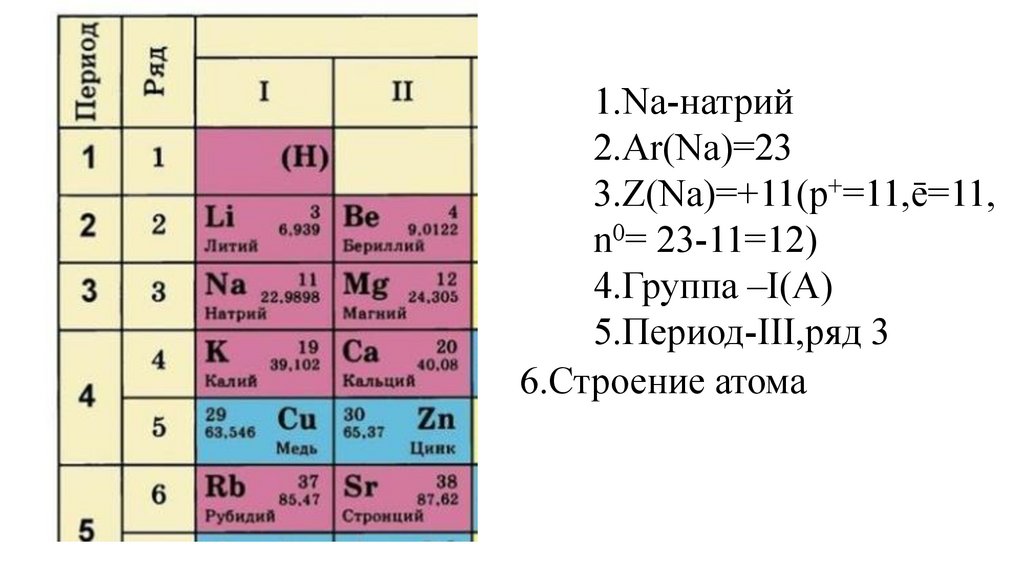
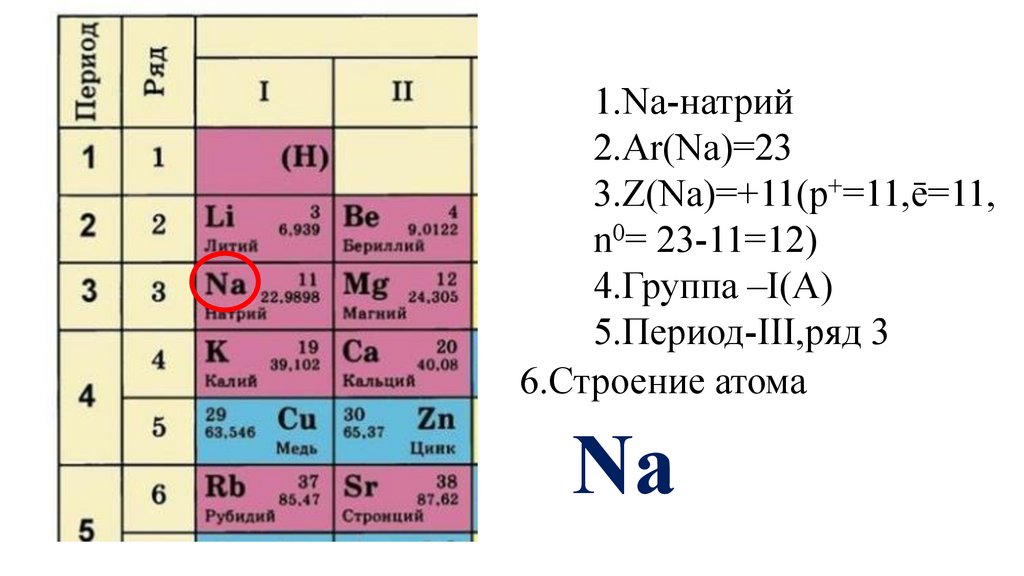
Этап -I. Актуализация знаний обучающихся о строении атома иПериодическом законе Д. И. Менделеева
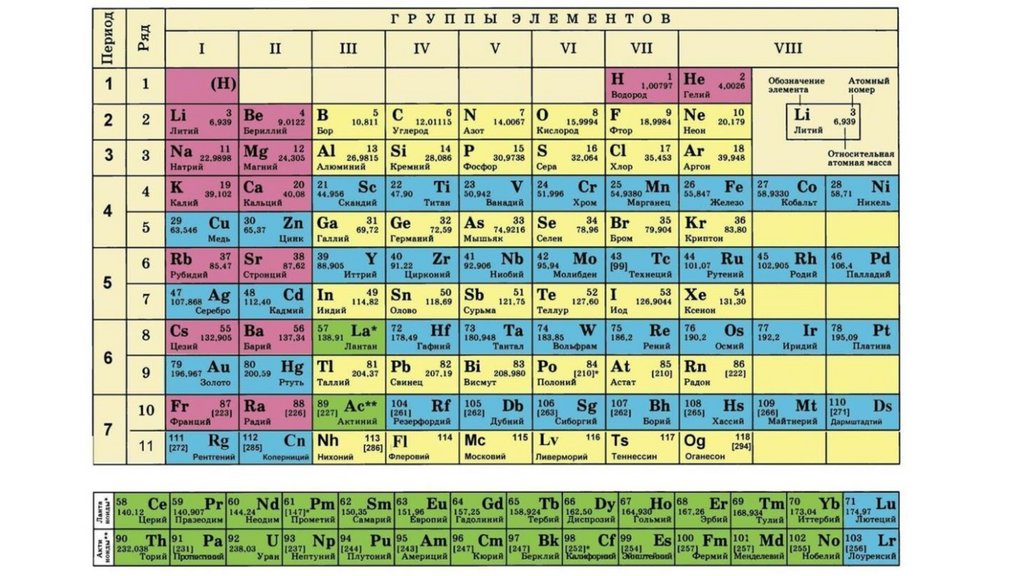
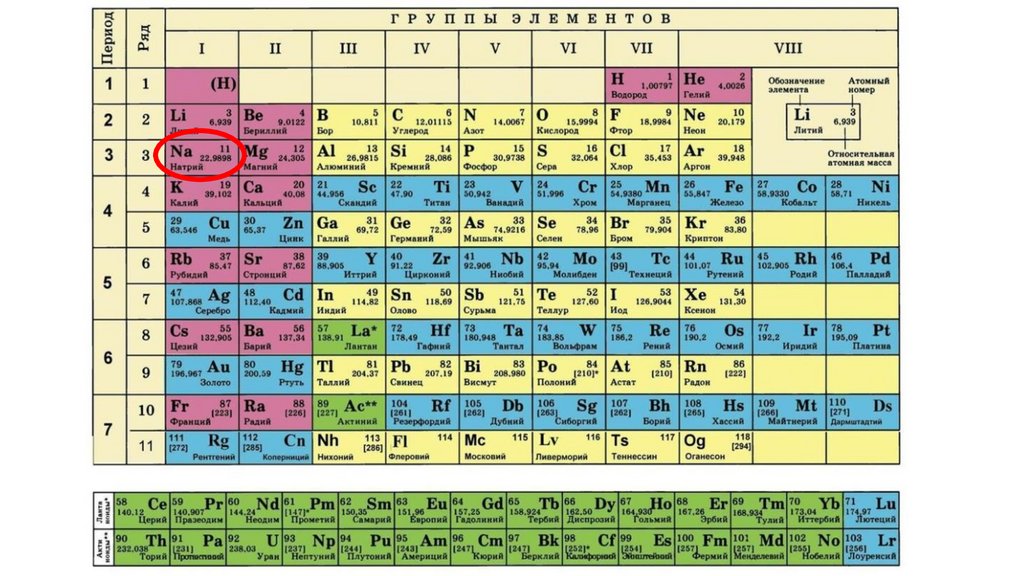
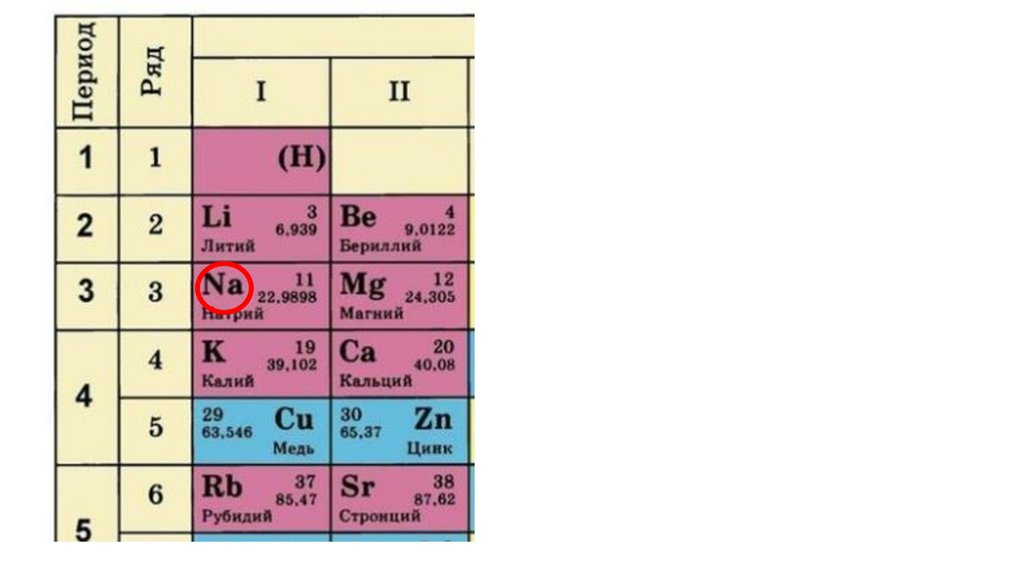
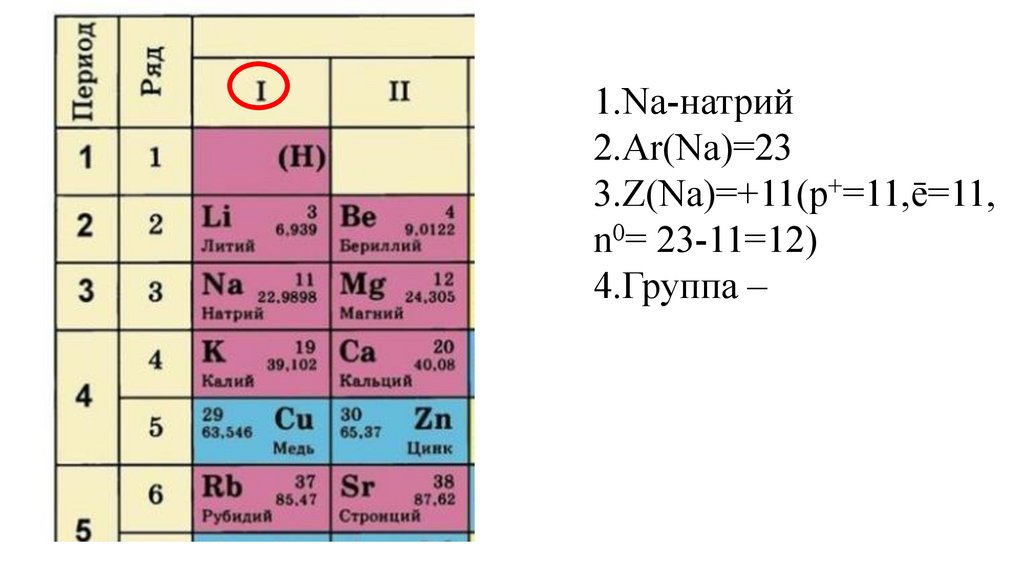
Дайте характеристику химического элемента
натрия в соответствии с планом(стр.3учебника).
6.
7.
8.
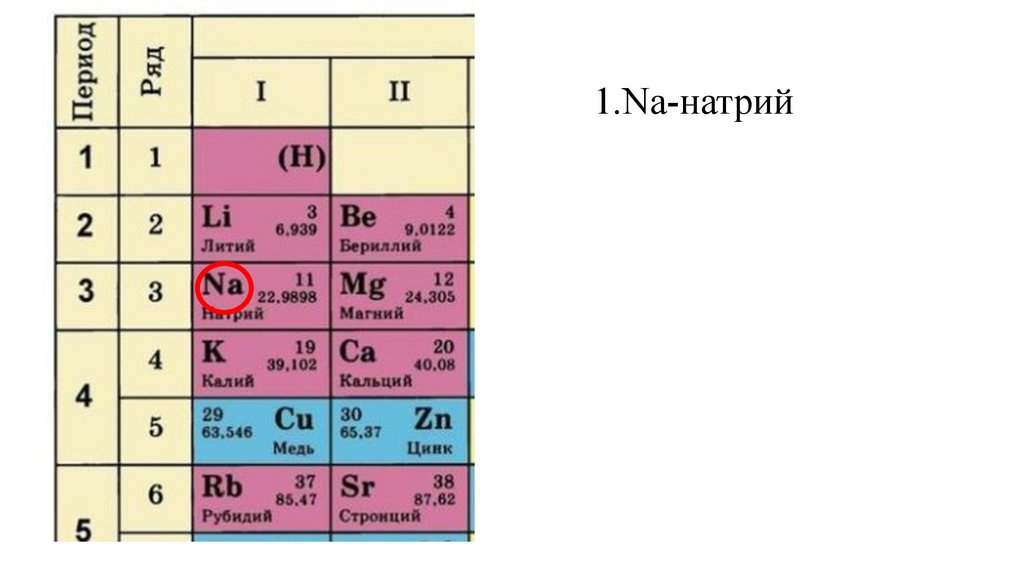
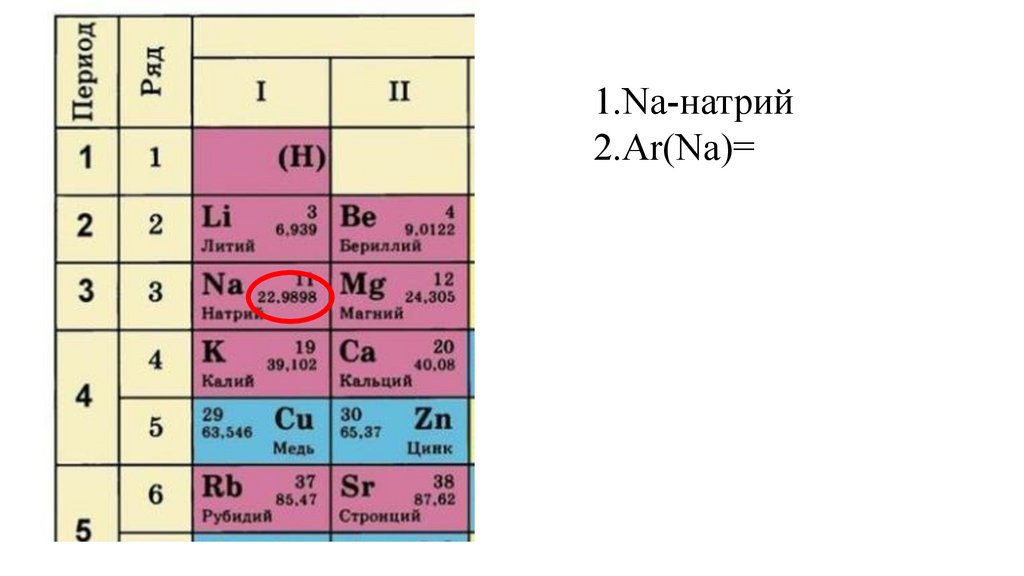
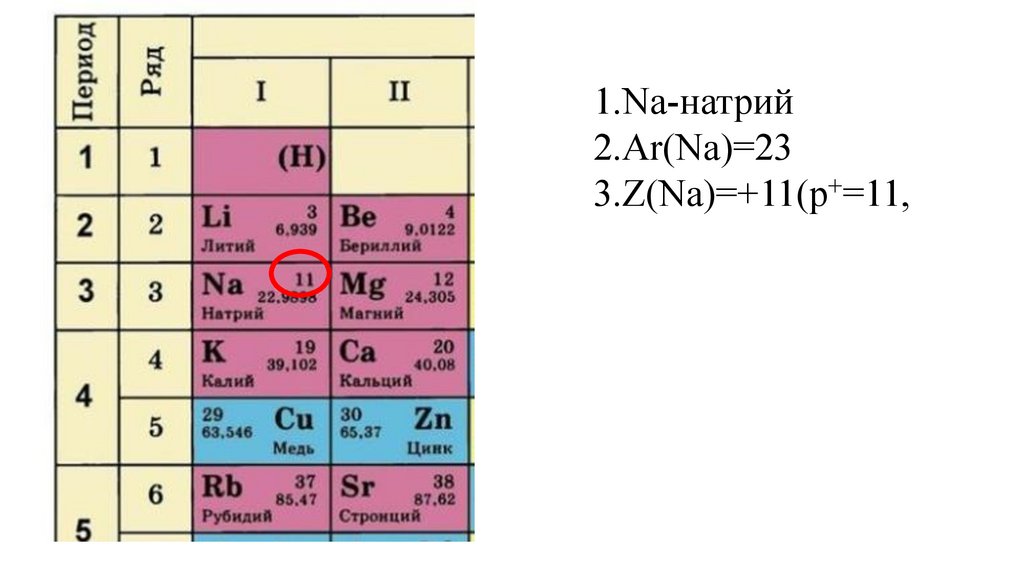
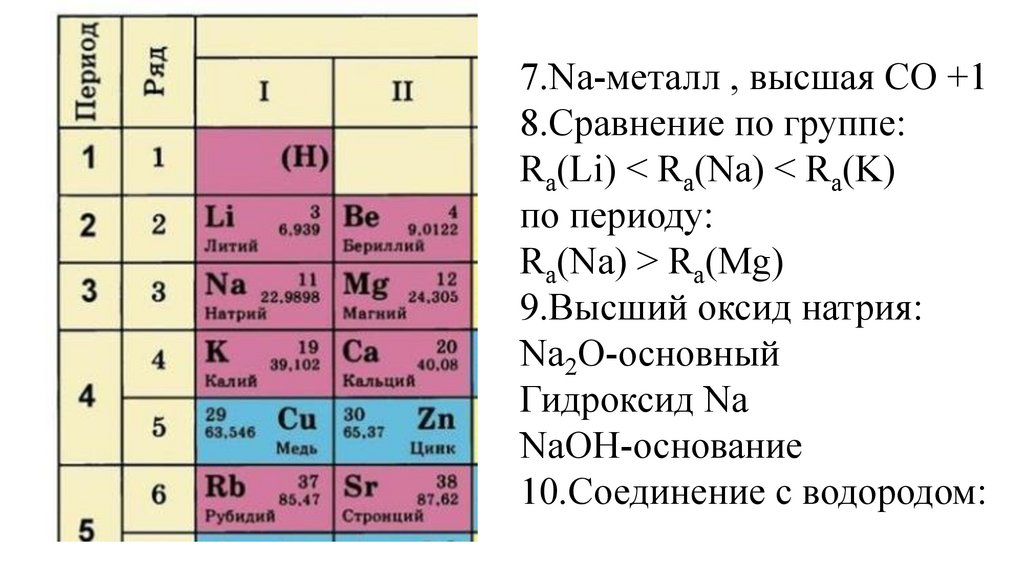
1.Na-натрий9.
1.Na-натрий10.
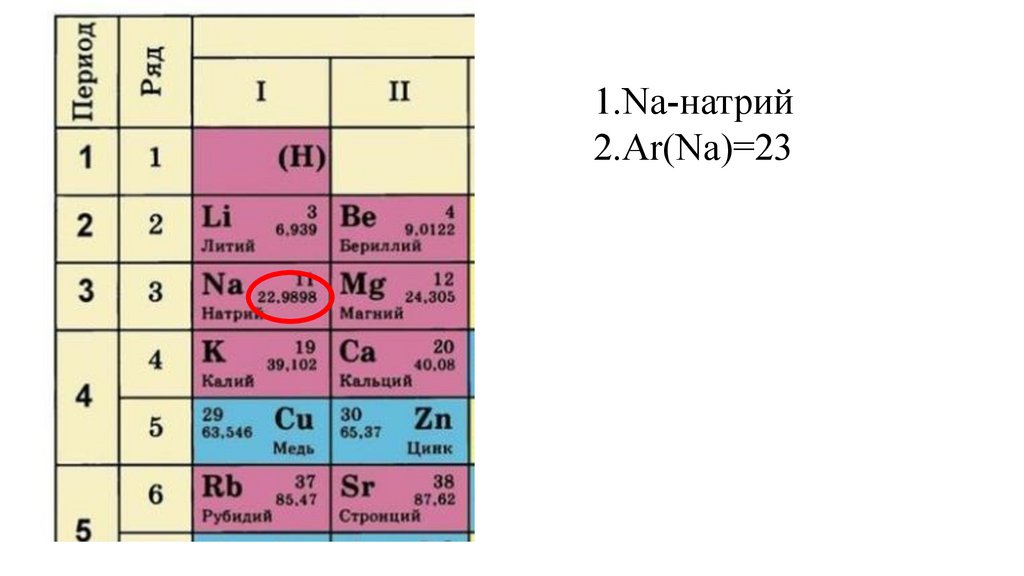
1.Na-натрий2.Ar(Na)=
11.
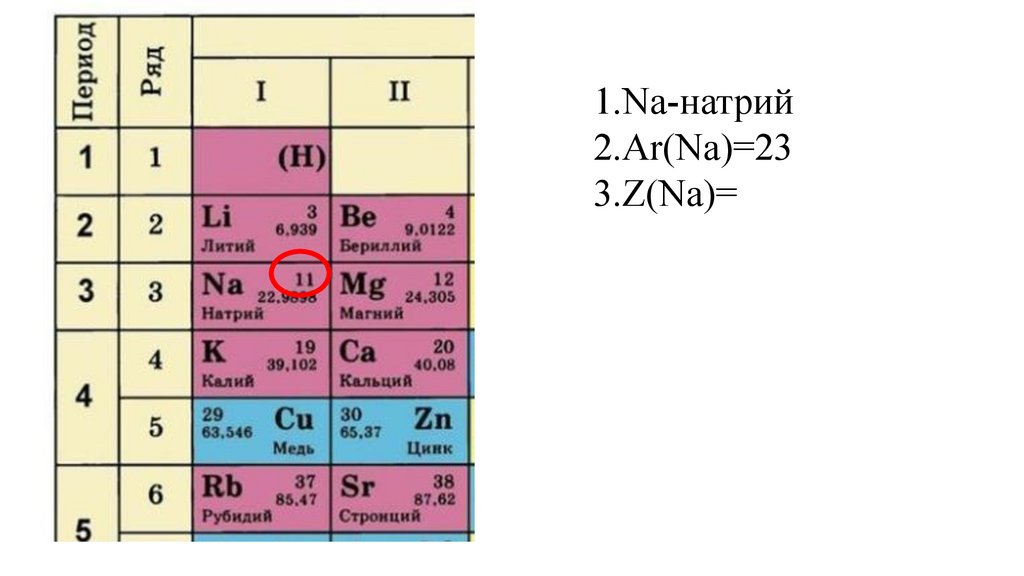
1.Na-натрий2.Ar(Na)=23
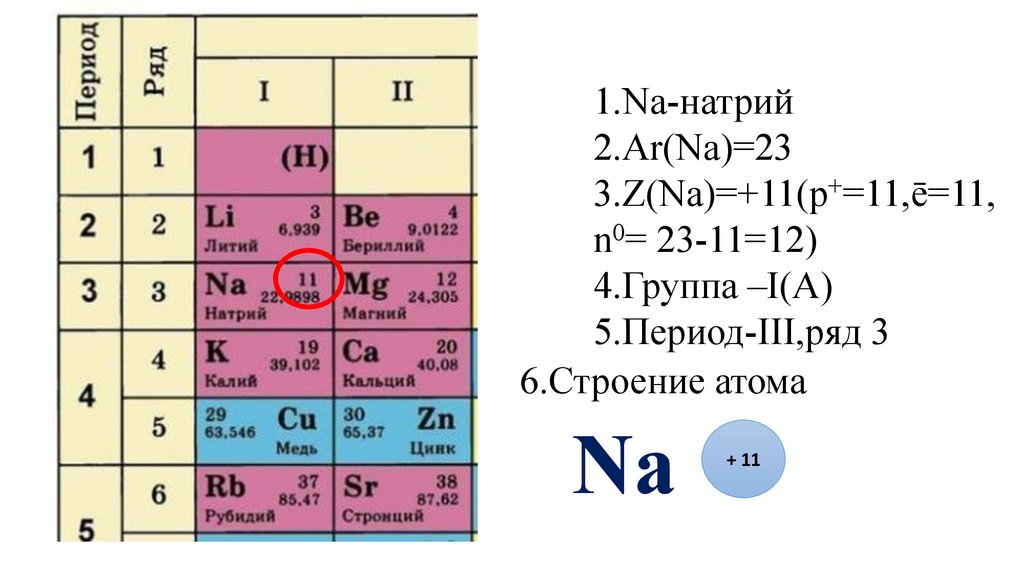
12.
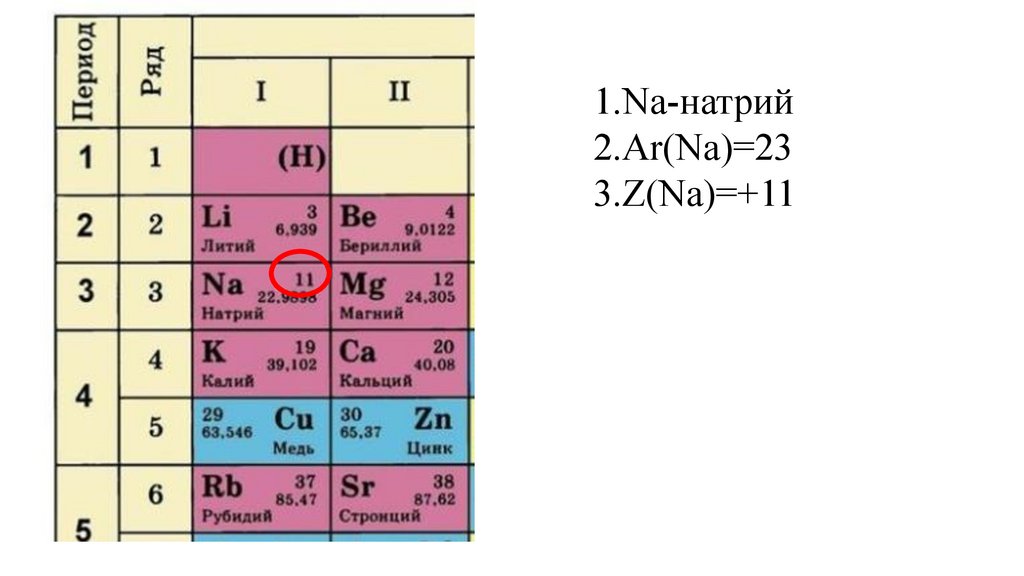
1.Na-натрий2.Ar(Na)=23
3.Z(Na)=
13.
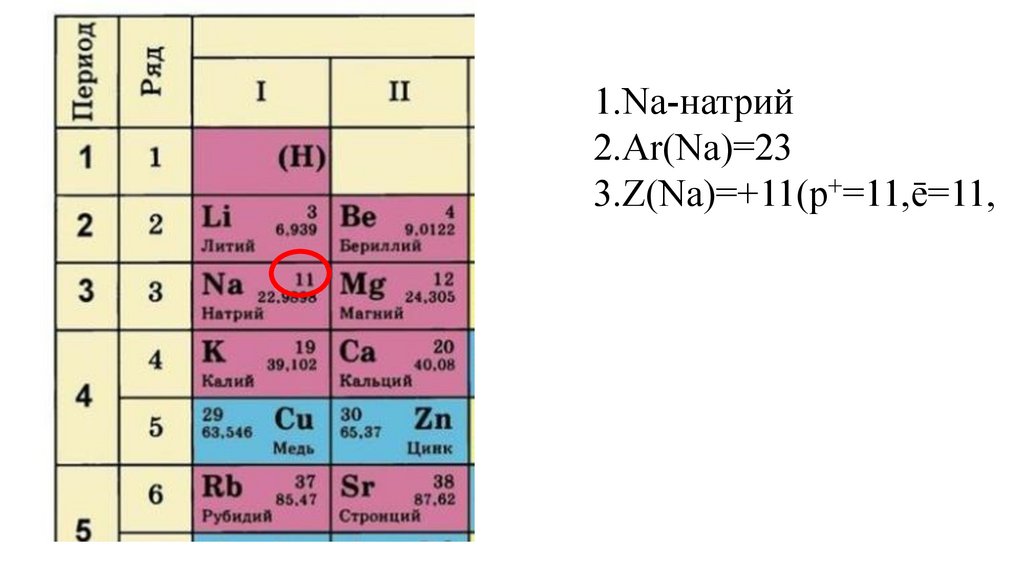
1.Na-натрий2.Ar(Na)=23
3.Z(Na)=+11(p+=11,
14.
1.Na-натрий2.Ar(Na)=23
3.Z(Na)=+11(p+=11,ē=11,
n0= 23-11=12
15.
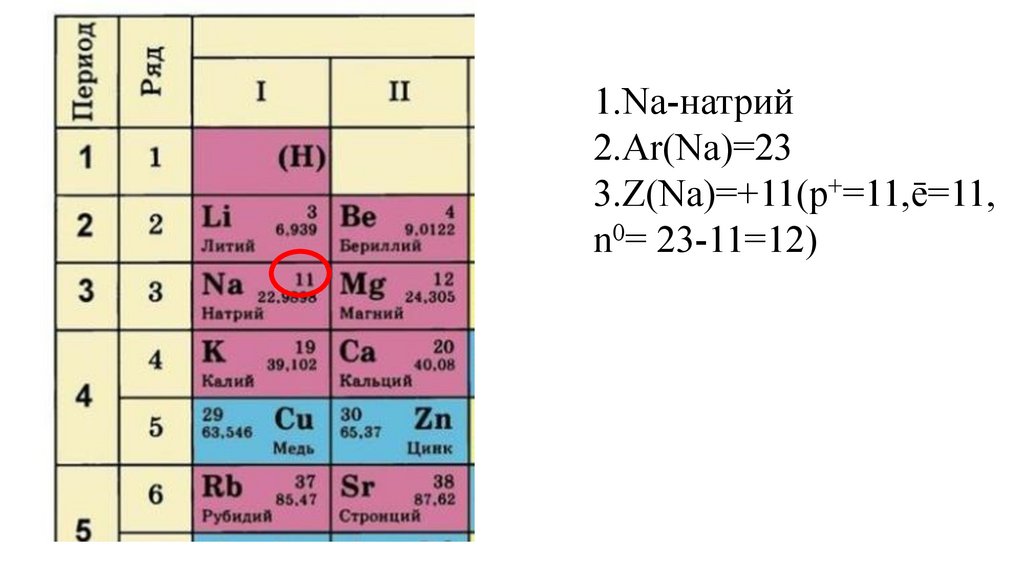
1.Na-натрий2.Ar(Na)=23
3.Z(Na)=+11(p+=11,ē=11,
n0= 23-11=12)
16.
1.Na-натрий2.Ar(Na)=23
3.Z(Na)=+11(p+=11,ē=11,
n0= 23-11=12)
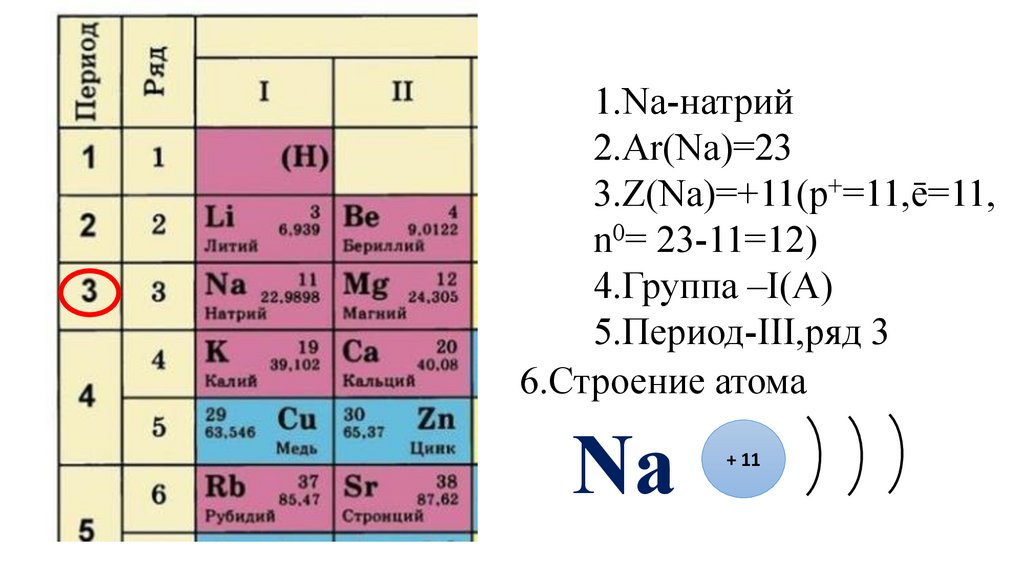
17.
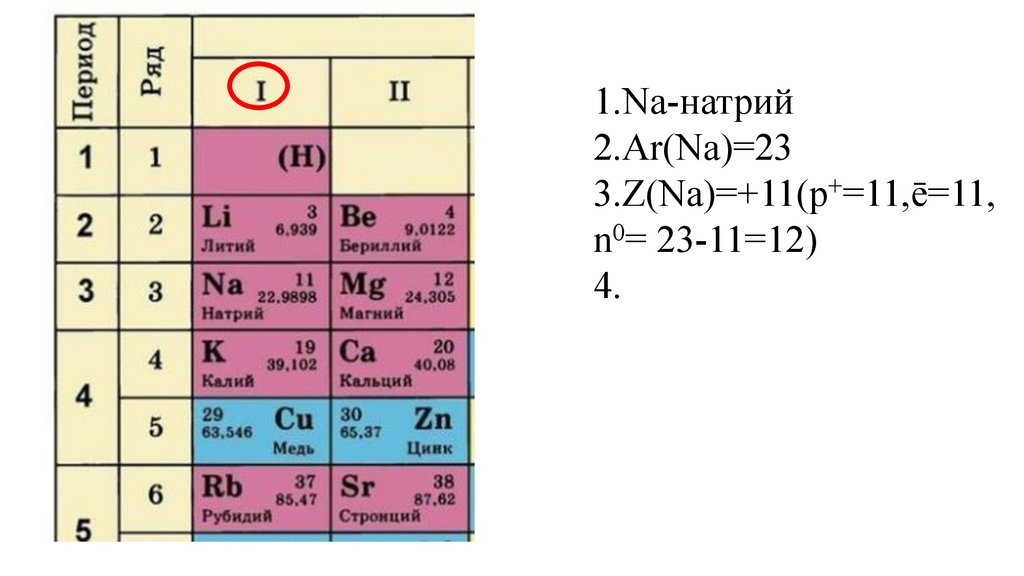
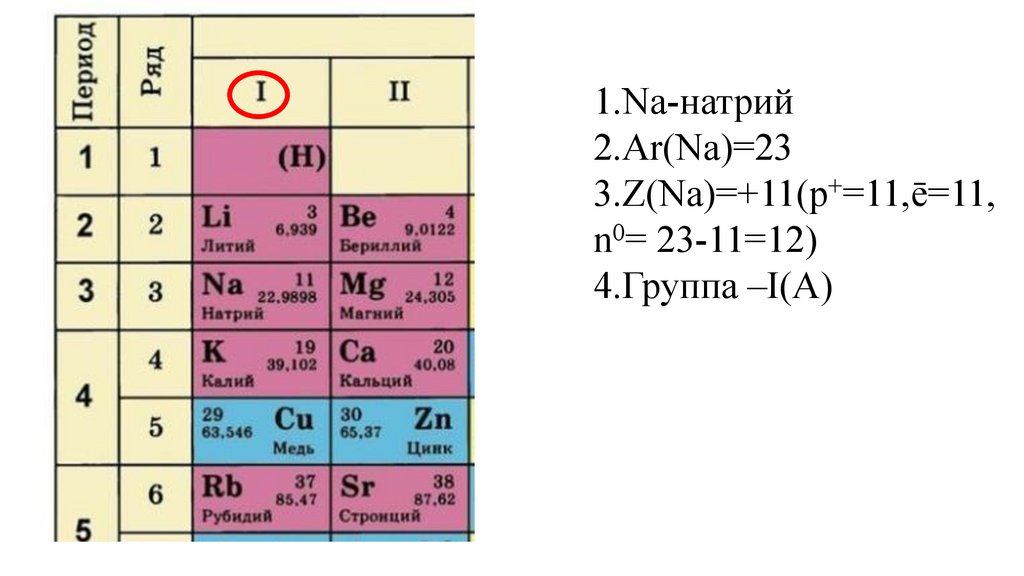
1.Na-натрий2.Ar(Na)=23
3.Z(Na)=+11(p+=11,ē=11,
n0= 23-11=12)
4.Группа –I(A)
18.
1.Na-натрий2.Ar(Na)=23
3.Z(Na)=+11(p+=11,ē=11,
n0= 23-11=12)
4.Группа –I(A)
19.
1.Na-натрий2.Ar(Na)=23
3.Z(Na)=+11(p+=11,ē=11,
n0= 23-11=12)
4.Группа –I(A)
20.
1.Na-натрий2.Ar(Na)=23
3.Z(Na)=+11(p+=11,ē=11,
n0= 23-11=12)
4.Группа –I(A)
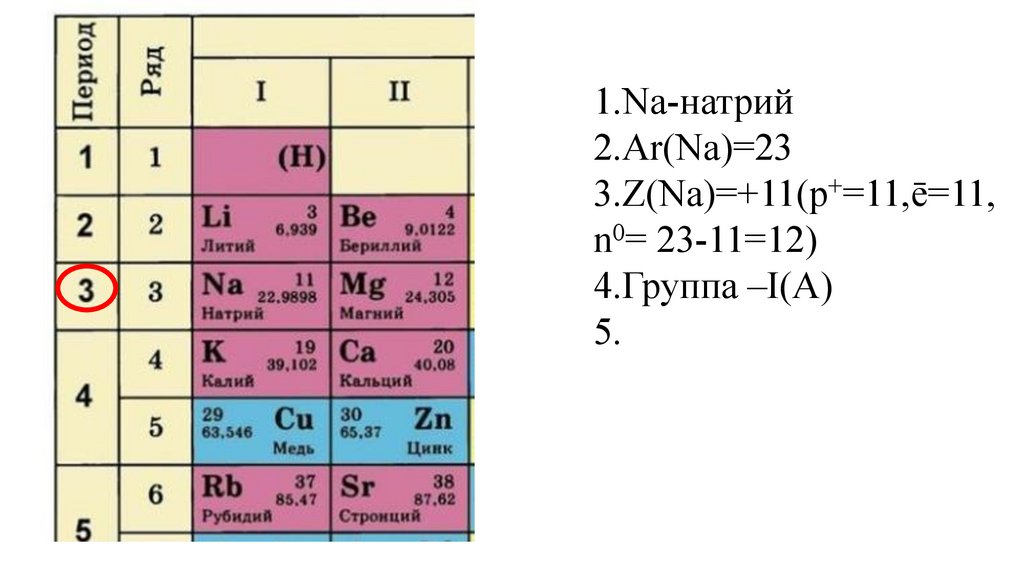
5.
21.
1.Na-натрий2.Ar(Na)=23
3.Z(Na)=+11(p+=11,ē=11,
n0= 23-11=12)
4.Группа –I(A)
5.Период-III,
22.
1.Na-натрий2.Ar(Na)=23
3.Z(Na)=+11(p+=11,ē=11,
n0= 23-11=12)
4.Группа –I(A)
5.Период-IIIII,
23.
1.Na-натрий2.Ar(Na)=23
3.Z(Na)=+11(p+=11,ē=11,
n0= 23-11=12)
4.Группа –I(A)
5.Период-III,
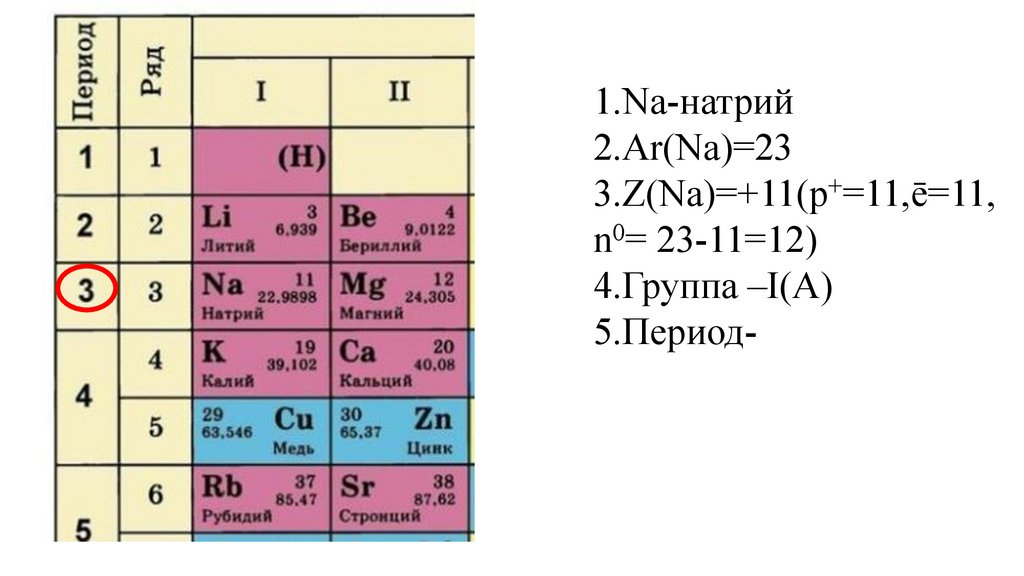
24.
1.Na-натрий2.Ar(Na)=23
3.Z(Na)=+11(p+=11,ē=11,
n0= 23-11=12)
4.Группа –I(A)
5.Период-III,ряд 3
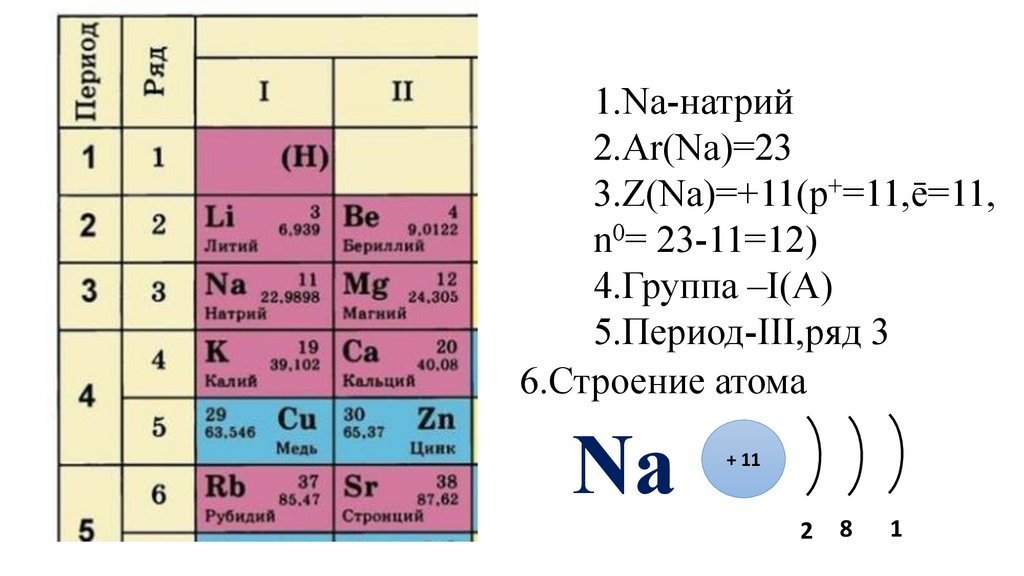
25.
1.Na-натрий2.Ar(Na)=23
3.Z(Na)=+11(p+=11,ē=11,
n0= 23-11=12)
4.Группа –I(A)
5.Период-III,ряд 3
6.Строение атома
26.
1.Na-натрий2.Ar(Na)=23
3.Z(Na)=+11(p+=11,ē=11,
n0= 23-11=12)
4.Группа –I(A)
5.Период-III,ряд 3
6.Строение атома
Na
+ 11
2
8
1
27.
1.Na-натрий2.Ar(Na)=23
3.Z(Na)=+11(p+=11,ē=11,
n0= 23-11=12)
4.Группа –I(A)
5.Период-III,ряд 3
6.Строение атома
Na
+ 11
2
8
1
28.
1.Na-натрий2.Ar(Na)=23
3.Z(Na)=+11(p+=11,ē=11,
n0= 23-11=12)
4.Группа –I(A)
5.Период-III,ряд 3
6.Строение атома
Na
+ 11
2
8
1
29.
1.Na-натрий2.Ar(Na)=23
3.Z(Na)=+11(p+=11,ē=11,
n0= 23-11=12)
4.Группа –I(A)
5.Период-III,ряд 3
6.Строение атома
Na
+ 11
2
8
1
30.
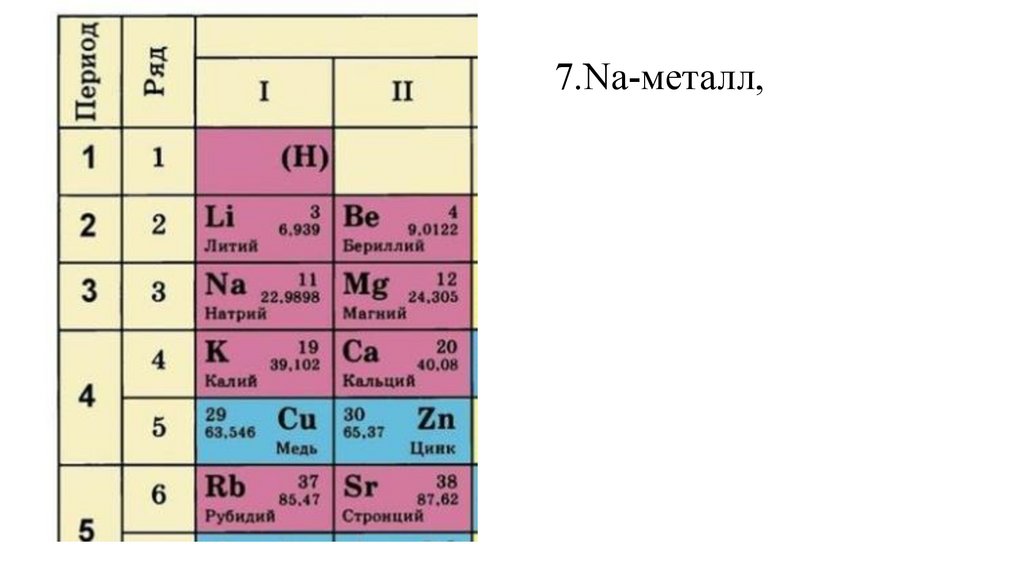
7.Na-металл,31.
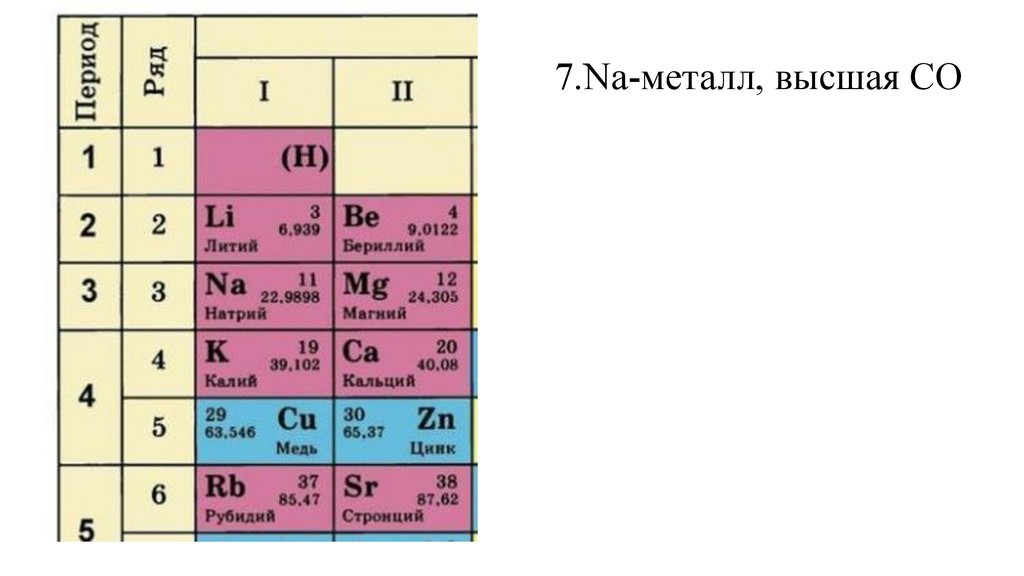
7.Na-металл, высшая СО +132.
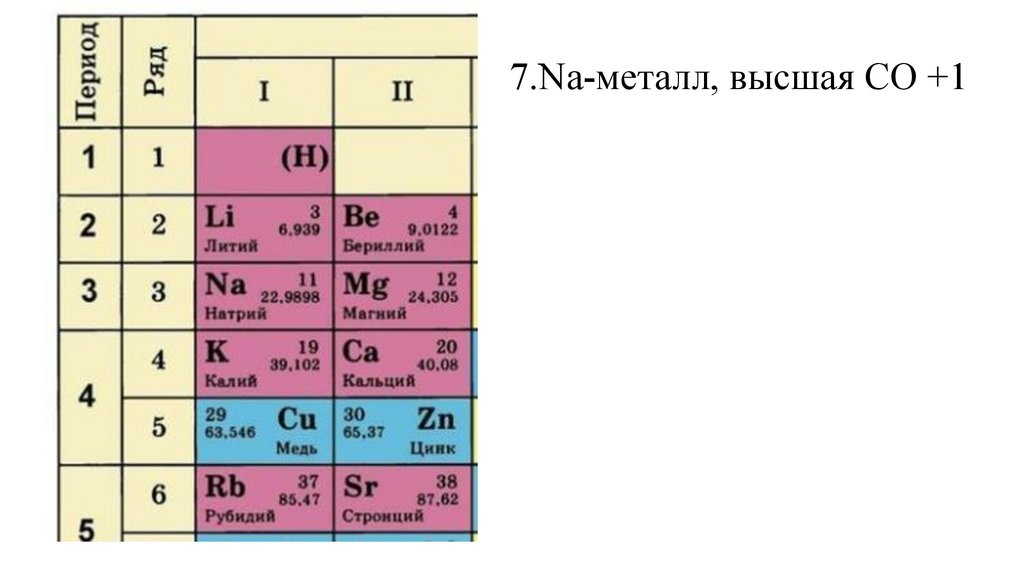
7.Na-металл, высшая СО +133.
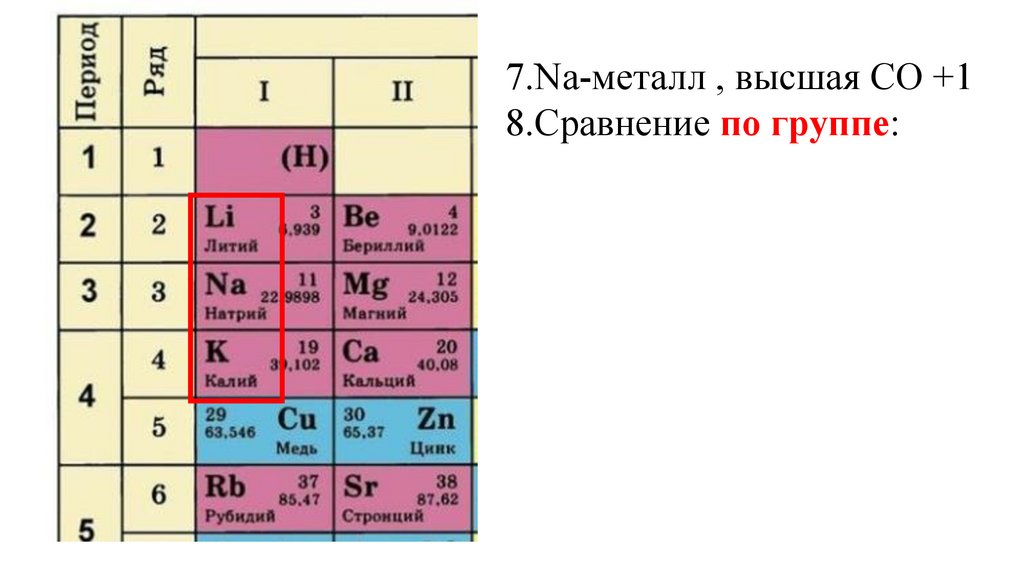
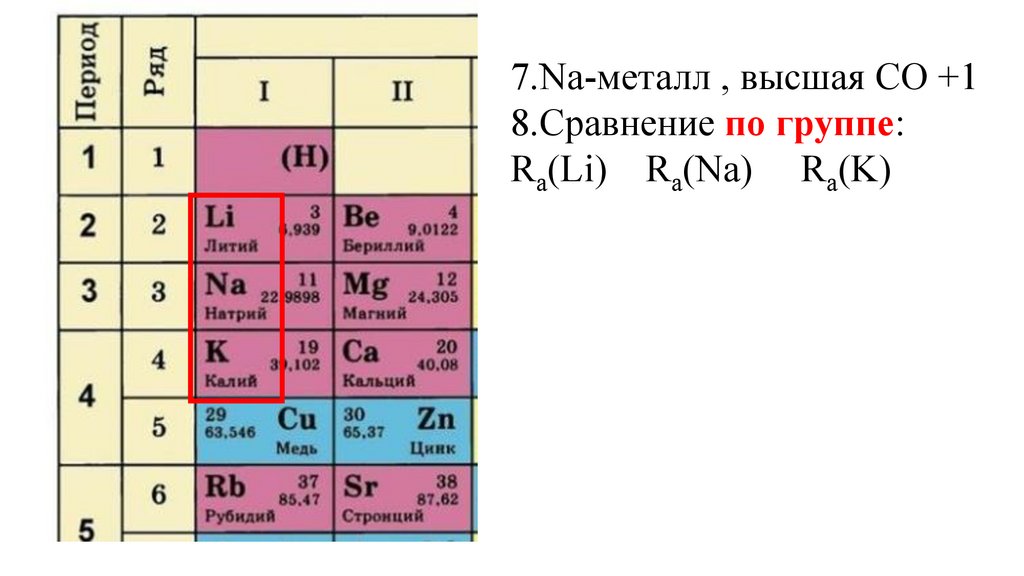
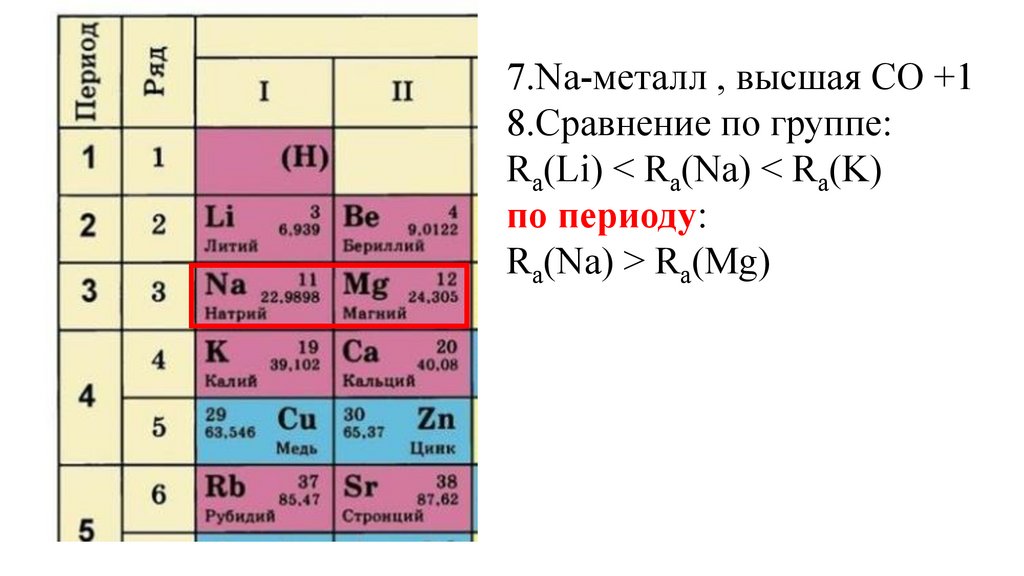
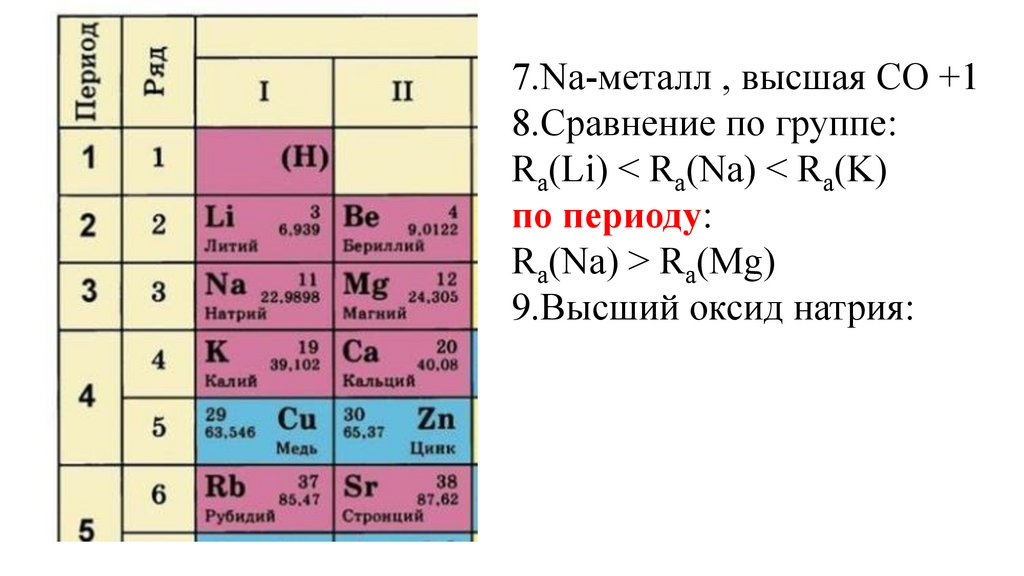
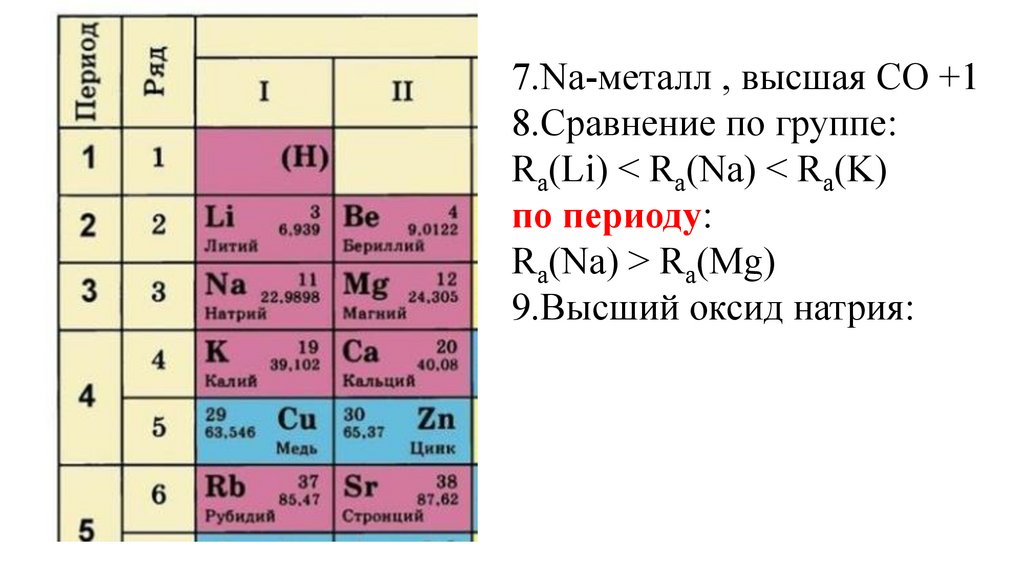
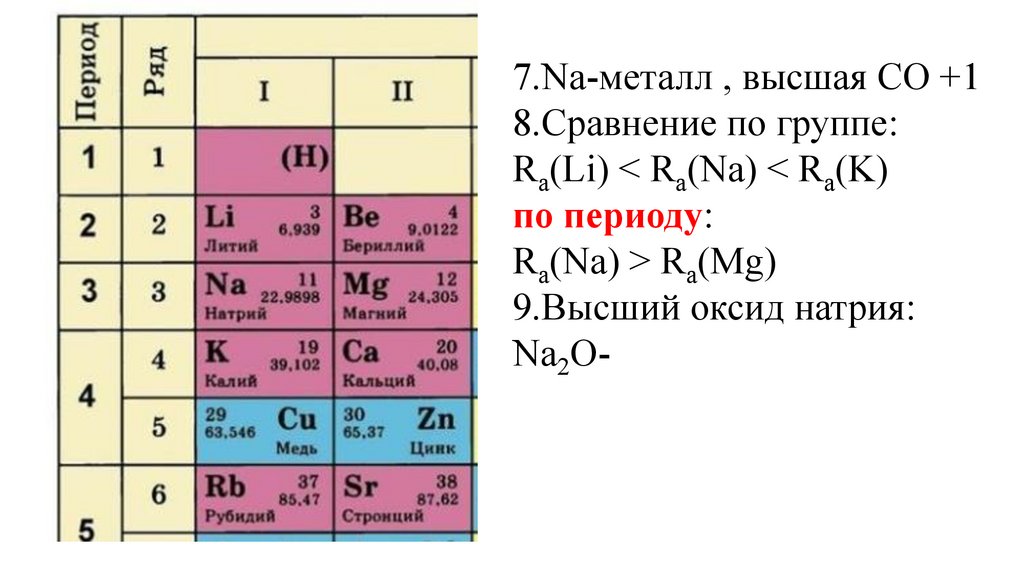
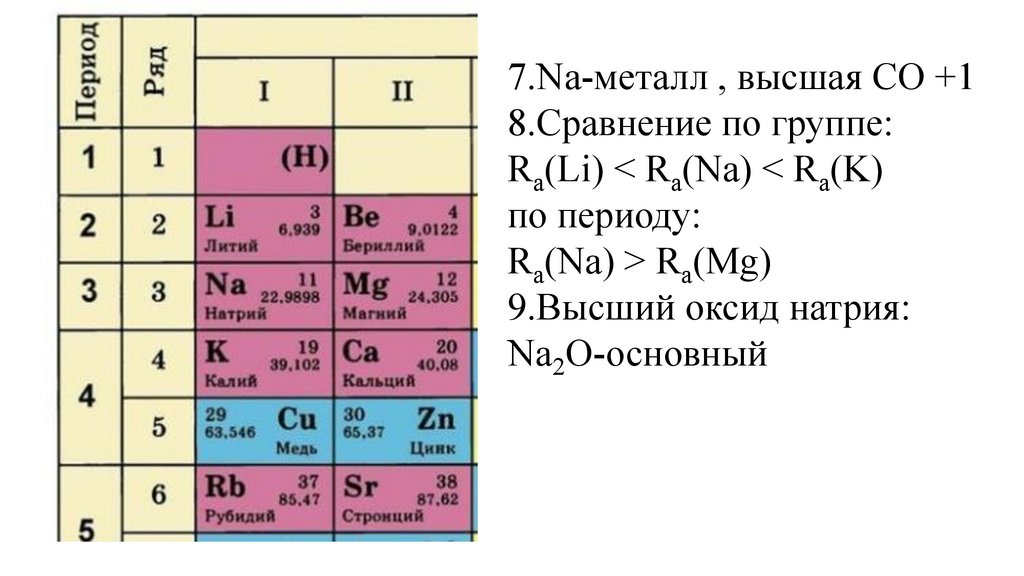
7.Na-металл , высшая СО +18.Сравнение по группе:
Ra(Li) Ra(Na) Ra(K)
34.
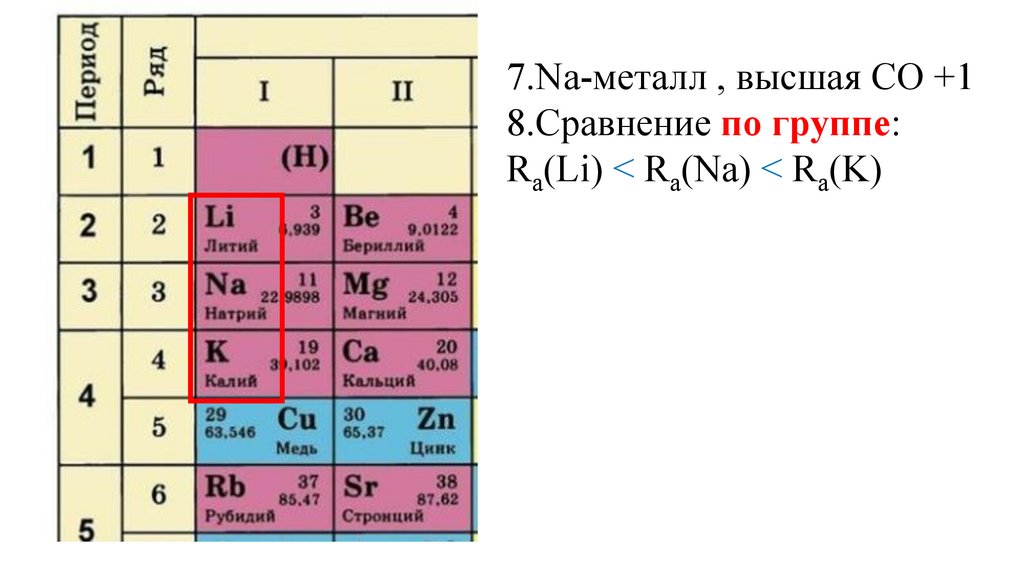
7.Na-металл , высшая СО +18.Сравнение по группе:
Ra(Li) Ra(Na) Ra(K)
35.
7.Na-металл , высшая СО +18.Сравнение по группе:
Ra(Li) < Ra(Na) < Ra(K)
36.
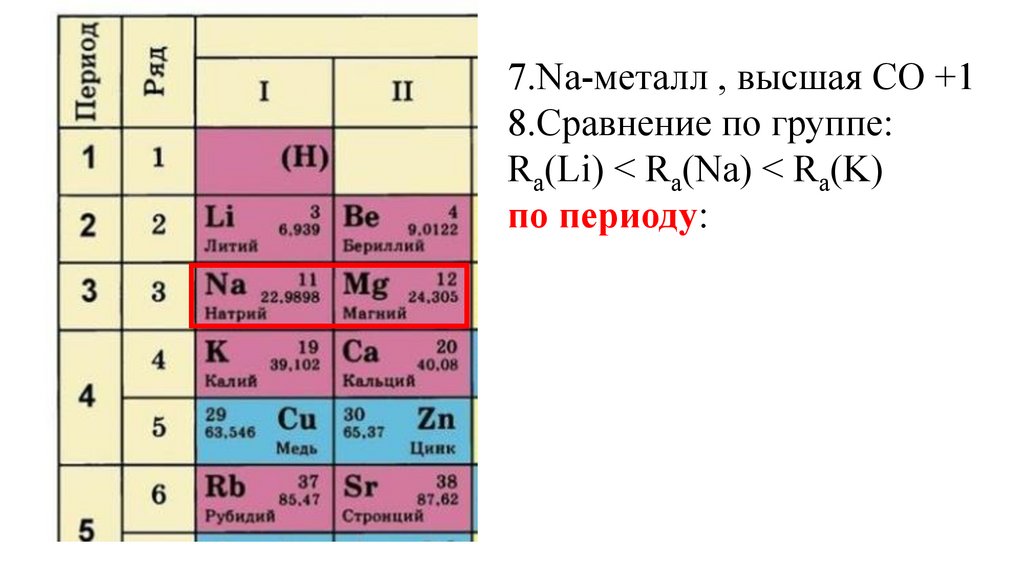
7.Na-металл , высшая СО +18.Сравнение по группе:
Ra(Li) < Ra(Na) < Ra(K)
по периоду:
37.
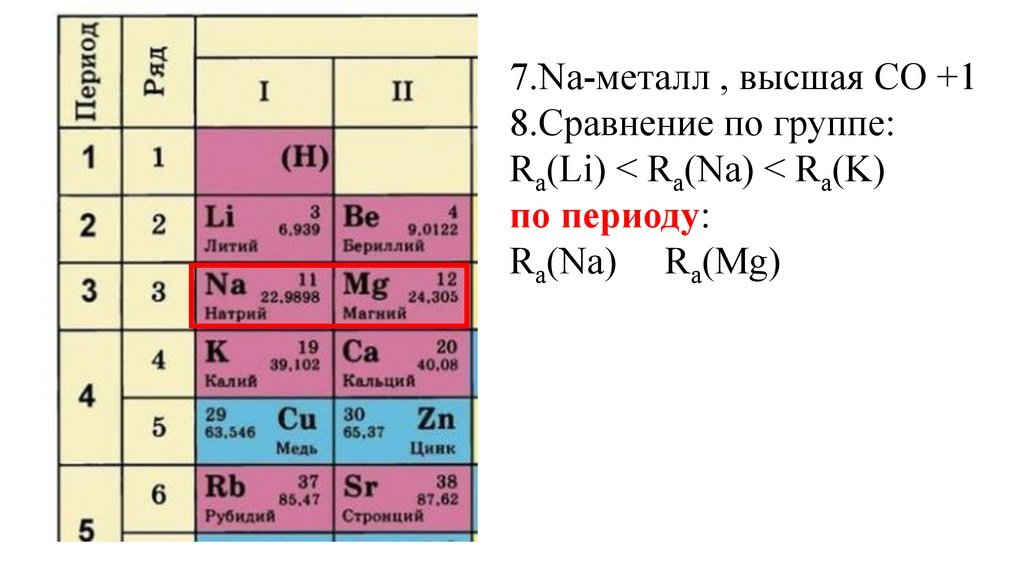
7.Na-металл , высшая СО +18.Сравнение по группе:
Ra(Li) < Ra(Na) < Ra(K)
по периоду:
Ra(Na) Ra(Mg)
38.
7.Na-металл , высшая СО +18.Сравнение по группе:
Ra(Li) < Ra(Na) < Ra(K)
по периоду:
Ra(Na) > Ra(Mg)
39.
7.Na-металл , высшая СО +18.Сравнение по группе:
Ra(Li) < Ra(Na) < Ra(K)
по периоду:
Ra(Na) > Ra(Mg)
9.Высший оксид натрия:
40.
Оксиды – это сложные вещества, состоящие из двух элементов, одним изкоторых является кислород в степени окисления -2
оксид (и. п.) + название элемента (р. п.)
основные
кислотные
41.
Оксиды – это сложные вещества, состоящие из двух элементов, одним изкоторых является кислород в степени окисления -2
оксид (и. п.) + название элемента (р. п.)
Основные(оксиды Ме)
кислотные (оксиды Неме)
42.
Оксиды – это сложные вещества, состоящие из двух элементов, одним изкоторых является кислород в степени окисления -2
оксид (и. п.) + название элемента (р. п.)
Основные(оксиды Ме)
кислотные (оксиды Неме)
❖ СаО – оксид кальция
❖ H2О – оксид водорода
❖ Al2O3 – оксид алюминия
❖ СО2 – оксид углерода
43.
7.Na-металл , высшая СО +18.Сравнение по группе:
Ra(Li) < Ra(Na) < Ra(K)
по периоду:
Ra(Na) > Ra(Mg)
9.Высший оксид натрия:
44.
7.Na-металл , высшая СО +18.Сравнение по группе:
Ra(Li) < Ra(Na) < Ra(K)
по периоду:
Ra(Na) > Ra(Mg)
9.Высший оксид натрия:
Na2O-основный
45.
7.Na-металл , высшая СО +18.Сравнение по группе:
Ra(Li) < Ra(Na) < Ra(K)
по периоду:
Ra(Na) > Ra(Mg)
9.Высший оксид натрия:
Na2O-основный
46.
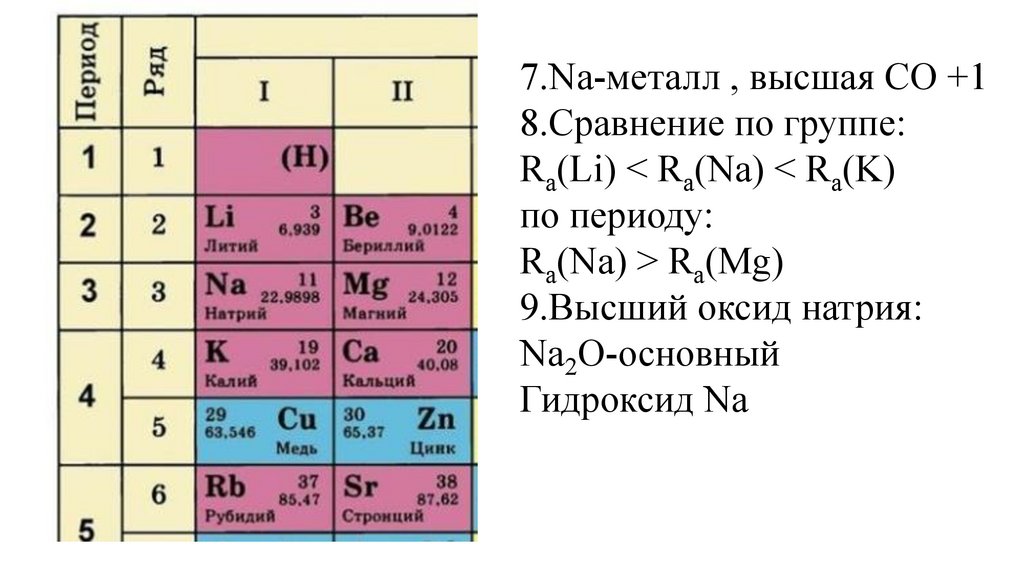
7.Na-металл , высшая СО +18.Сравнение по группе:
Ra(Li) < Ra(Na) < Ra(K)
по периоду:
Ra(Na) > Ra(Mg)
9.Высший оксид натрия:
Na2O-основный
Гидроксид Na
47.
7.Na-металл , высшая СО +18.Сравнение по группе:
Ra(Li) < Ra(Na) < Ra(K)
по периоду:
Ra(Na) > Ra(Mg)
9.Высший оксид натрия:
Na2O-основный
Гидроксид Na
NaOH-основание
48.
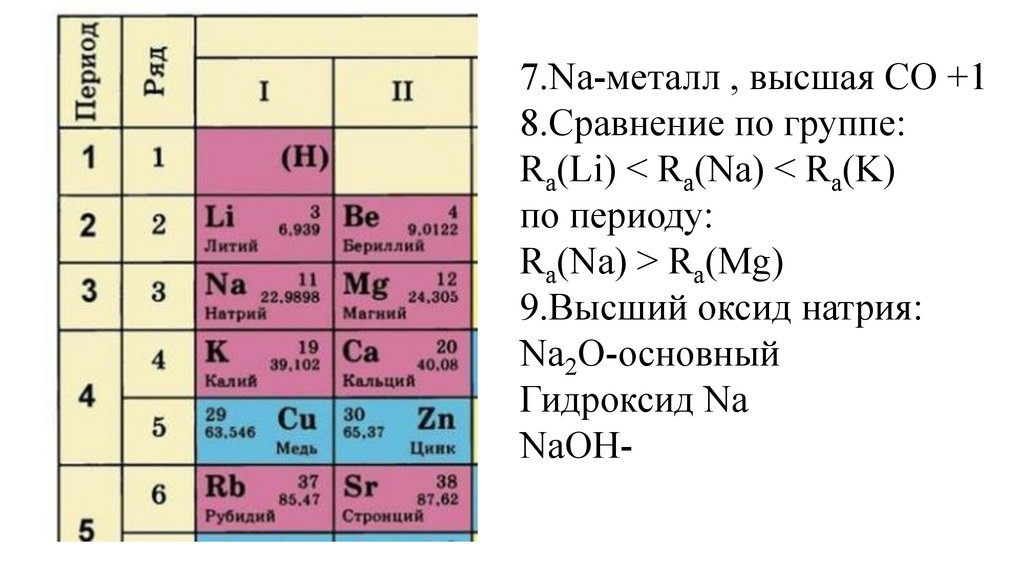
7.Na-металл, высшая СО +18.Сравнение по группе:
Ra(Li) < Ra(Na) < Ra(K)
по периоду:
Ra(Na) > Ra(Mg)
9.Высший оксид натрия:
Na2O-основный
Гидроксид Na
NaOH-основание
49.
7.Na-металл , высшая СО +18.Сравнение по группе:
Ra(Li) < Ra(Na) < Ra(K)
по периоду:
Ra(Na) > Ra(Mg)
9.Высший оксид натрия:
Na2O-основный
Гидроксид Na
NaOH-основание
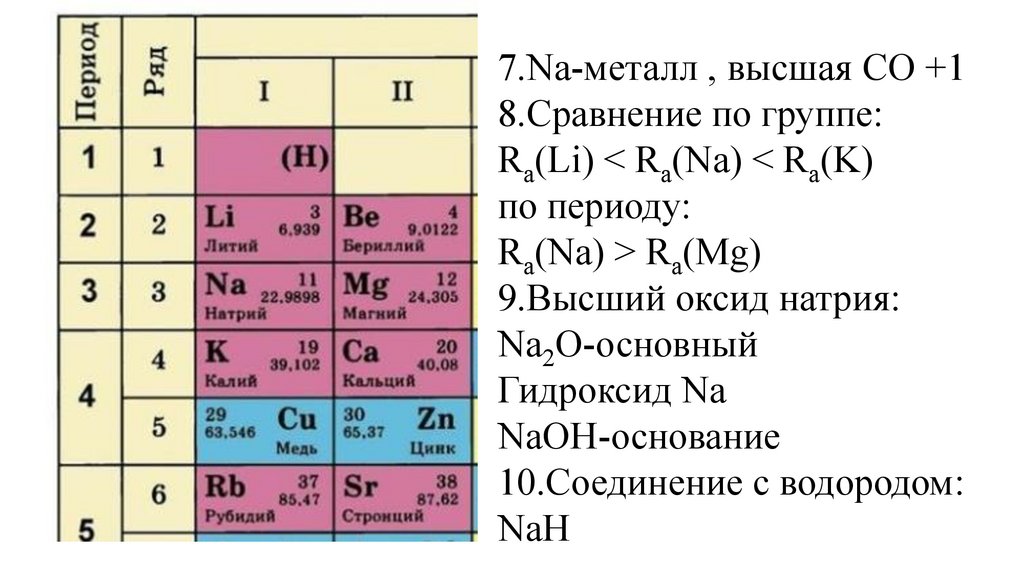
10.Соединение с водородом:
50.
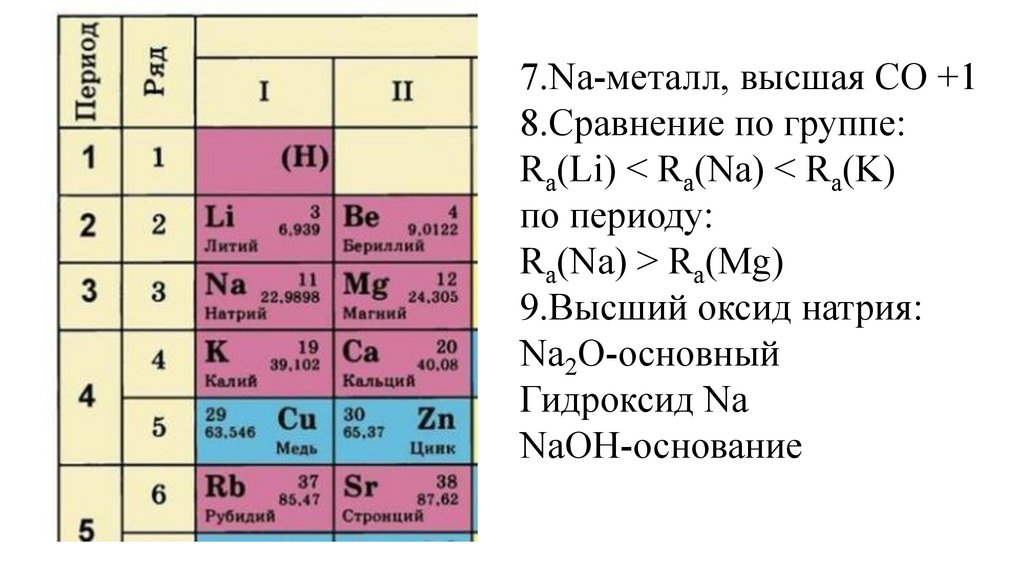
7.Na-металл , высшая СО +18.Сравнение по группе:
Ra(Li) < Ra(Na) < Ra(K)
по периоду:
Ra(Na) > Ra(Mg)
9.Высший оксид натрия:
Na2O-основный
Гидроксид Na
NaOH-основание
10.Соединение с водородом:
NaH
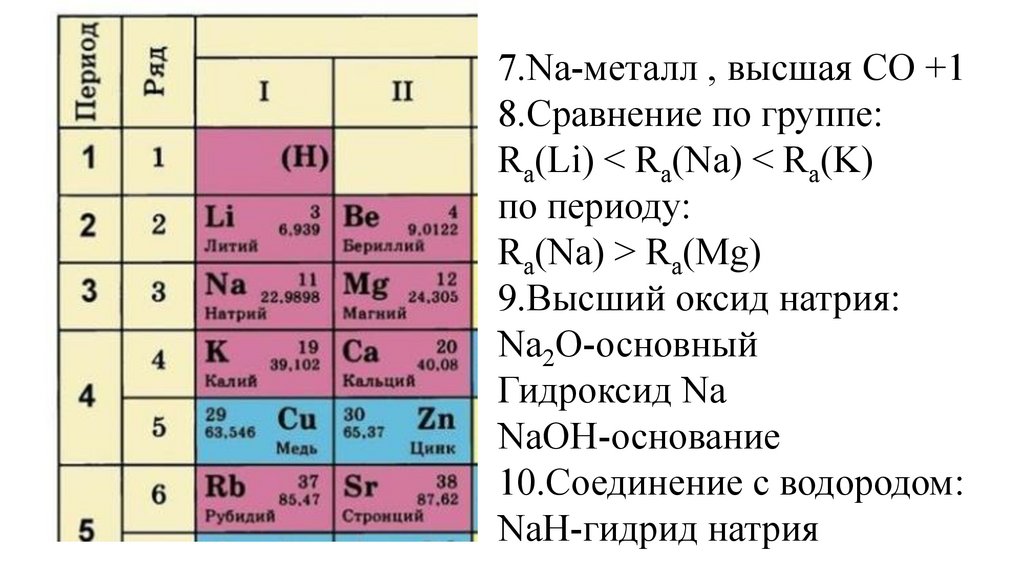
51.
7.Na-металл , высшая СО +18.Сравнение по группе:
Ra(Li) < Ra(Na) < Ra(K)
по периоду:
Ra(Na) > Ra(Mg)
9.Высший оксид натрия:
Na2O-основный
Гидроксид Na
NaOH-основание
10.Соединение с водородом:
NaH-гидрид натрия
52.
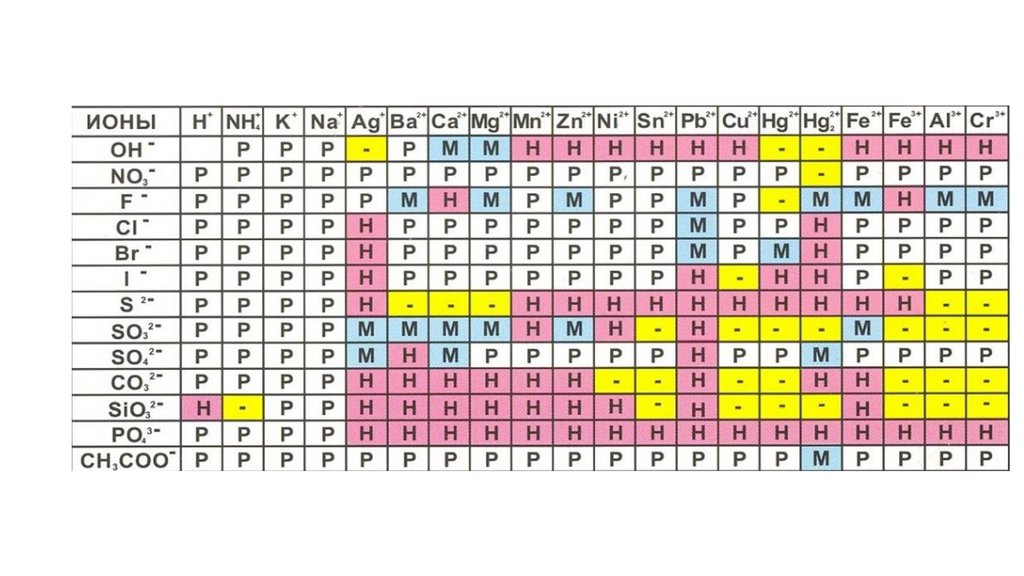
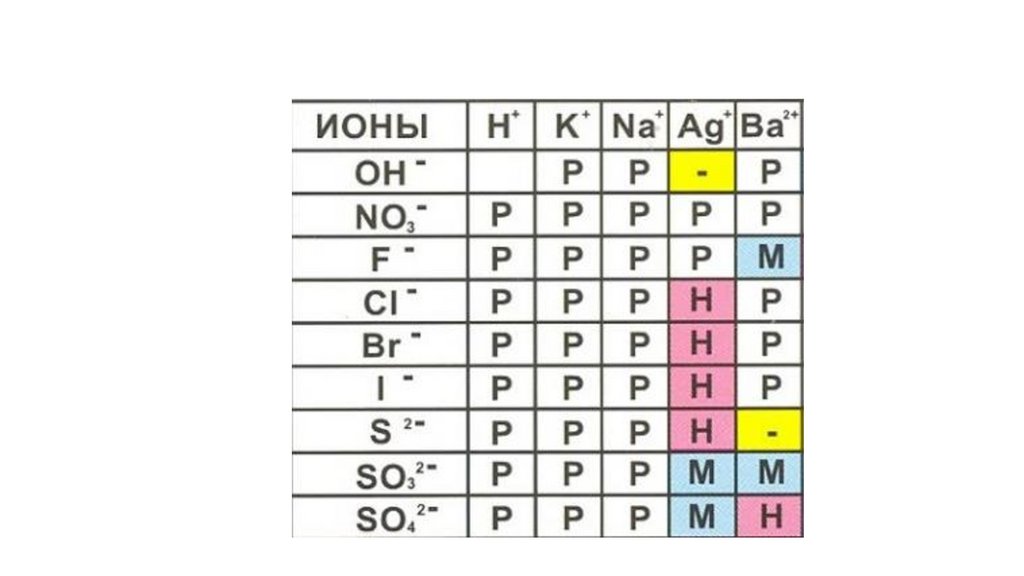
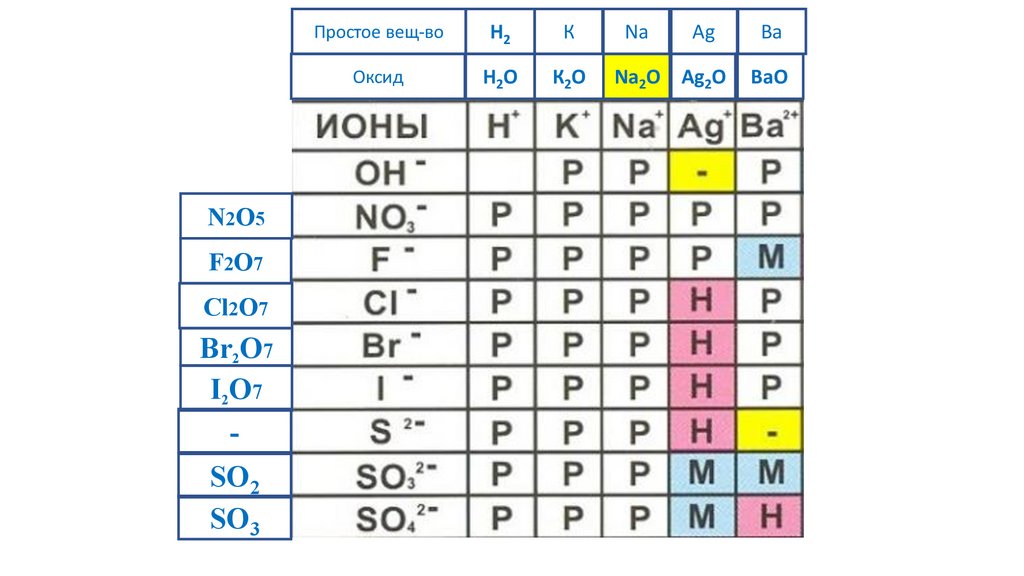
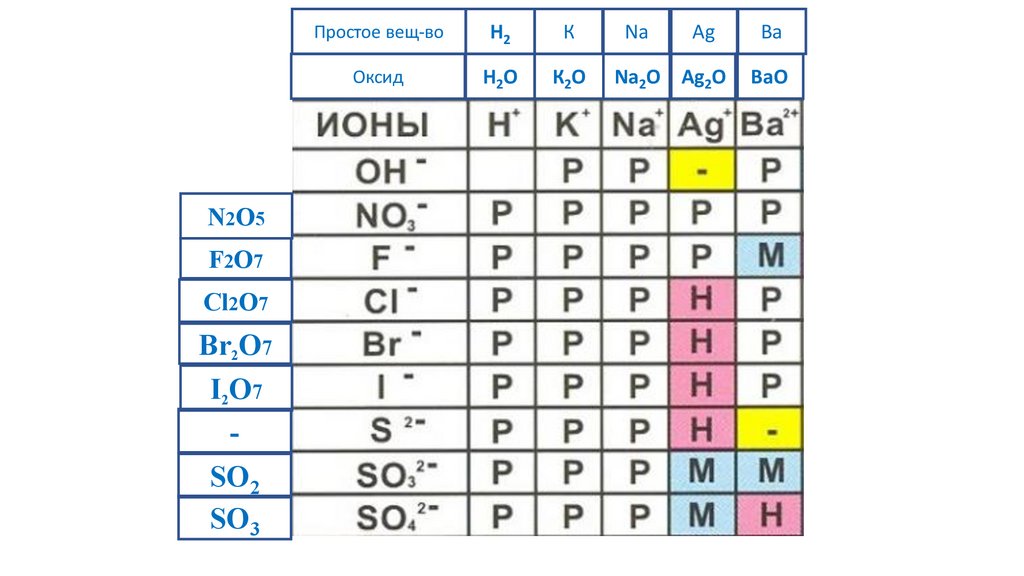
Свойства неорганических веществ.53.
54.
55.
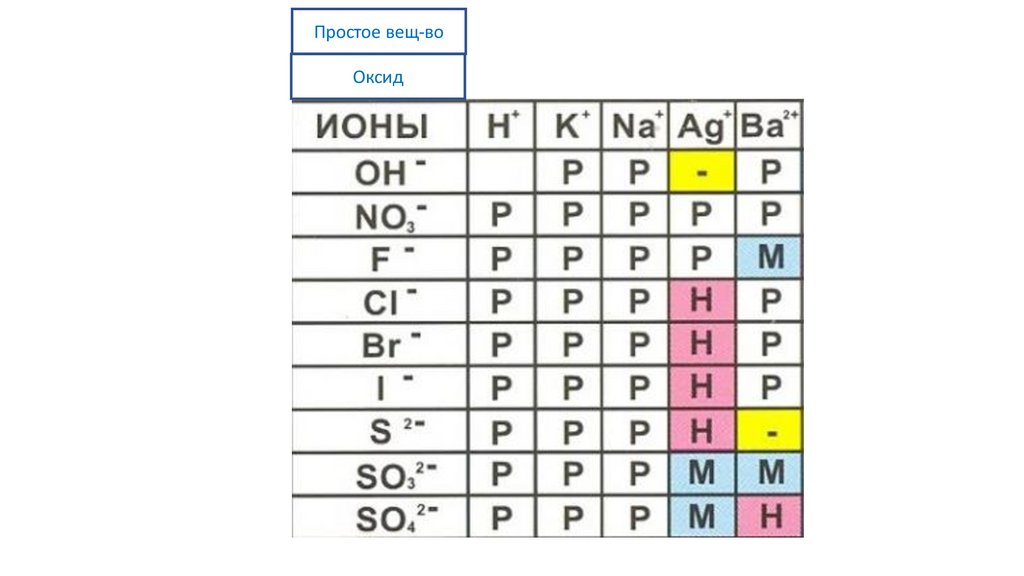
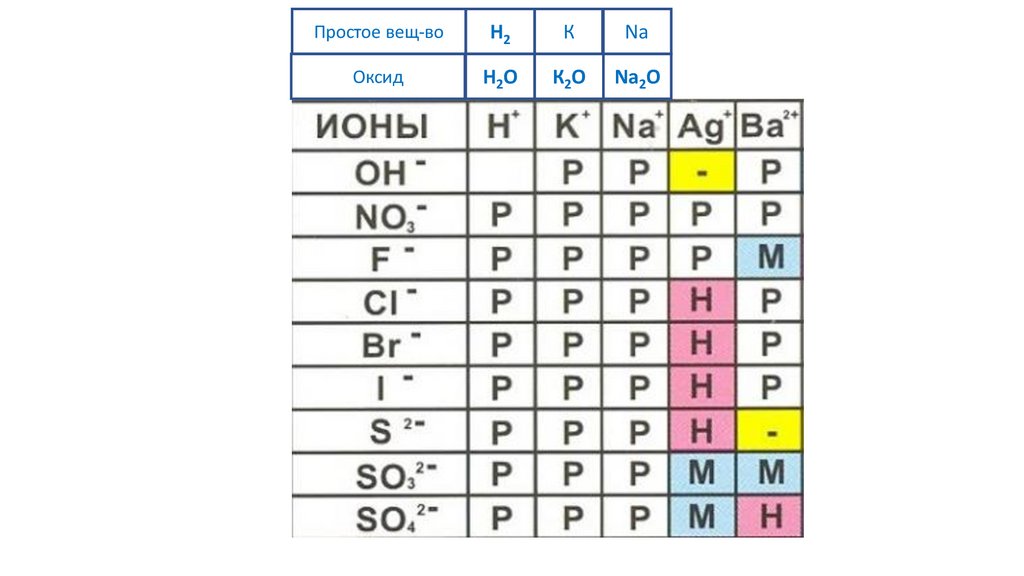
Простое вещ-воОксид
56.
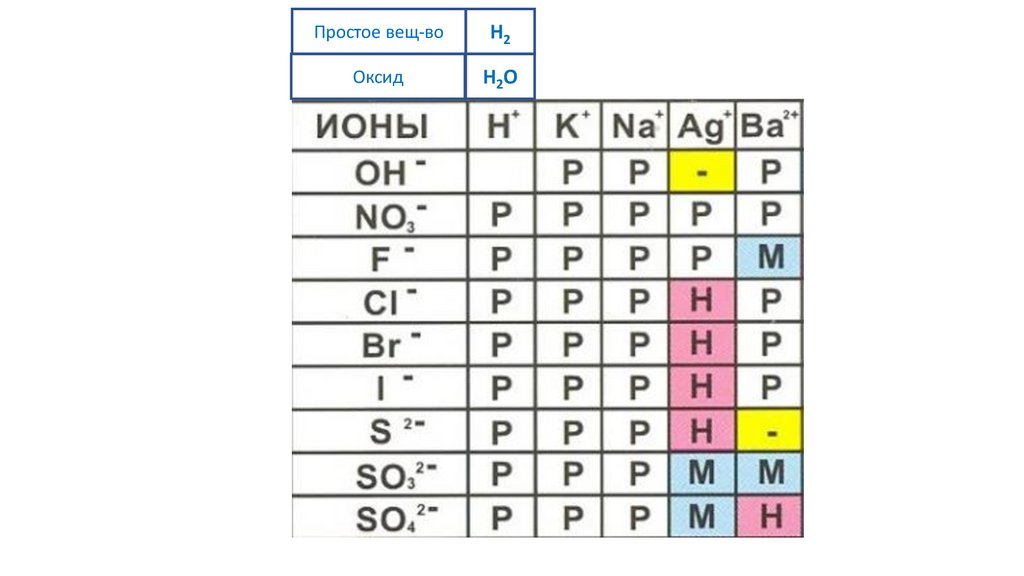
Простое вещ-воH2
Оксид
H2O
57.
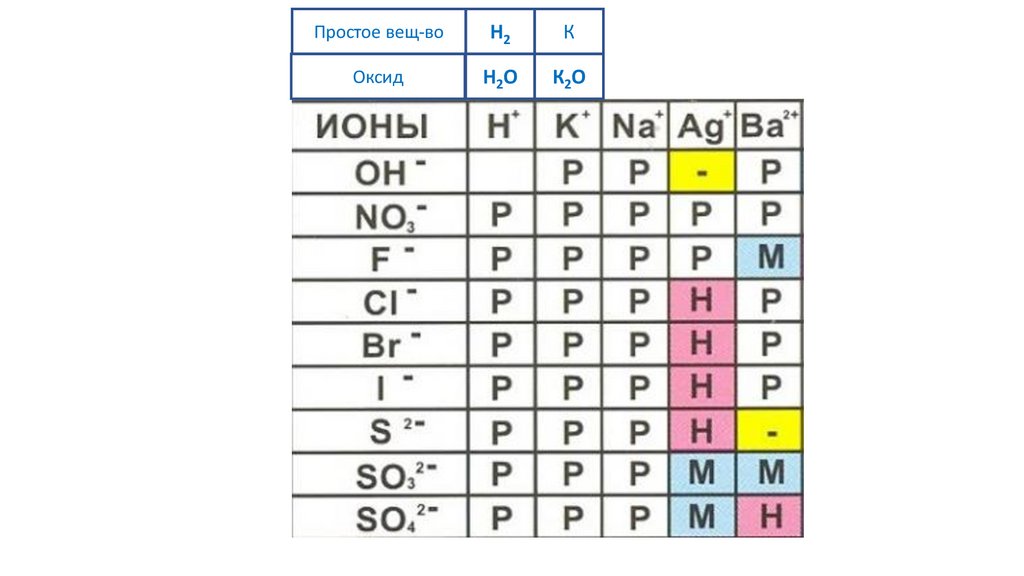
Простое вещ-воH2
К
Оксид
H2O
К2O
58.
Простое вещ-воH2
К
Na
Оксид
H2O
К2O
Na2O
59.
Простое вещ-воH2
К
Na
Ag
Оксид
H2O
К2O
Na2O Ag2O
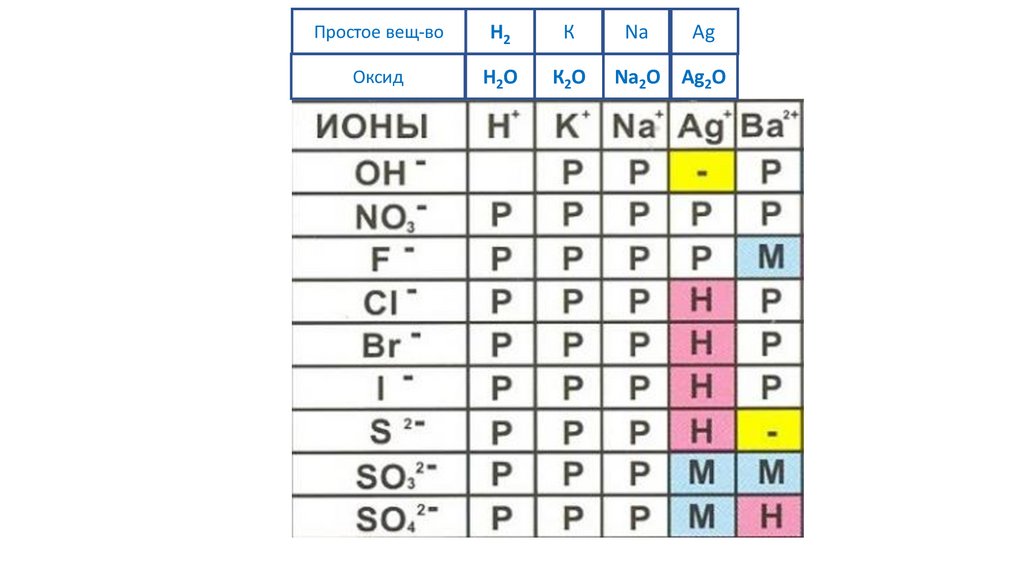
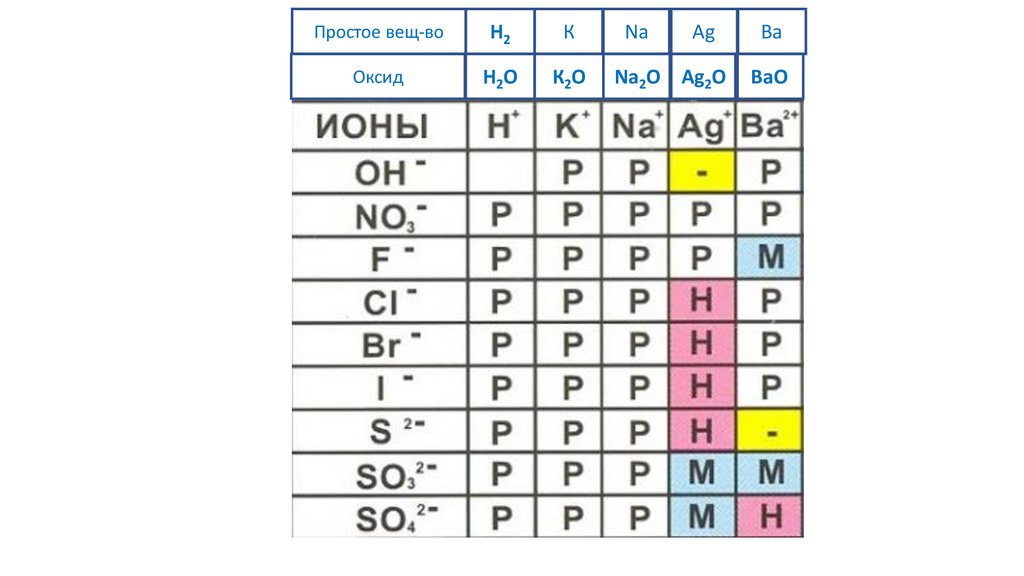
60.
Простое вещ-воH2
К
Na
Ag
Ba
Оксид
H2O
К2O
Na2O Ag2O
BaO
61.
Простое вещ-воH2
К
Na
Ag
Ba
Оксид
H2O
К2O
Na2O Ag2O
BaO
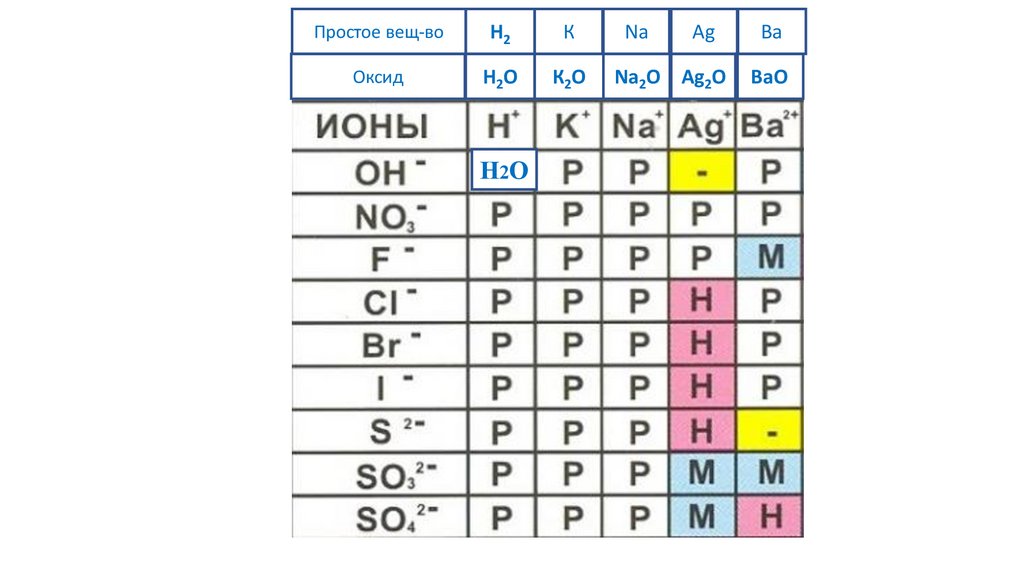
H2O
62.
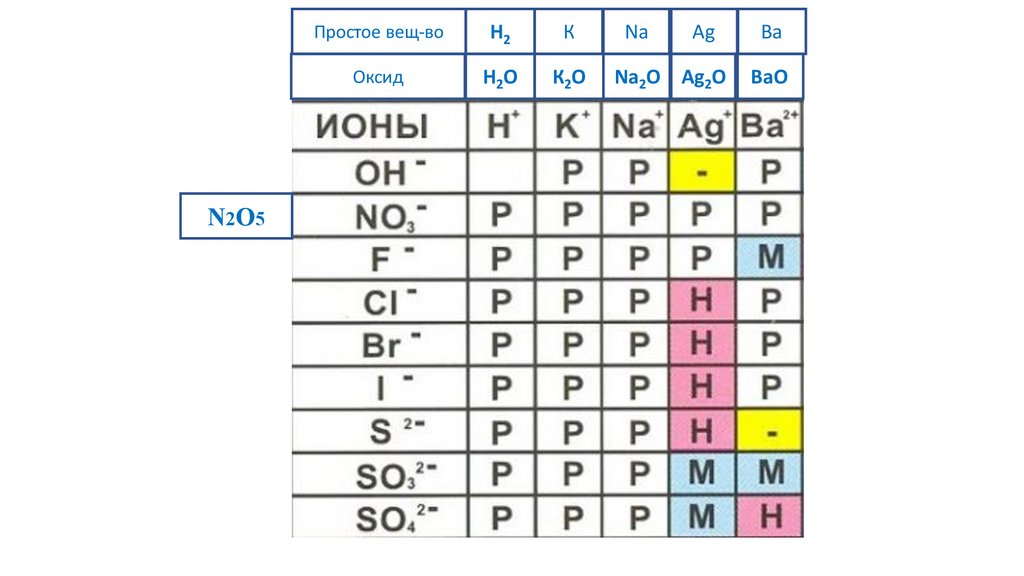
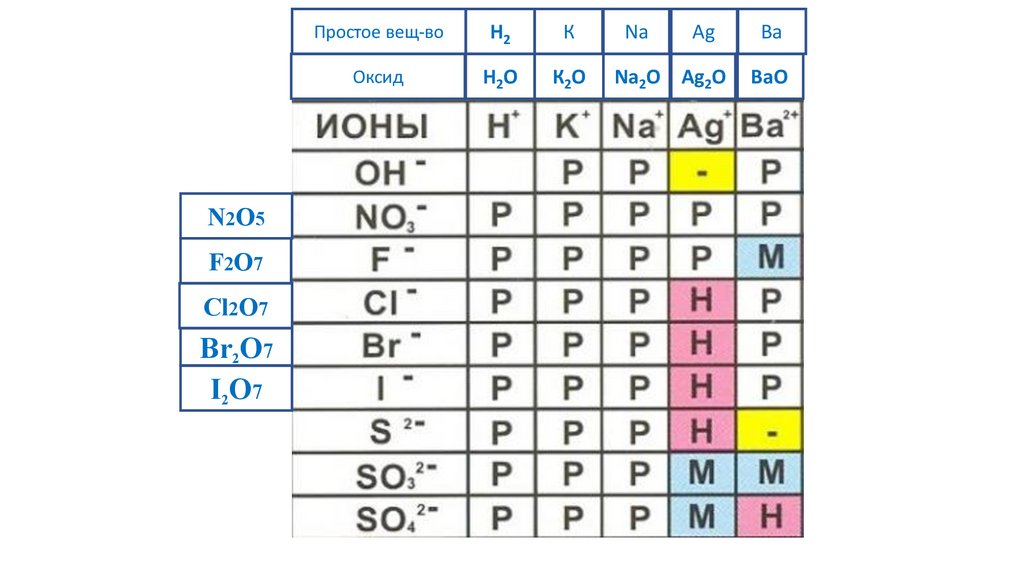
N2O5Простое вещ-во
H2
К
Na
Ag
Ba
Оксид
H2O
К2O
Na2O Ag2O
BaO
63.
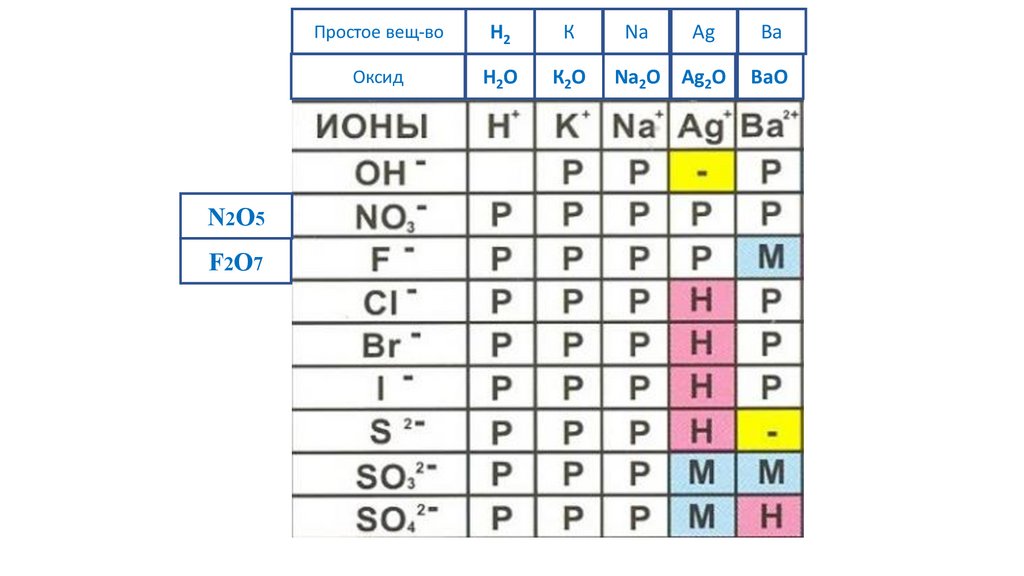
N2O5F2O7
Простое вещ-во
H2
К
Na
Ag
Ba
Оксид
H2O
К2O
Na2O Ag2O
BaO
64.
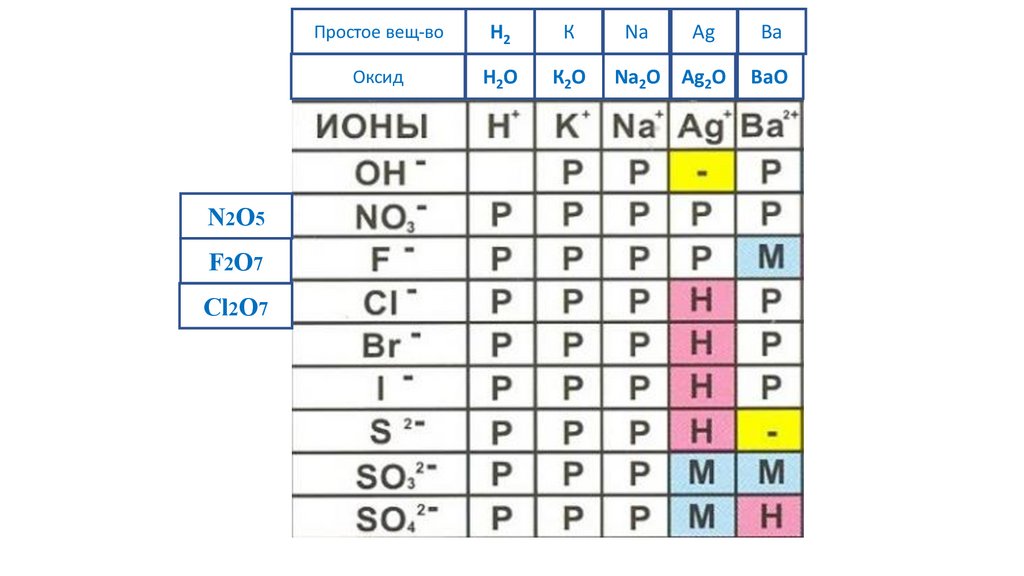
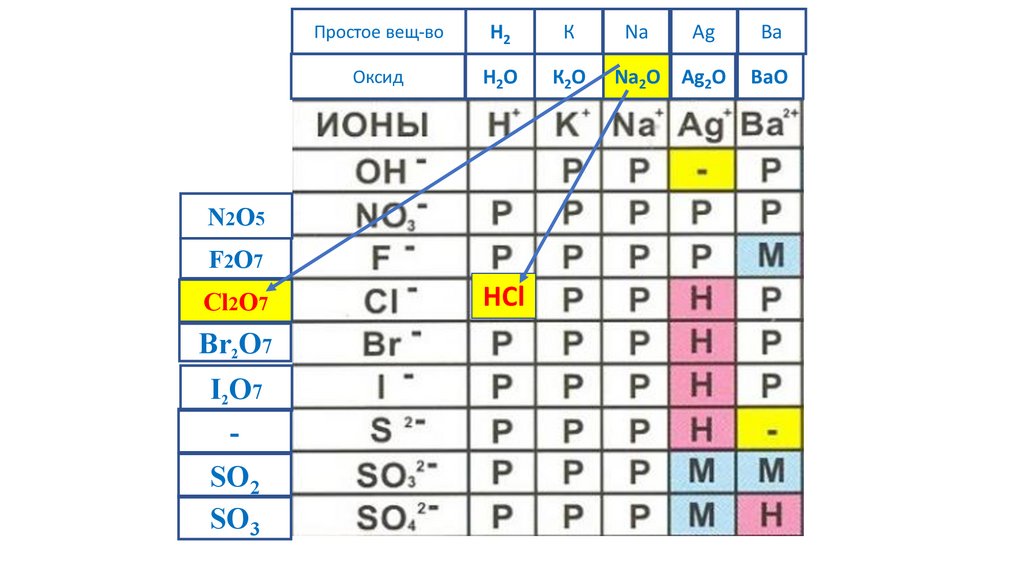
N2O5F2O7
Cl2O7
Простое вещ-во
H2
К
Na
Ag
Ba
Оксид
H2O
К2O
Na2O Ag2O
BaO
65.
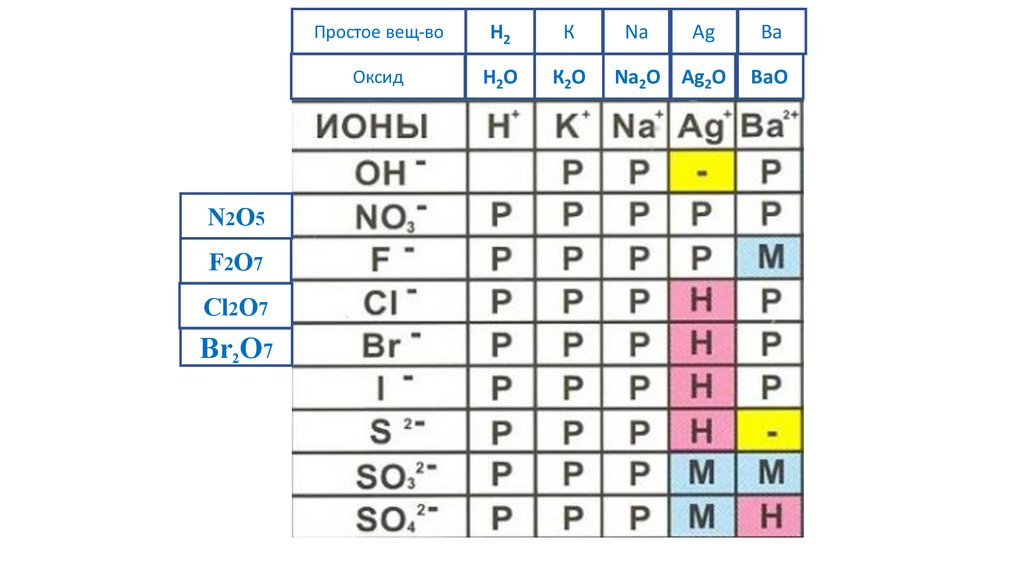
N2O5F2O7
Cl2O7
Br2O7
Простое вещ-во
H2
К
Na
Ag
Ba
Оксид
H2O
К2O
Na2O Ag2O
BaO
66.
N2O5F2O7
Cl2O7
Br2O7
I2O7
Простое вещ-во
H2
К
Na
Ag
Ba
Оксид
H2O
К2O
Na2O Ag2O
BaO
67.
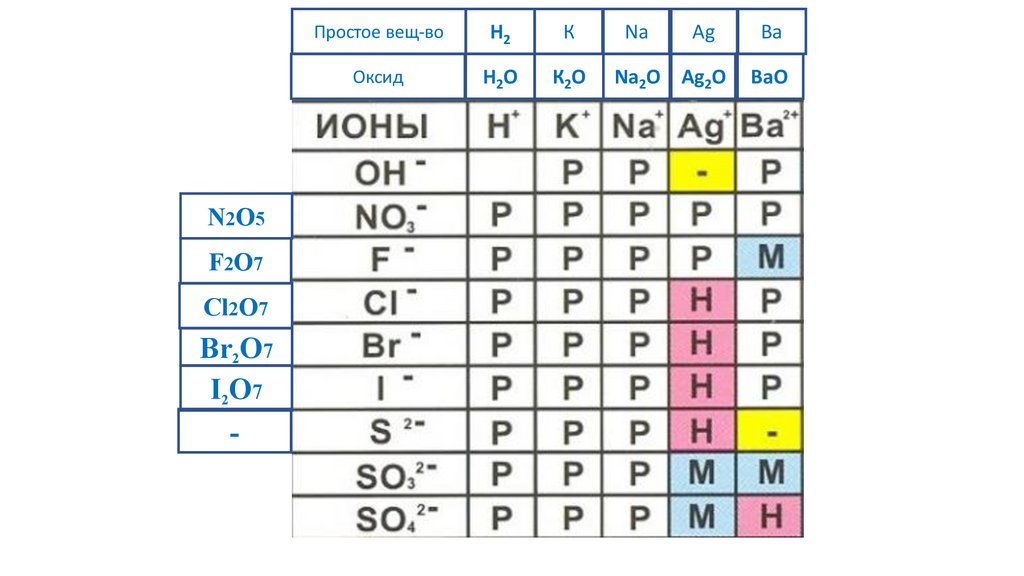
N2O5F2O7
Cl2O7
Br2O7
I2O7
-
Простое вещ-во
H2
К
Na
Ag
Ba
Оксид
H2O
К2O
Na2O Ag2O
BaO
68.
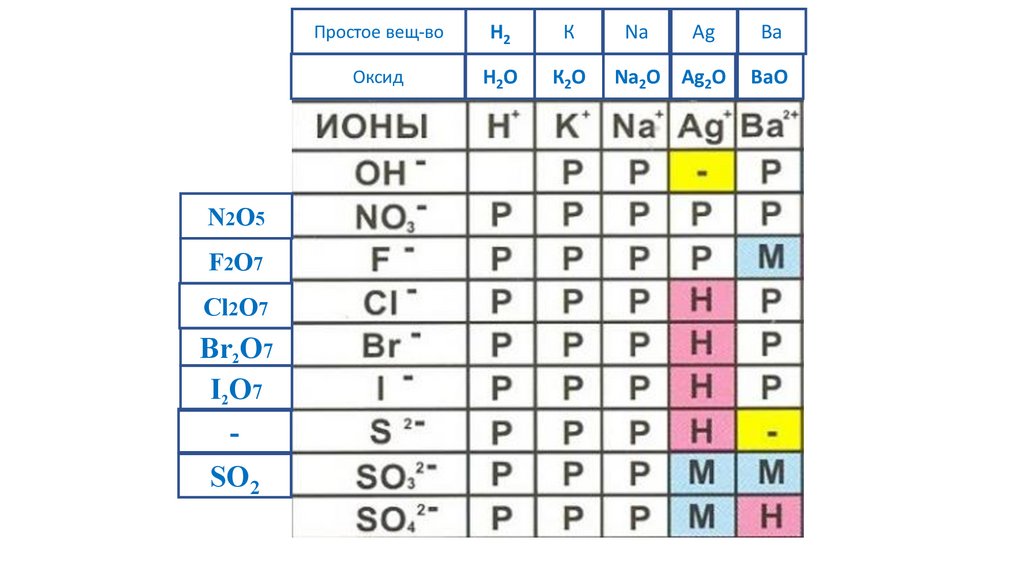
N2O5F2O7
Cl2O7
Br2O7
I2O7
-
SO2
Простое вещ-во
H2
К
Na
Ag
Ba
Оксид
H2O
К2O
Na2O Ag2O
BaO
69.
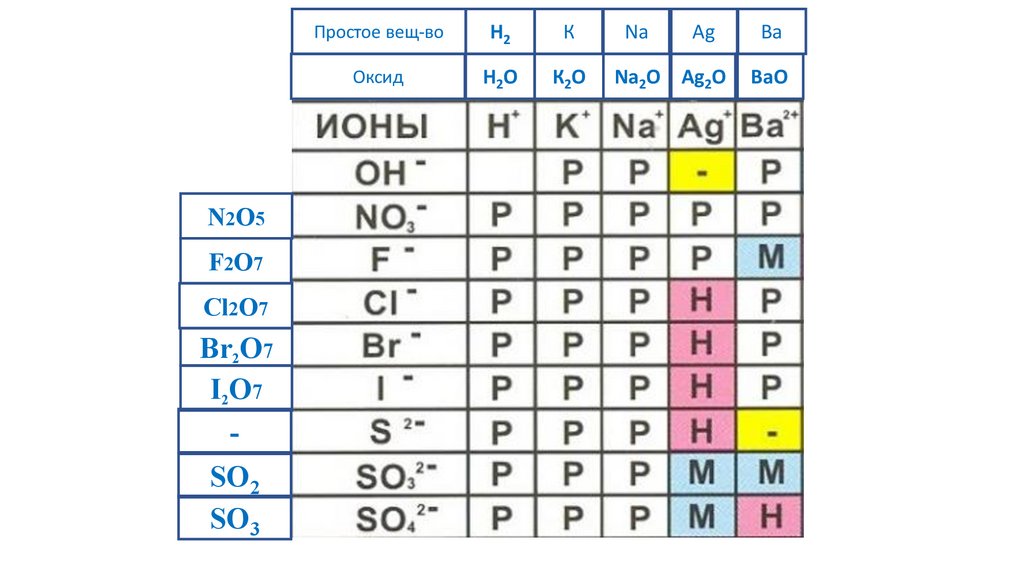
N2O5F2O7
Cl2O7
Br2O7
I2O7
-
SO2
SO3
Простое вещ-во
H2
К
Na
Ag
Ba
Оксид
H2O
К2O
Na2O Ag2O
BaO
70.
N2O5F2O7
Cl2O7
Br2O7
I2O7
-
SO2
SO3
Простое вещ-во
H2
К
Na
Ag
Ba
Оксид
H2O
К2O
Na2O Ag2O
BaO
71.
Простое вещ-воH2
К
Na
Ag
Ba
Оксид
H2O
К2O
Na2O Ag2O
BaO
N2O5
F2O7
Cl2O7
Br2O7
I2O7
-
SO2
SO3
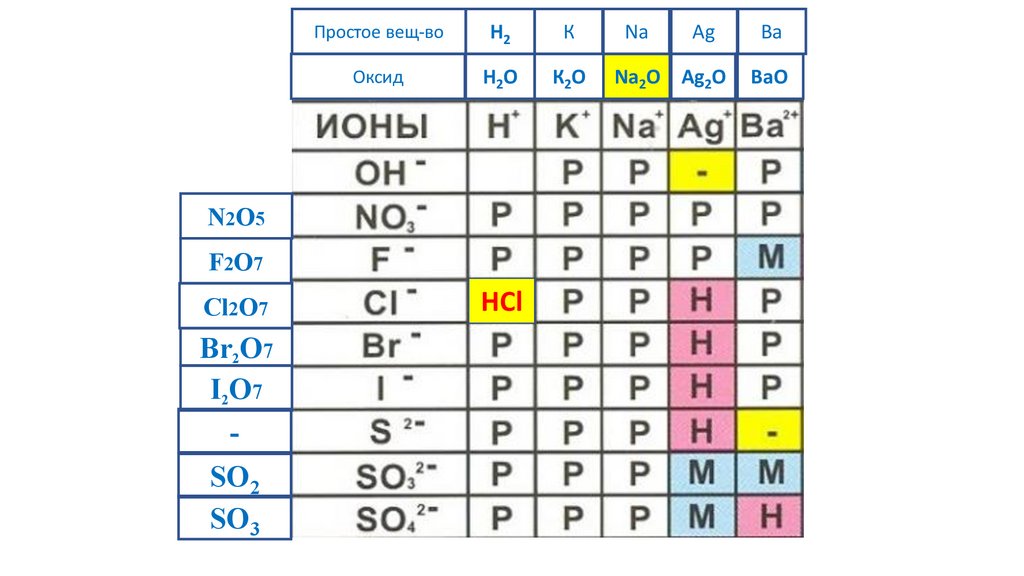
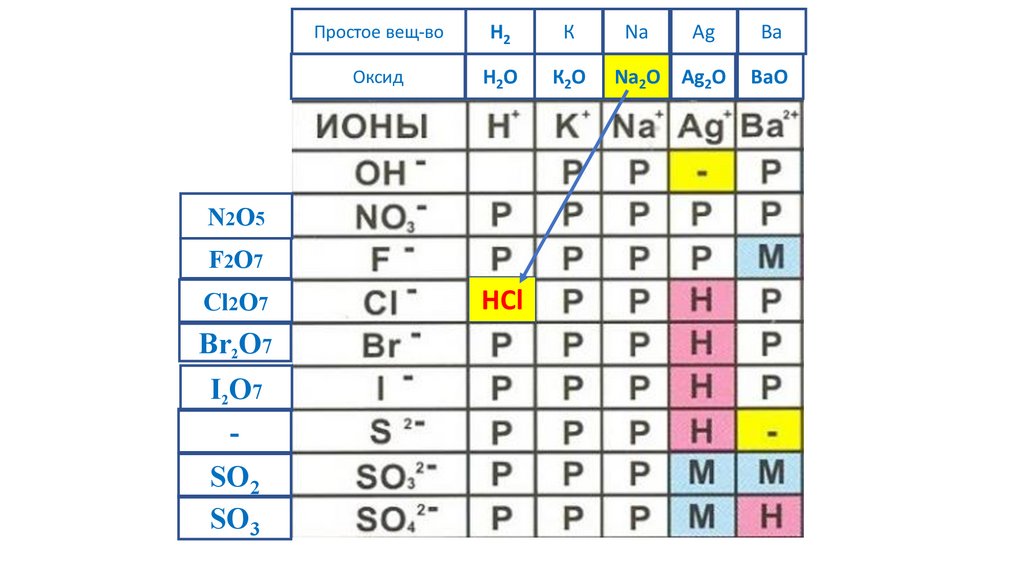
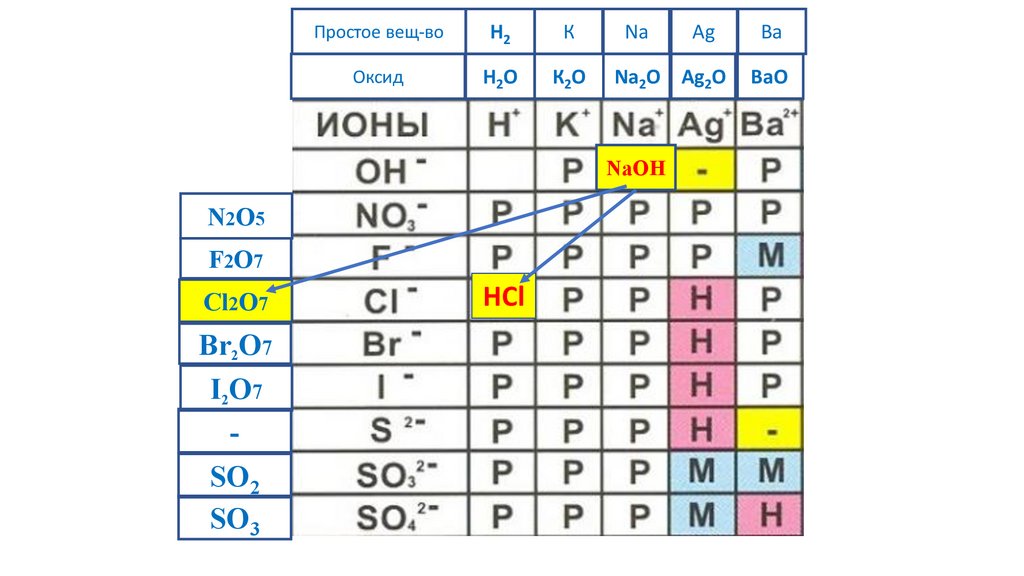
HCl
72.
Простое вещ-воH2
К
Na
Ag
Ba
Оксид
H2O
К2O
Na2O Ag2O
BaO
N2O5
F2O7
Cl2O7
Br2O7
I2O7
-
SO2
SO3
HCl
73.
Простое вещ-воH2
К
Na
Ag
Ba
Оксид
H2O
К2O
Na2O Ag2O
BaO
N2O5
F2O7
Cl2O7
Br2O7
I2O7
-
SO2
SO3
HCl
74.
Простое вещ-воH2
К
Na
Ag
Ba
Оксид
H2O
К2O
Na2O Ag2O
BaO
N2O5
F2O7
Cl2O7
Br2O7
I2O7
-
SO2
SO3
HCl
75.
Простое вещ-воH2
К
Na
Ag
Ba
Оксид
H2O
К2O
Na2O Ag2O
BaO
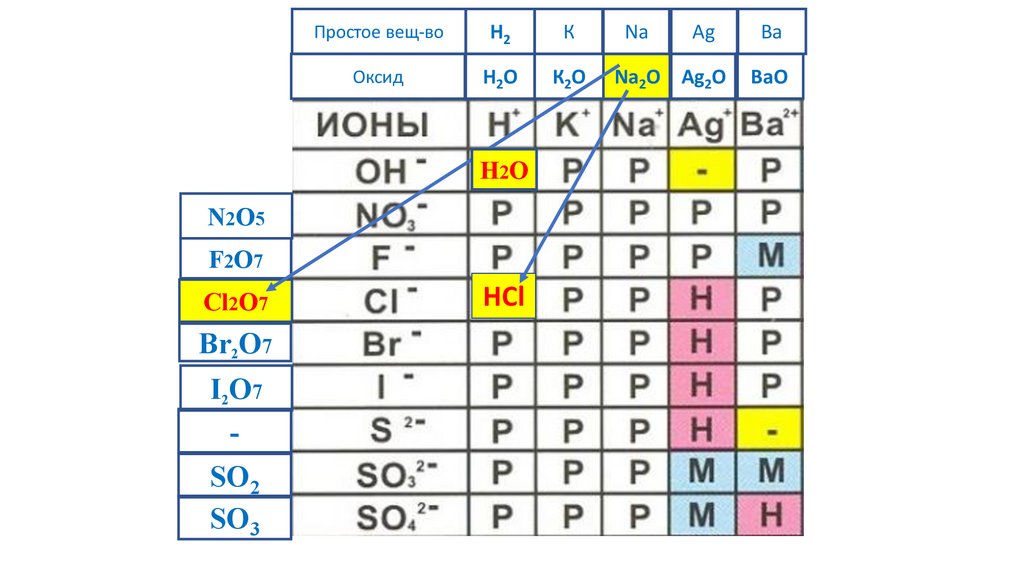
H2O
N2O5
F2O7
Cl2O7
Br2O7
I2O7
-
SO2
SO3
HCl
76.
Простое вещ-воH2
К
Na
Ag
Ba
Оксид
H2O
К2O
Na2O Ag2O
BaO
H2O
N2O5
F2O7
Cl2O7
Br2O7
I2O7
-
SO2
SO3
HCl
77.
N2O5F2O7
Cl2O7
Br2O7
I2O7
-
SO2
SO3
Простое вещ-во
H2
К
Na
Ag
Ba
Оксид
H2O
К2O
Na2O Ag2O
BaO
78.
Простое вещ-воH2
К
Na
Ag
Ba
Оксид
H2O
К2O
Na2O Ag2O
BaO
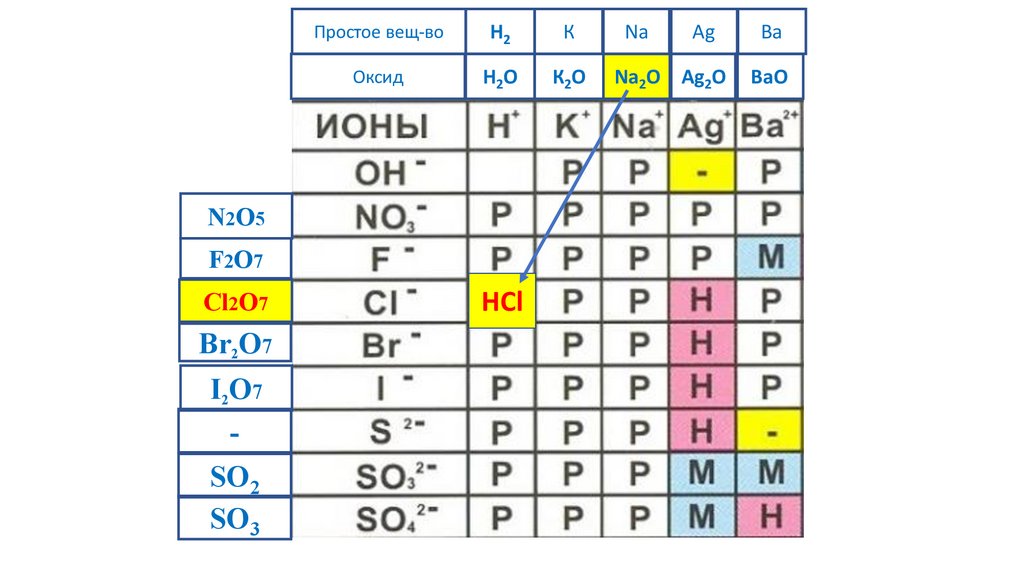
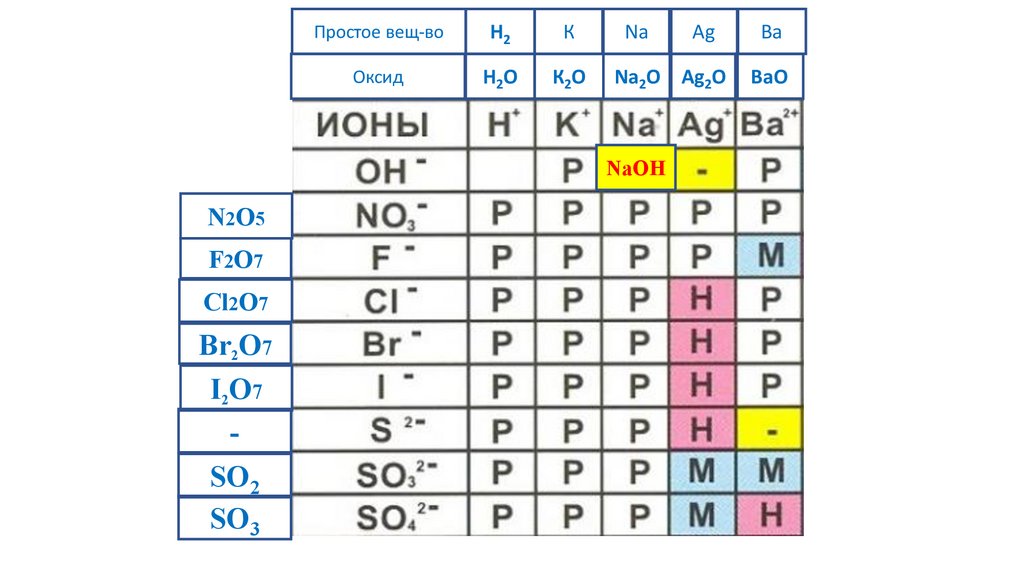
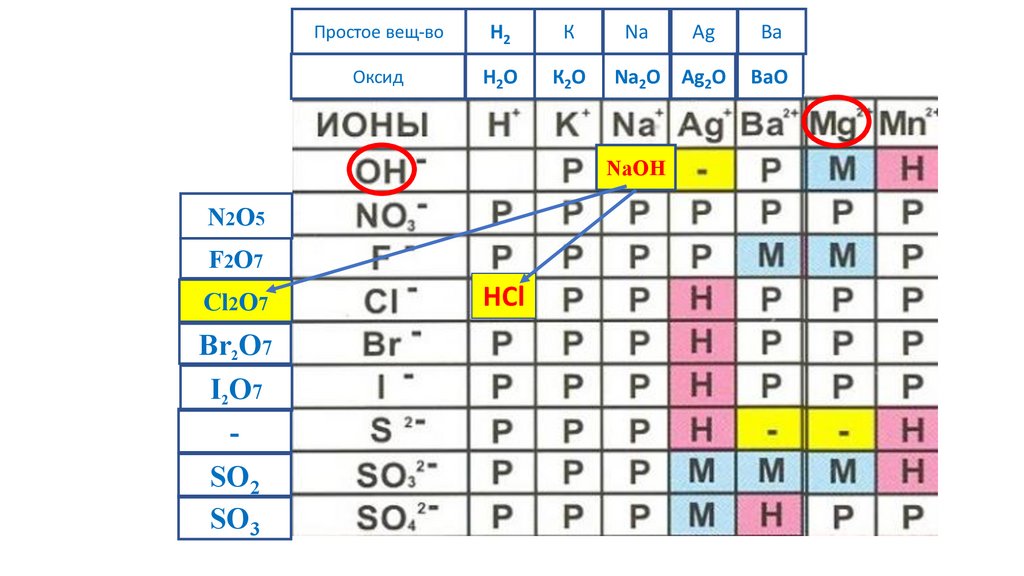
NaOH
N2O5
F2O7
Cl2O7
Br2O7
I2O7
-
SO2
SO3
79.
Простое вещ-воH2
К
Na
Ag
Ba
Оксид
H2O
К2O
Na2O Ag2O
BaO
NaOH
N2O5
F2O7
Cl2O7
Br2O7
I2O7
-
SO2
SO3
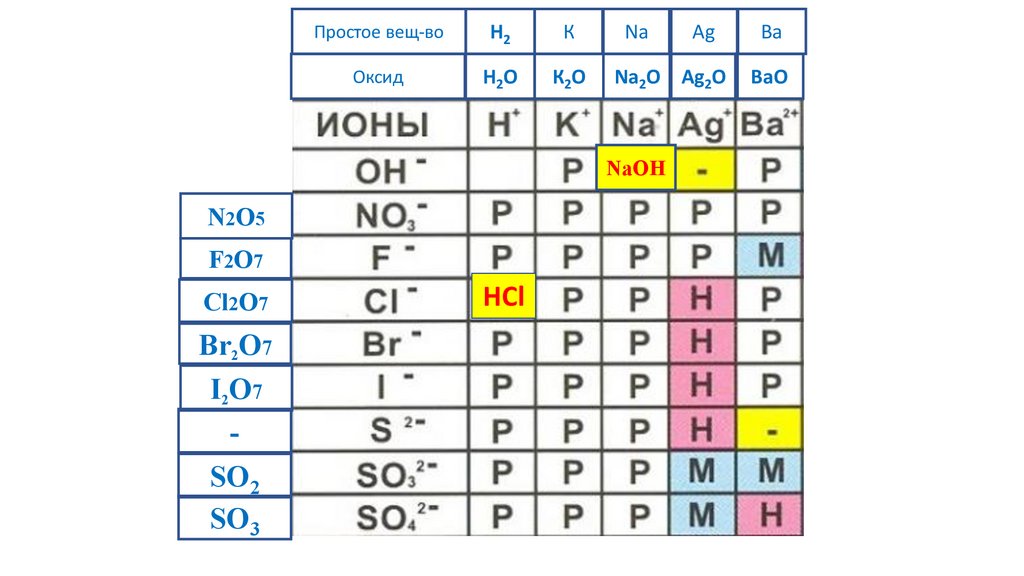
HCl
80.
Простое вещ-воH2
К
Na
Ag
Ba
Оксид
H2O
К2O
Na2O Ag2O
BaO
NaOH
N2O5
F2O7
Cl2O7
Br2O7
I2O7
-
SO2
SO3
HCl
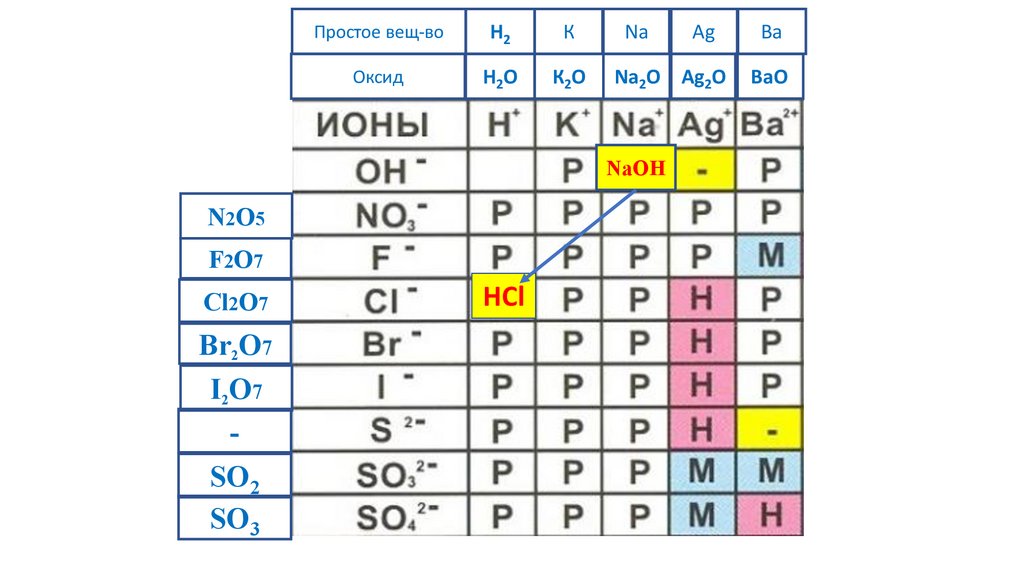
81.
Простое вещ-воH2
К
Na
Ag
Ba
Оксид
H2O
К2O
Na2O Ag2O
BaO
NaOH
N2O5
F2O7
Cl2O7
Br2O7
I2O7
-
SO2
SO3
HCl
82.
Простое вещ-воH2
К
Na
Ag
Ba
Оксид
H2O
К2O
Na2O Ag2O
BaO
NaOH
N2O5
F2O7
Cl2O7
Br2O7
I2O7
-
SO2
SO3
HCl
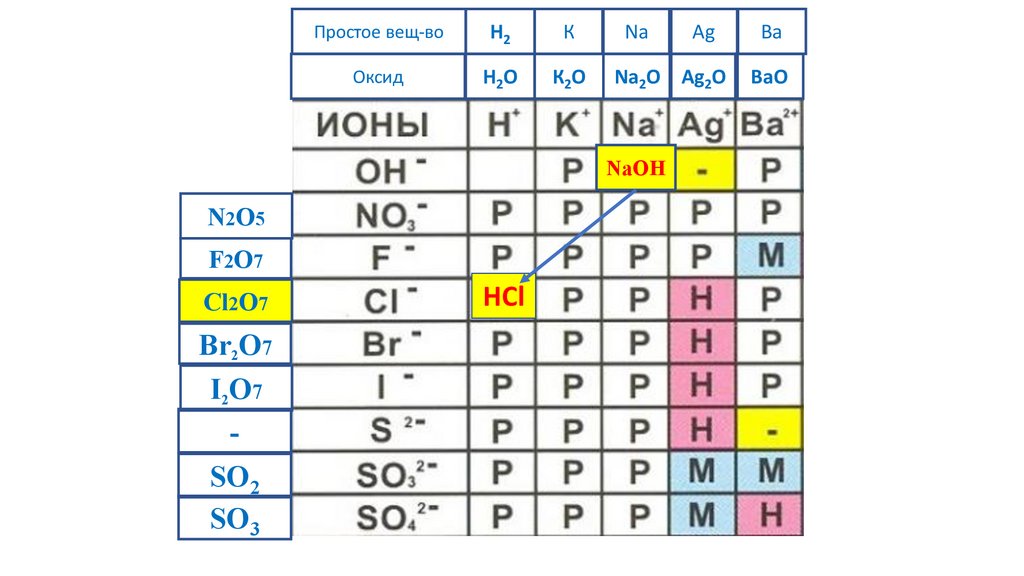
83.
Простое вещ-воH2
К
Na
Ag
Ba
Оксид
H2O
К2O
Na2O Ag2O
BaO
NaOH
N2O5
F2O7
Cl2O7
Br2O7
I2O7
-
SO2
SO3
HCl
84.
Простое вещ-воH2
К
Na
Ag
Ba
Оксид
H2O
К2O
Na2O Ag2O
BaO
NaOH
N2O5
F2O7
Cl2O7
Br2O7
I2O7
-
SO2
SO3
HCl
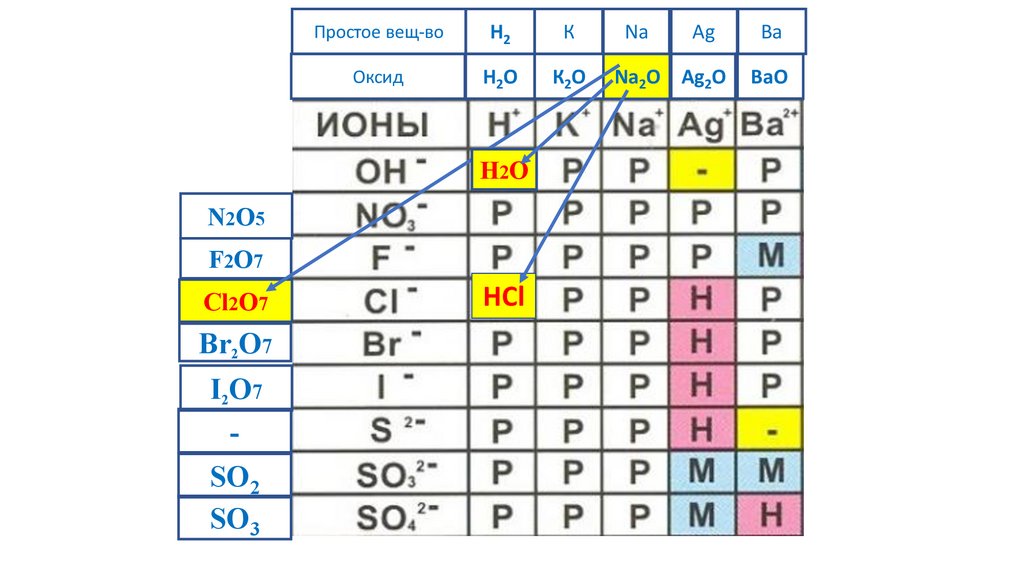
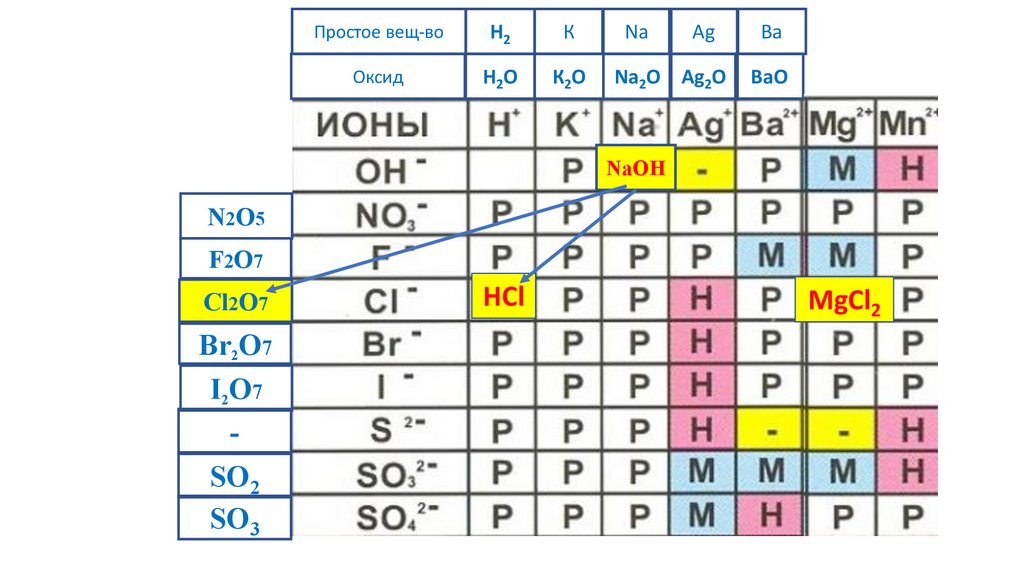
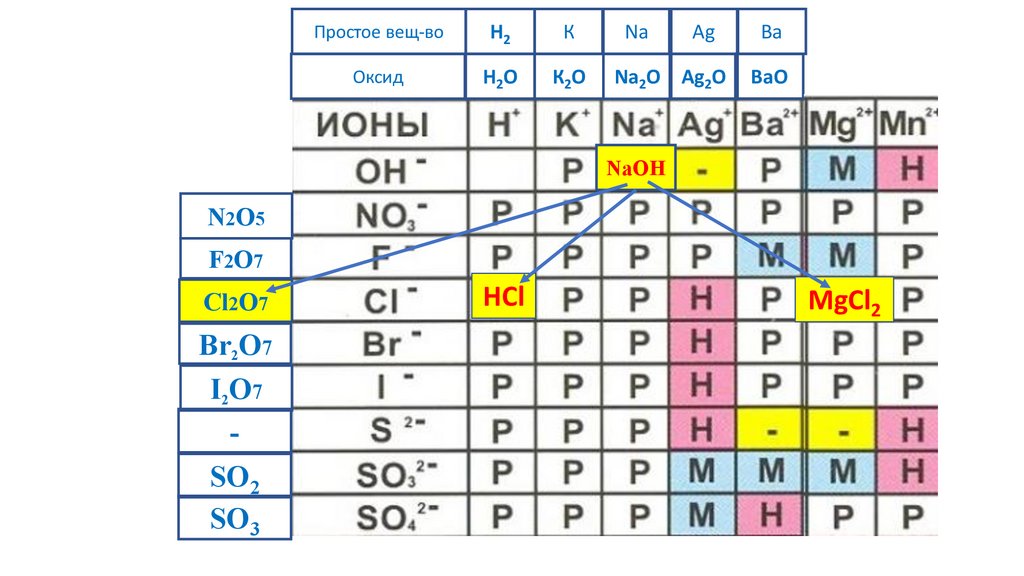
MgCl2
85.
Простое вещ-воH2
К
Na
Ag
Ba
Оксид
H2O
К2O
Na2O Ag2O
BaO
NaOH
N2O5
F2O7
Cl2O7
Br2O7
I2O7
-
SO2
SO3
HCl
MgCl2
86.
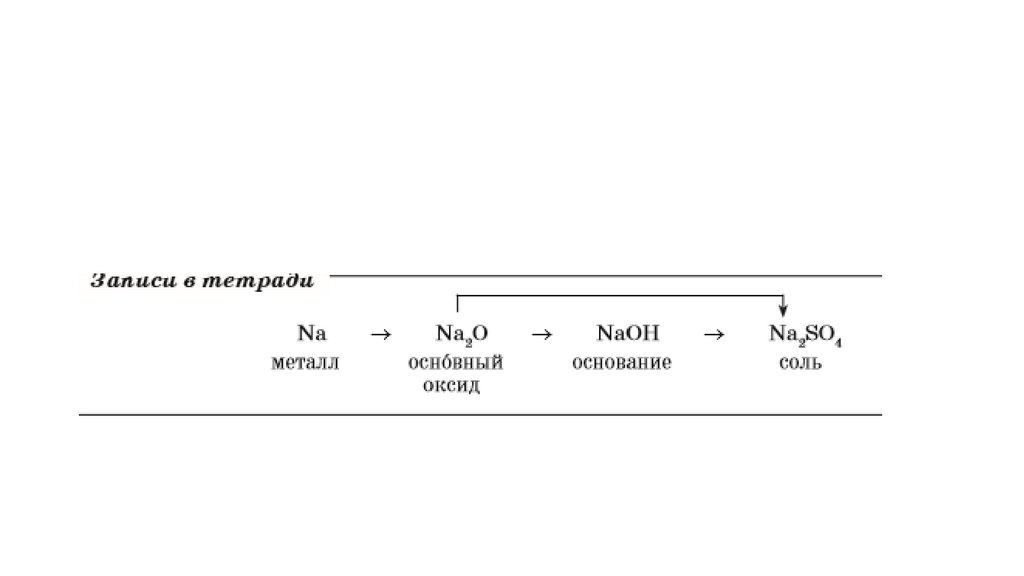
1.Дать характеристику натрия, фосфора.2.Записать генетические ряды металлов натрия и
фосфора.
87.
88.
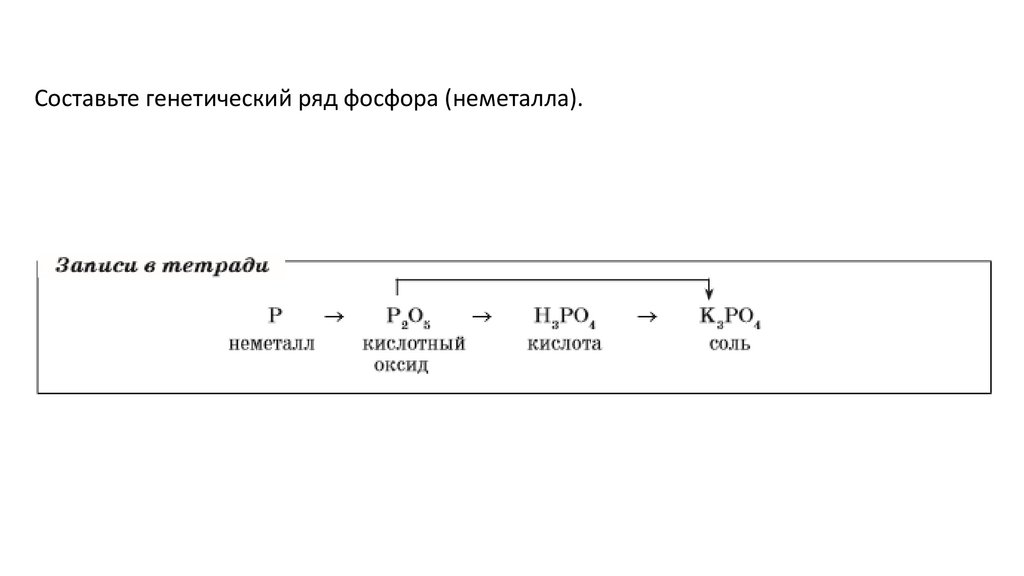
Составьте генетический ряд фосфора (неметалла).89.
Этап -3. Подведение итоговКакую информацию можно получить о свойствах
химического элемента и его соединений исходя из
положения элемента в Периодической системе
химических элементов Д. И. Менделеева?
90.
Этап -3. Подведение итоговДомашнее задание: § 1, выполнить
задания № 1—3 после § 1.












 chemistry
chemistry








