Similar presentations:
Введение в органическую химию
1. Введение в органическую химию
2. Йёнс Якоб Берцелиус шведский химик и минеролог, в 1808г. впервые ввёл понятие «органическая химия», по его представления
органическиминазывались такие соединения,
которые являлись продуктами
жизнедеятельности растительных и
животных организмов.
3.
4.
Фридрих Вёлер1828 год – синтез мочевины
NH4OCN → H2N – C – NH2
║
O
CO2+ 2NH3 → H2N – C – NH2 + H2O
║
O
«… Я не в силах больше молчать и должен сообщить Вам, что могу
получить мочевину без помощи почек собаки, человека и вообще без
участия какого-либо живого существа… ».
5. Адольф Вильгельм Герман Кольбе (1818-1884)
1845 год – синтез уксусной кислотыCI2
H2O
C + FeS → CS2 → CCl4 → Cl2C = CCl2 → Cl3CCOOH →
CH3COOH
6. Марселен Бертло (1827 – 1907)
1854 год – синтез жира1856 год – синтез метана
CS2 + 2H2S + 8Cu → CH4 + 4Cu2S
1862 год – синтез ацетилена
CaC2 +2H2O → Ca(OH)2 + C2H2
7.
А. Кекуле 1861г. «ОХ – это химия углерода".Органическая химия – химия углеводородов и их
производных. К. Шорлемер, 1889г.
Углеводороды (УВ) – простейшие органические
вещества, молекулы которых состоят из атомов
только двух элементов: С и Н.
Производные УВ – продукты замещения атомов
«Н» в молекулах УВ на другие атомы или группы
атомов.
8.
Органические веществаПриродные
Нефть, белки,
жиры, углеводы
Искусственные
Бензин, вискоза,
целлулоид,
целлофан
Синтетические
Лекарства,
витамины,
пластмасса
9.
10.
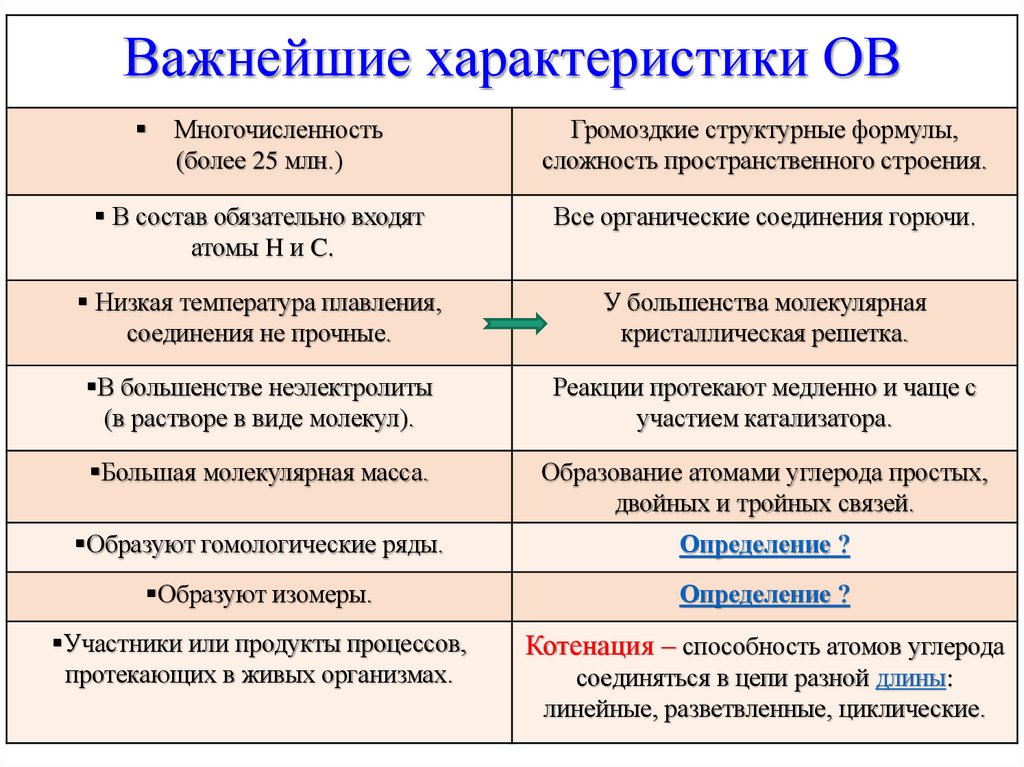
Важнейшие характеристики ОВМногочисленность
(более 25 млн.)
Громоздкие структурные формулы,
сложность пространственного строения.
В состав обязательно входят
атомы H и C.
Все органические соединения горючи.
Низкая температура плавления,
соединения не прочные.
У большенства молекулярная
кристаллическая решетка.
В большенстве неэлектролиты
(в растворе в виде молекул).
Реакции протекают медленно и чаще с
участием катализатора.
Большая молекулярная масса.
Образование атомами углерода простых,
двойных и тройных связей.
Образуют гомологические ряды.
Определение ?
Образуют изомеры.
Определение ?
Участники или продукты процессов,
протекающих в живых организмах.
Котенация – способность атомов углерода
соединяться в цепи разной длины:
линейные, разветвленные, циклические.
11.
Гомологический ряд – ряд веществ,расположеных в порядке возрастания
молекулярной массы, имеющих сходное
строение, свойства и отличающиеся друг от
друга на одну или несколько групп СН2,
которая называется гомологической
разницей.
Гомологи – сходное строение и свойства,
отличающиеся на одну или несколько СН2.
12.
Изомерия – явление существования разныхвеществ с одинаковым качественным и
количественным составом, но имеющих
разное строение и свойства.
Изомеры – вещества, имеющие одинаковую
молекулярную форму, но разное строение и
свойства.
13.
Теории строения ОВ1. Теория типов, разработанная в 40-50-х годах
французским ученым Ш. Жераром. Все органические
соединения рассматривались как производные
простейших неорганических веществ, принятых за типы.
2. Теория радикалов от «radicis» — корень,
основание. 1815 - Гей-Люссак, 1832 - Либих и Вёлер.
При х/р группа из нескольких атомов переходит, не
изменяясь, из молекулы одного вещества в молекулу
другого. Эта группа атомов называется радикал.
3. Теория строения ОВ –
1861 г. А.М. Бутлеров.
14.
1. Атомы в молекулах соединяются согласно валентности.Порядок соединения атомов называется химическим
строением.
Способность атома С образовывать разные виды
связей и углеродных цепей, называется котенацией.
2. Свойства вещества зависят не только от того, какие
атомы и в каком количеств входят в состав его молекулы,
но и от того, в каком порядке они соединены, т.е. от
химического строения (следствием этого является явление
изомерии).
3. Атомы или группы атомов, образующие молекулы
взаимно влияют друг на друга, от этого зависят свойства
вещества и его реакционная способность.













 chemistry
chemistry








