Similar presentations:
Классификация химических соединений
1.
Классификация химическихсоединений
Выполнил: Тимофеев
2.
Основные классы соединенийПривет, ребята! Сегодня мы погрузимся в удивительный мир химии и узнаем, как устроены различные химические вещества. Представьте, что все
вокруг нас состоит из разных "кирпичиков", и эти "кирпичики" можно сгруппировать по их свойствам. В химии таких основных групп четыре.
2
1
Оксиды
Кислоты
Это как будто "пара" из двух элементов, где один из них –всегда
В их составе обязательно есть атом водорода (Н) и особая часть,
кислород. Например, воздух, которым мы дышим, содержит много
которую называют кислотным остатком. Подумайте о лимоне –он
оксидов!
кислый, потому что в нем есть кислота!
3
4
Основания
Соли
Эти соединения содержат металлический элемент и группу (ОН⁻).
Соли состоят из ионов металла и кислотных остатков. Самый
Они на ощупь обычно скользкие, как мыло.
известный пример — обычная поваренная соль, которую мы
добавляем в еду!
3.
Примеры соединений в нашей жизниОксиды: CO₂ (углекислый газ, который мы выдыхаем) и
SO₂ (оксид серы, который может быть в воздухе от
выхлопов).
Кислоты: HCl (соляная кислота, есть у нас в желудке) и
H₂SO₄ (серная кислота, используется в аккумуляторах).
Основания: NaOH (едкий натр, используется для чистки
труб) и Ca(OH)₂ (гашеная известь, применяется в
строительстве).
Соли: NaCl (поваренная соль, которую мы едим) и K₂SO₄
(сульфат калия, удобрение для растений).
Как видите, эти соединения окружают нас повсюду, даже если мы их не замечаем! Понимая их классификацию, мы начинаем лучше
разбираться в мире.
4.
Закрепляем знания!Класс соединений
Определение
Пример
Оксиды
Соединение двух элементов, один из
CO₂
которых –кислород.
Кислоты
Содержат H и кислотный остаток.
HCl
Основания
Содержат ион металла и ОН⁻ группы.
NaOH
Соли
Состоят из ионов металлов и кислотных
NaCl
остатков.
Все химические соединения делятся на 4 основные группы.
5.
Химическая организация природы.1 . Общие положения:
• Земля, Солнце и другие небесные тела состоят из
химических элементов.
• Состав звезд (например, Солнца) – преимущественно
водород.
• В планетах-гигантах (например, Юпитере) – водород и
гелий.
2. Строение Земли:
• Ядро (железо и никель): внутреннее твердое, внешнее
расплавленное, высокая температура.
• Мантия (кремний, магний, железо): высокое давление,
магма.
• Литосфера (земная кора): относительно немного
элементов.
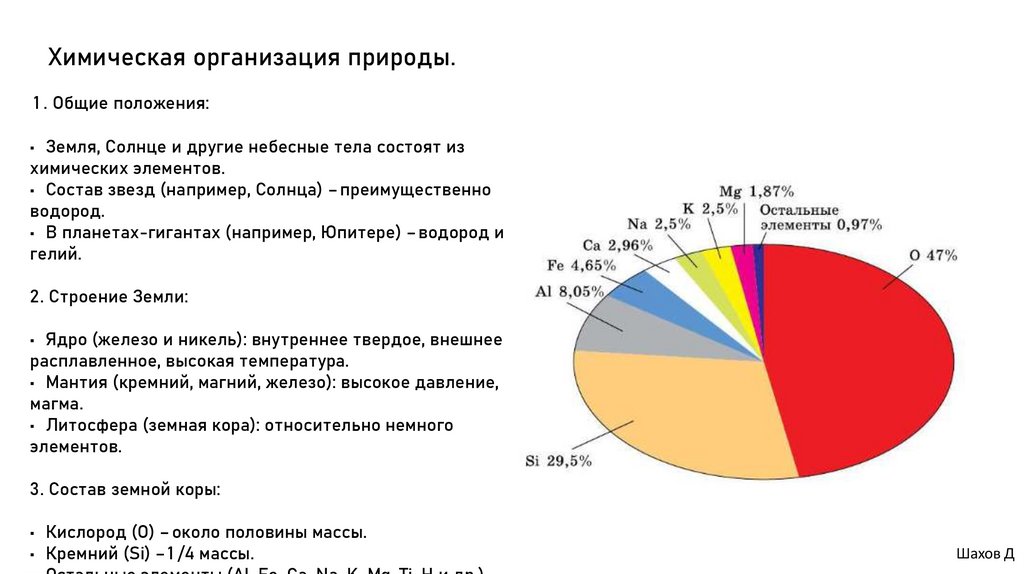
3. Состав земной коры:
• Кислород (O) – около половины массы.
• Кремний (Si) – 1 /4 массы.
Шахов Д
6.
4. Химические элементы в клетках живых организмов:• Более 70 элементов в клетках всех живых организмов.
• Делятся на макроэлементы и микроэлементы.
• Макроэлементы (98%): углерод, кислород, азот, водород,
магний, калий, кальций, натрий, фосфор, сера, хлор.
• Микроэлементы (около 0,1 %): железо, цинк, марганец, бор, медь,
йод, кобальт, бром, фтор, алюминий и др.
5. Функции элементов:
• Макроэлементы – основа органических веществ (белки, жиры,
углеводы, нуклеиновые кислоты, витамины, гормоны и др.).
• Микроэлементы – необходимы в незначительных количествах
для нормальной жизнедеятельности.
• При недостатке микроэлементов возникают болезни (например,
недостаток йода ведет к заболеваниям щитовидной железы).
6. Другие важные соединения:
• Витамины: органические вещества, поступающие с пищей,
влияют на обмен веществ.
• Гормоны: биологически активные вещества, регулирующие
работу органов и систем.
• Ферменты: биологические катализаторы, содержащие
микроэлементы.
• Вода: важнейшее неорганическое соединение, растворитель.
7.
Классификация химическихреакций
Выполнила: Голунцова
8.
Химические реакции классифицируют понескольким признакам:
1 . По изменению состава реагирующих веществ.
2. По тепловому эффекту.
3. По изменению степени окисления.
4. По направлению протекания реакции.
5. По агрегатному состоянию реагирующих
веществ.
6. По наличию катализатора.
Химические реакции –это процессы, в результате которых одни вещества(реагенты)
превращаются в другие вещества(продукты реакции) с изменением их химического
состава и строения.
9.
Изменение состава реагирующих веществ:По тепловому эффекту:
Реакции соединения - реакции между простыми
веществами или сложными веществами, если
образуется только один продукт реакции.
Например, S + O₂ = SO₂
Экзотермические реакции - сопровождаются
потерей энергии системой и выделением тепла во
внешнюю среду (почти все реакции соединения).
Например, горение.
Реакции разложения - если из одного вещества
образуется два или больше новых веществ.
Например, CaCO₃ = CaO + CO₂
Эндотермические реакции - сопровождаются
поглощением тепла, в результате которых
образуются вещества с более высоким
энергетическим уровнем (почти все реакции
разложения).
Например, разложение известняка.
Реакции замещения - реакции, в ходе которых
атомы или группы атомов одного вещества
замещаются на атомы или группы атомов другого
вещества.
Например, Zn + 2HCl = ZnCl₂ + H₂
Реакции обмена - реакции, в ходе которых два
сложных вещества обмениваются своими
составными частями.
Например, AgNO₃ + NaCl = AgCl + NaNO₃
10.
По изменению степениокисления:
Окислительно-восстановительные - Происходит
изменение степени окисления элементов.
Например, горение.
Не окислительно-восстановительные - Степень
окисления элементов не изменяется.
Например, реакции нейтрализации.
По направлению протекания реакции:
Обратимые реакции - реакции, которые могут
протекать и в прямом, и в обратном
направлении, т. е. когда при данных условиях
продукты реакции могут взаимодействовать
друг с другом.
Например, взаимодействие водорода с йодом с
образованием йодоводорода.
Необратимые реакции - реакции, которые
протекают преимущественно в одном
направлении, т. е. продукты реакции не могут
взаимодействовать друг с другом при данных
условиях.
Например, нейтрализация сильной кислоты
сильным основанием (щелочью).
*Реакция нейтрализации – это химическая реакция
между кислотой и основанием (щелочью), в
результате которой образуется соль и вода).
11.
По агрегатному состояниюПо наличию катализатора:
реагирующих веществ:
Обратимые - Протекают одновременно в прямом и
обратном направлениях.
Например, N₂ + 3H₂ = 2NH₃
Необратимые - Протекают только в одном
направлении до конца. Например, большинство
реакций горения.
Каталитические - Протекают в присутствии
катализатора.
Например, разложение пероксида водорода
(H₂O₂) с образованием воды и кислорода.
Уравнение (без катализатора) - 2H₂O₂ = 2H₂O +
O₂
Уравнение (с катализатором) - 2H₂O₂
(катализатор: MnO₂) → 2H₂O + O₂
Некаталитические - Протекают без
катализатора.
*Катализатор - это вещество, которое увеличивает
скорость химической реакции, не расходуясь при этом
в процессе самой реакции
12.
ПЕРЕОДИЧЕСКИЙ ЗАКОНИ ПЕРЕОДИЧЕСКАЯ
СИСТЕМА ХИМИЧЕСКИХ
ЭЛЕМЕНТОВ
Выполнил:Лях
13.
Периодический закон —фундаментальный закон
природы, который
устанавливает периодическое
изменение свойств
химических элементов в
зависимости от увеличения
зарядов ядер их атомов. Закон
был открыт Д. И.
Менделеевым в 1869 году при
сопоставлении свойств
известных в то время
элементов и величин их
атомных весов.
Периодический закон повлиял на
развитие химии:
Позволил предсказывать
существование новых элементов и
прогнозировать их свойства.
Например, Менделеев предсказал
существование 12 элементов,
которые в то время ещё не были
открыты, и определил их положение
в периодической системе.
•Помог учёным создавать новые
химические элементы и новые
соединения элементов, получать
вещества с нужными свойствами.
•Послужил базой для изучения
строения ядра атома и электронных
оболочек.
14.
Периодическая система химическихэлементов
(также известна как таблица Менделеева)
— классификация химических элементов,
устанавливающая зависимость их свойств от
заряда атомного ядра. Это графическое
выражение периодического закона,
открытого русским учёным Д. И.
Менделеевым в 1869 году.
Закономерности:
•Изменение химических свойств по
периодам: в каждом периоде слева
направо металлические свойства
ослабевают, а неметаллические —
усиливаются.
•Повторение свойств по группам:
элементы, расположенные в одной
группе, имеют схожие химические
свойства.
Некоторые элементы
периодической системы:
•Периоды — горизонтальные
строки, в которых элементы
расположены по возрастанию
их атомного номера. В системе
насчитывается семь периодов:
малые (1–3) — включают 2
либо 8 элементов, большие (4–
7) — состоят из 18 либо 32
элементов.
•Группы — вертикальные
колонки, объединяющие
элементы с аналогичными
химическими свойствами. Все
элементы разделены на 18
групп. В некоторых группах
элементы делятся на главную
подгруппу (обозначается
буквой А) и побочную
(обозначается буквой B).













 chemistry
chemistry








