Similar presentations:
Виды химической связи. Типы кристаллических решеток
1. Виды химической связи. Типы кристаллических решеток.
2.
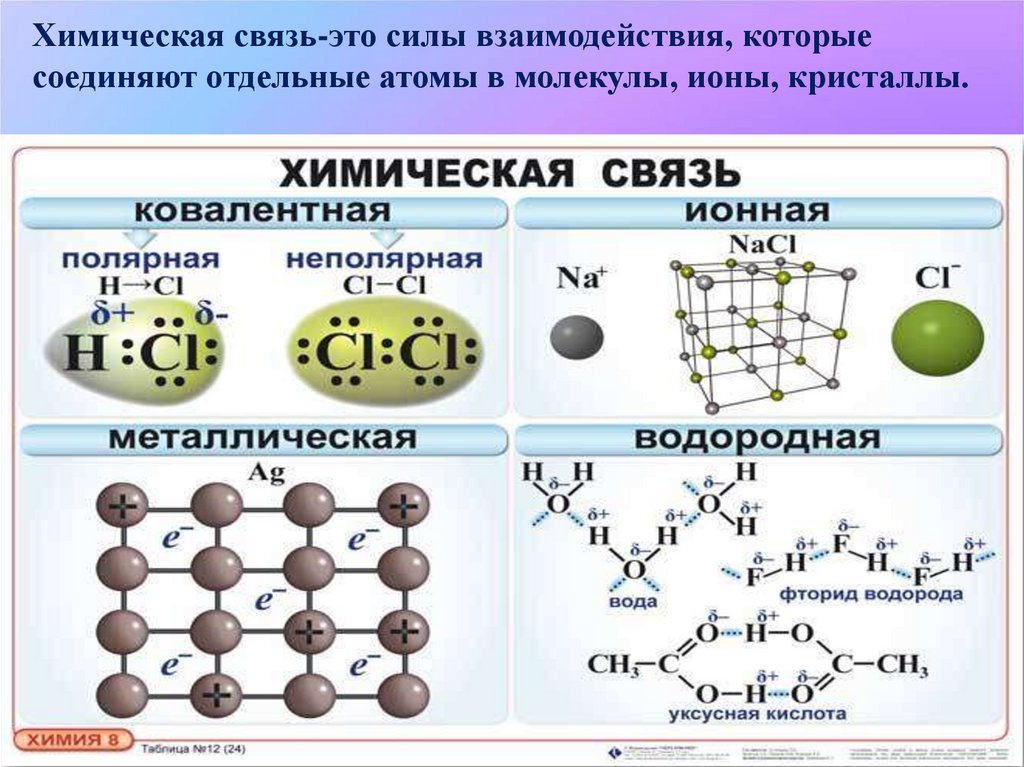
Химическая связь-это силы взаимодействия, которыесоединяют отдельные атомы в молекулы, ионы, кристаллы.
3.
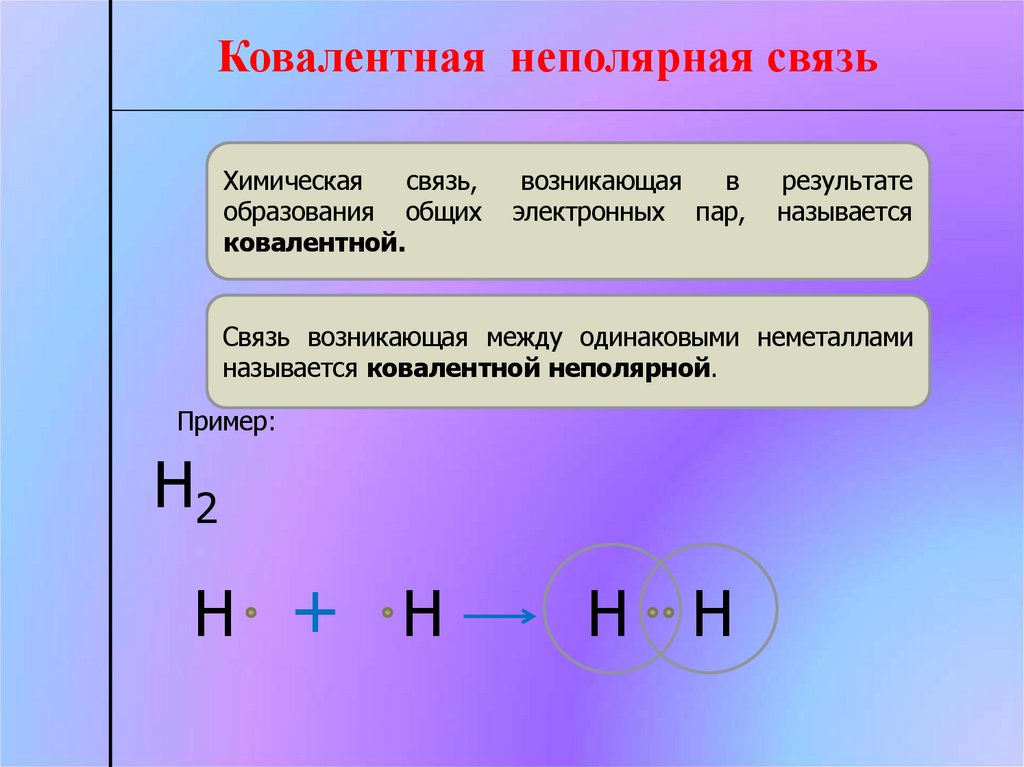
Ковалентная неполярная связьХимическая
связь,
образования общих
ковалентной.
возникающая
в
электронных пар,
результате
называется
Связь возникающая между одинаковыми неметаллами
называется ковалентной неполярной.
Пример:
Н2
Н + Н
Н Н
4.
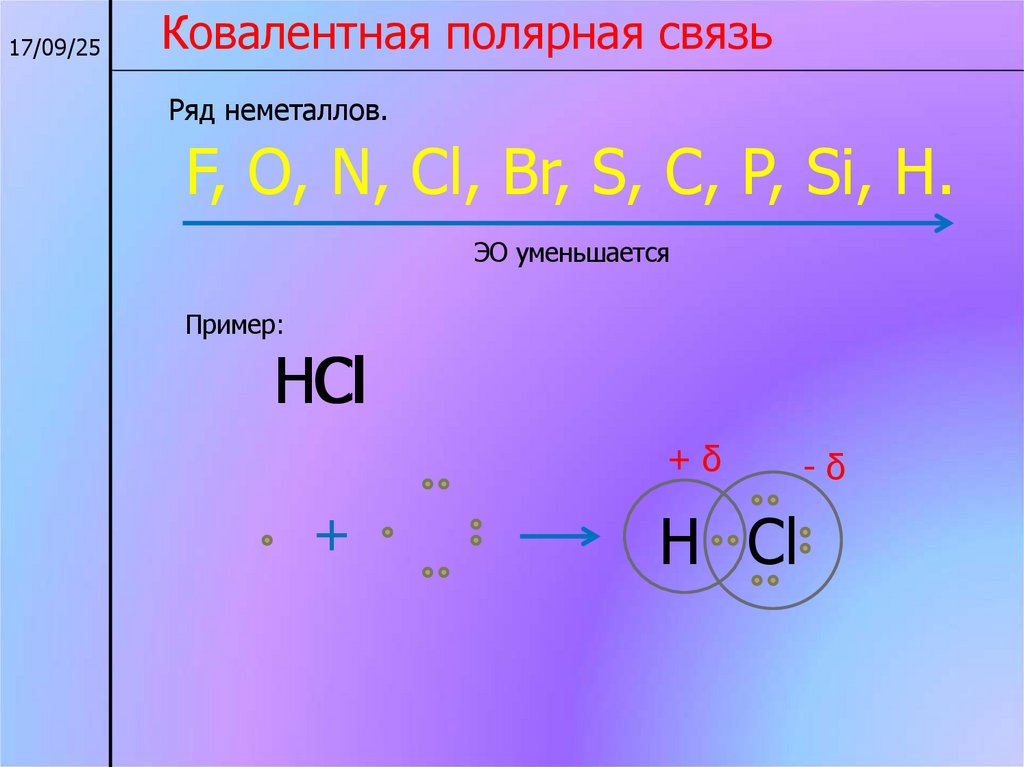
17/09/25Ковалентная полярная связь
Ряд неметаллов.
F, O, N, Cl, Br, S, C, P, Si, H.
ЭО уменьшается
Пример:
НCl
+δ
+
Н Cl
-δ
5.
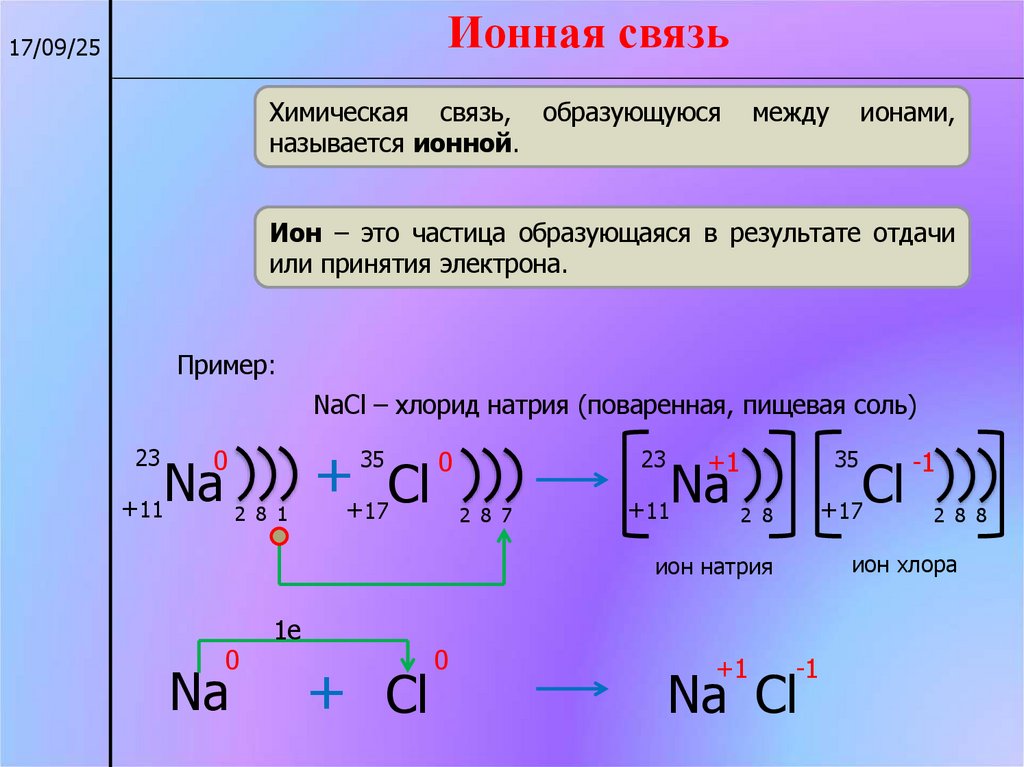
Ионная связь17/09/25
Химическая связь, образующуюся
называется ионной.
между
ионами,
Ион – это частица образующаяся в результате отдачи
или принятия электрона.
Пример:
NaCl – хлорид натрия (поваренная, пищевая соль)
23
0
Na
+11
++ Cl
35
2 8 1
23
0
17
2 8 7
35
+1
Na
+11
0
Na
+ Cl
0
+1
2 8 8
ион хлора
ион натрия
1e
Cl
+17
2 8
-1
-1
Na Cl
6.
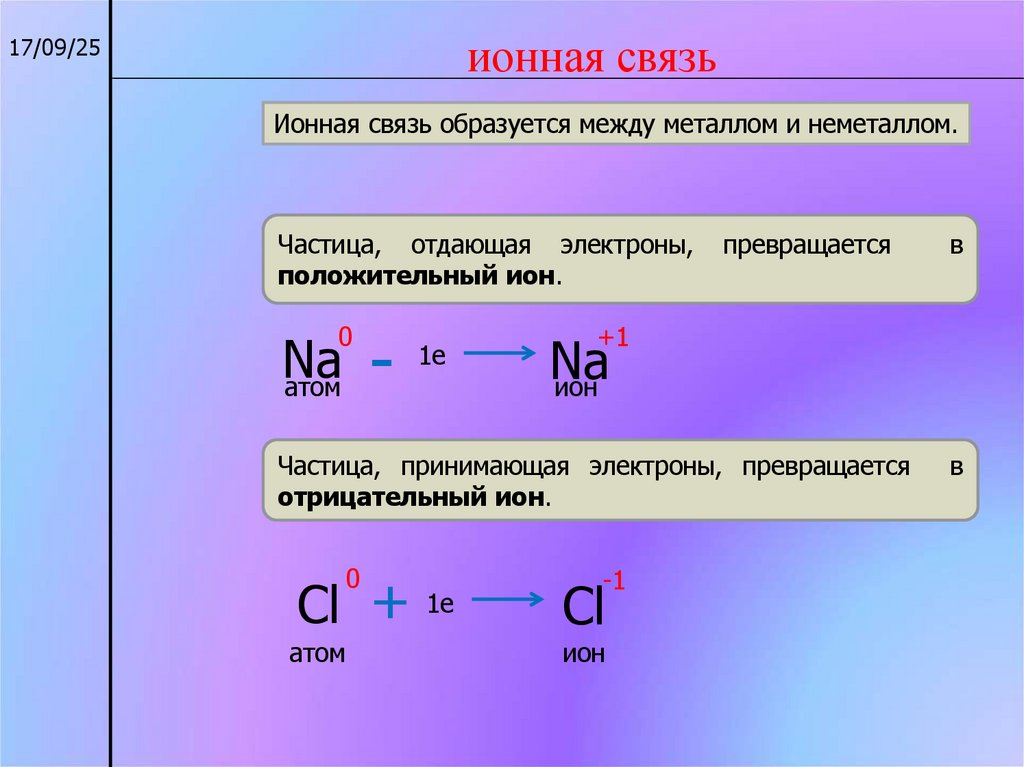
ионная связь17/09/25
Ионная связь образуется между металлом и неметаллом.
Частица, отдающая электроны,
положительный ион.
1e
Na
атом
0
превращается
+1
Na
ион
Частица, принимающая электроны, превращается
отрицательный ион.
0
в
-1
Cl + 1e
Cl
атом
ион
в
7.
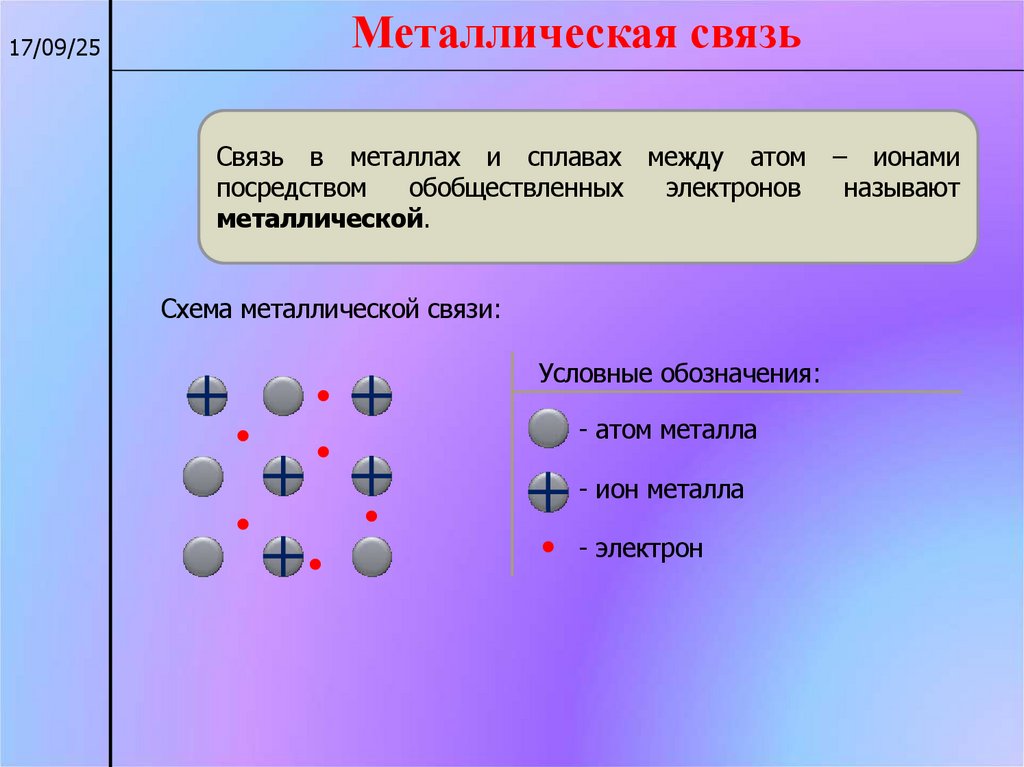
17/09/25Металлическая связь
Связь в металлах и сплавах между атом
посредством
обобществленных
электронов
металлической.
Схема металлической связи:
Условные обозначения:
- атом металла
- ион металла
- электрон
– ионами
называют
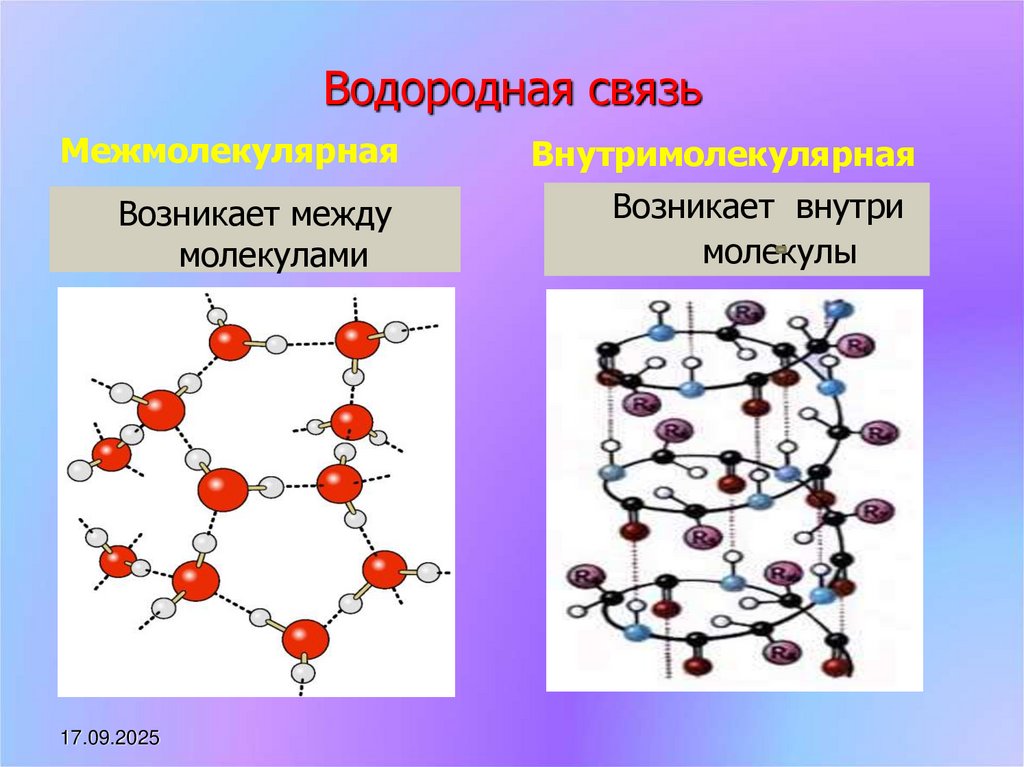
8. Водородная связь
МежмолекулярнаяВнутримолекулярная
Возникает между
молекулами
Возникает внутри
молекулы
17.09.2025
9. Сравнение различных видов связи
Сходство: любой вид связиобразуется за счет перехода
электронов
Различие: способ образования
( передача электронов,
образование общих
электронных пар,
переход электронов в
свободное пространство)
17.09.2025
10. Типы химической связи
H2OКовалентная Ковалентная
неполярная полярная
Ионная
KF
H2
NaI
LiBr
О2
NaCl
17.09.2025
Н2S
CO2
NH3
N2
Cl2
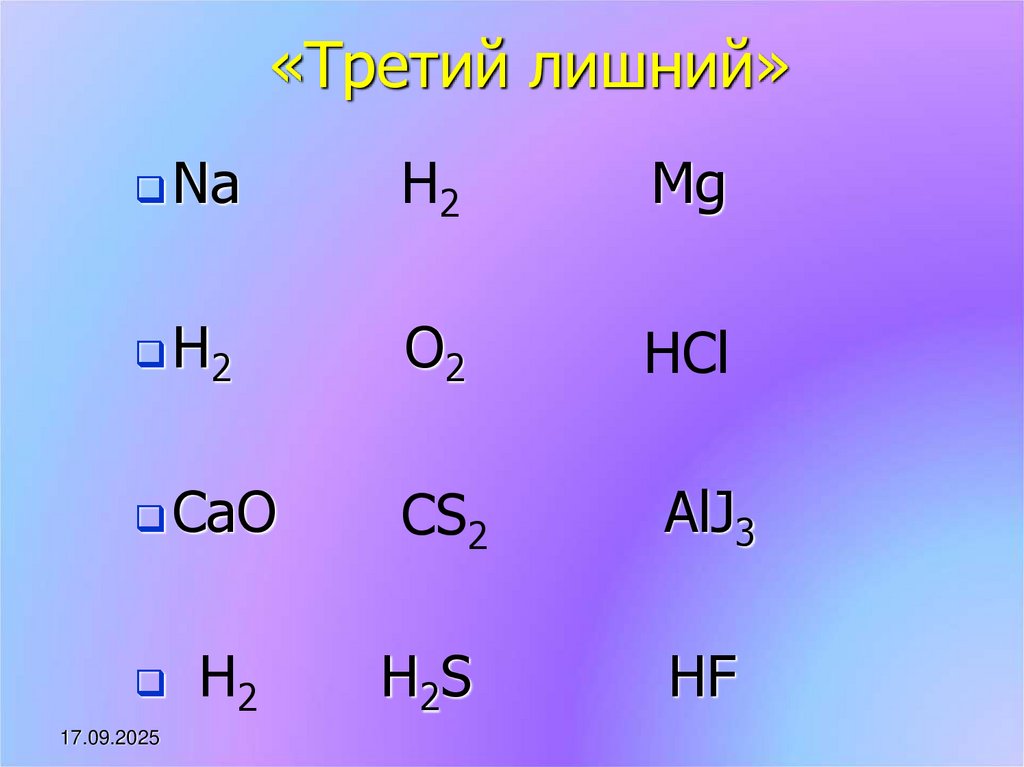
11. «Третий лишний»
NaН2
Mg
H2
O2
HCl
CaO
CS2
AlJ3
H2
H 2S
HF
17.09.2025
12.
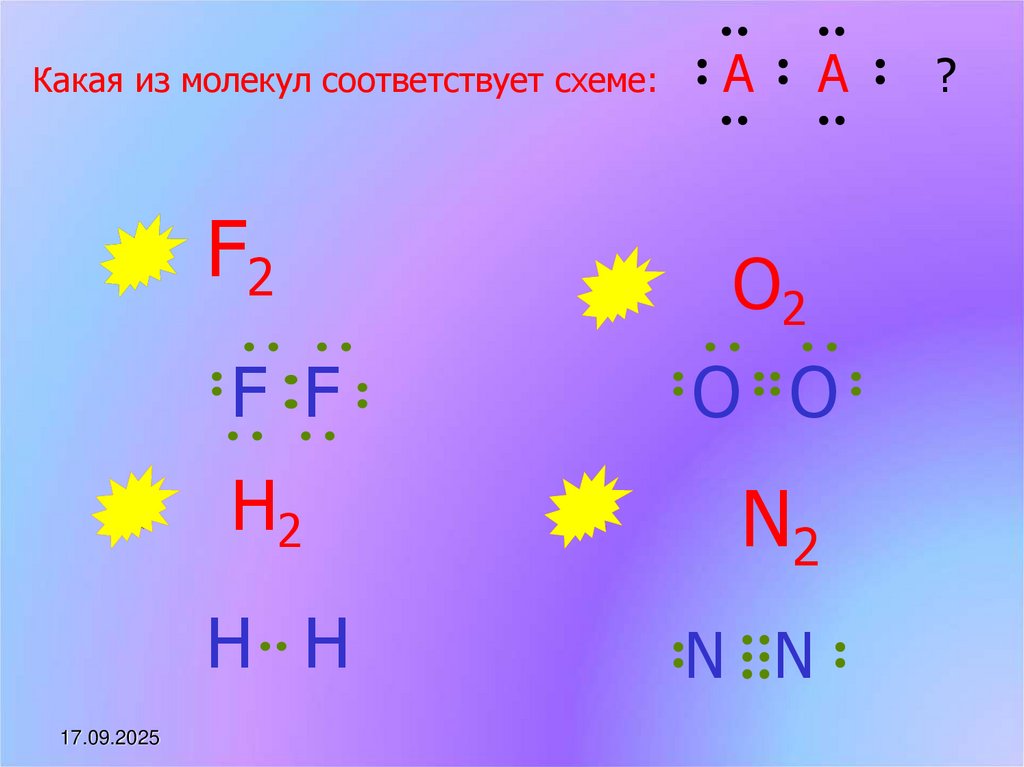
Какая из молекул соответствует схеме:17.09.2025
A
A
F2
O2
F F
O O
H2
N2
H H
N N
?
13.
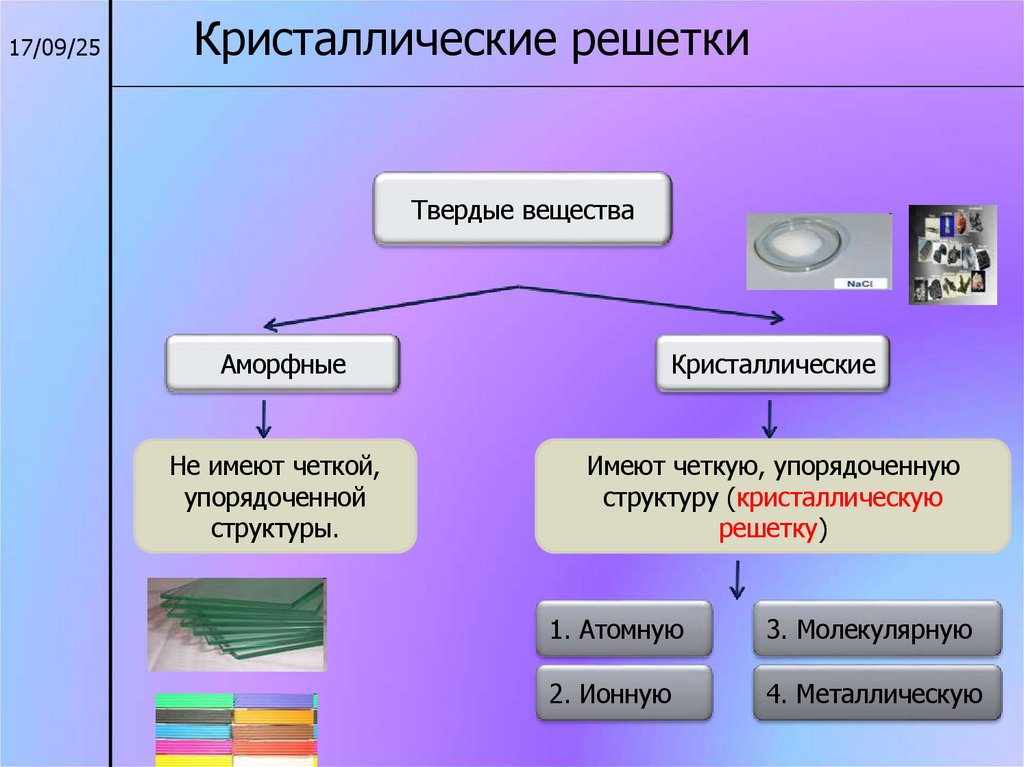
17/09/25Кристаллические решетки
Твердые вещества
Аморфные
Кристаллические
Не имеют четкой,
упорядоченной
структуры.
Имеют четкую, упорядоченную
структуру (кристаллическую
решетку)
1. Атомную
3. Молекулярную
2. Ионную
4. Металлическую
14.
17.09.202515.
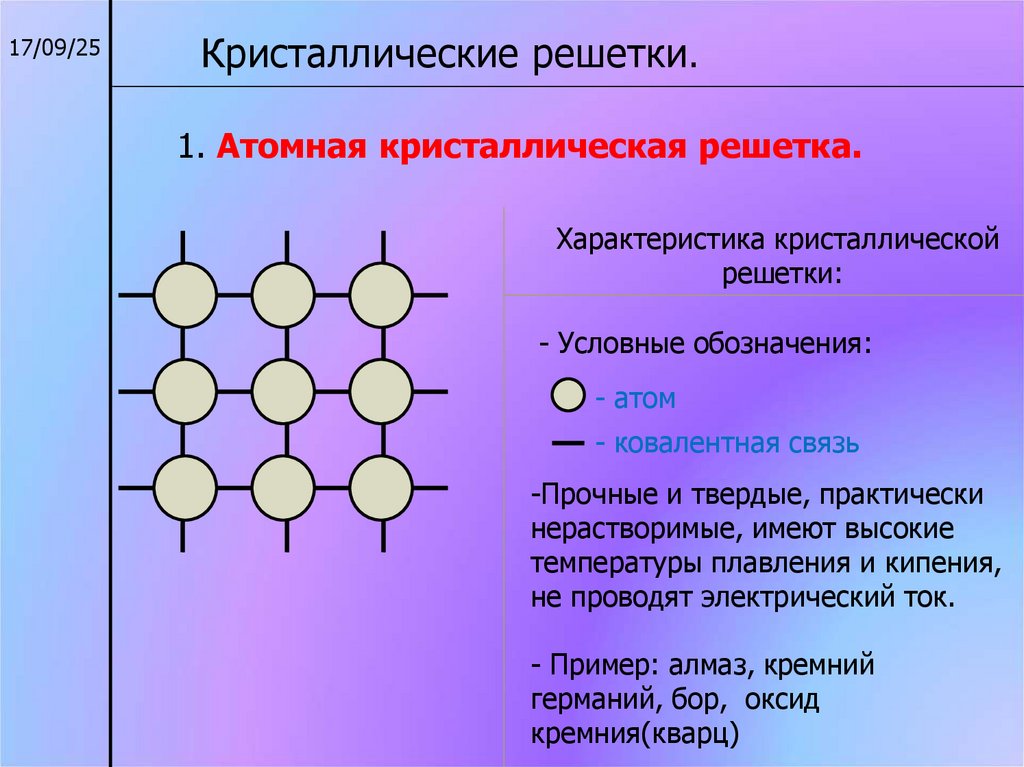
17/09/25Кристаллические решетки.
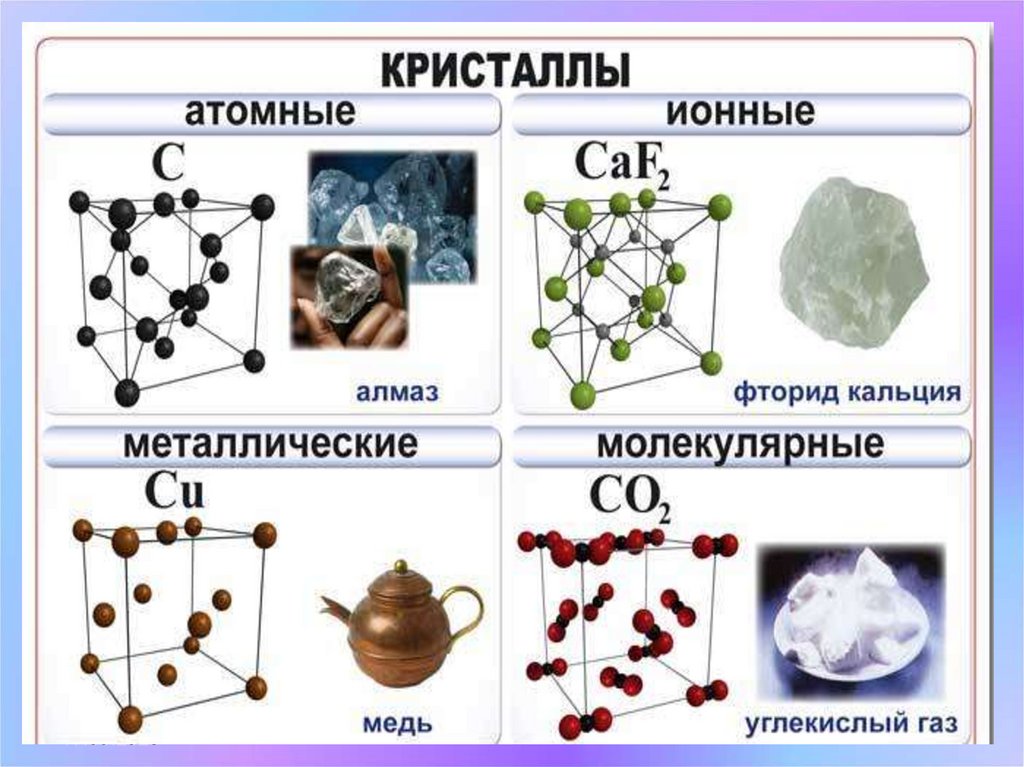
1. Атомная кристаллическая решетка.
Характеристика кристаллической
решетки:
- Условные обозначения:
- атом
- ковалентная связь
-Прочные и твердые, практически
нерастворимые, имеют высокие
температуры плавления и кипения,
не проводят электрический ток.
- Пример: алмаз, кремний
германий, бор, оксид
кремния(кварц)
16.
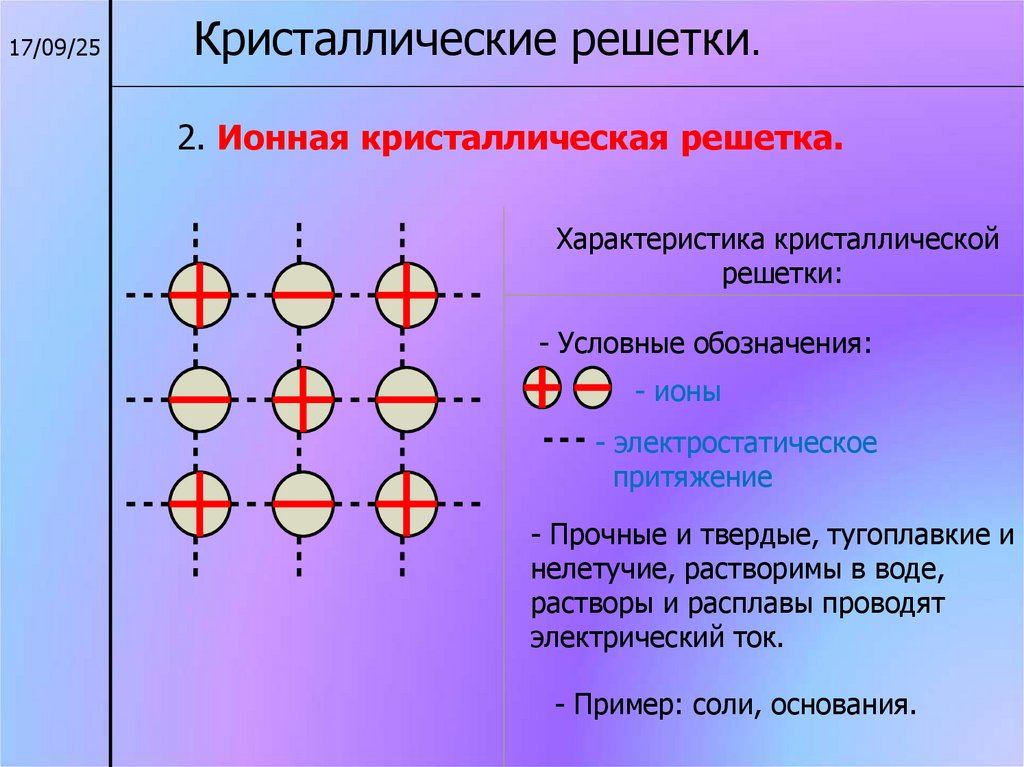
17/09/25Кристаллические решетки.
2. Ионная кристаллическая решетка.
Характеристика кристаллической
решетки:
- Условные обозначения:
- ионы
- электростатическое
притяжение
- Прочные и твердые, тугоплавкие и
нелетучие, растворимы в воде,
растворы и расплавы проводят
электрический ток.
- Пример: соли, основания.
17.
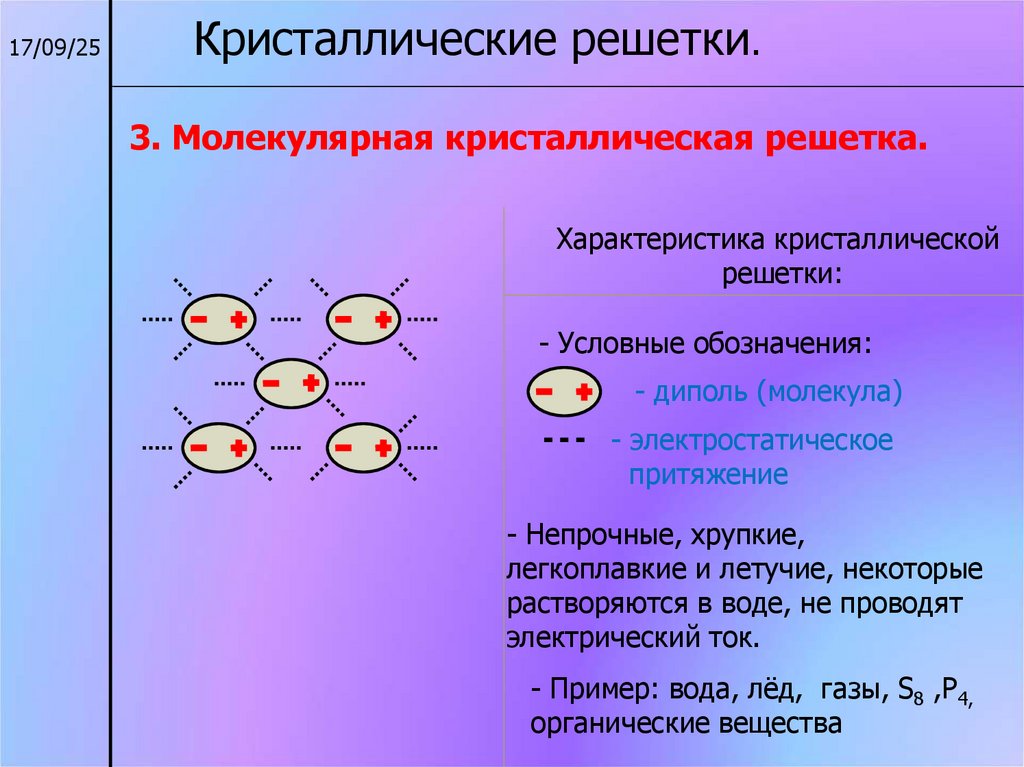
17/09/25Кристаллические решетки.
3. Молекулярная кристаллическая решетка.
Характеристика кристаллической
решетки:
- Условные обозначения:
- диполь (молекула)
- электростатическое
притяжение
- Непрочные, хрупкие,
легкоплавкие и летучие, некоторые
растворяются в воде, не проводят
электрический ток.
- Пример: вода, лёд, газы, S8 ,P4,
органические вещества
18.
17/09/25Кристаллические решетки.
4. Металлическая кристаллическая решетка.
Характеристика кристаллической
решетки:
- Условные обозначения:
- ион металла
- атом металла
-электрон
- Ковкие, пластичные, электро- и
теплопроводные, обладающие
металлическим блеском.
- Пример: все металлы.
19. Вывод:
Строение атомаЭО
Вид химической связи
Тип кристаллической решетки
Свойства веществ
17.09.2025
20. Установите соответствие
Между названиемвещества и видом
химической связи в
нем
А) NO
1.Ковалентная
неполярная
Б) Na2S 2.Ковалентная
полярная
Между названием
вещества и типом
кристаллической
решётки в нем
А) CaCl2 1.металлическая
Б) Al
2.ионная
В)Ca
3.Металлическая
В) NH3
3.атомная
Г) Cl2
4.ионная
Г) Si
4.молекулярная
17.09.2025





 chemistry
chemistry








