Similar presentations:
Ортофосфорная кислота и её соли. Минеральные удобрения
1. ОРТОФОСФОРНАЯ КИСЛОТА И ЕЁ СОЛИ. МИНЕРАЛЬНЫЕ УДОБРЕНИЯ
Подготовила студентка Ленцевич Ксения МихайловнаНаучный руководитель: Якубовская Злата Александровна
Минск,2025
2. АКТУАЛЬНОСТЬ И ЦЕЛЬ РАБОТЫ
Эти соединения используются в промышленности,медицине, пищевой отрасли, но особенно важны они в
сельском хозяйстве, где играют ключевую роль в
обеспечении
плодородия
почв
и
устойчивого
земледелия.
Цель работы: изучение свойств ортофосфорной
кислоты и её солей, а также методов синтеза и
применения.
2
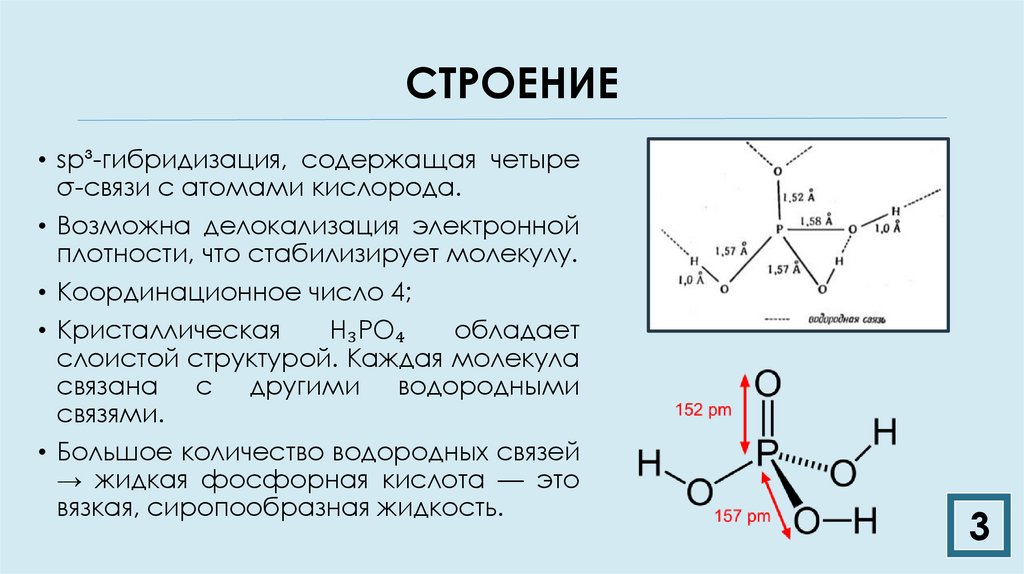
3. СТРОЕНИЕ
• sp³-гибридизация, содержащая четыреσ-связи с атомами кислорода.
• Возможна делокализация электронной
плотности, что стабилизирует молекулу.
• Координационное число 4;
• Кристаллическая
H₃PO₄
обладает
слоистой структурой. Каждая молекула
связана с другими водородными
связями.
• Большое количество водородных связей
→ жидкая фосфорная кислота — это
вязкая, сиропообразная жидкость.
3
4. ФИЗИЧЕСКИЕ СВОЙСТВА
• Твердое прозрачное• Твердые кристаллы;
кристаллическое вещество; • Фосфаты щелочных
металлов растворимы,
• Гигроскопичное;
остальные – нет. Большинство
• Хорошо растворимое в воде
дигидрофосфатов хорошо
в любых соотношениях;
растворимы в воде;
• Трехосновная кислота
• Чаще всего бесцветные или
средней силы;
белые, реже – цветные;
• Tпл= 42°С;
• Высокие Tпл(1000–1700 °C).
• p = 1,88 г/см3.
4
5.
Ортофосфорная кислота H₃PO₄ образует триряда солей:
1) Средние соли, или фосфаты - Ca₃(PO₄)₂.
Нерастворимы в воде, кроме фосфатов щелочных металлов.
2) Дигидрофосфаты - Са(Н₂PO₄)₂.
Большинство дигидрофосфатов хорошо растворимы в воде.
3) Гидрофосфаты - СаНРО₄.
Гидрофосфаты малорастворимы в воде (кроме фосфатов натрия,
калия и аммония).
Вывод: с увеличением содержания атомов водорода в молекуле
соли, ее растворимость повышается.
5
6. ХИМИЧЕСКИЕ СВОЙСТВА
• При н.у. малоактивна и вступает в реакции только с карбонатами, гидроксидамии некоторыми металлами, стоящими в ряду напряжений до водорода.
3Mg + 2H3 PO4 = Mg
3
PO4 ↓ + 3 H2 ↑
2
• Фосфорная кислота сильнее, чем угольная, сероводородная, кремниевая,
поэтому может вытеснять перечисленные кислоты из водных растворов их солей:
2H3 PO4 + Na2 CO3 = 2NaH2 PO4 + H2 О + СO2 ↑
2H3 PO4 + Na2 S = 2NaH2 PO4 +H2 S↑
2H3 PO4 + Na2 SiO3 = 2NaH2 PO4 +H2 SiO3 ↓
• При нагревании образуется пирофосфорная и метафосфорная кислоты,
температура разложения составляет около 158 °C:
2H3 PO4 → H2 O+H4 P2 O7
H4 P2 O7 →H2 O+2HPO3
6
7. МЕТОДЫ ПОЛУЧЕНИЯ
• Взаимодействие с водой оксида фосфора (V), полученногосжиганием фосфора в кислороде:
P2 O5 + 3H2 O → 2H3 PO4
• Вытеснение из фосфатов
Ca5 F PO4
3
+ 5H2 SO4 = 5CaSO4 тв + 3H3 PO4 + HF
• Окисление фосфора азотной кислотой
3Р + 5HNO3 + 2H2 O = 3Н3 РО4 + 5NO
7
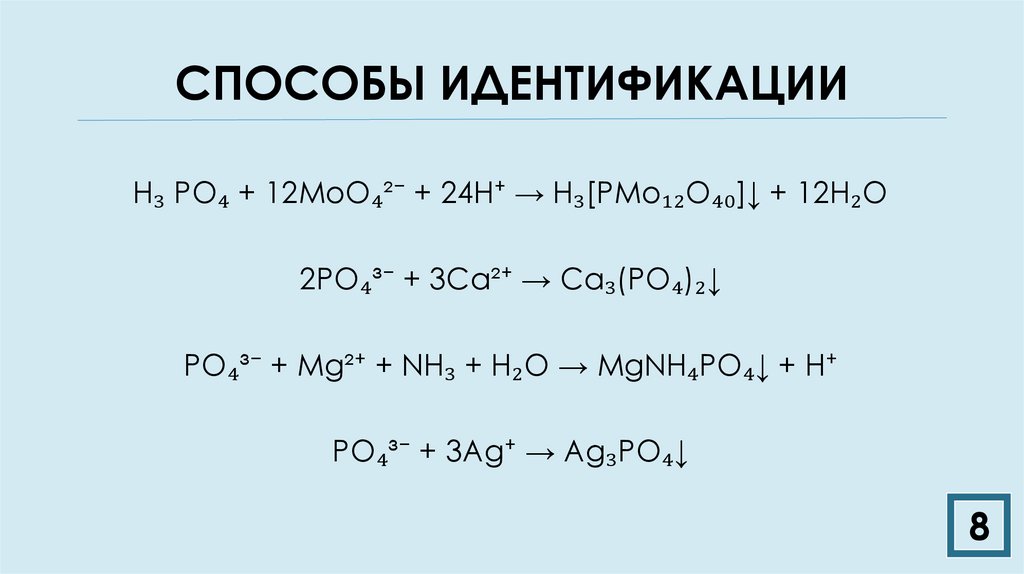
8. СПОСОБЫ ИДЕНТИФИКАЦИИ
H₃ PO₄ + 12MoO₄²⁻ + 24H⁺ → H₃[PMo₁₂O₄₀]↓ + 12H₂O2PO₄³⁻ + 3Ca²⁺ → Ca₃(PO₄)₂↓
PO₄³⁻ + Mg²⁺ + NH₃ + H₂O → MgNH₄PO₄↓ + H⁺
PO₄³⁻ + 3Ag⁺ → Ag₃PO₄↓
8
9. МИНЕРАЛЬНЫЕ УДОБРЕНИЯ
Двойной суперфосфат Ca(H2PO4)2 · Н2ОПростой суперфосфат Ca(H2PO4)2 + 2CaSO4 · H2O
Преципитат CaHPO4 · 2H2O
Аммофос — смесь двух солей NH4H2PO4 и (NH4)2HPO4
Аммофоска — NH4H2PO4 + (NH4)2HPO4 + KCl
9
10. ПРИМЕНЕНИЕ
• В агрохимии — для производства минеральных удобрений;• В пищевой промышленности — как пищевая добавка Е338;
• В медицине — при стоматологических процедурах;
• В строительстве и металлургии — как компонент
антикоррозионных покрытий и антипиренов.
10
11. ЗАЧЕТНЫЙ СИНТЕЗ
Bi(NO3)3+Na2HPO4+HNO3→BiPO4↓+2NaNO3+H2OМетодика: Готовят насыщенные растворы Bi(NO3)3·5H2O и
Na2HPO4. Раствор Bi(NO3)3 должен быть предварительно
подкислен азотной кислотой. Затем оба раствора смешиваются:
добавляем раствор гидрофосфата в раствор нитрата висмута
(III). При получении осадка, его отсасывают и промывают
дистиллированной водой, а затем сушат в сушильном шкафу
при температуре не менее 50 оС.
11
12.
21
1. Bi³⁺ + 4I⁻ → [BiI₄]⁻
2. 2Bi³⁺ + 3S²⁻ → Bi₂S₃↓
3. Bi(OH)₃ + NaClO + NaOH → NaBiO₃↓
+ NaCl + 2H₂O
4. BiPO₄ +FeCl3₃→FePO₄ ↓+BiCl ₃
5. BiPO₄ + 6HCl → BiCl₃ + H₃PO₄ + 3H₂O
1
3
4
5
12
13. ВЫВОД
Ортофосфорная кислота – бесцветное, хорошо растворимое вводе вещество с высокой гигроскопичностью. Она обладает
высокой плотностью, вязкостью. Её соли — фосфаты — широко
распространены в природе и могут существовать в виде
разнообразных
соединений
с
катионами
металлов,
что
обуславливает их широкое химическое разнообразие.
Среди наиболее важных областей применения ортофосфорной
кислоты и её производных можно выделить:
• производство
минеральных
удобрений,
особенно
суперфосфата и аммофоса;
• использование в пище (в качестве регулятора кислотности);
• применение в медицине и фармацевтике.
10
14. СПИСОК ЛИТЕРАТУРЫ
• Неорганическая химия: В 3 т./ под ред. Ю.Д. Третьякова. Т.2: химия непереходных элементов: Учебник для студ. Высш. Учеб.Заведений/ А.А. Дроздов, В.П. Зломанов, Г.Н. Мазо, Ф.М. Спиридонов – Москва: Издательский центр «Академия», 2004. - 368 с.
• Schrödter K., Bettermann G., Staffel T., Wahl F., Klein T., Hofmann T. Phosphoric Acid and Phosphates (англ.) // Ullmann's Encyclopedia of
Industrial Chemistry. — Wiley, 2008. — doi:10.1002/14356007.a19_465.pub3
• Химия элементов : в 2 т. Т. 1 / Н. Гринвуд, А. Эрншо ; пер. с англ. –5-е изд., испр. – М. : Лаборатория знаний, 2021. – 670 с.
• Глинка Н. Л. Общая химия: Учебное пособие для вузов.—23-с изд., стереотипное./ Под ред. В. А. Рабиновича.— Л.: Химия, 1983.—
701 с. ил.
• Фосфорная кислота / [Электронный ресурс] // chemport.ru : [сайт]. — URL:
http://www.chemport.ru/data/chemipedia/article_4093.html
• Ортофосфорная кислота // ВикипедиЯ URL:
https://ru.wikipedia.org/wiki/%D0%9E%D1%80%D1%82%D0%BE%D1%84%D0%BE%D1%81%D1%84%D0%BE%D1%80%D0%BD%D0%B0%D1%8F_
%D%B.
• Неорганическая химия. Учебник / А. В. Шевельков, А.А. Дроздов, М. Е. Тамм; под ред. А. В. Шевелькова. — М. : Лаборатория
знаний, 2021. — 586 с.
• Везер Ван. Фосфор и его соединения. — Москва: Издательство иностранной литературы, 1962 — 688 c.
• Бузко В.Ю., Артеменко А.А. Неорганические материалы. – М.: Академкнига, 2012. – 324 с.
• Электрохимические источники тока / под ред. Кожевникова С.А. – М.: Энергоатомиздат, 2010. – 489 с.
• Современные неорганические материалы: учебник / Под ред. Н.С. Скакунова. – М.: Лань, 2020. – 368 с.
• Ф.Н. Капуцкий, В.Ф. Тикавый Пособие по химии для поступающих в вузы.— Минск: Выш. школа, 1979. — С. 384
• Кислотные методы переработки фосфатного сырья в фосфорную кислоту и удобрения / под ред. Я.К. Балабакович. – М.:
Гидрометеоиздат, 1986. – 180с.
• Руководство по неорганическому синтезу: в 6 т. / под ред. Г. Брауэра. Т. 5: Ч. 2: Элементы и соединения. - М.: Мир, 1986. - 360 с.
• Ортофосфорная кислота // Югреактив. База химической продукции URL: https://ugreaktiv-galvanika.ru/ortofosfornaya-kislota-85.












 chemistry
chemistry








