Similar presentations:
Марганец
1.
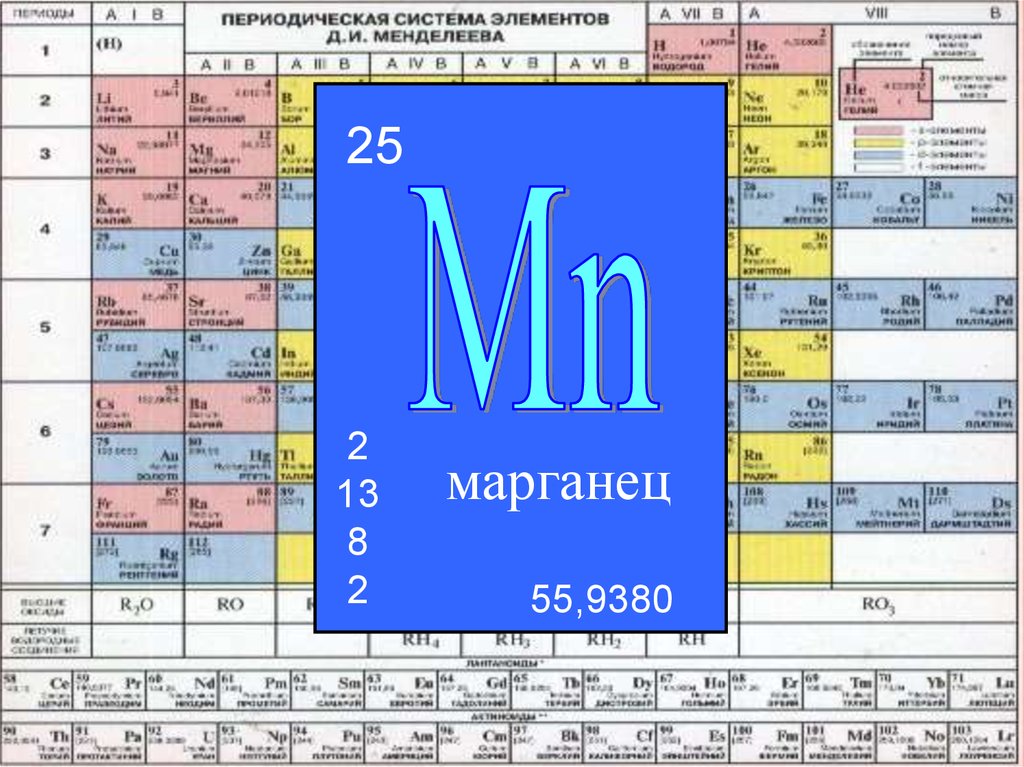
252
13
8
2
марганец
55,9380
2.
• Нахождение в природе• Положение в ПСХЭ
• Физические свойства
• Химические свойства
• Соединения Mn
• Получение
• Применение
?
3.
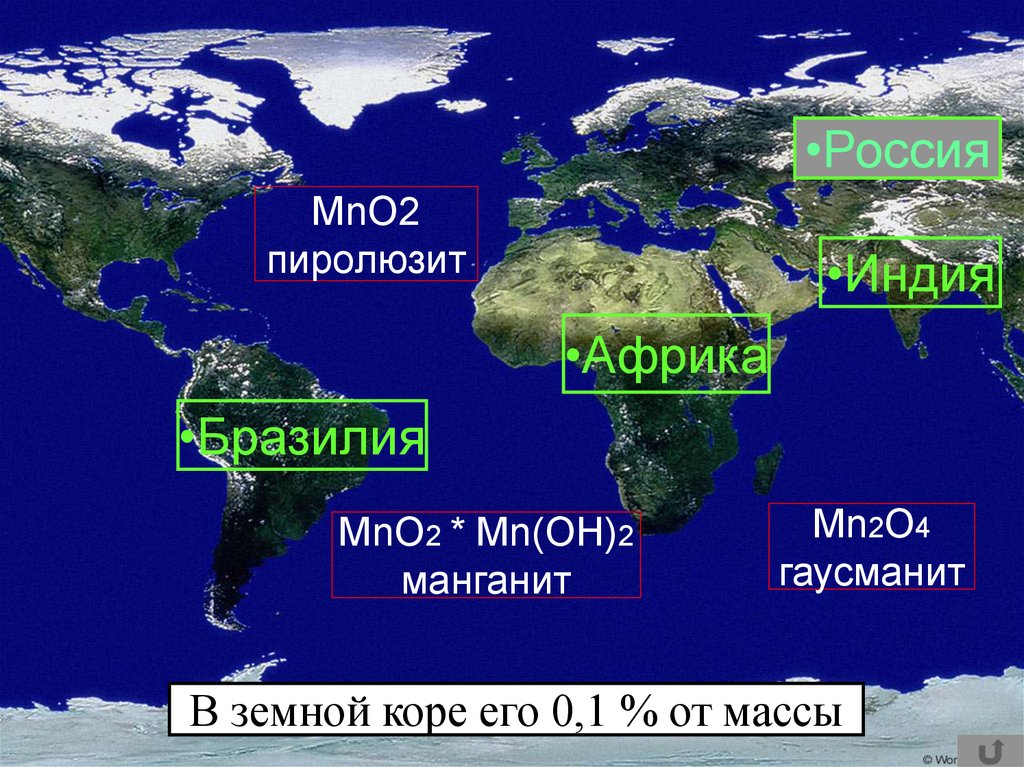
•РоссияMnO2
пиролюзит
•Индия
•Африка
•Бразилия
MnO2 * Mn(OH)2
манганит
Mn2O4
гаусманит
В земной коре его 0,1 % от массы
4.
• твердый• плотность = 7,44г/см³
• хрупкий
металл
• cеребристобелого цвета
с розовым
отливом
• Т ПЛАВ = 1245 º С
Mn
• т КИП = 2150 º С
•На воздухе покрывается оксидной пленкой
5.
5525
Mn + 25 ) ) ) )
n= 30
2 8 13 2
1s² 2s² 2p 3s² 3p 3d 4s²
4s
2
5
6
6
N=4
↓↑
↑ ↑ ↑ ↑ ↑
↓↑ ↓↑ ↓↑
N=3
↓↑
↓↑ ↓↑ ↓↑
N=2
↓↑
N=1
↓↑
+2, +3, +4, +6, +7
6.
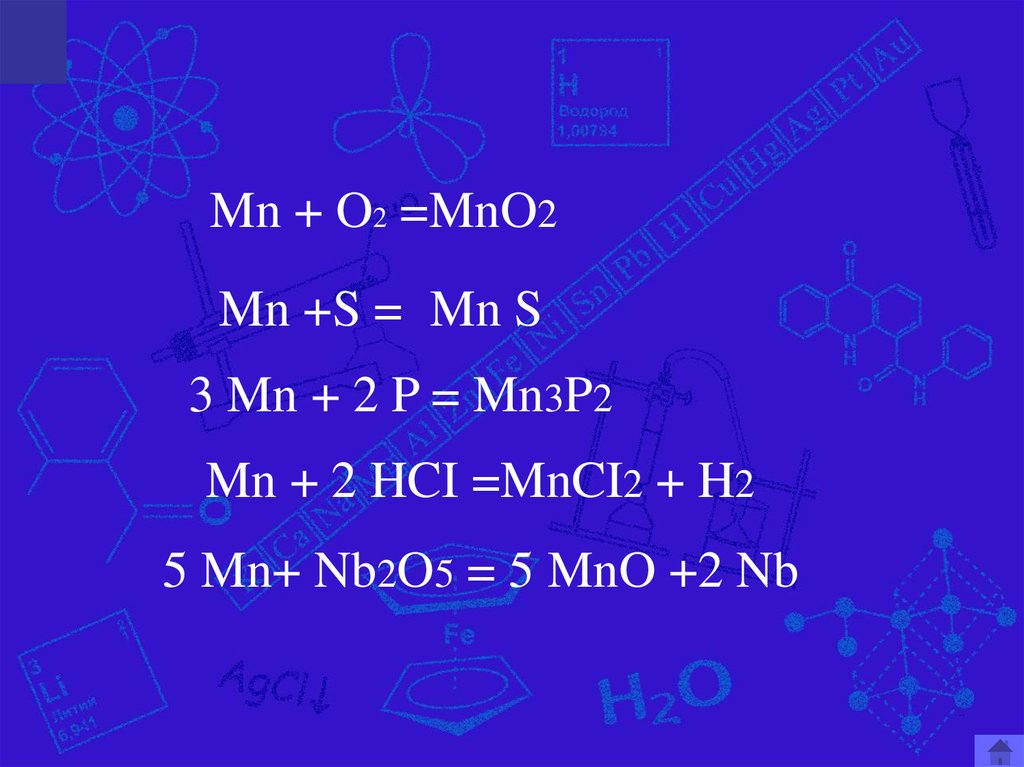
Mn + O2 =MnO2Mn +S = Mn S
3 Mn + 2 P = Mn3P2
Mn + 2 HCI =MnCI2 + H2
5 Mn+ Nb2O5 = 5 MnO +2 Nb
7.
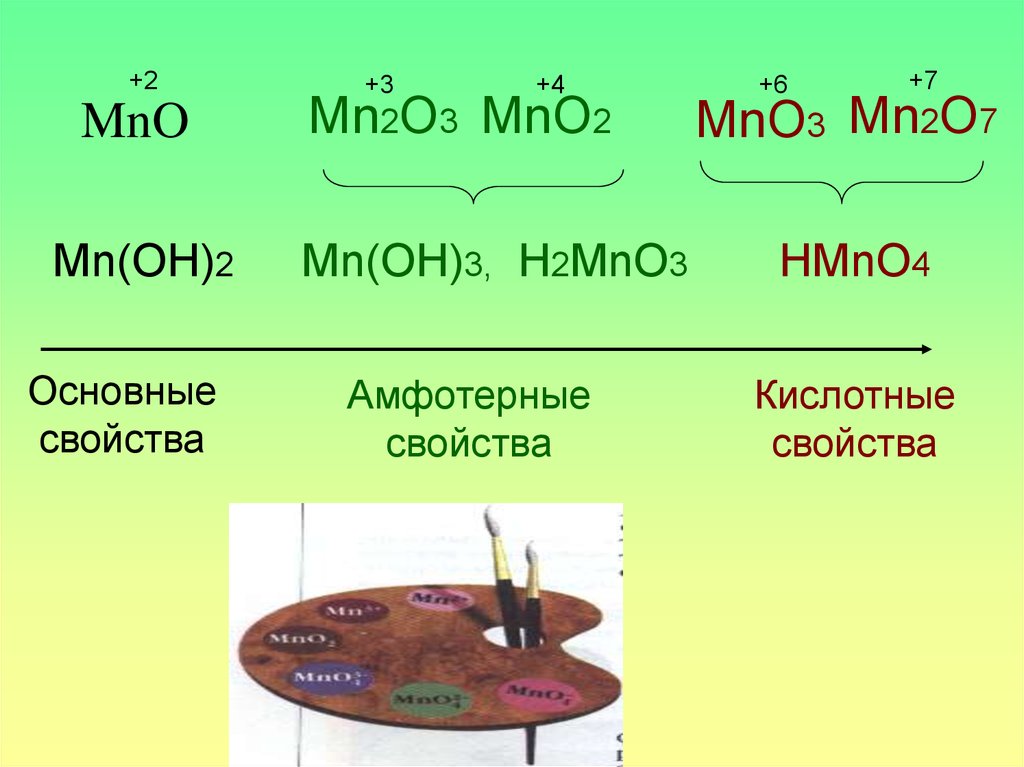
+2MnO
Mn(OH)2
Основные
свойства
+3
+4
Mn2O3 MnO2
Mn(OH)3, H2MnO3
Амфотерные
свойства
+6
+7
MnO3 Mn2O7
HMnO4
Кислотные
свойства
8.
МанганатыВажнейшие соединения
Перманганаты:
t
2 KMnO4 = K2MnO4 +MnO2 +O2
9.
H+Mn
H2O
OH -
+2
Mn
MnO2 (Mn
2-
MnO4
+4
)
10.
В промышленности:•Алюминотермия
3MnO2+4AI=2AI2O3+3Mn
•Электролиз солей
11.
12.
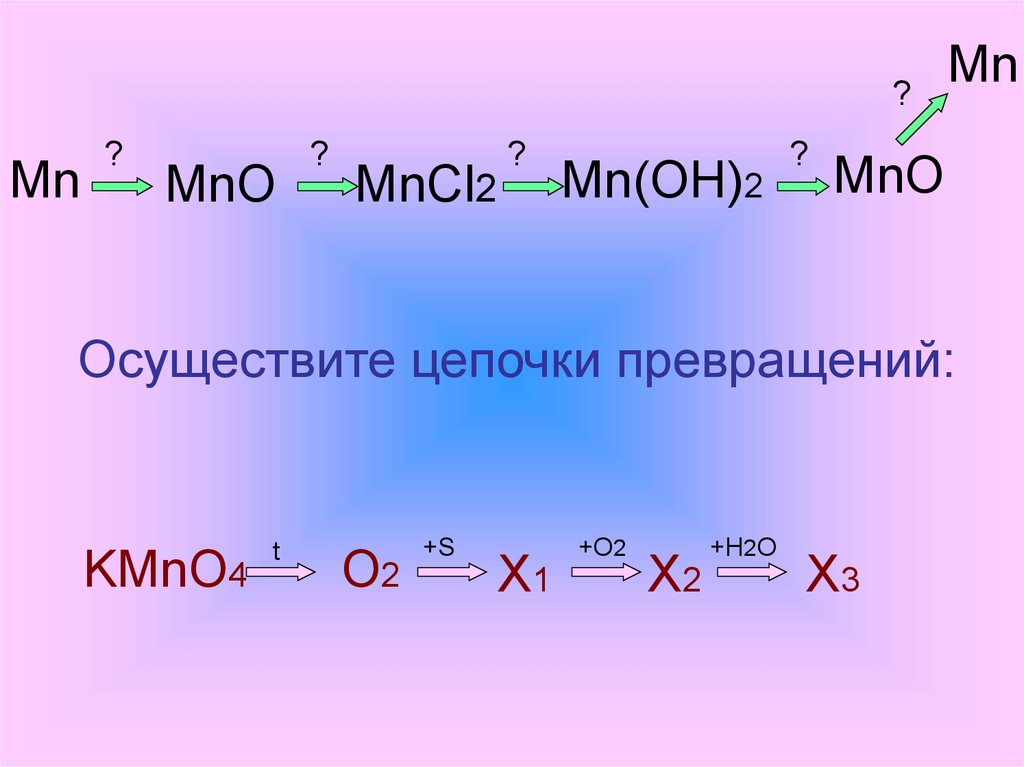
?Mn
?
MnO
?
MnCl2
?
Mn(OH)2
?
Mn
MnO
Осуществите цепочки превращений:
KMnO4
t
O2
+S
X1
+O2
X2
+H2O
X3
13.
1. БЖЕГ2. В
3. В
4. ДВГБ
5. АВД
+2
+5
+4
-1
6 ) 3 MnCO3 +KClO3 = 3 MnO2 +KCl +3CO2
Mn+2 -2e Mn+4 3 - окисляется, восстановитель
+5 +6e
-1
Cl
Cl
1 - восстанавливается, окислитель
+7
+4
+6
+6
2KMnO4 +Na2SO3 +2 KOH = Na2SO4 +2 K2MnO4 + H2O
+6
+7 +1e
2- восстанавливается, окислитель
Mn
Mn
-2e
S +4
S +6 1 - окисляется, восстановитель








 chemistry
chemistry








