Similar presentations:
Основные сведения о строении атома
1.
ОСНОВНЫЕ СВЕДЕНИЯ О СТРОЕНИИАТОМА
2. Современная модель атома
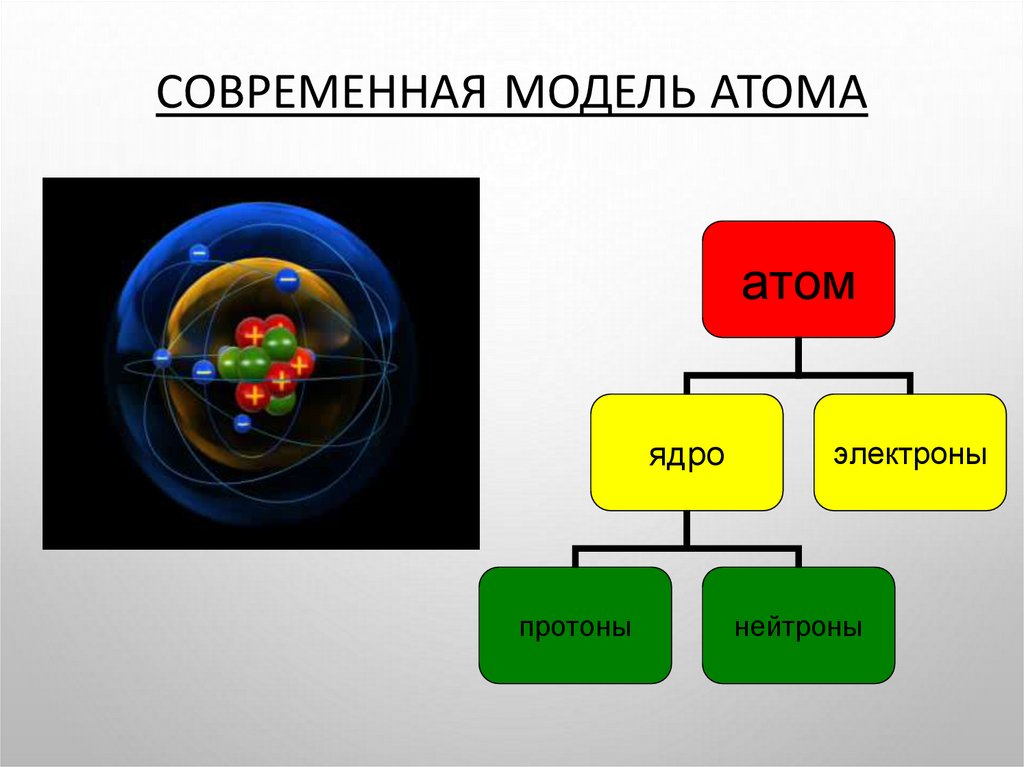
СОВРЕМЕННАЯ МОДЕЛЬ АТОМАатом
ядро
протоны
электроны
нейтроны
3. УСЛОВНОЕ ОБОЗНАЧЕНИЕ ЯДРА ХИМИЧЕСКОГО ЭЛЕМЕНТА
AZ
Х
Х - СИМВОЛ
ХИМИЧЕСКОГО ЭЛЕМЕНТА
Z - ЗАРЯД ЯДРА
А – МАССОВОЕ ЧИСЛО
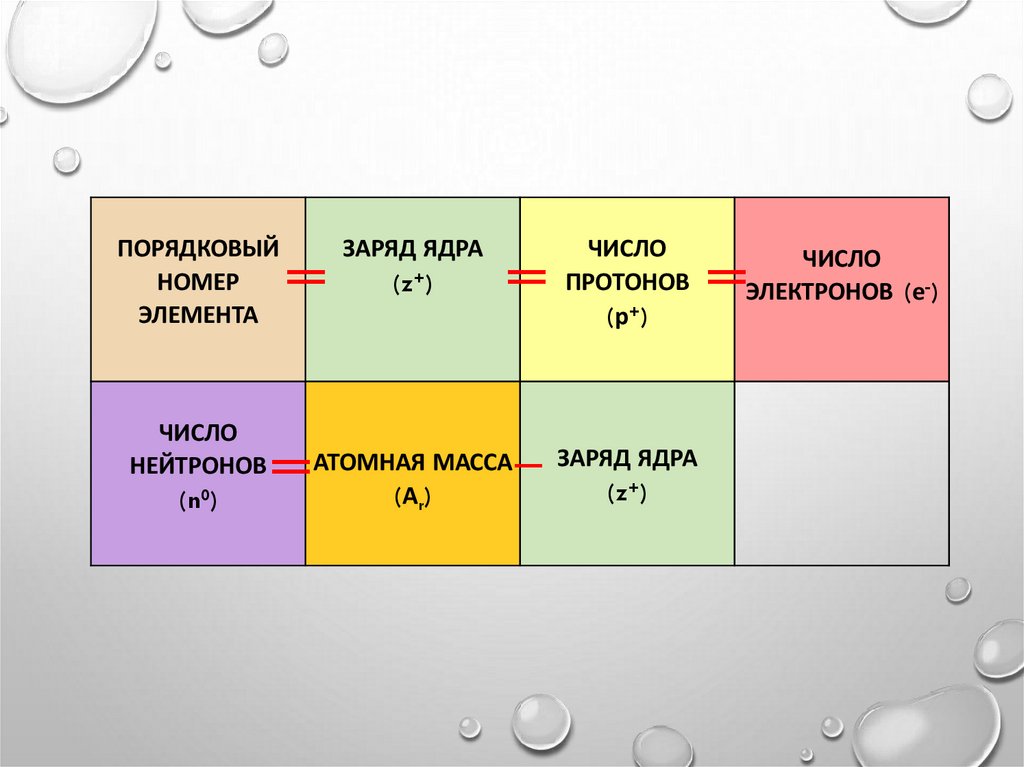
4.
ПОРЯДКОВЫЙНОМЕР
ЭЛЕМЕНТА
ЧИСЛО
НЕЙТРОНОВ
(n0)
═
ЗАРЯД ЯДРА
(z+)
═
ЧИСЛО
ПРОТОНОВ
(р+)
МАССА − ЗАРЯД ЯДРА
═ АТОМНАЯ
(z )
(А )
r
+
═
ЧИСЛО
ЭЛЕКТРОНОВ (е-)
5.
Число энергетических уровней номер периода (1,2,3…для(слоев) всех)
Число е- на внешнем уровне номер группы (I,II,III…для Aгрупп)
Высшая СО элемента номер группы (I,II,III…для
многих)
Низшая СО элемента Nгруппы – 8 (для неМе)
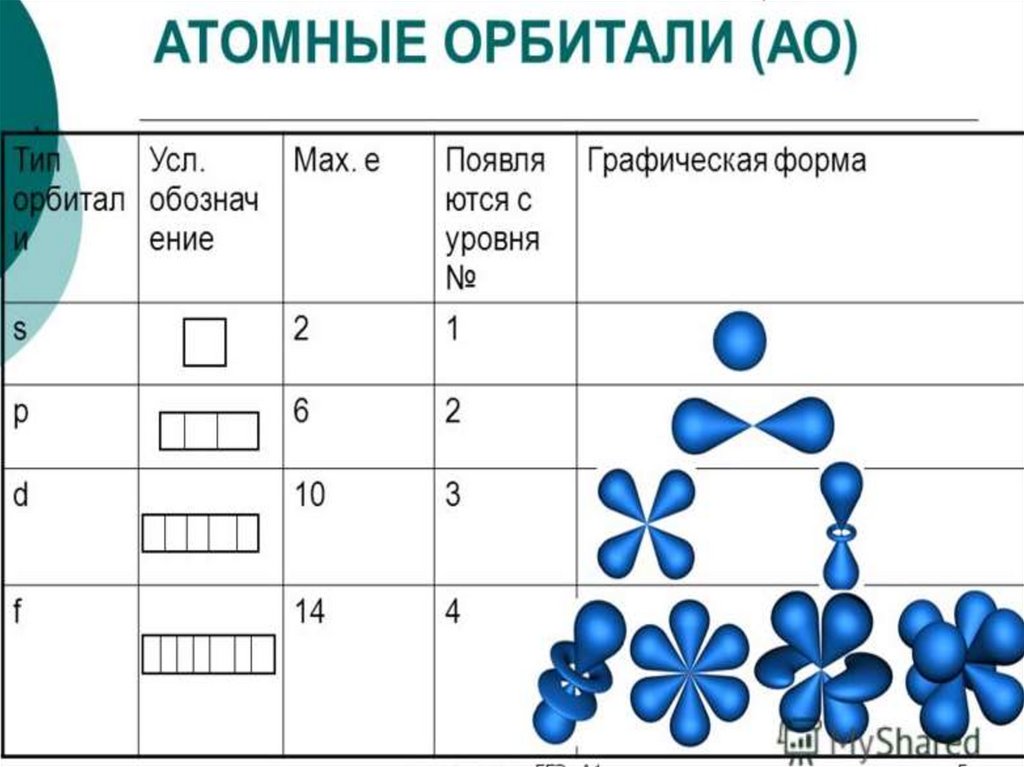
6. Правила заполнения электронных оболочек атомов
ПРАВИЛАЗАПОЛНЕНИЯ
ЭЛЕКТРОННЫХ
ОБОЛОЧЕК АТОМОВ
7.
8. 1. Принцип Паули
1. ПРИНЦИП ПАУЛИ• В АТОМЕ НЕ МОЖЕТ БЫТЬ ДВУХ И БОЛЕЕ ЭЛЕКТРОНОВ, У КОТОРЫХ
ВСЕ ЧЕТЫРЕ КВАНТОВЫХ ЧИСЛА БЫЛИ БЫ ОДИНАКОВЫМИ.
• ЗНАЧЕНИЯ ХОТЯ БЫ ОДНОГО ИЗ КВАНТОВЫХ ЧИСЕЛ У НИХ ДОЛЖНЫ
РАЗЛИЧАТЬСЯ. ИМЕННО ПОЭТОМУ НА ОДНОЙ ОРБИТАЛИ НЕ МОГУТ
НАХОДИТСЯ ДВА ЭЛЕКТРОНА С ОДИНАКОВЫМИ СПИНОВЫМИ
ЧИСЛАМИ:
9. 2. Правило Хунда
2. ПРАВИЛО ХУНДА• В ПРЕДЕЛАХ ОДНОГО ЭНЕРГЕТИЧЕСКОГО ПОДУРОВНЯ ЭЛЕКТРОНЫ
РАСПОЛАГАЮТСЯ ТАКИМ ОБРАЗОМ, ЧТОБЫ СУММА ИХ СПИНОВЫХ ЧИСЕЛ
БЫЛА МАКСИМАЛЬНОЙ.
• ЭТО ОЗНАЧАЕТ, ЧТО В ПЕРВУЮ ОЧЕРЕДЬ ЭЛЕКТРОНЫ ПО ОДНОМУ
РАСПОЛАГАЮТСЯ НА ВСЕХ СВОБОДНЫХ ОРБИТАЛЯХ ПОДУРОВНЯ, И ТОЛЬКО
ПОТОМ НАЧИНАЮТ ЗАНИМАТЬ ОРБИ- ТАЛИ, НА КОТОРЫХ УЖЕ ЕСТЬ ОДИН
ЭЛЕКТРОН. В СЛУЧАЕ, НАПРИМЕР, P-ПОДУРОВНЯ, ЭТО ВЫГЛЯДИТ ТАК:
10. 3. Правило Клечковского
3. ПРАВИЛО КЛЕЧКОВСКОГО• КАЖДЫЙ ЭЛЕКТРОН СТРЕМИТСЯ ЗАНЯТЬ ОРБИТАЛЬ С НАИМЕНЬШИМ
ЗНАЧЕНИЕМ ЭНЕРГИИ.
• КАК МЫ УЖЕ ЗНАЕМ, ЗА ЭНЕРГИЮ ЭЛЕКТРОНА В АТОМЕ ОТВЕЧАЮТ ДВА
КВАНТОВЫХ ЧИСЛА: ГЛАВНОЕ И ПОБОЧНОЕ. ПОЭТОМУ, В СООТВЕТСТВИИ С
ПРАВИЛОМ КЛЕЧКОВСКОГО, СНАЧАЛА ЭЛЕКТРОНЫ ЗАПОЛНЯЮТ ОРБИТАЛИ
ТОГО ПОДУРОВНЯ, ДЛЯ КОТОРОГО СУММА ЭТИХ КВАНТОВЫХ ЧИСЕЛ (N + L)
МЕНЬШЕ.
• ПРАВИЛО КЛЕЧКОВСКОГО ЧАСТО НАЗЫВАЮТ ТАКЖЕ ПРИНЦИПОМ
НАИМЕНЬШЕЙ ЭНЕРГИИ. НА ЕГО ОСНОВАНИИ НЕ СЛОЖНО И ПОЛНОСТЬЮ
ОПРЕДЕЛИТЬ ПОСЛЕДОВАТЕЛЬНОСТЬ, В КОТОРОЙ ПРОИСХОДИТ ЗАПОЛНЕНИЕ
ЭНЕРГЕТИЧЕСКИХ ПОДУРОВНЕЙ:
1s 2s 2s 2p 3s 3p 4s 3d 4p 5s 6s 4f 5d 6p 7s 5f 6d







 chemistry
chemistry








