Similar presentations:
Агрегатное состояние вещества: виды и фазовые переходы
1. Агрегатное состояние вещества: виды и фазовые переходы
2. План
• Агрегатные состояния веществ• Фазовые переходы
• Плавление вещества
• Кристаллизация вещества
• Парообразование
• Испарение
• Кипение
• Конденсация вещества
• Сублимация
• Жидкие кристаллы
3. Задания
1. Запишите тему в тетрадь.2. Изучите материал презентации.
3. Перенесите в тетрадь таблицу «Агрегатные состояния веществ»
(слайд 8) и заполните её.
4. Выпишите и выучите определения всех фазовых переходов.
5. Письменно ответьте на вопросы для самоконтроля.
Тетрадь нужно сдать на первой очной паре по химии.
4. Агрегатные состояния веществ
• Вещества могут находиться в трёх основныхагрегатных состояниях: твёрдом, жидком,
газообразном.
• Силы взаимодействия между частицами
(атомами, ионами или молекулами),
образующими вещество, обусловливают
характерные свойства веществ в разных
агрегатных состояниях.
5. Для твёрдых веществ
Для твёрдых веществ• характерно сильное притяжение между образующими их
частицами, вследствие чего они сохраняют объём и форму
(несжимаемы).
• Частицы в твёрдых веществах практически неподвижны и
находятся на малом расстоянии друг от друга.
• Твёрдые вещества могут быть в кристаллическом и аморфном
состоянии.
Для аморфных веществ, например стекла или смолы, характерно
неупорядоченное расположение частиц, отсутствие определённой
температуры плавления. Аморфные вещества при нагревании
размягчаются и плавятся в некотором температурном интервале.
Для
кристаллических
веществ
характерна
высокая
упорядоченность
внутренней
структуры.
Кристаллические
вещества, в отличие от аморфных, имеют строго определённую
температуру плавления.
6. Для жидкостей
Для жидкостей• характерно умеренное взаимодействие между
образующими их частицами.
• Силы притяжения между частицами меньше,
чем в твёрдых веществах, поэтому структура
жидкостей неупорядоченная, вследствие чего
жидкости не имеют собственной формы, но, в
отличие от газов, обладают собственным
объёмом.
• Жидкости текучи, практически не сжимаются
(сохраняют объём).
7. Для газов
Для газов• характерно
слабое
взаимодействие
между
молекулами.
• Расстояние между молекулами газа в несколько
десятков раз больше размеров молекул.
• Молекулы газов находятся в постоянном хаотичном
движении.
• Всё это обусловливает способность газов легко
сжиматься и расширяться.
• Газы не имеют собственной формы и собственного
объёма, их объём определяется объёмом сосуда, в
который они помещены.
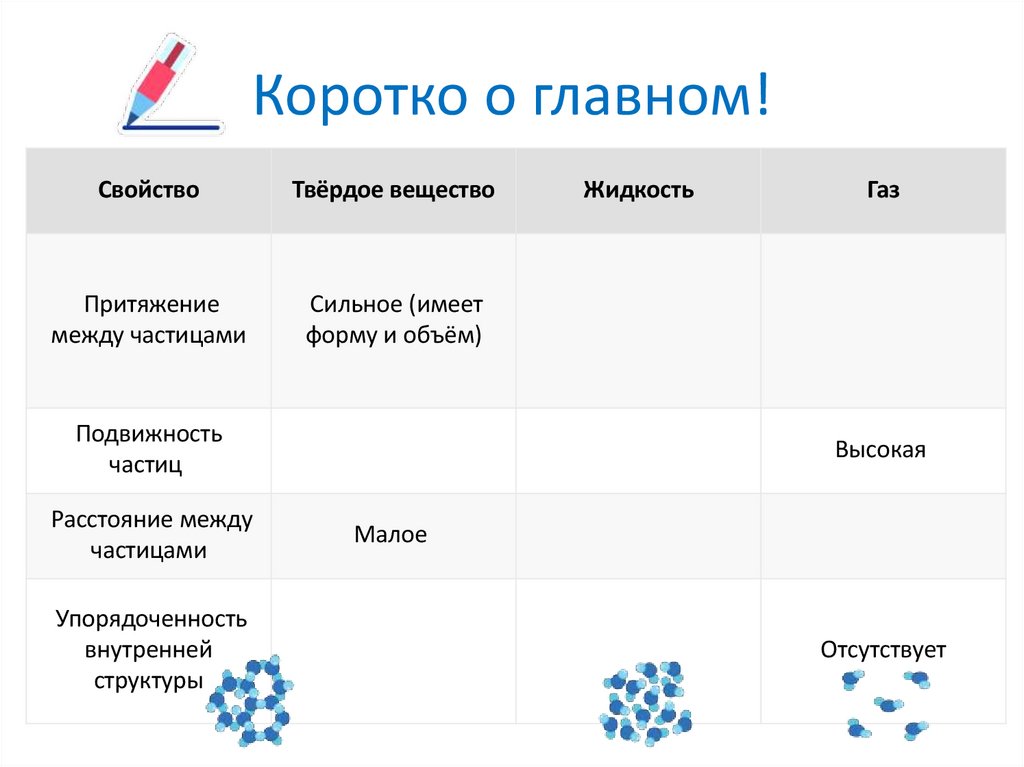
8. Коротко о главном!
СвойствоТвёрдое вещество
Притяжение
между частицами
Сильное (имеет
форму и объём)
Подвижность
частиц
Расстояние между
частицами
Упорядоченность
внутренней
структуры
Жидкость
Газ
Высокая
Малое
Отсутствует
9. Агрегатное состояние любого вещества зависит в первую очередь от температуры и давления
• При низком давлении и высокой температуревещество может перейти в газообразное
состояние, а при повышении давления и
понижении температуры — в жидкое.
Дальнейшее
понижение
температуры
способствует переходу вещества из жидкого
состояния в твёрдое.
• Таким образом, изменение температуры и
давления обусловливает фазовые переходы
вещества из одного агрегатного состояния в
другое.
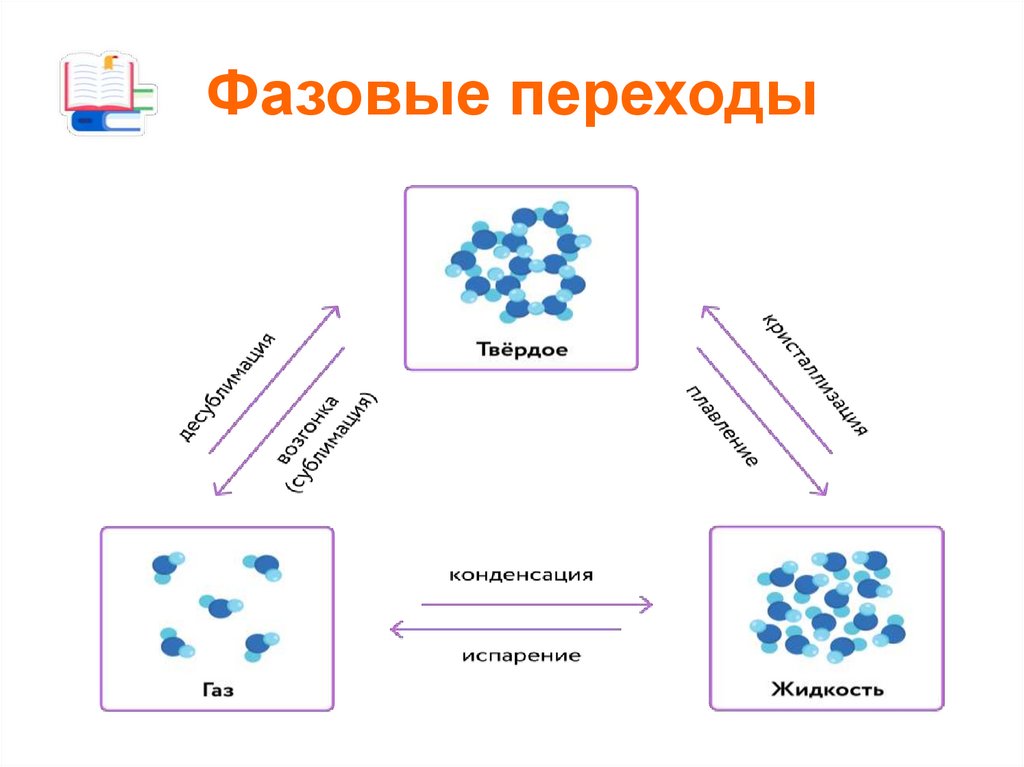
10. Фазовые переходы
11. Плавление вещества - переход вещества из твёрдого состояния в жидкое
• Плавление всегда сопровождается поглощением энергии, т. е. квеществу необходимо подводить теплоту. Внутренняя энергия
вещества при этом увеличивается.
• Плавление чистых кристаллических веществ происходит только при
определённой температуре, которая называется температурой
плавления. Каждое чистое вещество имеет свою температуру
плавления. Например, температура плавления льда составляет ,
свинца , железа . В процессе плавления температура вещества не
изменяется до тех пор, пока всё вещество не расплавится.
• Давление мало влияет на температуру плавления, так как при
плавлении
объём
вещества
изменяется
незначительно.
Температура плавления относится к важнейшим физическим
свойствам
вещества.
• При охлаждении жидкого вещества происходит его переход в
твёрдое состояние.
12. Кристаллизация (затвердевание) вещества - переход вещества из жидкого состояния в твёрдое
Кристаллизация (затвердевание) вещества переход вещества из жидкого состояния втвёрдое
• Кристаллизация
—
процесс,
обратный
плавлению.
• Кристаллизация
всегда
сопровождается
выделением энергии, при этом внутренняя
энергия вещества уменьшается.
• Кристаллизация чистого вещества происходит
при определённой температуре, совпадающей с
температурой
плавления.
В
процессе
кристаллизации
температура
вещества не изменяется до тех пор, пока всё
вещество не перейдёт в твёрдое состояние.
13. Парообразование - переход вещества из жидкого состояния в газообразное
Парообразование переход вещества из жидкого состояния вгазообразное
• Парообразование
всегда
сопровождается поглощением энергии,
при этом внутренняя энергия вещества
увеличивается.
• Различают два вида парообразования:
испарение и кипение.
14. Испарение - парообразование с поверхности жидкости, происходящее при любой температуре
Испарение парообразование с поверхности жидкости,происходящее при любой температуре
• Скорость испарения зависит от:
• природы жидкости;
• температуры;
• площади поверхности;
• наличия
или
отсутствия
движения
воздуха
(ветра)
над
поверхностью
испаряемой жидкости.
15. Кипение - парообразование по всему объёму жидкости, которое происходит только при определённой температуре, называемой
Кипение парообразование по всему объёму жидкости, котороепроисходит только при определённой температуре,
называемой температурой кипения.
• Каждое чистое вещество имеет свою определённую
температуру кипения. Например, у воды температура
кипения составляет , у этилового спирта , у
кислорода.
• В процессе кипения температура вещества не
изменяется до тех пор, пока всё вещество не
перейдёт в газообразное состояние.
• На температуру кипения, в отличие от температуры
плавления, влияет давление: с ростом давления
температура кипения увеличивается.
• При охлаждении газа происходит его переход в
жидкое состояние — конденсация.
16. Конденсация вещества переход вещества из газообразного состояния в жидкое
• Конденсация — процесс, обратный парообразованию.• Конденсация всегда сопровождается выделением энергии,
при этом внутренняя энергия вещества уменьшается.
• Конденсация чистого вещества происходит при определённой
температуре, совпадающей с температурой кипения.
• В процессе конденсации температура вещества не
изменяется до тех пор, пока всё вещество не перейдёт из
газообразного
состояния
в
жидкое.
• Вещества могут также переходить из твёрдого состоянии в
газообразное,
минуя
жидкое.
Такой
процесс
называется сублимацией или возгонкой, а обратный
процесс — десублимацией.
17. Сублимация - переход вещества из твёрдого состояния в газообразное, минуя жидкое
Сублимация переход вещества из твёрдого состояния вгазообразное, минуя жидкое
• Например, чёрные кристаллы йода превращаются
(сублимируют) в фиолетовые пары йода.
• Аналогично может испаряться лёд, на чём основана
сушка белья на морозе.
• При температуре легко возгоняется «сухой лёд» —
твёрдый углекислый газ, который используется для
охлаждения
пищевых
продуктов,
например
мороженого.
• С помощью метода сублимационной сушки при
пониженном давлении получают некоторые продукты
питания, например растворимый кофе.
18. Коротко о главном!
1)Вещества могут находиться в трёхагрегатных состояниях — твёрдом,
жидком, газообразном.
2)Переход из одного агрегатного
состояния в другое происходит при
изменении температуры и давления.
19. Вопросы для самоконтроля
1.Назовите вещество, которое существует вприроде одновременно в трёх агрегатных
состояниях.
2.Изменяются ли свойства вещества при его
переходе из одного агрегатного состояния
в другое? Поясните свой ответ на примере
воды.
3.Как вы считаете, является ли водный
раствор сахара его жидким агрегатным
состоянием? Поясните свой ответ.
20. Тепловые эффекты фазовых переходов
• Веществамогут
находиться
в
различных
агрегатных
состояниях:
твёрдом, жидком, газообразном.
• Молекулярные
силы
в
разных
агрегатных состояниях различны: в
твёрдом состоянии они наибольшие, в
газообразном — наименьшие.


















 physics
physics








