Similar presentations:
Углерод и кремний. Их соединения
1.
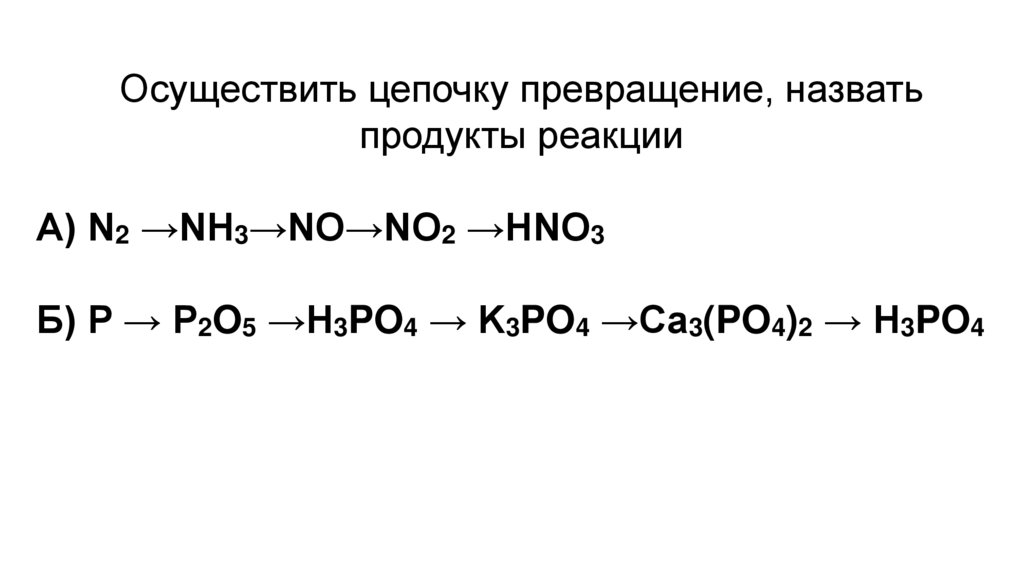
Осуществить цепочку превращение, назватьпродукты реакции
А) N2 →NH3→NO→NO2 →HNO3
Б) P → P2O5 →H3PO4 → K3PO4 →Ca3(PO4)2 → H3PO4
2.
Углерод и кремнийИх соединения
3.
Химические свойства углеродаПри обычных условиях углерод
химически инертен; при нагревании
его активность увеличивается. Самой
активной формой является аморфный
углерод, менее активен графит, самый
инертный — алмаз.
Как восстановитель
1. Взаимодействие с неметаллами:
кислородом, галогенами, серой
4.
2. Взаимодействие соксидами металлов
5.
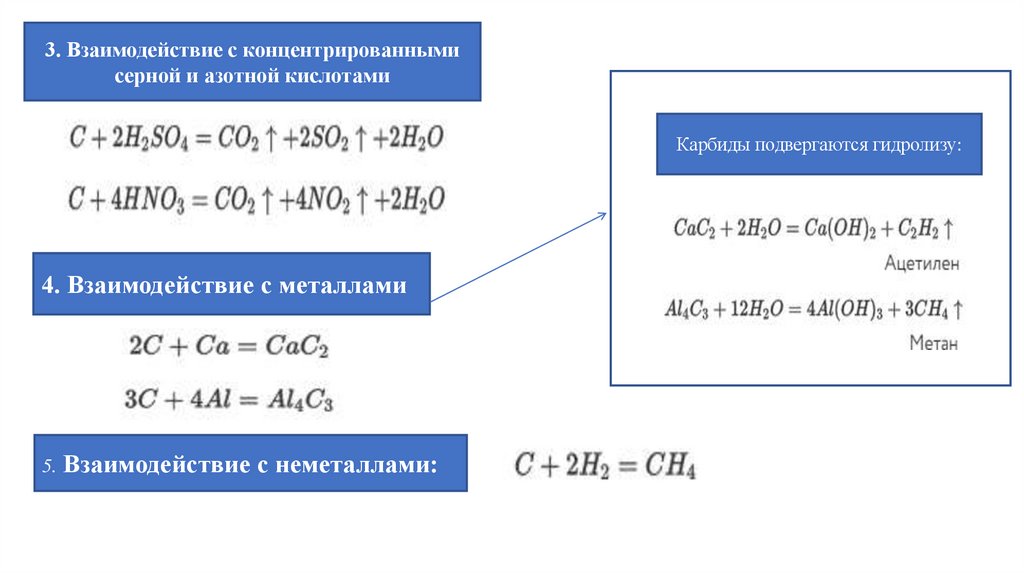
3. Взаимодействие с концентрированнымисерной и азотной кислотами
Карбиды подвергаются гидролизу:
4. Взаимодействие с металлами
5. Взаимодействие с неметаллами:
6.
Химические свойства кремнияВ химическом отношении кремний
малоактивен. В реакциях он может
проявлять как окислительные, так
и восстановительные свойства, но
восстановительные выражены у
него сильнее.
Как восстановитель
Взаимодействие с неметаллами
7.
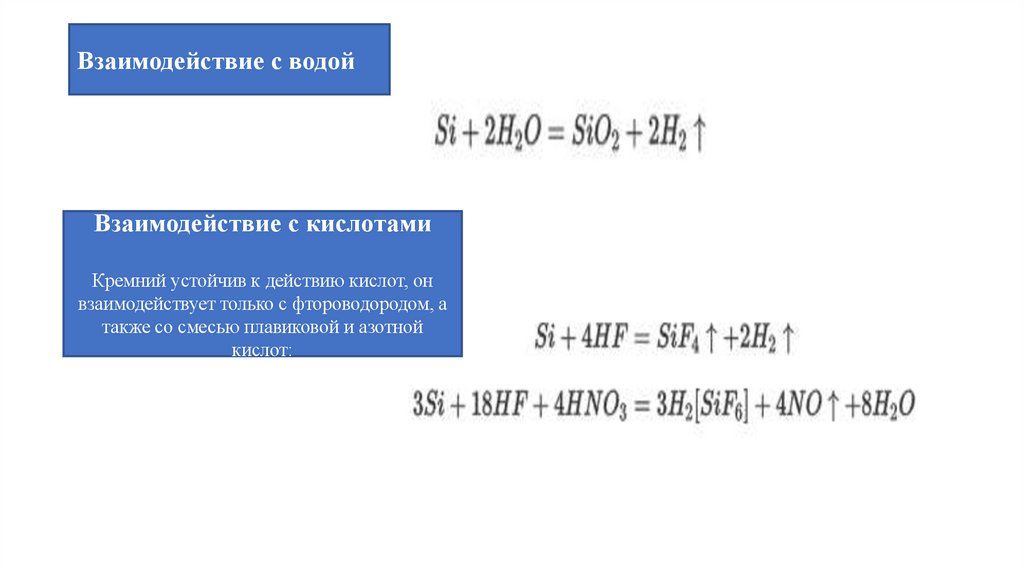
Взаимодействие с водойВзаимодействие с кислотами
Кремний устойчив к действию кислот, он
взаимодействует только с фтороводородом, а
также со смесью плавиковой и азотной
кислот:
8.
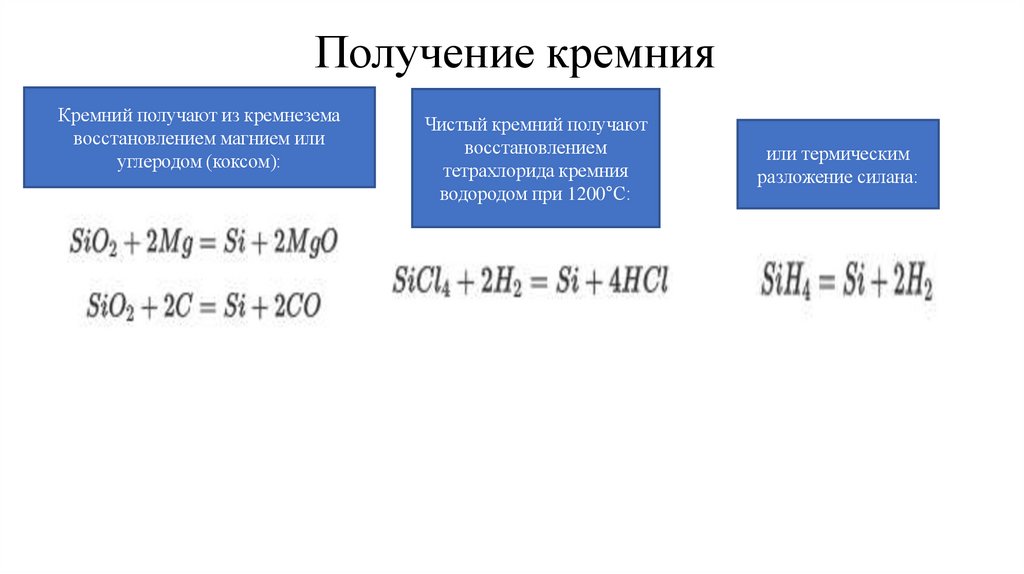
Получение кремнияКремний получают из кремнезема
восстановлением магнием или
углеродом (коксом):
Чистый кремний получают
восстановлением
тетрахлорида кремния
водородом при 1200°С:
или термическим
разложение силана:
9.
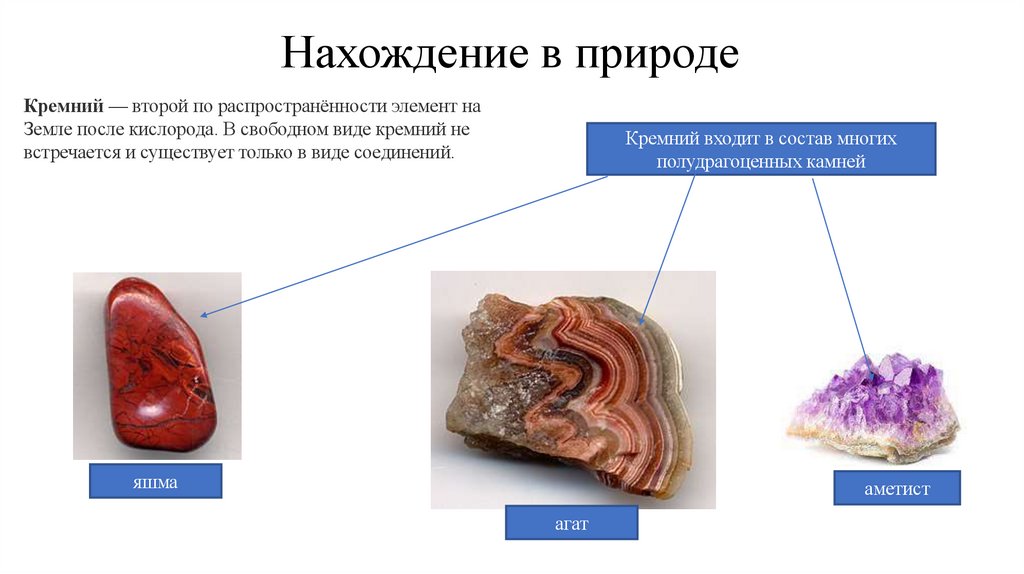
Нахождение в природеКремний — второй по распространённости элемент на
Земле после кислорода. В свободном виде кремний не
встречается и существует только в виде соединений.
Кремний входит в состав многих
полудрагоценных камней
яшма
аметист
агат
10.
И в породообразующих минералов — силикатов иалюмосиликатов
глина
слюда
11.
Кислородсодержащиесоединения углерода и
кремния
12.
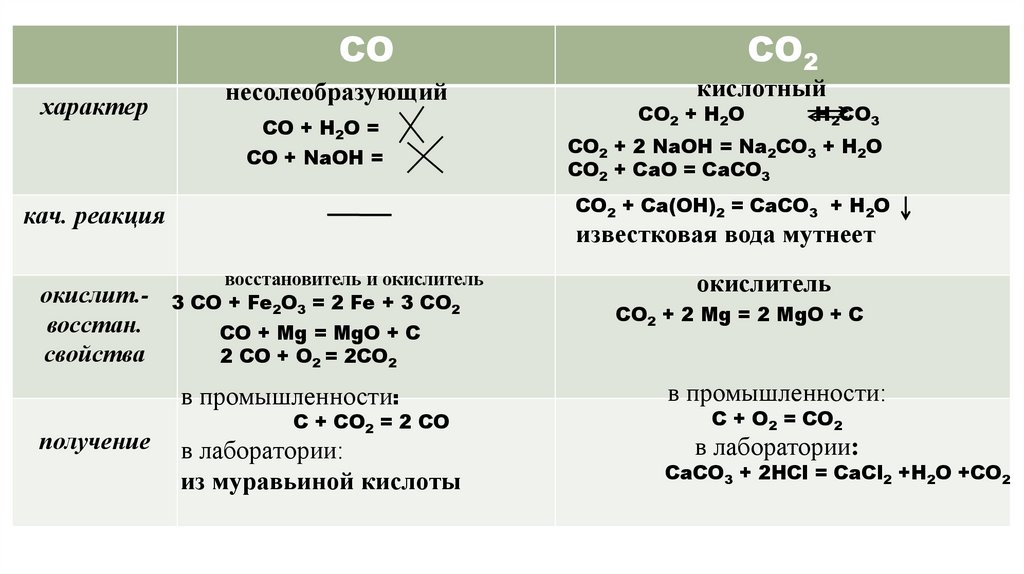
СОхарактер
несолеобразующий
СО + Н2О =
СО + NaОH =
СО2 + Н2О
H2CO3
СО2 + 2 NaОН = Na2CO3 + H2O
СО2 + СаО = СаСО3
известковая вода мутнеет
восстановитель и окислитель
3 CO + Fe2O3 = 2 Fe + 3 CO2
CO + Mg = MgO + C
2 CO + О2 = 2СО2
в промышленности:
получение
кислотный
СО2 + Са(ОН)2 = СаСО3 + Н2О
кач. реакция
окислит.восстан.
свойства
СО2
С + СО2 = 2 СО
в лаборатории:
из муравьиной кислоты
окислитель
CO2 + 2 Mg = 2 MgO + C
в промышленности:
С + О2 = СО2
в лаборатории:
СаСО3 + 2НСl = CaCl2 +H2O +CO2
13.
Физиологическое действиеУгарный газ
чрезвычайно ядовит, так
образует с
гемоглобином крови
гораздо более прочную
связь, чем кислород.
14.
Применение15.
Угольная кислота и ее соли16.
Угольная кислотаH2CO3 – очень слабая и неустойчивая кислота,
разлагается при кипячении.
Получение:
1) растворением СО2 в воде
СО2 + Н2О <=> H2CO3
2) из солей под действием сильных кислот
Nа2СО3 + 2НСl = Н2СО3 + 2NaСl
17.
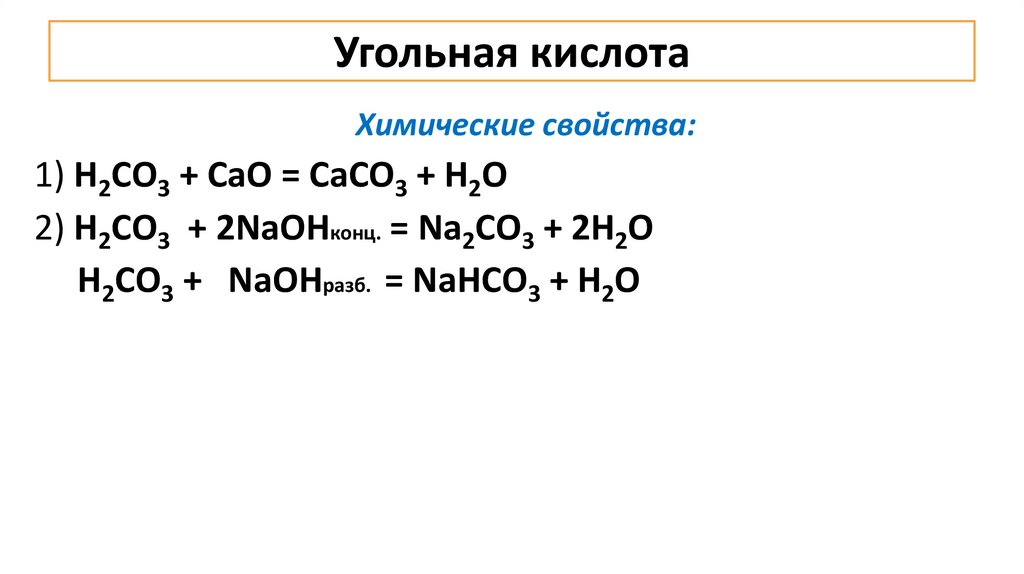
Угольная кислотаХимические свойства:
1) Н2СО3 + СаО = СаСО3 + Н2О
2) Н2СО3 + 2NаОНконц. = Nа2СО3 + 2Н2О
Н2СО3 + NаОНразб. = NаНСО3 + Н2О
18.
Соли угольной кислотыСоли: средние – карбонаты Nа2СО3, СаСО3 и
кислые – гидрокарбонаты NаНСО3, Са(НСО3)2
1) разлагаются при нагревании: СаСО3 = СаО + СО2
2 КНСО3 = К2СО3 + Н2О + СО2
2) При пропускании углекислого газа через раствор карбоната:
К2СО3 + Н2О + СО2 = 2 КНСО3
3) Взаимодействуют с кислотами: К2СО3 + 2 НСl = 2 КСl + Н2О + СО2
4) Взаимодействуют с другими солями (Качественная реакция на карбонат-ион)
К2СО3 + СаСl2 = 2КСl + СаСО3 белый осадок
19.
Карбонаты и гидрокарбонаты легко превращаютсядруг в друга
CaCO3 + CO2 + H2O = Ca(HCO3)2
Ca(HCO3)2 = CaCO3 + CO2 + H2O
При этом в природе образуются
причудливые сталактиты и
сталагмиты.
20.
Соли угольной кислотыГидрокарбонат натрия – NaHCO3 , питьевая, или
пищевая сода
Добавляется в кондитерские изделия, чтобы они были рыхлыми и
пышными, и используется в медицине для полоскания горла, для
снижения кислотности желудочного сока
Карбонат натрия - Na2CO3 – стиральная, или
кальцинированная
Применяется в производстве стекла, бумаги, мыла и даже в качестве
моющего средства.
21.
Химические свойства SiO21) Кислотный оксид
А) со щелочами: SiO2 + 2NaOH Na2SiO3 + H2O
Б) с основными оксидами: SiO2 + CaO CaSiO3
2) C солями: SiO2 + CaCO3 CaSiO3 + CO2
22.
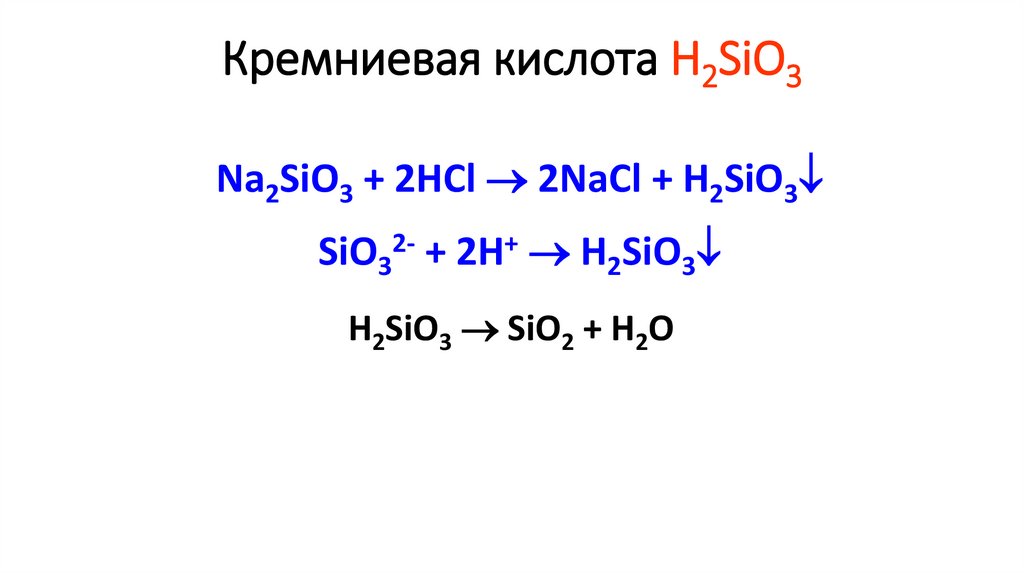
Кремниевая кислота H2SiO3Na2SiO3 + 2HCl 2NaCl + H2SiO3
SiO32- + 2H+ H2SiO3
H2SiO3 SiO2 + H2O
23.
Соли кремниевой кислоты - силикатыСиликаты широко распространены в природе, из них
главным образом состоит земная кора. Силикаты входят
в состав горных пород.
А также силикатами являются
многие драгоценные камни
Аквамарин
Гранит
Базальт
Изумруд
24.
Стекло также представляет собойсиликат.
Состав оконного стекла условно
выражают формулой
Стекло получают при сплавлении в
специальных печах смеси соды,
известняка и кремнезёма:
Для получения специального стекла в него
вводят различные добавки.















 chemistry
chemistry








