Similar presentations:
ВПР. Химия. 8 класс. Образец
1.
КодВПР. Химия. 8 класс. Образец
Проверочная работа
по ХИМИИ
8 КЛАСС
Образец
Пояснение к образцу проверочной работы
На выполнение проверочной работы по химии отводится два урока (не более 45 минут
каждый). Работа состоит из двух частей и включает в себя 9 заданий.
Обе части работы могут выполняться в один день с перерывом не менее 10 минут или
в разные дни.
При выполнении работы разрешается использовать следующие дополнительные
материалы:
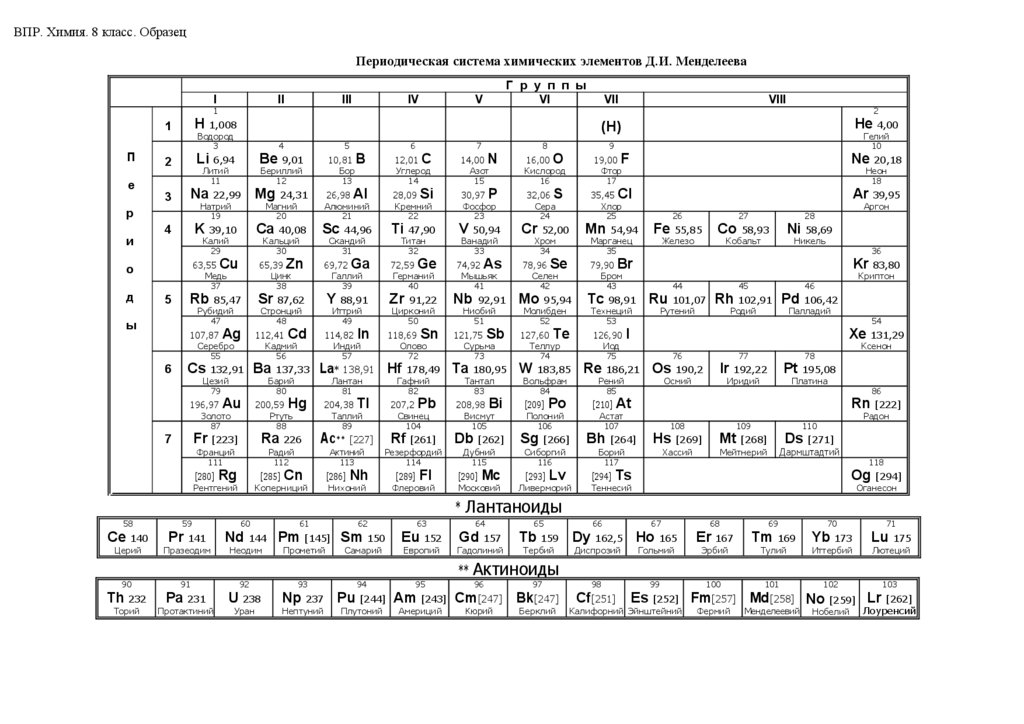
– Периодическая система химических элементов Д.И. Менделеева;
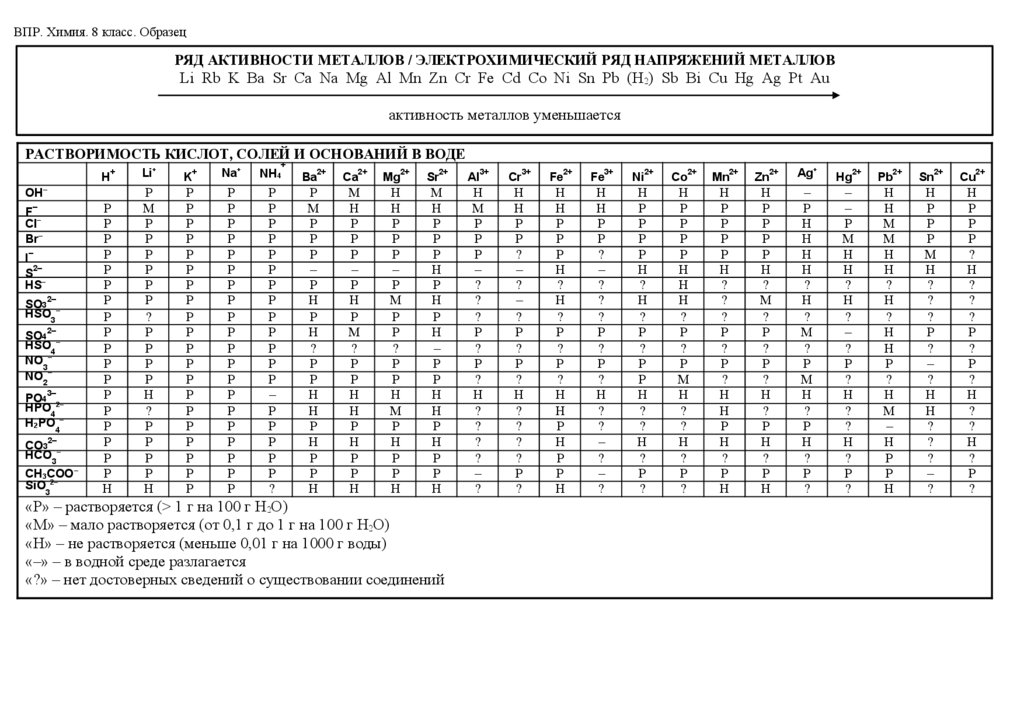
– таблица растворимости кислот, солей и оснований в воде;
– ряд активности металлов / электрохимический ряд напряжений металлов;
– непрограммируемый калькулятор.
При необходимости можно пользоваться черновиком. Записи в черновике
проверяться и оцениваться не будут.
В образце представлено по несколько примеров заданий 2 и 6.5. В реальных вариантах
проверочной работы на каждую из этих позиций будет предложено только одно задание.
Таблица для внесения баллов участника*
Часть 1
Номер
задания
1.1
1.2
2.1
2.2
3.1
3.2
4.1
4.2
4.3
4.4
5.1
5.2
Баллы
Часть 2
Номер
задания
6.1
6.2
6.3
6.4
6.5
7.1
7.2
7.3(1) 7.3(2)
8
9
Сумма
баллов
Отметка
за
Баллы
* Обратите внимание: в случае, если какие-либо задания не могли быть выполнены целым классом по
причинам, связанным с особенностями организации учебного процесса, в форме сбора результатов ВПР всем
обучающимся класса за данные задания вместо баллов выставляется значение «Тема не пройдена». В
соответствующие ячейки таблицы заполняется н/п.
© 2025 Федеральная служба по надзору в сфере образования и науки
2.
ВПР. Химия. 8 класс. ОбразецПериодическая система химических элементов Д.И. Менделеева
I
II
1
е
4
2
Li 6,94
3
Na 22,99 Mg 24,31
Бериллий
12
Натрий
19
4
Магний
20
ы
VII
6
7
10,81 B
12,01 C
14,00 N
26,98 Al
28,09 Si
30,97 P
Бор
13
Углерод
14
Алюминий
21
Кремний
22
8
VIII
2
He 4,00
16,00 O
19,00 F
Ne 20,18
32,06 S
35,45 Cl
Ar 39,95
Азот
15
Кислород
16
Фосфор
23
Сера
24
Фтор
17
Хлор
25
Sc 44,96
Ti 47,90
V 50,94
Cr 52,00
Mn 54,94
63,55 Cu
65,39 Zn
69,72 Ga
72,59 Ge
74,92 As
78,96 Se
79,90 Br
Кальций
30
Скандий
31
Цинк
38
Титан
32
Галлий
39
Германий
40
Ванадий
33
Мышьяк
41
Гелий
10
9
Ca 40,08
Калий
29
Хром
34
Марганец
35
Селен
42
Неон
18
26
Fe 55,85
Железо
27
Аргон
28
Co 58,93
Ni 58,69
Кобальт
Никель
36
Kr 83,80
Бром
43
Криптон
44
45
46
Рутений
Родий
Палладий
Rb 85,47
Sr 87,62
Y 88,91
Zr 91,22
Nb 92,91 Mo 95,94
Tc 98,91 Ru 101,07 Rh 102,91 Pd 106,42
107,87 Ag
112,41 Cd
114,82 In
118,69 Sn
121,75 Sb
126,90 I
Рубидий
47
Серебро
55
6
Г р у п п ы
VI
K 39,10
Медь
37
5
5
Be 9,01
Литий
11
о
д
V
(H)
Водород
3
р
и
IV
H 1,008
1
П
III
Стронций
48
Иттрий
49
Кадмий
56
Цирконий
50
Индий
57
Олово
72
Ниобий
51
Сурьма
73
Молибден
52
127,60 Te
Теллур
74
Технеций
53
Иод
75
76
Cs 132,91 Ba 137,33 La* 138,91 Hf 178,49 Ta 180,95 W 183,85 Re 186,21 Os 190,2
Цезий
79
196,97 Au
Золото
87
7
Барий
80
Лантан
81
200,59 Hg
Ртуть
88
Гафний
82
204,38 Tl
207,2 Pb
Таллий
89
Свинец
104
Тантал
83
Вольфрам
84
Висмут
105
Полоний
106
208,98 Bi
Рений
85
[209] Po
Осмий
77
Ir 192,22
108
109
Ra 226
Ac** [227]
Rf [261]
Db [262]
Sg [266]
Bh [264]
Hs [269]
Mt [268]
Радий
112
Актиний
113
Резерфордий
114
Дубний
115
Сиборгий
116
Борий
117
Хассий
Мейтнерий
Нихоний
Флеровий
Московий
Ливерморий
Рентгений
Коперниций
[286] Nh
[289] Fl
[290] Mc
[293] Lv
Платина
86
Rn [222]
Франций
111
[285] Cn
Pt 195,08
Иридий
Fr [223]
[280] Rg
Ксенон
78
[210] At
Астат
107
54
Xe 131,29
Радон
110
Ds [271]
Дармштадтий
[294] Ts
118
Og [294]
Теннесий
Оганесон
* Лантаноиды
58
59
Ce 140
Pr 141
Церий
Празеодим
90
Th 232
60
61
62
Nd 144 Pm [145] Sm 150
Неодим
Прометий
Самарий
91
92
93
94
Pa 231
U 238
63
64
Eu 152
Gd 157
Европий
Гадолиний
65
66
67
Tb 159 Dy 162,5 Ho 165
Тербий
Диспрозий
Гольмий
98
99
68
69
70
71
Er 167
Tm 169
Yb 173
Lu 175
100
101
102
103
Эрбий
Тулий
Иттербий
Лютеций
** Актиноиды
Торий
Протактиний
Уран
95
96
97
Np 237 Pu [244] Am [243] Cm[247] Bk[247]
Нептуний
Плутоний
Америций
Кюрий
Берклий
Cf[251] Es [252] Fm[257] Md[258] No [259] Lr [262]
Калифорний Эйнштейний
Фермий
Менделеевий
Нобелий
Лоуренсий
3.
ВПР. Химия. 8 класс. ОбразецРЯД АКТИВНОСТИ МЕТАЛЛОВ / ЭЛЕКТРОХИМИЧЕСКИЙ РЯД НАПРЯЖЕНИЙ МЕТАЛЛОВ
Li Rb K Ba Sr Ca Na Mg Al Mn Zn Cr Fe Cd Co Ni Sn Pb (H2) Sb Bi Cu Hg Ag Pt Au
активность металлов уменьшается
РАСТВОРИМОСТЬ КИСЛОТ, СОЛЕЙ И ОСНОВАНИЙ В ВОДЕ
+
Li+
K
+
Na+
NH4
Ba
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Н
Р
М
Р
Р
Р
Р
Р
Р
?
Р
Р
Р
Р
Н
?
Р
Р
Р
Р
Н
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
Р
–
Р
Р
Р
Р
Р
?
Р
М
Р
Р
Р
–
Р
Н
Р
Н
?
Р
P
Н
H
P
Н
P
Р
Н
OH–
–
F
Cl–
Br–
–
I
2–
S
HS–
2–
SO3 –
HSO3
2–
SO4 –
HSO4
NO3–
NO2–
3–
PO4 2–
HPO4
H2PO4–
2–
CO3 –
HCO3
CH3COO–
SiO32–
+
H
2+
Ca
2+
М
Н
Р
Р
Р
–
Р
Н
Р
М
?
Р
P
Н
H
P
Н
P
Р
Н
Mg
2+
Н
Н
Р
Р
Р
–
Р
М
Р
Р
?
Р
P
Н
M
P
Н
P
Р
Н
Sr
2+
Al
3+
Cr
Fe
Fe
Ni
М
Н
Р
Р
Р
Н
Р
Н
Р
Н
–
P
P
H
H
P
H
P
P
H
Н
М
Р
Р
Р
–
?
?
?
Р
?
Р
?
Н
?
?
?
?
–
?
Н
Н
Р
Р
?
–
?
–
?
Р
?
Р
?
Н
?
?
?
?
Р
?
Н
Н
Р
Р
Р
Н
?
Н
?
Р
?
Р
?
Н
H
P
Н
P
Р
Н
Н
Н
Р
Р
?
–
?
?
?
Р
?
Р
?
Н
?
?
–
?
–
?
Н
Р
Р
Р
Р
Н
?
Н
?
Р
?
Р
P
Н
?
?
H
?
Р
?
«Р» – растворяется (> 1 г на 100 г H2O)
«М» – мало растворяется (от 0,1 г до 1 г на 100 г H2O)
«Н» – не растворяется (меньше 0,01 г на 1000 г воды)
«–» – в водной среде разлагается
«?» – нет достоверных сведений о существовании соединений
3+
2+
3+
2+
Co
2+
Н
Р
Р
Р
Р
Н
Н
Н
?
Р
?
P
M
H
?
?
H
?
P
?
Mn
2+
Н
Р
Р
Р
Р
Н
?
?
?
Р
?
Р
?
Н
H
P
Н
?
Р
Н
Zn
Ag+
Hg
Н
Р
Р
Р
Р
Н
?
М
?
Р
?
Р
?
Н
?
P
Н
?
Р
Н
–
Р
Н
Н
Н
Н
?
Н
?
М
?
Р
M
Н
?
P
Н
?
Р
?
–
–
Р
М
Н
Н
?
Н
?
–
?
Р
?
Н
?
?
Н
?
Р
?
2+
2+
Pb
2+
Н
Н
М
М
Н
Н
?
Н
?
Н
Н
Р
?
Н
M
–
Н
P
Р
Н
Sn
2+
Н
Р
Р
Р
М
Н
?
?
?
Р
?
–
?
Н
Н
?
?
?
–
?
Cu
2+
Н
Р
Р
Р
?
Н
?
?
?
Р
?
Р
?
Н
?
?
Н
?
Р
?
4.
КодВПР. Химия. 8 класс. Образец
Инструкция по выполнению заданий части 1 проверочной работы
На выполнение заданий части 1 проверочной работы по химии отводится один урок
(не более 45 минут). Часть 1 включает в себя 5 заданий.
При выполнении работы разрешается использовать следующие дополнительные
материалы:
– Периодическая система химических элементов Д.И. Менделеева;
– таблица растворимости кислот, солей и оснований в воде;
– ряд активности металлов / электрохимический ряд напряжений металлов;
– непрограммируемый калькулятор.
Ответы на задания запишите в поля ответов в тексте работы. В случае записи
неверного ответа зачеркните его и запишите рядом новый.
При необходимости можно пользоваться черновиком. Записи в черновике
проверяться и оцениваться не будут.
Советуем выполнять задания в том порядке, в котором они даны. В целях экономии
времени пропускайте задание, которое не удаётся выполнить сразу, и переходите
к следующему. Если после выполнения работы у Вас останется время, то Вы сможете
вернуться к пропущенным заданиям.
Желаем успеха!
© 2025 Федеральная служба по надзору в сфере образования и науки
5.
КодВПР. Химия. 8 класс. Образец
Часть 1
1
1.1. Внимательно рассмотрите предложенные рисунки. Укажите номер рисунка, на котором
изображён объект, содержащий только одно (индивидуальное) химическое вещество.
Рис. 1
Рис. 2
Рис. 3
Индивидуальное химическое вещество
содержится в объекте, изображённом на рисунке:
1.2. Какие вещества содержатся в объектах, изображённых на остальных рисунках?
Приведите по ОДНОМУ примеру.
Для каждого вещества укажите его химическое название и формулу.
2
Рис. 1:
(название)
(формула).
Рис. 2:
(название)
(формула).
Рис. 3:
(название)
(формула).
Превращение одних веществ в другие называется химической реакцией.
2.1. Из представленных ниже рисунков выберите тот, на котором изображено протекание
химической реакции.
Рис. 1
Рис. 2
Рис. 3
Протекание химической реакции изображено на рисунке:
Обоснуйте свой выбор:
2.2. Укажите один ЛЮБОЙ признак протекания этой химической реакции:
© 2025 Федеральная служба по надзору в сфере образования и науки
6.
КодВПР. Химия. 8 класс. Образец
ИЛИ
2
Превращение одних веществ в другие называется химической реакцией.
2.1. Укажите, какой из приведённых ниже процессов является химической реакцией.
1) распространение аромата цветов в комнате
2) движение маятника в механических часах
3) образование накипи в чайнике при кипячении водопроводной воды
Напишите номер выбранного процесса:
Обоснуйте свой выбор:
2.2. Укажите один ЛЮБОЙ признак протекания этой химической реакции:
3
В таблице приведены названия и химические формулы некоторых газообразных веществ.
№
п/п
Название вещества
Формула
1
Кислород
О2
2
Метан
СН4
3
Сернистый газ
SО2
Молярная масса,
г/моль
3.1. Используя предложенные Вам справочные материалы, вычислите молярные массы
каждого из газов и запишите полученные данные в таблицу.
3.2. Каким из приведённых в таблице газов следует наполнить шарик с практически
невесомой оболочкой, чтобы он оказался легче воздуха и смог взлететь? (Средняя молярная
масса воздуха равна 29 г/моль.). Укажите номер вещества.
Ответ:
Обоснуйте свой выбор:
© 2025 Федеральная служба по надзору в сфере образования и науки
7.
КодВПР. Химия. 8 класс. Образец
4
Даны два химических элемента: А и В. Известно, что в атоме элемента А содержится
12 протонов, а в атоме элемента В – 16 электронов.
4.1. Используя Периодическую систему химических элементов Д.И. Менделеева, определите
химические элементы А и В.
4.2. Укажите номер периода и номер группы в Периодической системе химических
элементов Д.И. Менделеева, в которых расположен каждый элемент.
4.3. Установите, металлом или неметаллом являются простые вещества, образованные этими
химическими элементами.
4.4. Составьте формулы высших оксидов, которые образуют элементы А и В.
Ответы запишите в таблицу.
Элемент
Название
химического
элемента
Номер
периода
Металл
или
неметалл
группы
Формула
высшего
оксида
А
В
5
Восьмиклассник Никита выпил после обеда один стакан (200 г) яблочного сока.
5.1. Используя данные приведённой ниже таблицы, определите, какую массу углеводов
получил при этом организм юноши. Ответ подтвердите расчётом.
Содержание углеводов в некоторых соках
Сок
Лимонный
Яблочный
Апельсиновый
Гранатовый
Сливовый
Массовая доля
углеводов, %
2,5
9,1
12,8
14,5
16,1
Решение:
Ответ:
.
5.2. Какую долю суточной физиологической нормы углеводов (360 г) получил Никита, выпив
стакан яблочного сока? Ответ подтвердите расчётом.
Решение:
Ответ:
.
© 2025 Федеральная служба по надзору в сфере образования и науки
8.
КодВПР. Химия. 8 класс. Образец
Инструкция по выполнению заданий части 2 проверочной работы
На выполнение заданий части 2 проверочной работы по химии отводится один урок
(не более 45 минут). Часть 2 включает в себя 4 задания.
При выполнении работы разрешается использовать следующие дополнительные
материалы:
– Периодическая система химических элементов Д.И. Менделеева;
– таблица растворимости кислот, солей и оснований в воде;
– ряд активности металлов / электрохимический ряд напряжений металлов;
– непрограммируемый калькулятор.
Ответы на задания запишите в поля ответов в тексте работы. В случае записи
неверного ответа зачеркните его и запишите рядом новый.
При необходимости можно пользоваться черновиком. Записи в черновике
проверяться и оцениваться не будут.
Советуем выполнять задания в том порядке, в котором они даны. В целях экономии
времени пропускайте задание, которое не удаётся выполнить сразу, и переходите
к следующему. Если после выполнения работы у Вас останется время, то Вы сможете
вернуться к пропущенным заданиям.
Желаем успеха!
© 2025 Федеральная служба по надзору в сфере образования и науки
9.
КодВПР. Химия. 8 класс. Образец
Часть 2
6
Имеется следующий перечень химических веществ: калий, хлор, алюминий, водород, хлорид
калия, серная кислота, сульфат алюминия. Используя этот перечень, выполните
задания 6.1–6.5.
6.1. Напишите химические формулы каждого из указанных веществ:
Калий –
Хлор –
Хлорид калия –
Алюминий –
Серная кислота –
Сульфат алюминия –
Водород –
6.2. Какое из веществ, упоминаемых в перечне, соответствует следующему описанию:
«Ядовитый газ жёлто-зелёного цвета, тяжелее воздуха, с резким запахом»?
Ответ:
.
6.3. Из данного перечня выберите ЛЮБОЕ СЛОЖНОЕ вещество. Запишите его химическую
формулу и укажите, к какому классу неорганических соединений оно относится:
Вещество –
.
Класс соединений –
.
6.4. Из приведённого перечня веществ выберите ЛЮБОЕ соединение, состоящее из атомов
ТРЁХ элементов. Вычислите массовую долю кислорода в этом соединении.
Вещество –
.
Решение:
Ответ:
.
6.5. Вычислите массу 0,5 моль газообразного водорода.
Решение:
Ответ:
.
ИЛИ
6.5. Вычислите, сколько молекул содержится в 0,5 моль газообразного водорода.
Решение:
Ответ:
.
© 2025 Федеральная служба по надзору в сфере образования и науки
10.
КодВПР. Химия. 8 класс. Образец
7
Ниже даны словесные описания двух химических превращений с участием веществ, перечень
которых был приведён в задании 6:
(1) калий + хлор → хлорид калия;
(2) алюминий + серная кислота (разб.) → сульфат алюминия + водород.
7.1. Составьте уравнения указанных реакций, используя химические формулы веществ из п. 6.1:
(1)
(2)
7.2. В зависимости от количества и состава веществ, вступающих в химическую реакцию
и образующихся в результате неё, различают реакции соединения, разложения, замещения
и обмена. Выберите ЛЮБУЮ из реакций (1) или (2) и укажите её тип. Объясните свой ответ.
Реакция:
Тип –
.
Объясните свой ответ:
7.3. Из приборов, изображённых на рисунках, выберите тот, с помощью которого можно
получить и собрать газообразный водород по реакции (2).
Рис. 1
Рис. 2
Водород можно получить и собрать с помощью прибора, изображённого на рисунке:
Каким методом – вытеснения воды или вытеснения воздуха – получают водород в этом
приборе?
Ответ: методом вытеснения
.
Почему невозможно получить и собрать водород, используя прибор, изображённый
на другом рисунке?
Объяснение:
© 2025 Федеральная служба по надзору в сфере образования и науки
11.
КодВПР. Химия. 8 класс. Образец
8
Установите соответствие между названием химического вещества и областью его применения.
К каждому элементу первого столбца подберите соответствующий элемент из второго
столбца.
ВЕЩЕСТВО
А) серная кислота
Б) хлорид калия
В) алюминий
Г) водород
1)
2)
3)
4)
5)
ПРИМЕНЕНИЕ
в авиации в составе лёгких сплавов
в автомобильных аккумуляторах
в качестве удобрения
средство для мытья посуды
топливо в ракетных
двигателях Запишите в таблицу выбранные цифры под соответствующими
буквами.
А
Б
В
Г
Ответ:
9
Из приведённого списка выберите верные суждения о правилах поведения в химической
лаборатории и обращения с химическими веществами. В ответе запишите цифры, под
которыми они указаны.
1) В химическом кабинете разрешается пробовать вещества на вкус.
2) Для получения разбавленных растворов серной кислоты концентрированную кислоту
осторожно приливают к дистиллированной воде.
3) Если на лабораторном столе случайно загорелась тетрадка, то, чтобы потушить пламя,
необходимо ограничить доступ воздуха к очагу возгорания, например накрыв тетрадь
плотной тканью (полотенцем или тряпкой).
4) Если нет шпателя (ложечки), твёрдые реактивы можно брать руками.
Ответ:
.
© 2025 Федеральная служба по надзору в сфере образования и науки
12.
ВПР. Химия. 8 класс. ОбразецКод
© 2025 Федеральная служба по надзору в сфере образования и науки










 chemistry
chemistry








