Similar presentations:
Алканы. Общая формула
1. АЛКАНЫ
2.
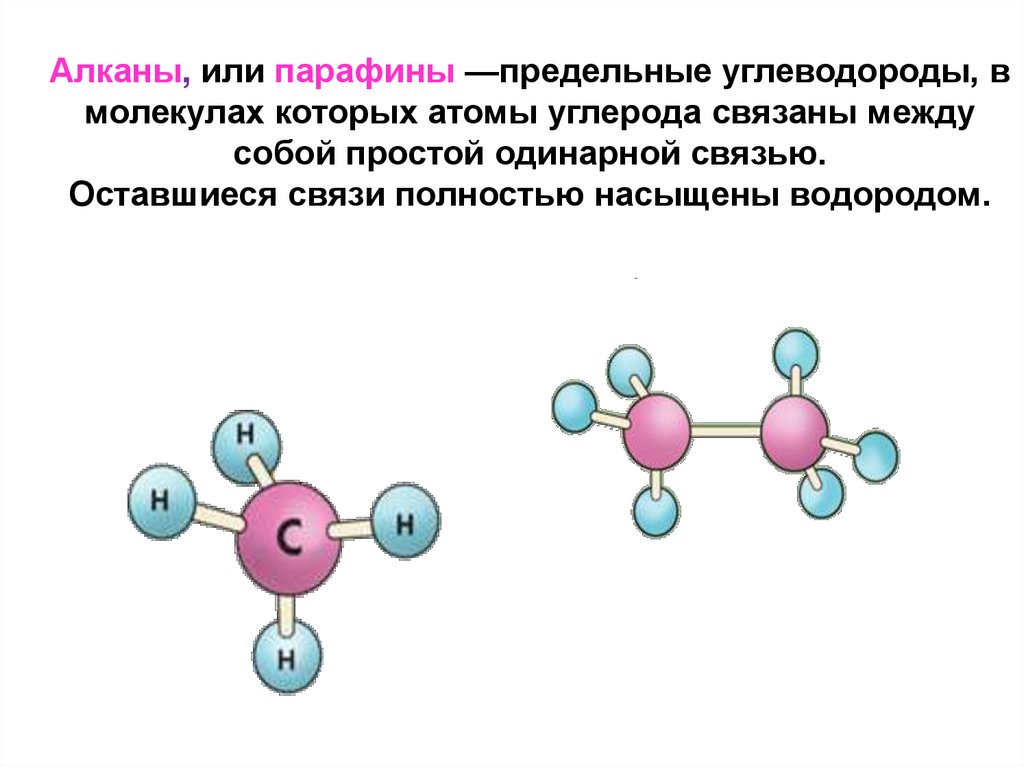
Алканы, или парафины —предельные углеводороды, вмолекулах которых атомы углерода связаны между
собой простой одинарной связью.
Оставшиеся связи полностью насыщены водородом.
3.
Общая формулаСnH2n+2 , где n=1,2,3…
4. Нахождение в природе
НАХОЖДЕНИЕ В ПРИРОДЕОсновными природными источниками алканов
являются нефть и природный газ. Основной
компонент природного газа — метан
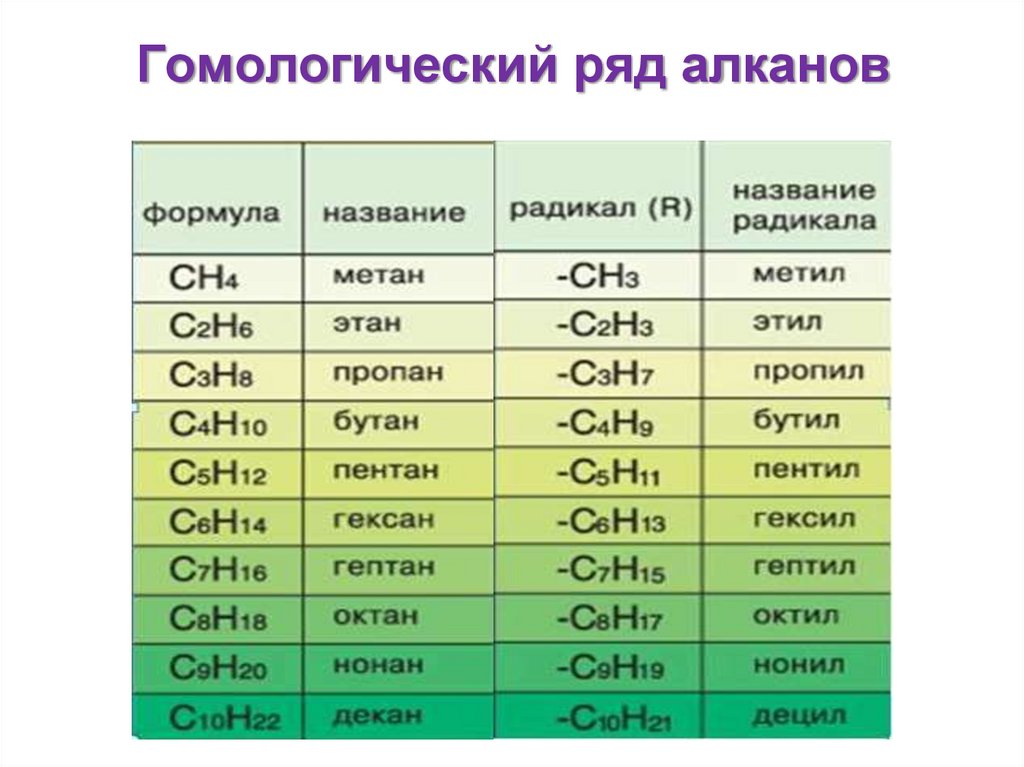
5. Гомологический ряд алканов
6.
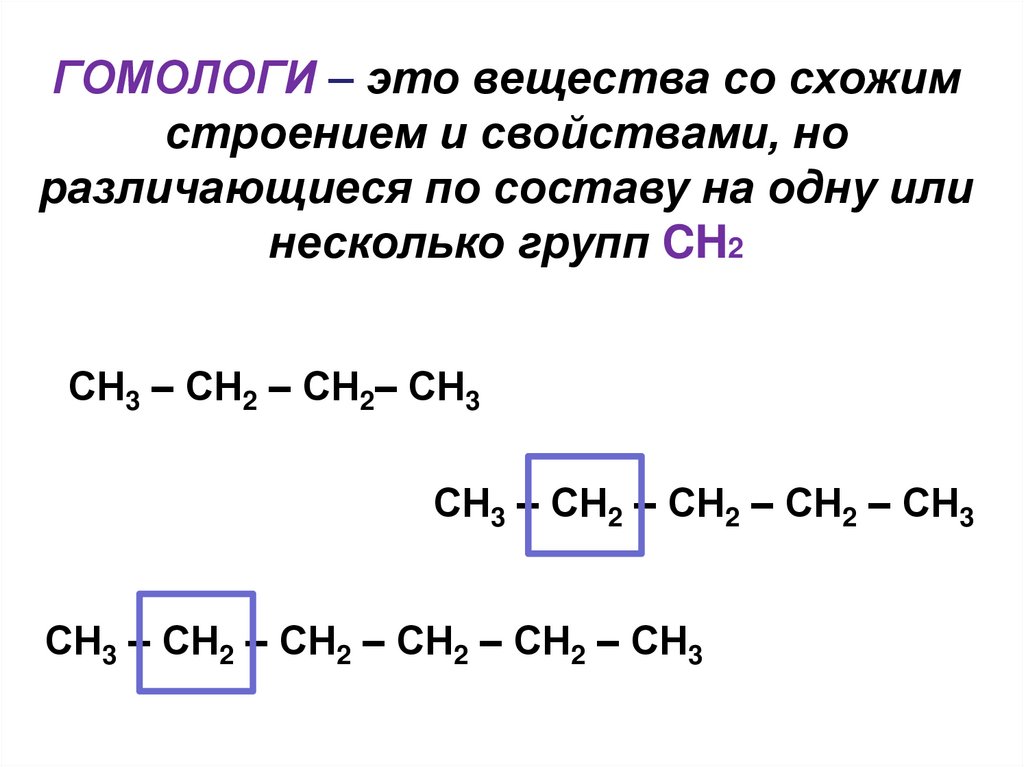
ГОМОЛОГИ – это вещества со схожимстроением и свойствами, но
различающиеся по составу на одну или
несколько групп CH2
СН3 – СН2 – СН2– СН3
СН3 – СН2 – СН2 – СН2 – СН3
СН3 – СН2 – СН2 – СН2 – СН2 – СН3
7.
ИЗОМЕРЫ – вещества, имеющиеодинаковый состав молекул, но различное
химическое строение и обладающие
поэтому разными свойствами.
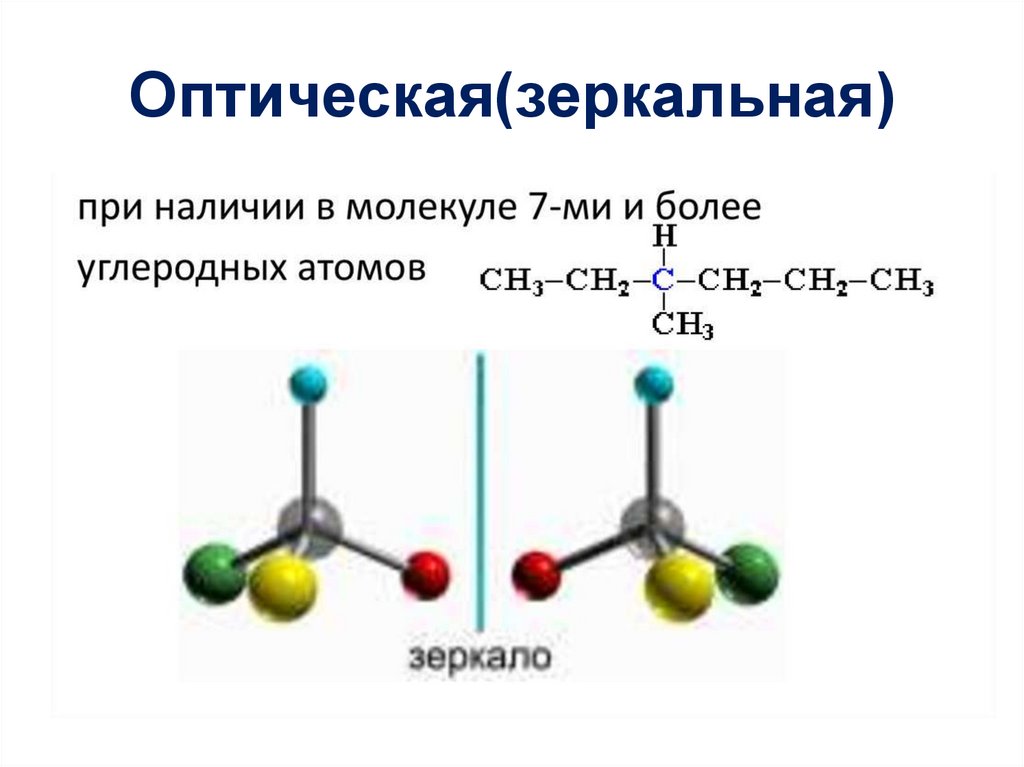
Виды изомерии алканов:
структурная(изомерия углеродного скелета)
поворотная
оптическая(зеркальная)
8.
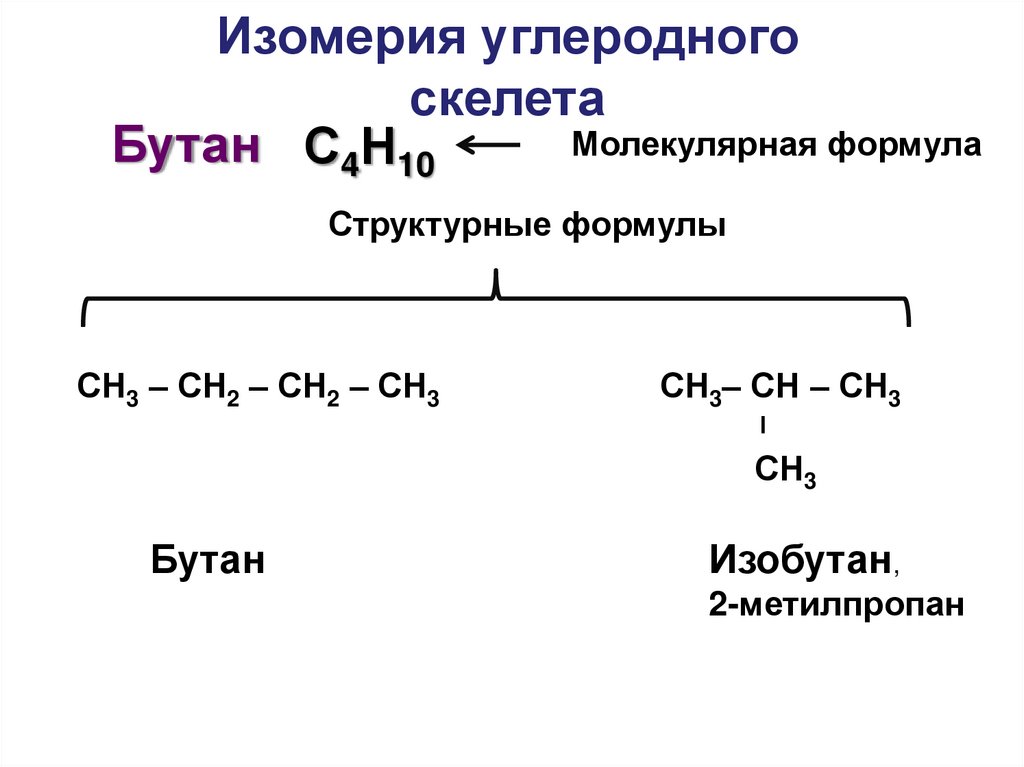
Изомерия углеродногоскелета
Молекулярная формула
Бутан С4Н10
Структурные формулы
СН3 – СН2 – СН2 – СН3
СН3– СН – СН3
СН3
Бутан
Изобутан,
2-метилпропан
9. Оптическая(зеркальная)
10. НОМЕНКЛАТУРА АЛКАНОВ
Алгоритм:1. Выбор главной, самой длинной цепи:
CH3 – CH - CH2 - CH3
│
CH3
11. Номенклатура алканов
НОМЕНКЛАТУРА АЛКАНОВПо номенклатуре ИЮПАК названия
предельных углеводородов
характеризуются суффиксом –ан.
2. Нумерация атомов главной цепи:
1
2
3
4
CH3 – CH - CH2 - CH3
│
CH3
12. Номенклатура алканов
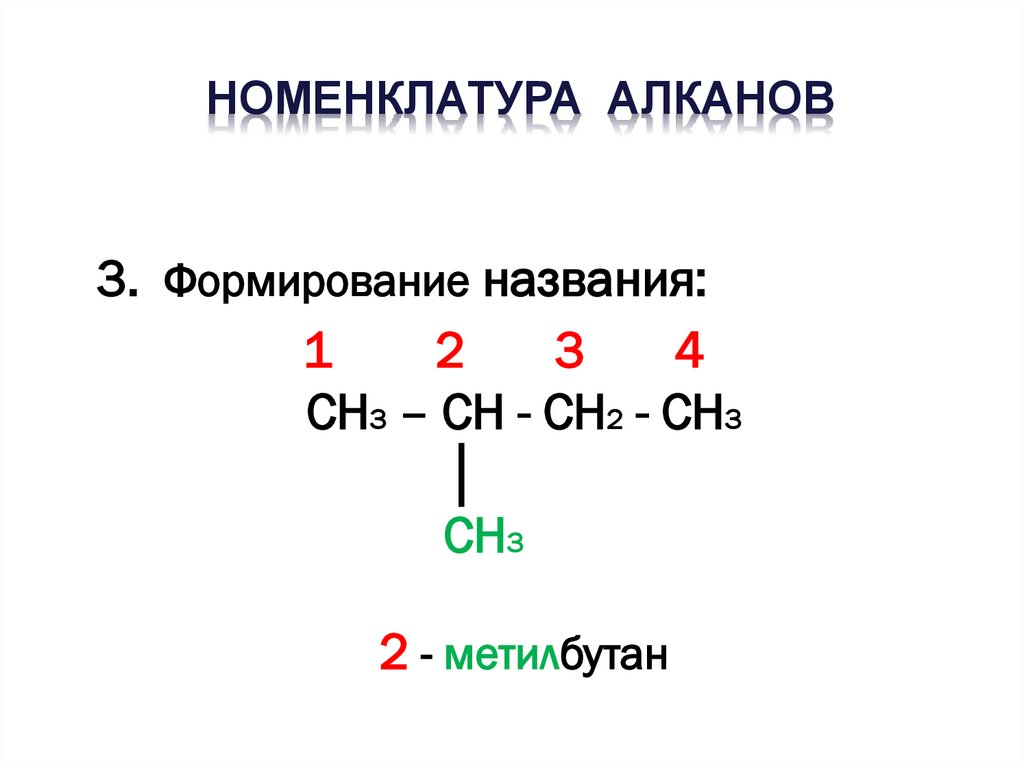
НОМЕНКЛАТУРА АЛКАНОВ3. Формирование названия:
1
2
3
4
CH3 – CH - CH2 - CH3
│
CH3
2 - метилбутан
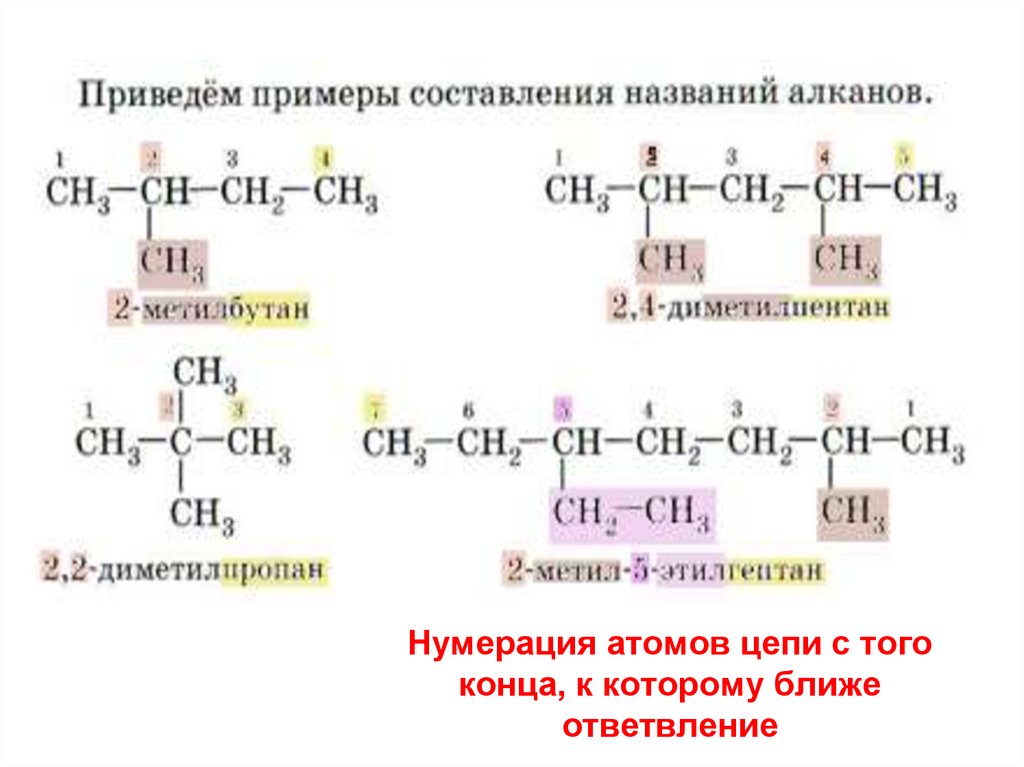
13. Нумерация атомов цепи с того конца, к которому ближе ответвление
14.
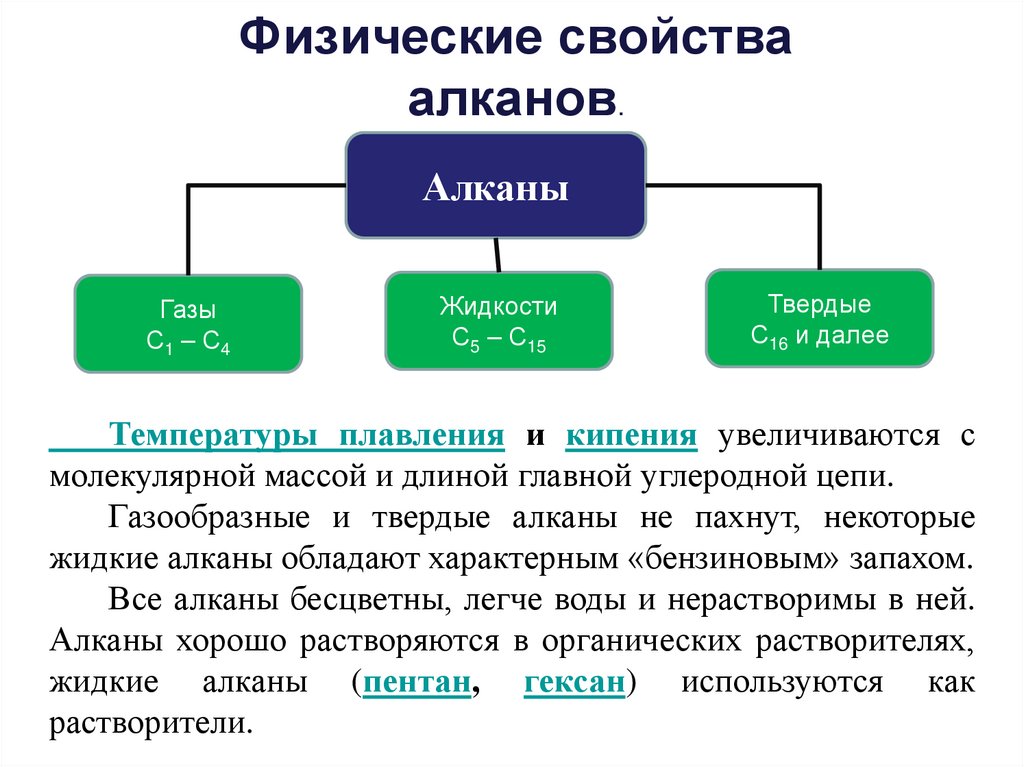
Физические свойстваалканов.
Алканы
Газы
С1 – С4
Жидкости
С5 – С15
Твердые
С16 и далее
Температуры плавления и кипения увеличиваются с
молекулярной массой и длиной главной углеродной цепи.
Газообразные и твердые алканы не пахнут, некоторые
жидкие алканы обладают характерным «бензиновым» запахом.
Все алканы бесцветны, легче воды и нерастворимы в ней.
Алканы хорошо растворяются в органических растворителях,
жидкие алканы (пентан, гексан) используются как
растворители.
15. 1. Реакции замещения
а) с галогенами (с Cl2 – на свету, с Br2 – при нагревании).Хлорирование метана
16. 2. Реакции окисления
а) горение: алканы горят с образованием воды ивыделением углекислого газа
CH4 + 2O2 → CO2 + 2H2O
C3H8 + 5O2 → 3CO2 + 4H2O
б) неполное окисление: горение алканов в недостатке
кислорода приводит к продуктам неполного окисления
2C3H8 + 7O2 → 6CO + 8H2O
CH4 + O2 → C + 2H2O
17. 3. Термические превращения алканов
а) дегидрирование(отщепление водорода) в присутствиикатализатора при высоких температурах:
Pt,t°
CH3 – CH3
CH2=CH2 + H2
этилен
Пиролиз - промышленный способ получения ацетилена.
18.
в) крекинг - это реакция разложения алкана с длиннойуглеродной цепью на алканы и алкены с более короткой
углеродной цепью.
19.
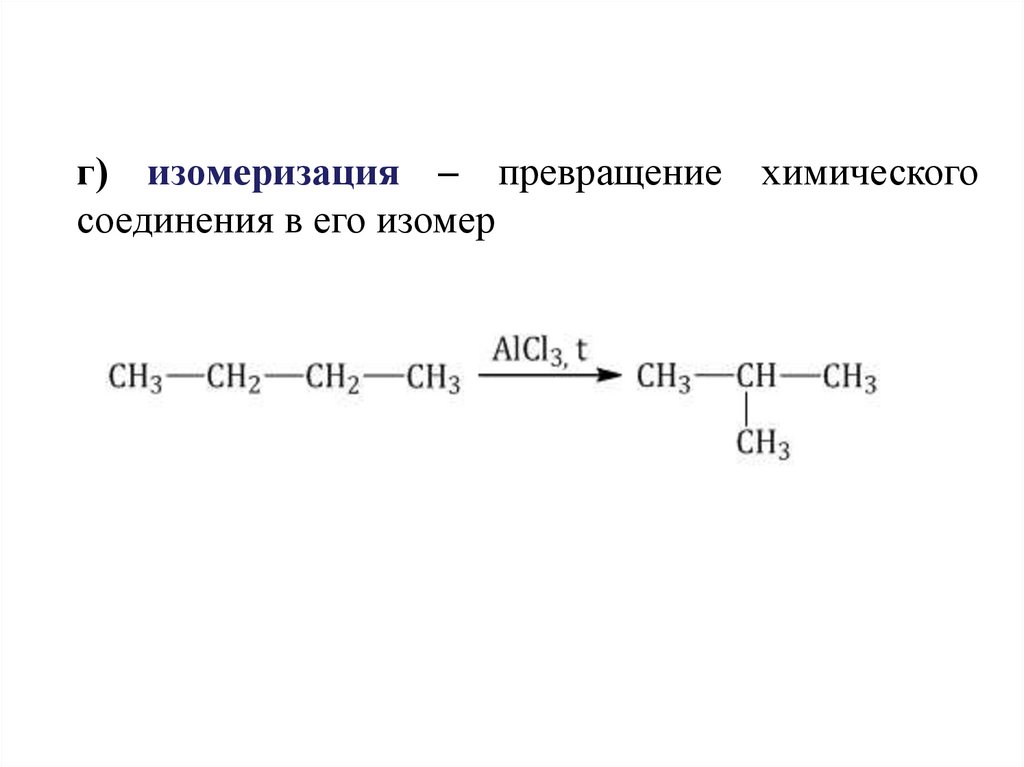
г) изомеризация – превращение химическогосоединения в его изомер
20. Способы получения
21.
• Значение алканов в современном мире огромно.• В нефтехимической промышленности предельные улеводороды являются
базой для получения разнообразных органических соединений, важным
сырьем в процессах получения полупродуктов для производства пластмасс,
каучуков, синтетических волокон, моющих средств и многих других веществ.
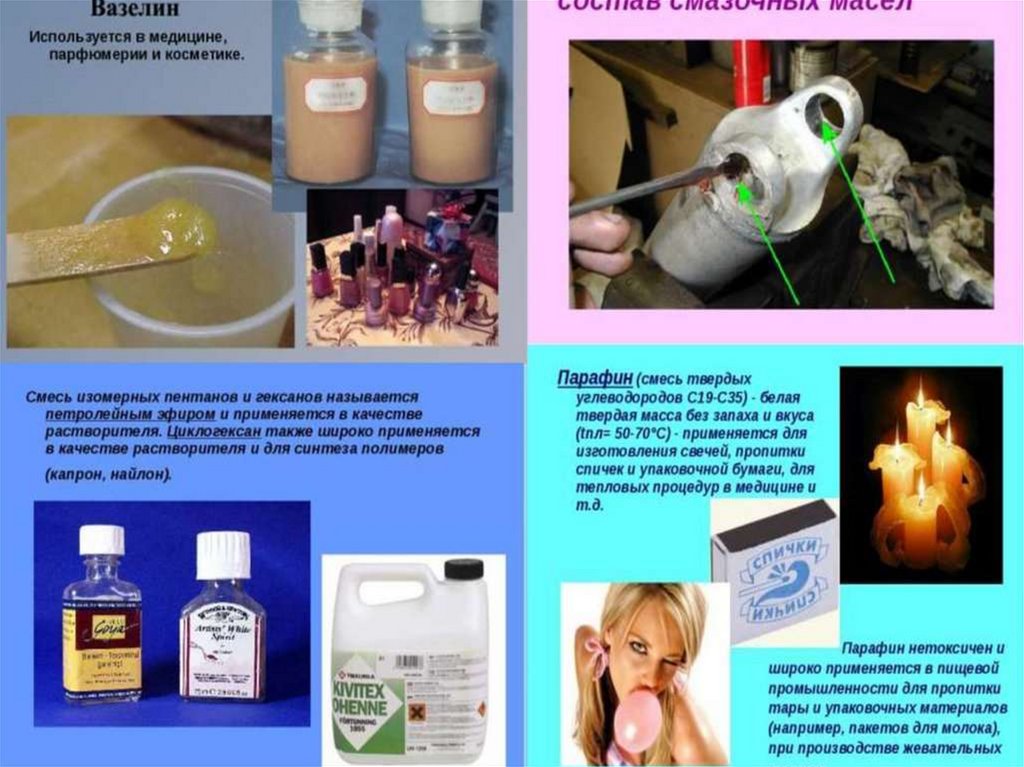
• Велико значение в медицине, парфюмерии и косметике.
22. Применение
23.
24.
25.
• Метан используется для производствашин и краски.
26.
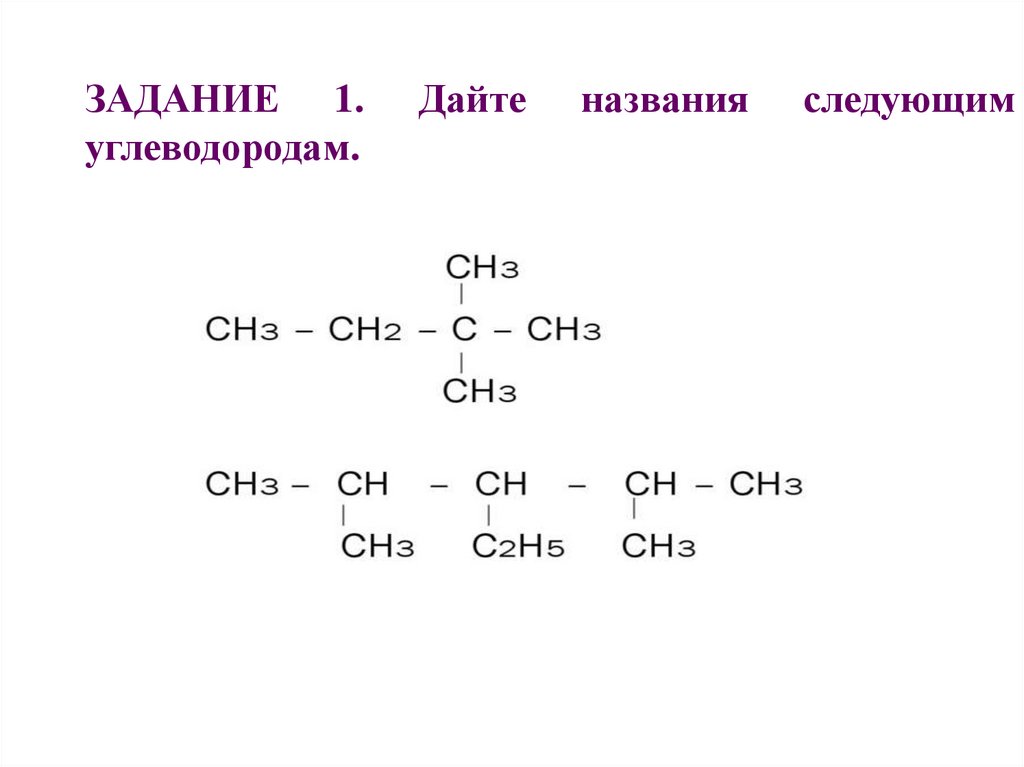
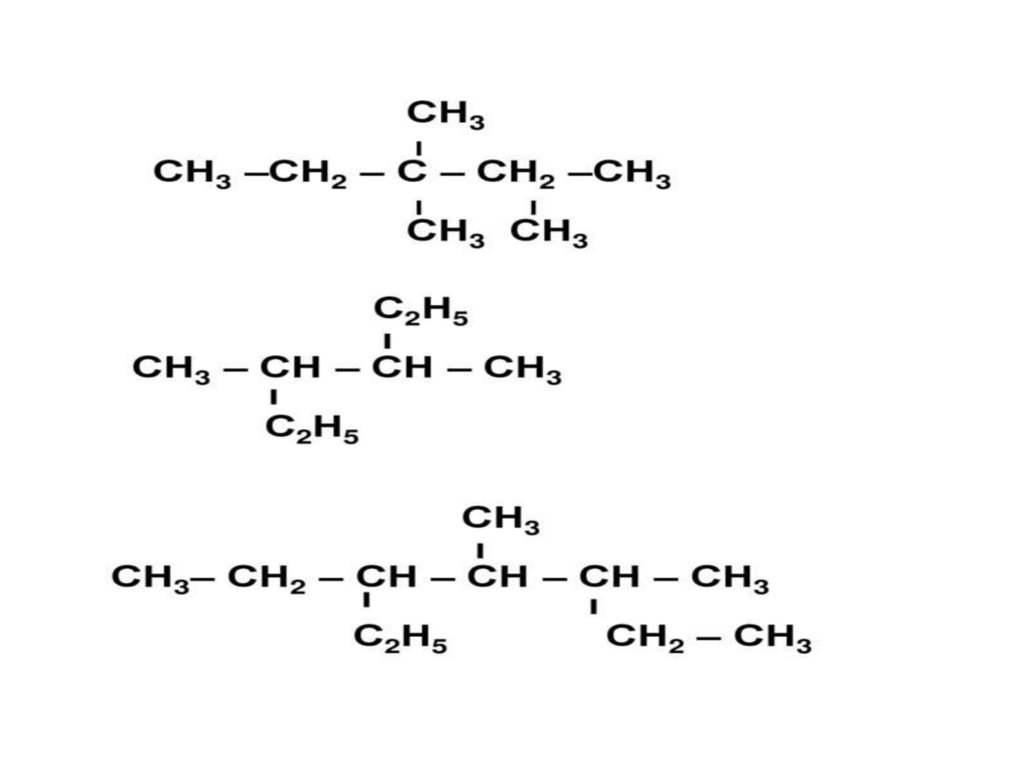
ЗАДАНИЕ 1.углеводородам.
Дайте
названия
следующим
















 chemistry
chemistry








