Similar presentations:
Сокращение и релаксация мышц
1. Сокращение и релаксация мышц
Самостоятельная работа:Самостоятельная работа:
1.
Состав и свойства основных соединений,
участвующих в механизме мышечного сокращения
2.
Последовательность этапов сокращения мышц
Дополнительная литература:
Рогожин, В.В. Биохимия мышц и мяса / В.В.Рогожин. – СПб:
ГИОРД. – 2006. – С. 130-136.
2. Учим наизусть
• Миофибриллы –нити, которые состоят изчередующихся темных и светлых участков
(дисков), создаваемых структурными
элементами миофибрилл – саркомерами.
• Диски разных миофибрилл расположены в
строгом порядке (темные – против темных,
светлые – против светлых), что в целом
придает волокну поперечную исчерченность.
• Часть миофибриллы между двумя
соседними мембранами или полосками Z в
светлых дисках принято называть
саркомером или мышечным сегментом.
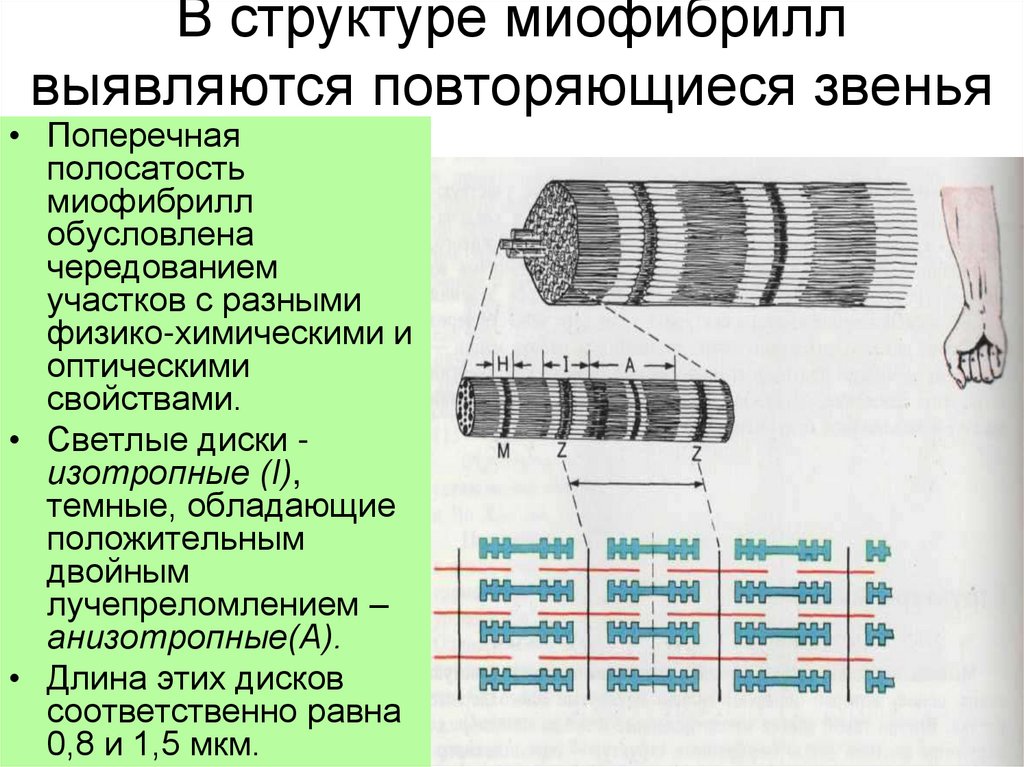
3. В структуре миофибрилл выявляются повторяющиеся звенья
• Поперечнаяполосатость
миофибрилл
обусловлена
чередованием
участков с разными
физико-химическими и
оптическими
свойствами.
• Светлые диски изотропные (I),
темные, обладающие
положительным
двойным
лучепреломлением –
анизотропные(А).
• Длина этих дисков
соответственно равна
0,8 и 1,5 мкм.
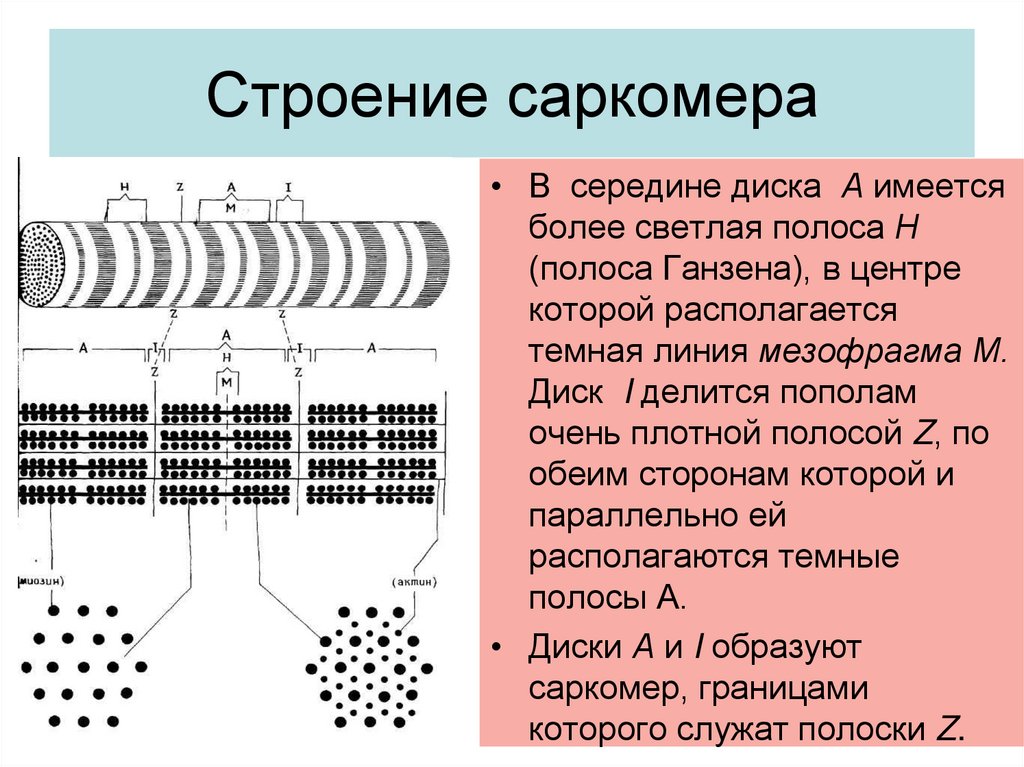
4. Строение саркомера
• В середине диска А имеетсяболее светлая полоса Н
(полоса Ганзена), в центре
которой располагается
темная линия мезофрагма М.
Диск I делится пополам
очень плотной полосой Z, по
обеим сторонам которой и
параллельно ей
располагаются темные
полосы А.
• Диски А и I образуют
саркомер, границами
которого служат полоски Z.
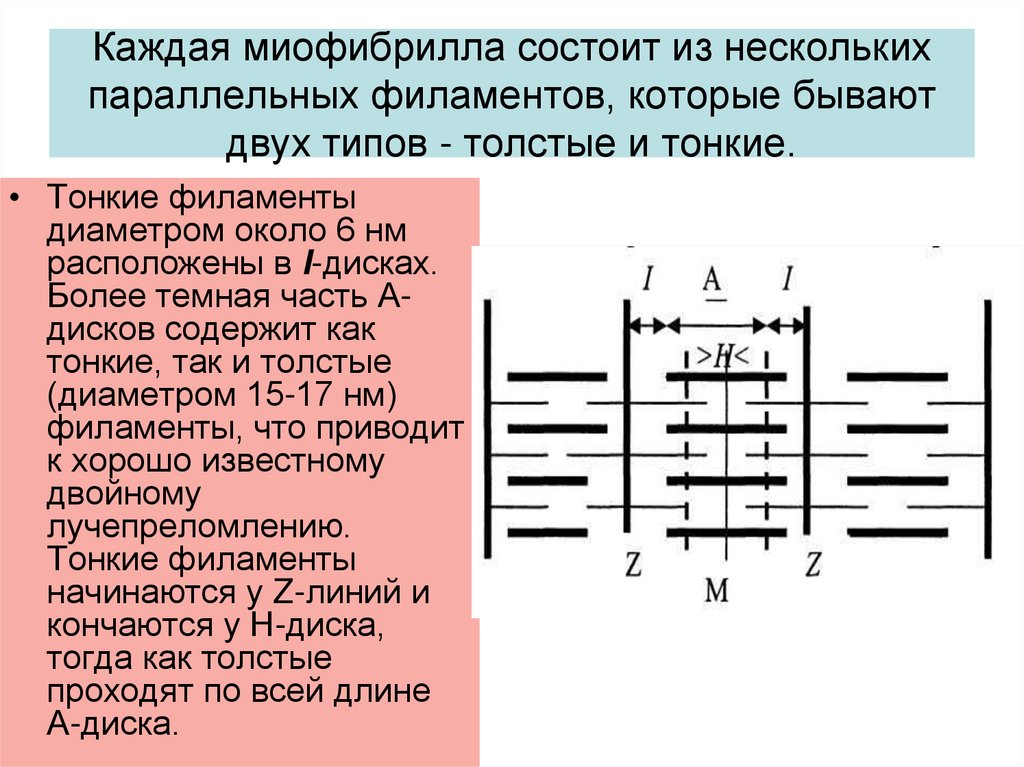
5. Каждая миофибрилла состоит из нескольких параллельных филаментов, которые бывают двух типов - толстые и тонкие.
• Тонкие филаментыдиаметром около 6 нм
расположены в I-дисках.
Более темная часть Адисков содержит как
тонкие, так и толстые
(диаметром 15-17 нм)
филаменты, что приводит
к хорошо известному
двойному
лучепреломлению.
Тонкие филаменты
начинаются у Z-линий и
кончаются у Н-диска,
тогда как толстые
проходят по всей длине
А-диска.
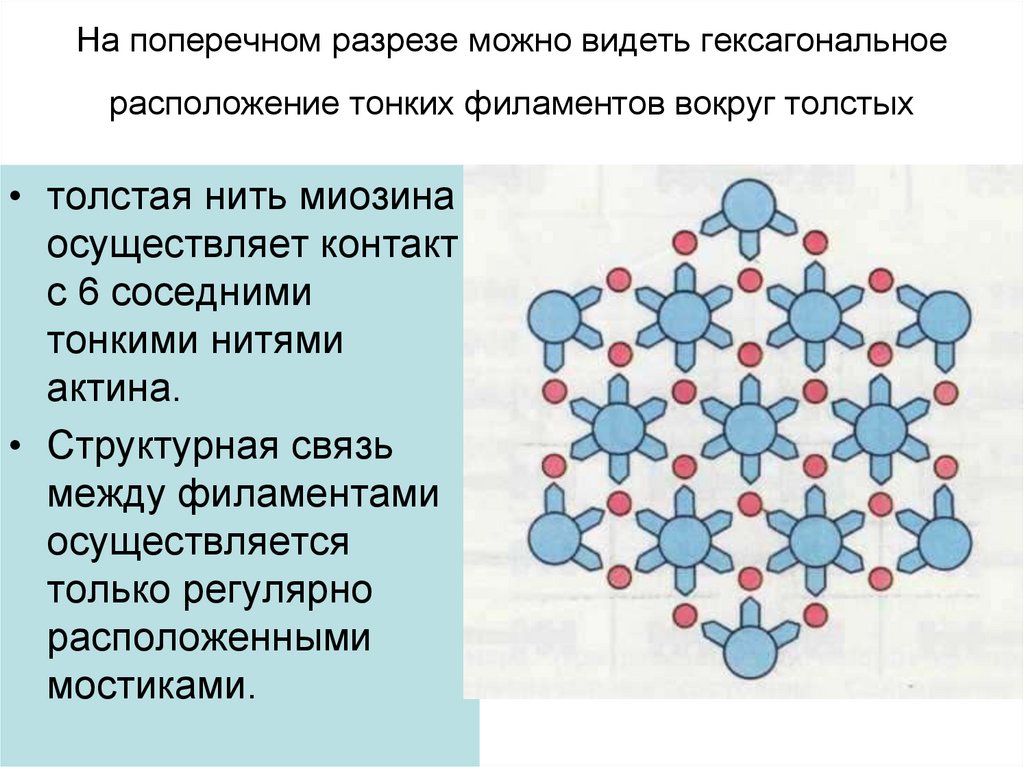
6. На поперечном разрезе можно видеть гексагональное расположение тонких филаментов вокруг толстых
• толстая нить миозинаосуществляет контакт
с 6 соседними
тонкими нитями
актина.
• Структурная связь
между филаментами
осуществляется
только регулярно
расположенными
мостиками.
7. Основные положения теории мышечного сокращения «Модель скользящих нитей»
• Длина как толстых, так и тонких нитей в ходемышечного сокращения не меняется
• Длина саркомера при сокращении
уменьшается вследствие того, что в ходе
сокращения толстые и тонкие нити
миофибрилл скользят относительно друг
друга
• Сила сокращения генерируется в результате
активного движения нитей одного типа вдоль
прилегающих нитей второго типа.
• При максимальном сокращении саркомер
укорачивается на 30-40% своей нормальной
длины.
8. Для обеспечения функции движения большую роль играет определенная ориентация молекул актина и миозина.
• Вдоль нити миозина поспирали выступают
поперечные мостики,
образованные головками
(S1), и только в середине
остается свободная
область протяженностью
1500 Å. Молекулы миозина,
расположенные по одну
сторону от свободной
мостиковой зоны,
ориентированы в одном
направлении, тогда как
молекулы по другую
сторону – в
противоположном
направлении
• Тонкие нити актина также
ориентированы: по одну
сторону от Z-линии они
имеют одно направление,
по другую –
противоположное.
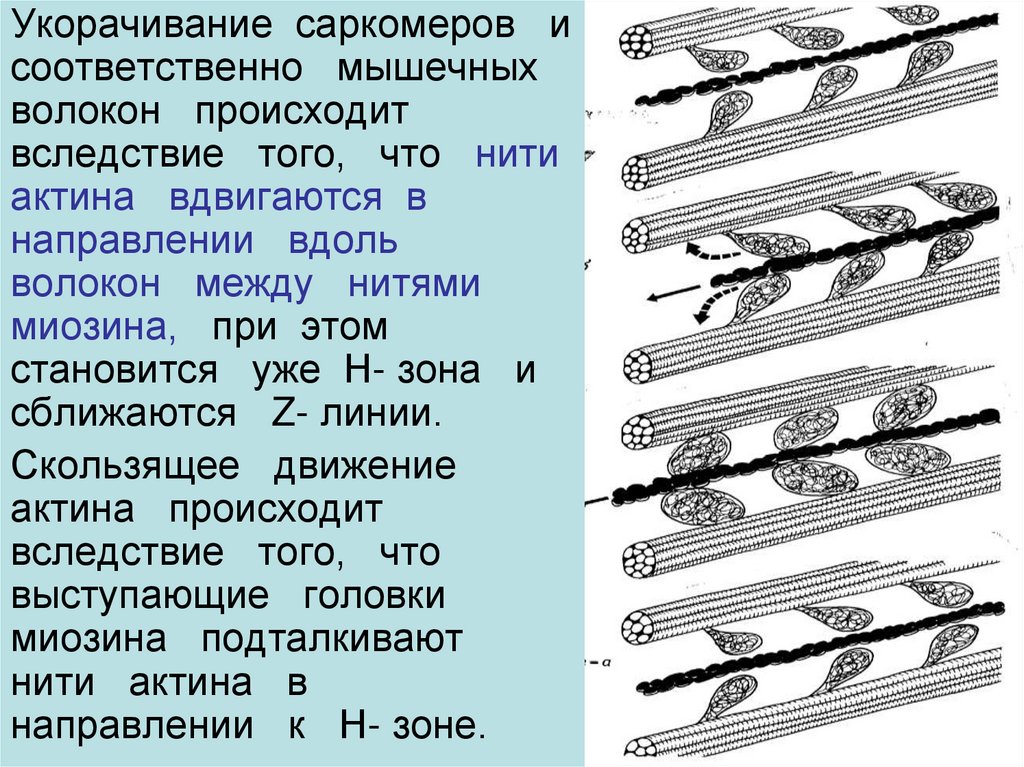
9.
Укорачивание саркомеров исоответственно мышечных
волокон происходит
вследствие того, что нити
актина вдвигаются в
направлении вдоль
волокон между нитями
миозина, при этом
становится уже Н- зона и
сближаются Z- линии.
Скользящее движение
актина происходит
вследствие того, что
выступающие головки
миозина подталкивают
нити актина в
направлении к Н- зоне.
10.
• Благодаря тому, что участкиконтакта на нитях актина и миозина
ориентированы одинаково по
отношению друг к другу, в ходе их
скольжения происходит сложение
сил, развивающихся в каждом
участке взаимодействия.
• Кроме того, посередине между
двумя z-линиями саркомера
направление меняется на
противоположное.
• В итоге две тонкие нити при
взаимодействии с одной толстой
скользят навстречу друг другу, что
приводит к уменьшению длины
саркомера миофибрилл.
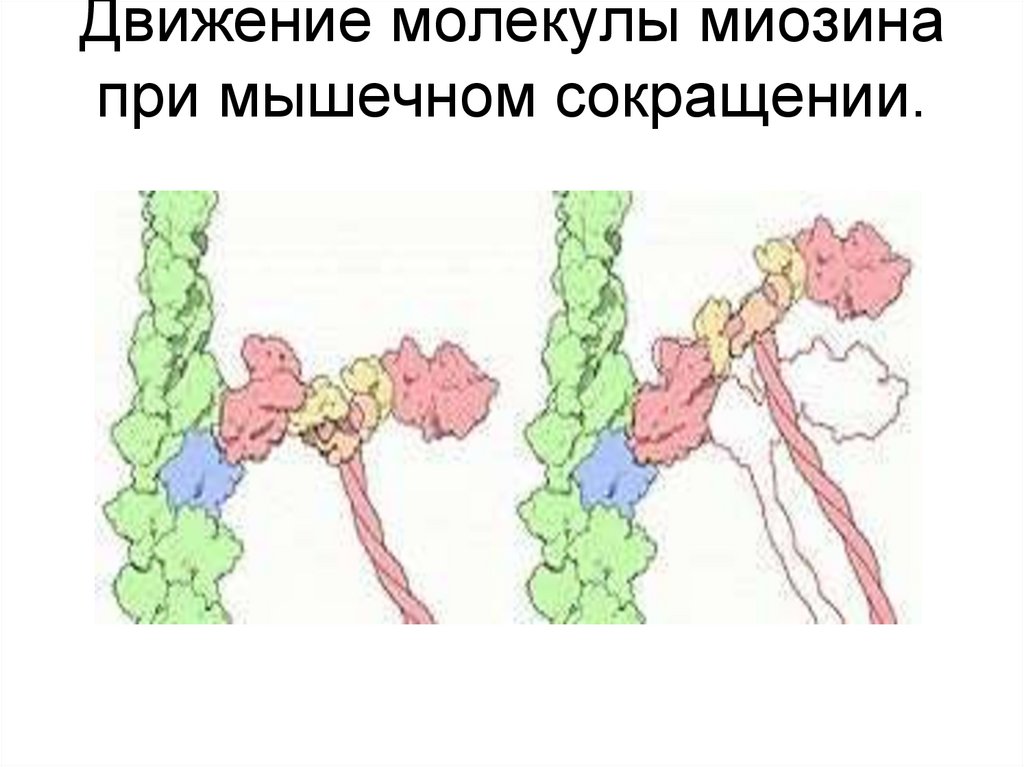
11. Движение молекулы миозина при мышечном сокращении.
12. В пользу этой модели свидетельствуют данные
• полученные при измерении длины А и I- дисковсаркомера, а также зоны Н в растянутой, покоящейся
и сократившейся мышце.
• А-диск характеризуется постоянной длиной, т.е.
размер толстых нитей при сокращении не меняется.
• Расстояние между Z-линией и началом ближайшей к
ней зоны Н также постоянно, следовательно размер
тонких нитей не меняется.
• Однако зона Н и диск I при сокращении становятся
уже, поскольку в сократившемся волокне толстые и
тонкие нити перекрываются в большей мере, чем в
покоящейся мышце.
• Координированное движение возникает благодаря
циклическому процессу образования и диссоциации
комплекса миозина и актина.
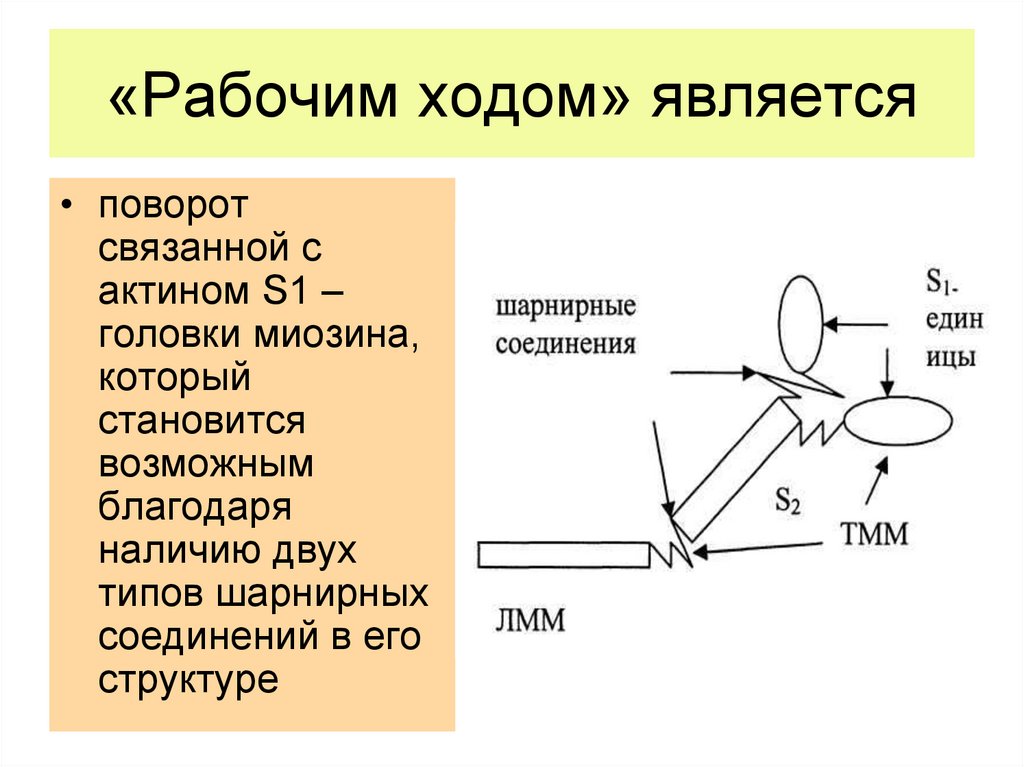
13. «Рабочим ходом» является
• поворотсвязанной с
актином S1 –
головки миозина,
который
становится
возможным
благодаря
наличию двух
типов шарнирных
соединений в его
структуре
14. Факт ферментативного расщепления миозина на фрагменты указывает на то
• что миозин образован из доменов, соединенныхмежду собой шарнирными участками.
• Функция домена S2 состоит в передаче напряжения
от связанной с тонкой нитью головки S1 на домен
ЛММ, составляющий часть толстой нити.
• Наличие шарнирного участка между S1 и S2
позволяет головке по-разному взаимодействовать с
актином в зависимости от того, имеются ли на ней
прочно связанные продукты АДФ и Рi или нет.
• Шарнирный участок, соединяющий S2 и ЛММ,
допускает довольно большие изменения в
положении S1-головки относительно толстой нити и
тем самым обеспечивает точность взаимодействия
миозина с актином.
15. В поперечно-полосатой мышце сокращение зависит от концентрации Са 2+, которая
регулируется саркоплазматическимретикуломом - специализированной
системой мембран, накапливающей Са 2+ в
состоянии покоя и высвобождающей его при
воздействии нервного импульса на
мышечное волокно.
В состоянии покоя система активного транспорта,
включая кальциевый насос, приводимый в
действие АТФ, и специфический Са 2+ связывающий белок, концентрируют Са 2+ в
саркоплазматическом ретикулуме до уровня
свыше 10-3М. Одновременно его содержание в
саркоплазме снижается до концентрации ниже
10-6М.
16. Нервный импульс вызывает
• деполяризацию наружной мембранымышечного волокна,
• которая затем распространяется внутрь
клетки и передается
саркоплазматическому ретикулуму.
• В результате этого воздействия
происходит выброс Са 2+ из цистерн
ретикулума с последующим
связыванием его с тропониновым
комплексом тонких нитей миофибрилл.
17. Алан Р. Сэмс, англ. считает В присутствии АТФ ионы кальция инициируют формирование на основе АТФ мостика между тонкими и
толстыми нитями• Молекула АТФ высвобождает энергию, необходимую для
того, чтобы растянуть тонкие нити вместе с концами
саркомера, к которым они прикреплены. Затем новая
молекула АТФ разрывает связь между нитями и позволяет
мышце расслабиться до исходной длины. Таким образом,
АТФ вызывает сокращение мышц, снабжая их энергией, и
расслабление, разрушая связь между сокращенными
толстыми и тонкими нитями. Минимальная концентрация
АТФ, необходимая для выполнения этих функций,
составляет приблизительно 1 мкмоль АТФ на 1 г мышцы
Поэтому при снижении концентрации АТФ в мышечных клетках
ниже этого уровня мышца перестает реагировать на нервные
или другие импульсы и переходит в состояние посмертного
окоченения.
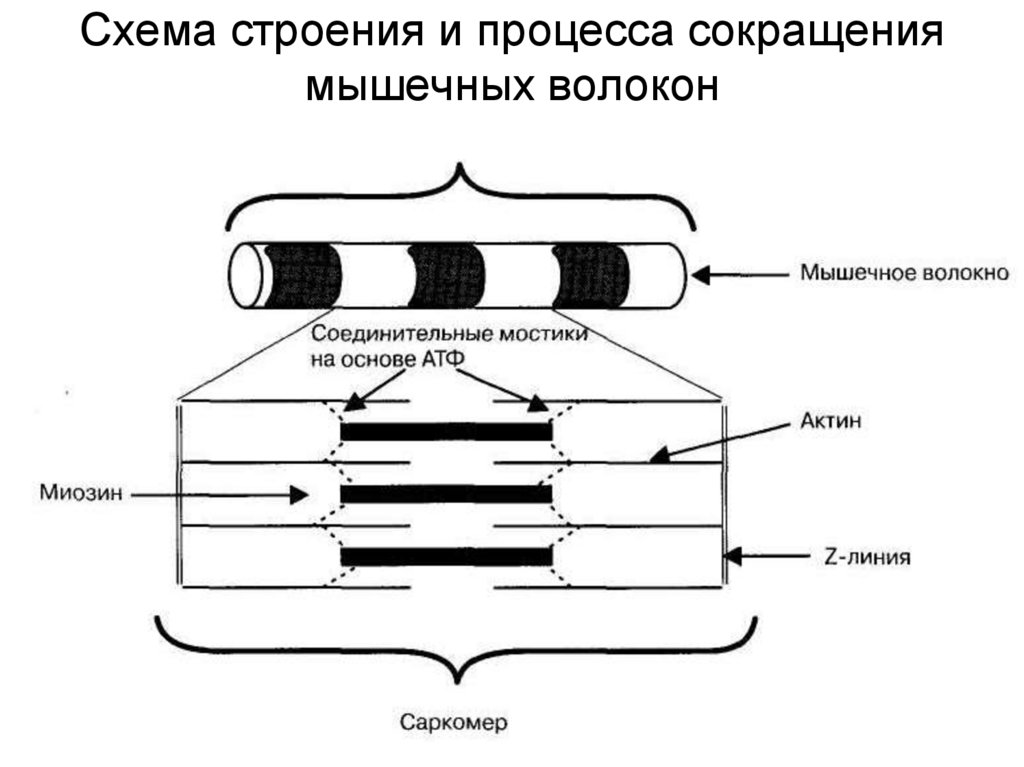
18. Схема строения и процесса сокращения мышечных волокон
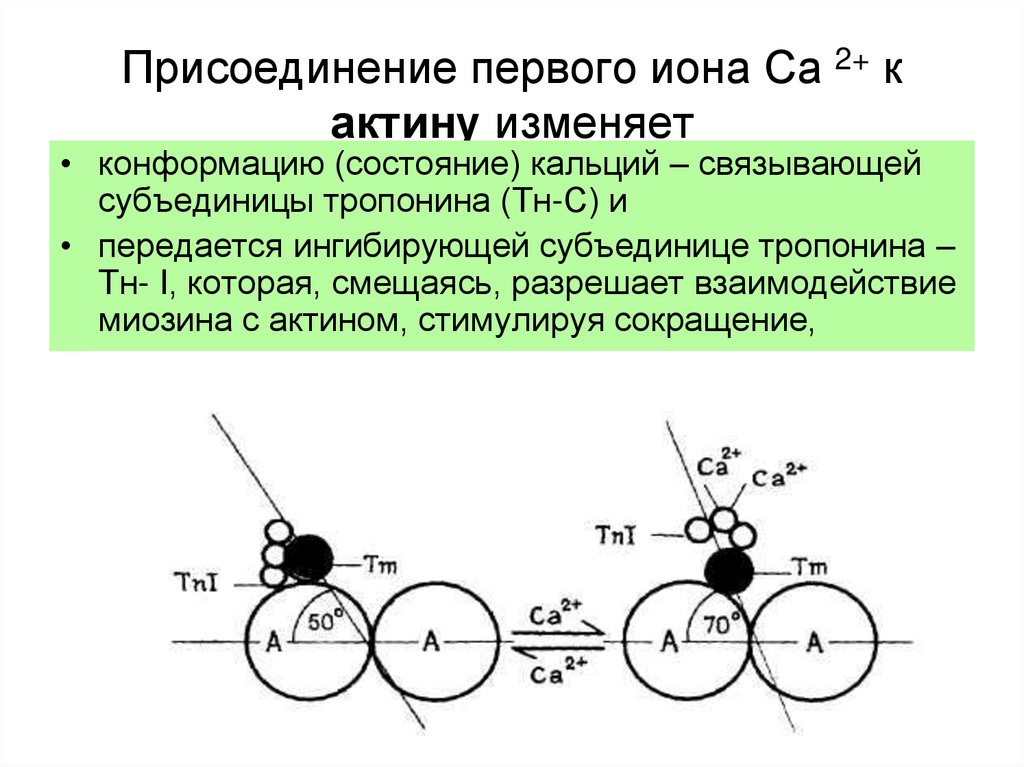
19. Присоединение первого иона Са 2+ к актину изменяет
• конформацию (состояние) кальций – связывающейсубъединицы тропонина (Тн-С) и
• передается ингибирующей субъединице тропонина –
Тн- I, которая, смещаясь, разрешает взаимодействие
миозина с актином, стимулируя сокращение,
20.
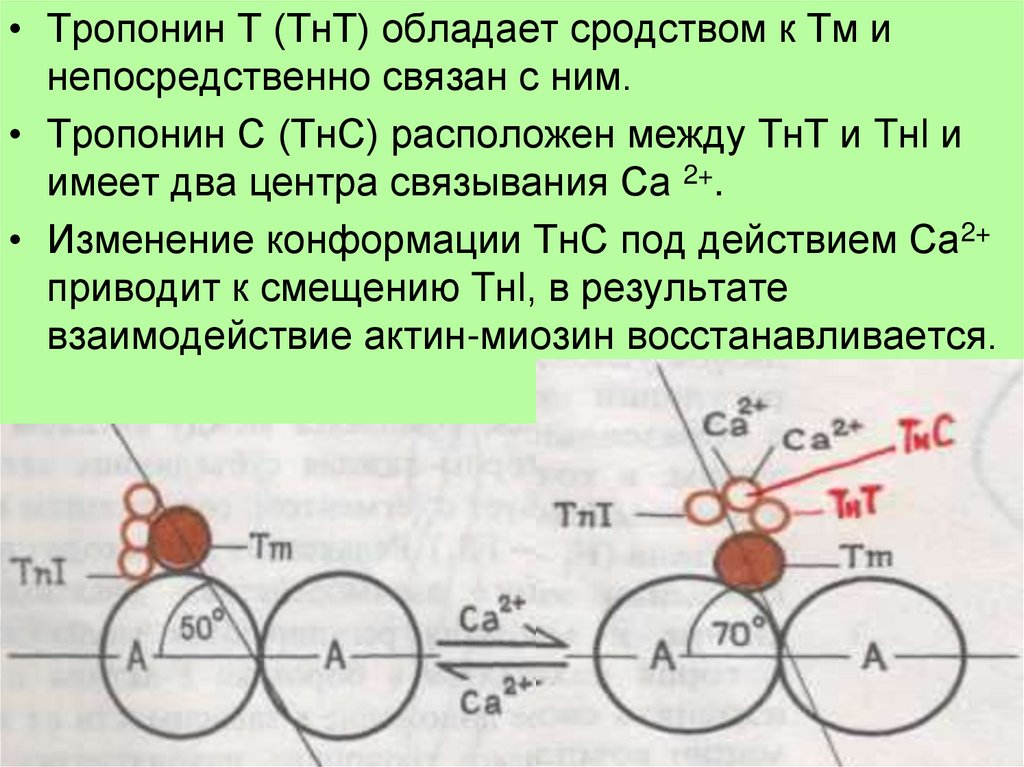
• Тропонин Т (ТнТ) обладает сродством к Тм инепосредственно связан с ним.
• Тропонин С (ТнС) расположен между ТнТ и Tнl и
имеет два центра связывания Са 2+.
• Изменение конформации ТнС под действием Са2+
приводит к смещению Tнl, в результате
взаимодействие актин-миозин восстанавливается.
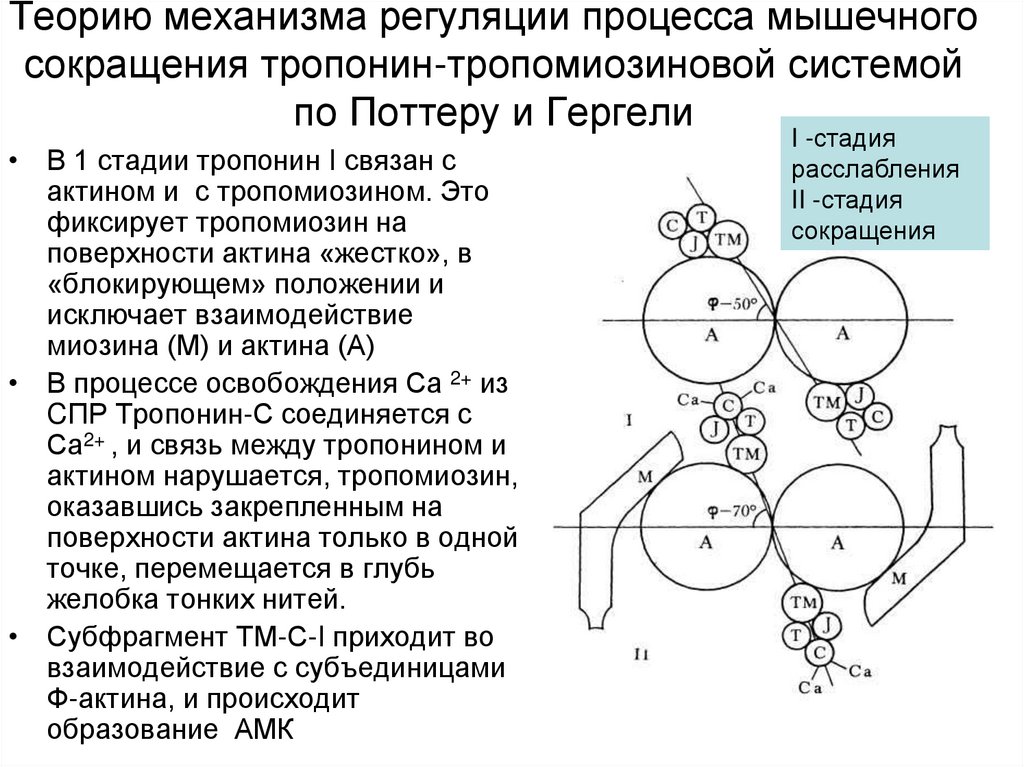
21. Теорию механизма регуляции процесса мышечного сокращения тропонин-тропомиозиновой системой по Поттеру и Гергели
• В 1 стадии тропонин I связан сактином и с тропомиозином. Это
фиксирует тропомиозин на
поверхности актина «жестко», в
«блокирующем» положении и
исключает взаимодействие
миозина (М) и актина (А)
• В процессе освобождения Са 2+ из
CПР Тропонин-С соединяется с
Са2+ , и связь между тропонином и
актином нарушается, тропомиозин,
оказавшись закрепленным на
поверхности актина только в одной
точке, перемещается в глубь
желобка тонких нитей.
• Субфрагмент ТМ-С-I приходит во
взаимодействие с субъединицами
Ф-актина, и происходит
образование АМК
I -стадия
расслабления
II -стадия
сокращения
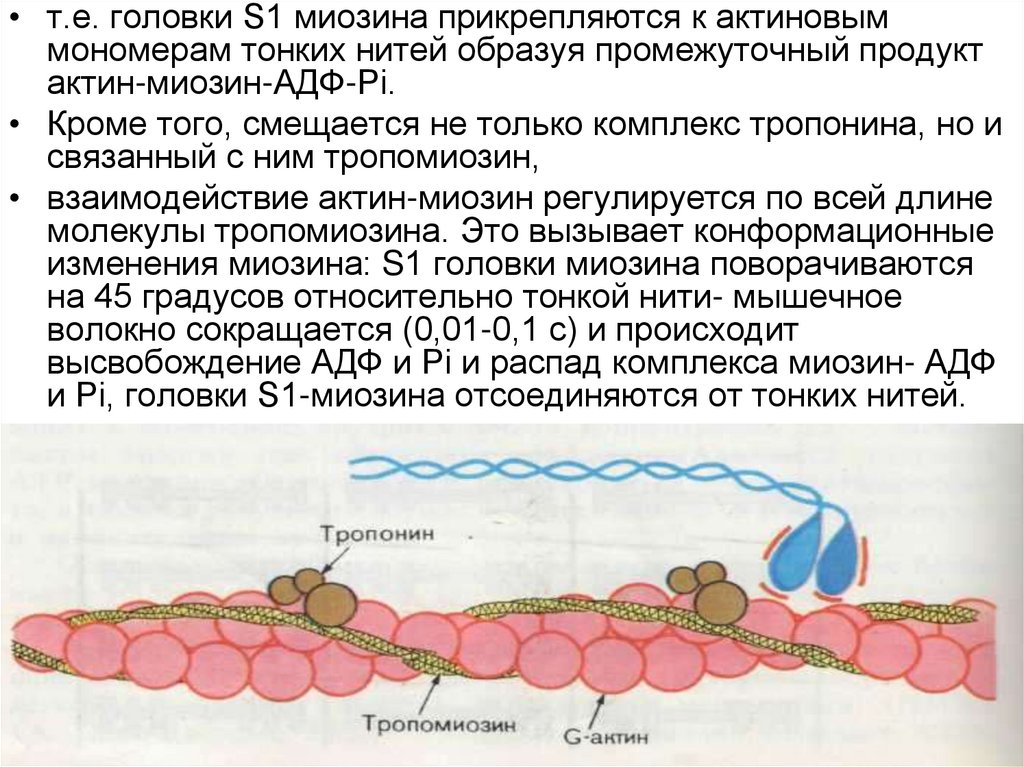
22.
• т.е. головки S1 миозина прикрепляются к актиновыммономерам тонких нитей образуя промежуточный продукт
актин-миозин-АДФ-Рi.
• Кроме того, смещается не только комплекс тропонина, но и
связанный с ним тропомиозин,
• взаимодействие актин-миозин регулируется по всей длине
молекулы тропомиозина. Это вызывает конформационные
изменения миозина: S1 головки миозина поворачиваются
на 45 градусов относительно тонкой нити- мышечное
волокно сокращается (0,01-0,1 с) и происходит
высвобождение АДФ и Рi и распад комплекса миозин- АДФ
и Рi, головки S1-миозина отсоединяются от тонких нитей.
23. Ионы Са 2+ возвращаются в эндоплазматическую сеть
• их исчезновение из саркоплазмы освобождаеттропонин,
• и через Тн-I-субъединицу он препятствует
дальнейшему взаимодействию актина с миозином.
• Мышца возвращается в состояние покоя и S1головки миозина не связаны с тонкими актиновыми
нитями и проявляют АТФ-азную активность.
• Миозин активно гидролизует АТФ до продуктов,
которые прочно удерживаются в комплексе
миозин-АДФ-Рi
24. Однако, количество АТФ, которое имеется в мышце, может поддержать сократительную активность на протяжении доли секунды.
• Источником, обеспечивающим системуэнергии в мышцах, является
креатинфосфат.
• Это соединение характеризуется более
высоким потенциалом переноса
высокоэнергетических фосфатных групп, чем
АТФ.
• Фермент креатинкиназа катализирует
перенос фосфорильной группы от
креатинфосфата(КРФ) на АДФ с
образованием АТФ: КРФ + АДФ↔АТФ +КР.
• Концентрация креатинфосфата в скелетных
мышцах позвоночных животных в 4-5 раз
превышает концентрацию АТФ.
25. В работающей мышце запас креатинфосфата быстро истощается, а следовательно и содержание АТФ.
• При этом возрастает концентрация АДФ и Рi , а придальнейшем распаде и АМФ.
• В целом резерва энергии АДФ и креатинфосфата
хватает на 10-12 с мышечной работы.
• Понижение энергетического потенциала приводит к
стимулированию гликолиза и гликогенолиза, цикла
трикарбоновых кислот и окислительного
фосфорилирования.
• Аэробное расщепление гликогена достигает
максимума через 40-50 с непрерывной работы мышц.
Через 60-70 с доминируют аэробные процессы
благодаря увеличению транспорта кислорода в
работающую мышцу. При аэробном
фосфорилировании АТФ образуется в митохондриях,
которые в большом количестве окружают рабочий
аппарат клетки.
26. Относительный вклад каждого из этих процессов в генерировании АТФ зависит от типа мышц и может варьировать в широких пределах.
• В высокоактивных, или красных, мышцах с высокимсодержанием миоглобина и цитохромов
(летательные мышцы птиц, конечностей и шеи
животных) главным источником энергии для
ресинтеза АТФ являются гликолиз и гликогенолиз,
даже если такие мышцы хорошо снабжаются
кислородом.
• Субстраты для ресинтеза АТФ могут быть разными в
зависимости также от активности мышц. В
покоящихся мышцах, например во время сна
животных, используются в основном жирные
кислоты. При совершении активной работы главным
топливом становится глюкоза.














 biology
biology