Similar presentations:
Обмен азотсодержащих соединений. Образование и обезвреживание аммиака
1.
БИОХИМИЯ(для медицинских специальностей ВО)
Лекция № 15
Раздел
Обмен азотсодержащих соединений
Общие пути обмена аминокислот
Образование и обезвреживание
аммиака
НГМУ, кафедра медицинской химии
д.б.н., доцент Суменкова Дина Валерьевна
2.
Актуальность темыВ процессе реакций обмена аминокислот образуются важные для
организма соединения (другие амино- и кетокислоты, биогенные
амины, нейромедиаторы, гормоны, АТФ и другие).
Наследственные нарушения обмена аминокислот – причина
развития ряда заболеваний (фенилкетонурия, алкаптонурия,
альбинизм, болезнь «кленового сиропа», цистинурия, болезнь
Хартнупа, синдром «голубых пеленок» и другие).
При катаболизме азотсодержащих соединений образуется
токсичный для нервной системы аммиак, обезвреживание
которого является одной из жизненоважных задач организма.
3.
План лекцииОбщие пути обмена аминокислот
(особенности обмена отдельных
аминокислот – самостоятельное изучение)
Образование и механизм токсичного
действия аммиака. Обезвреживание
аммиака: универсальная реакция и
орнитиновый цикл.
4.
Цель лекцииЗнать:
Общие пути обмена аминокислот (реакции трансаминирования,
декарбоксилирования, дезаминирования): суть реакций, ферменты, витаминыкоферменты, продукты, роль реакций, виды дезаминирования, регуляция процессов
дезаминирования.
Биогенные амины: примеры, реакции образования, роль, способы инактивации.
Источники образования аммиака, механизм его токсичного действия и способы
обезвреживания (универсальный механизм и реакции орнитинового цикла).
Уметь писать формулами реакции:
непрямого окислительного дезаминирования аланина и аспартата
декарбоксилирования аминокислот (с использованием общей формулы
аминокислот)
универсальную реакцию обезвреживания аммиака
первую реакцию орнитинового цикла
5.
Общие путиобмена
аминокислот
ТРАНСАМИНИРОВАНИЕ
ДЕКАРБОКСИЛИРОВАНИЕ
ДЕЗАМИНИРОВАНИЕ
6.
ТрансаминированиеНаиболее активно трансаминируются аланин, аспартат
Не трансаминируются лизин, треонин, пролин
7.
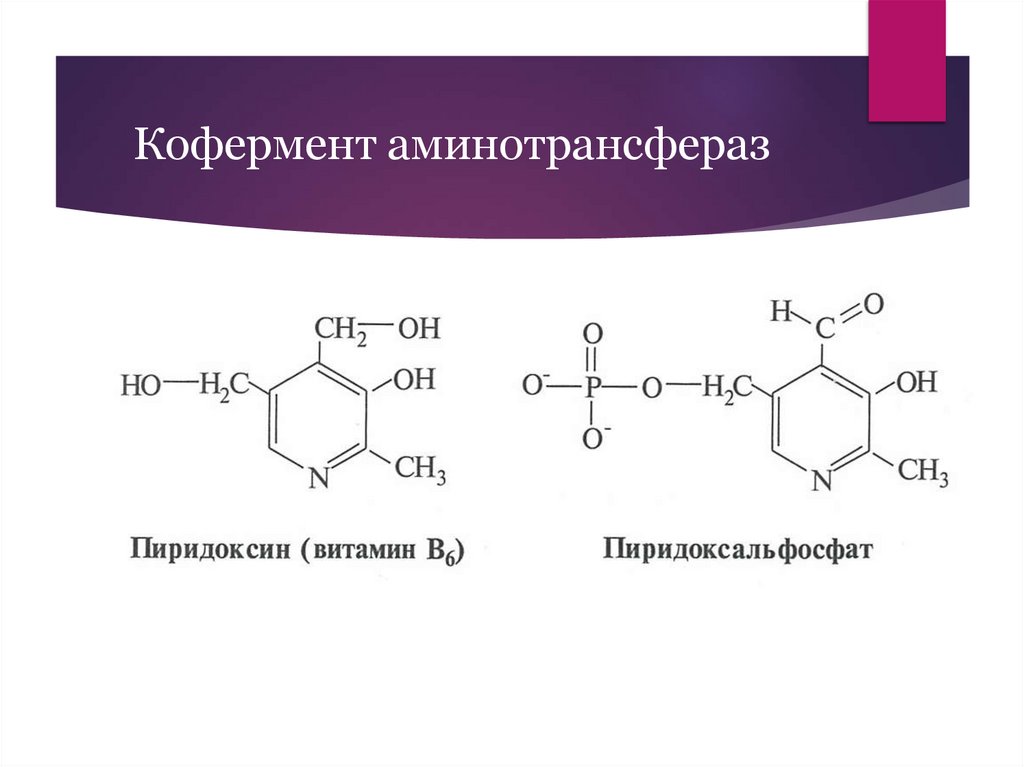
Кофермент аминотрансфераз8.
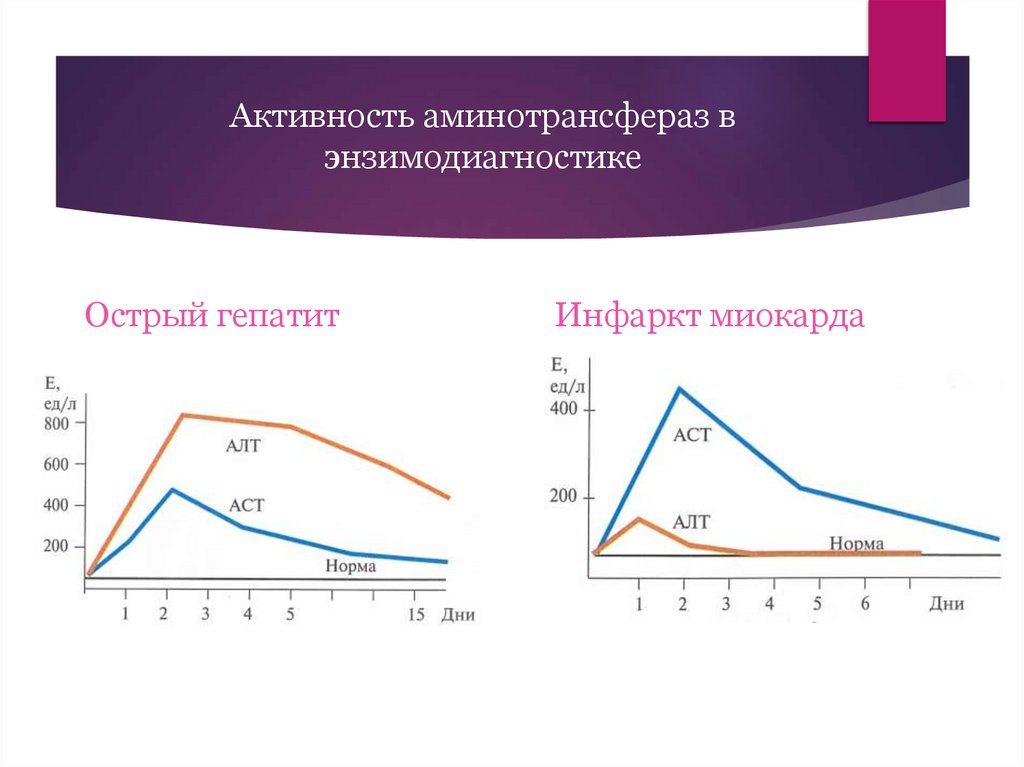
Активность аминотрансфераз вэнзимодиагностике
Острый гепатит
Инфаркт миокарда
9.
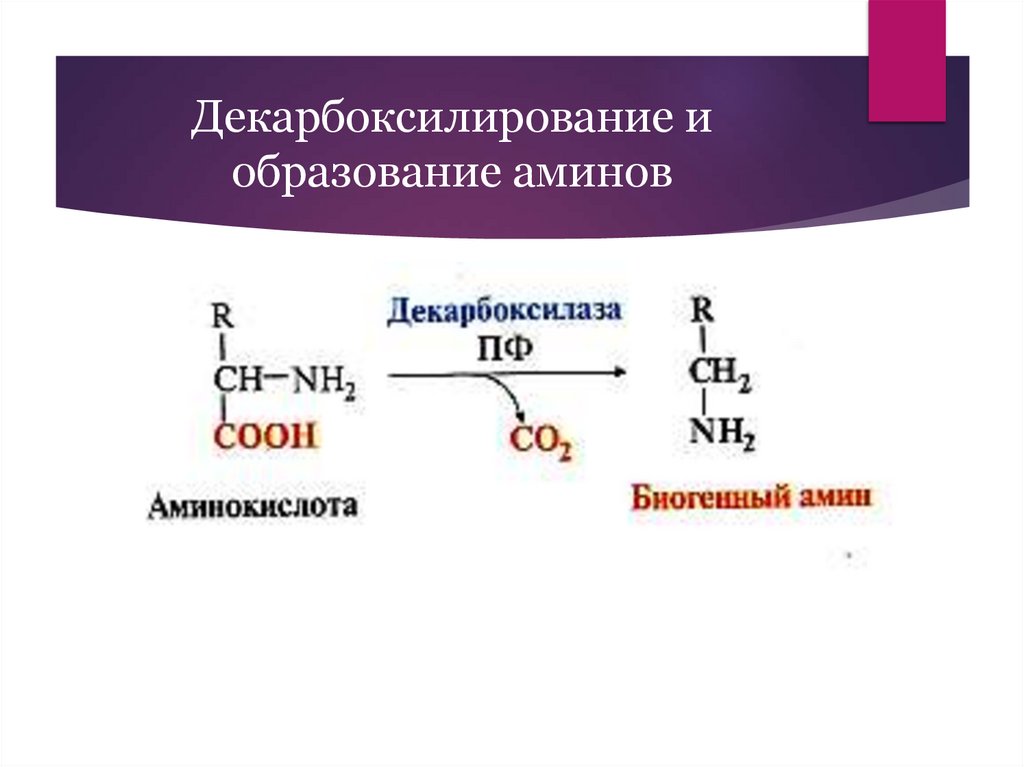
Декарбоксилирование иобразование аминов
10.
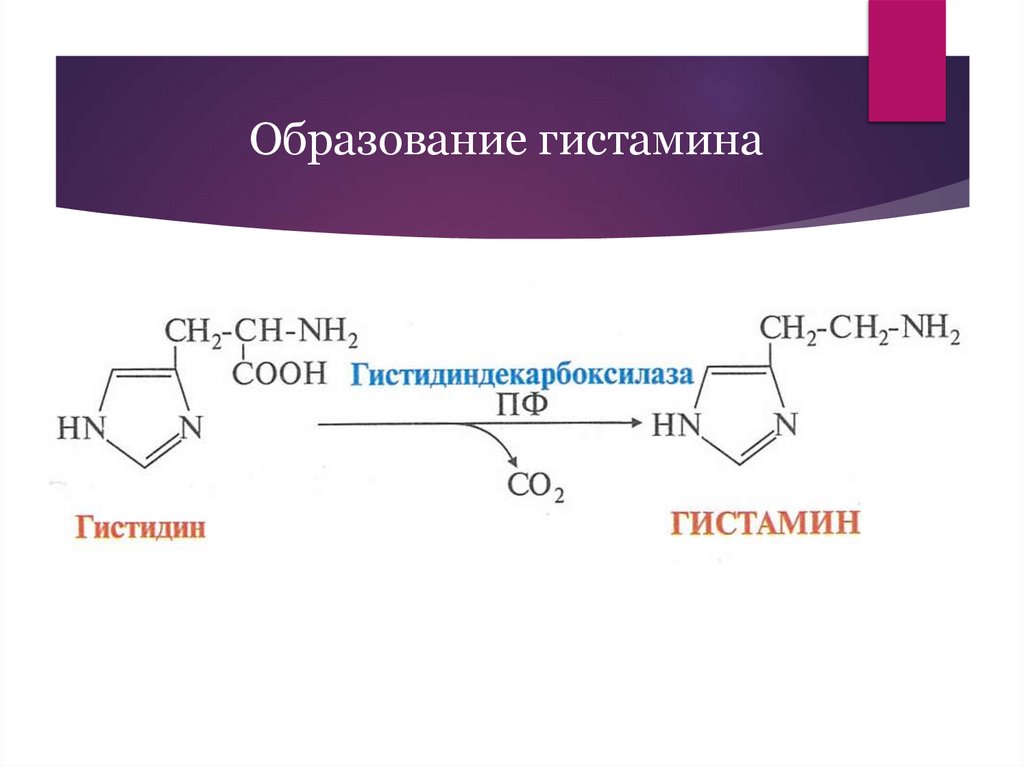
Образование гистамина11.
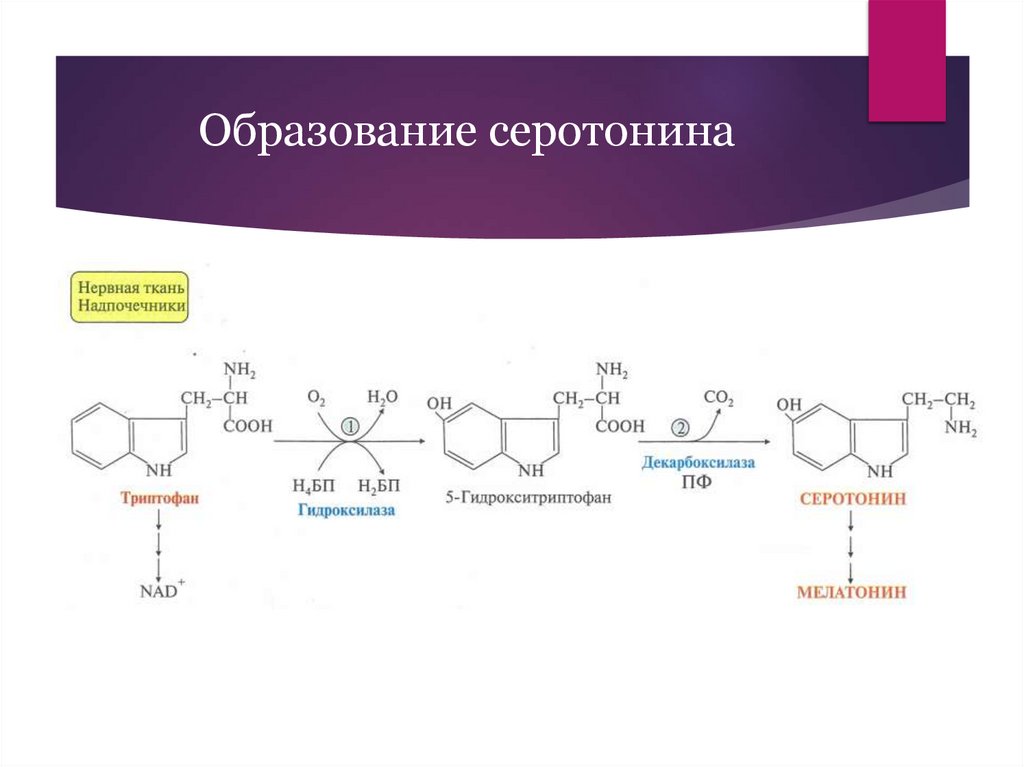
Образование серотонина12.
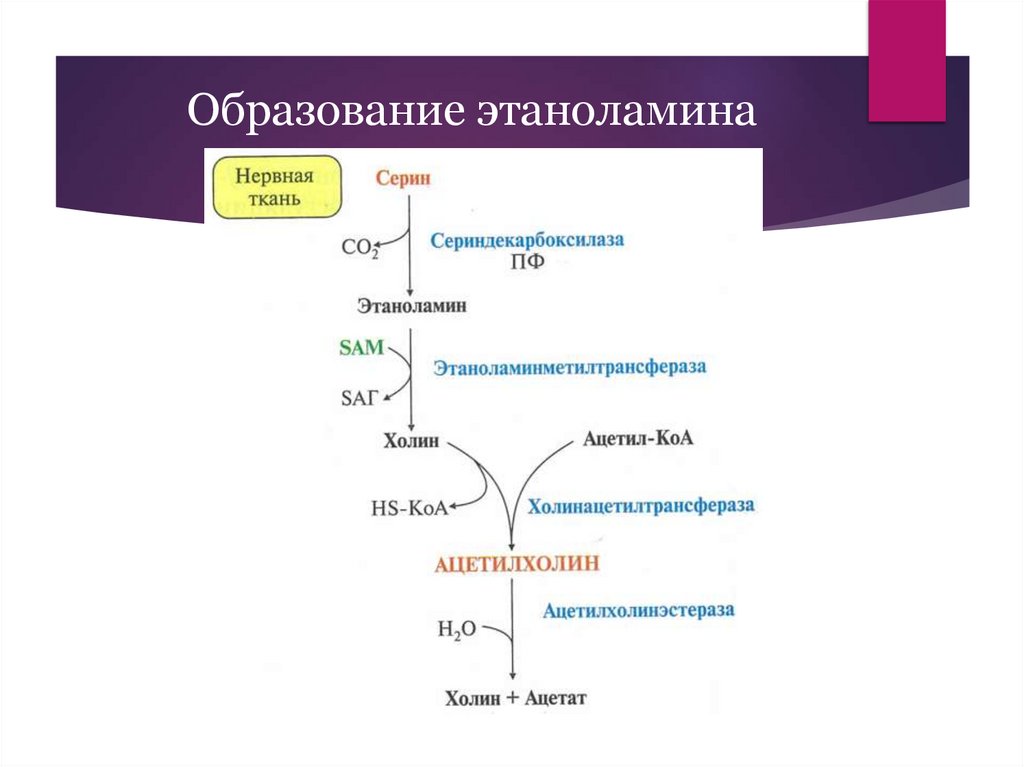
Образование этаноламина13.
Образование ГАМК14.
Образование дофамина и катехоламиновВспомните и запишите
последовательность реакций образования
из тирозина дофамина, норадреналина и
адреналина. Назовите ферменты и
коферменты-витамины.
В цепочке превращений отметьте реакцию
декарбоксилирования и назовите
аминокислоту-субстрат реакции.
15.
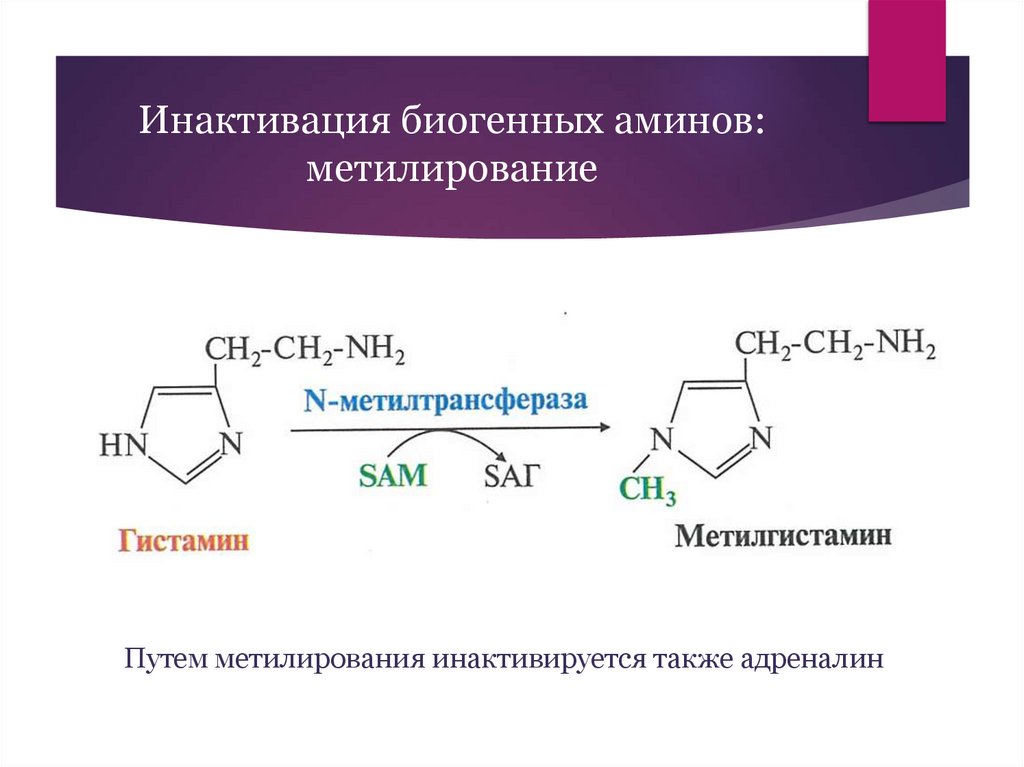
Инактивация биогенных аминов:метилирование
Путем метилирования инактивируется также адреналин
16.
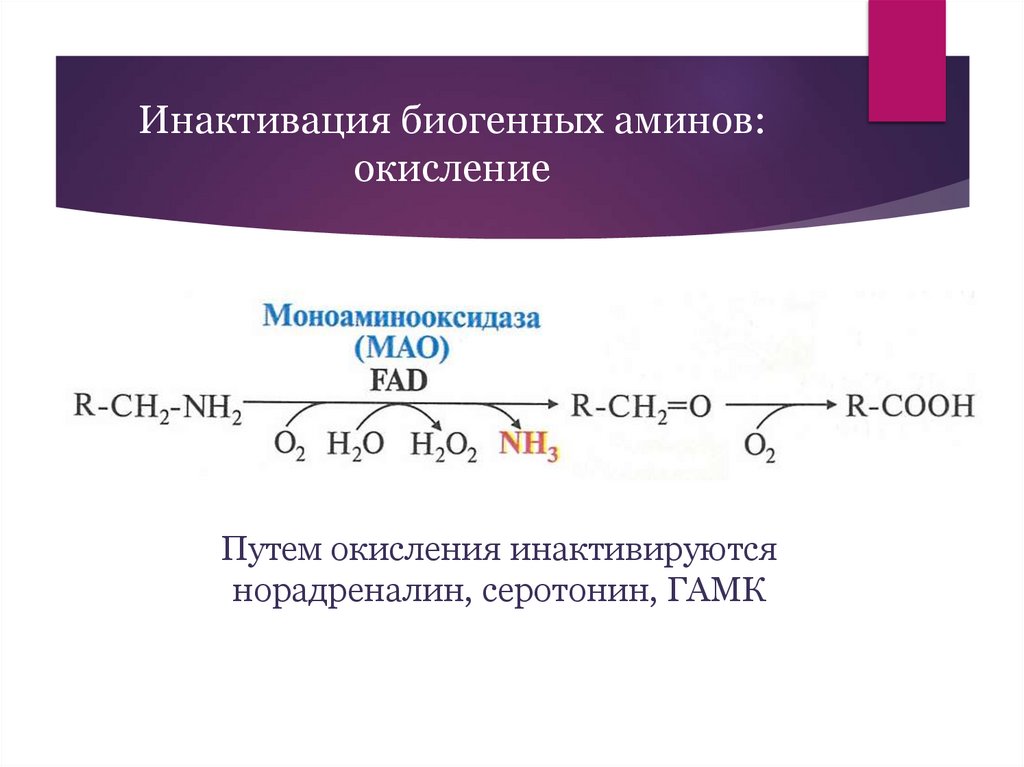
Инактивация биогенных аминов:окисление
Путем окисления инактивируются
норадреналин, серотонин, ГАМК
17.
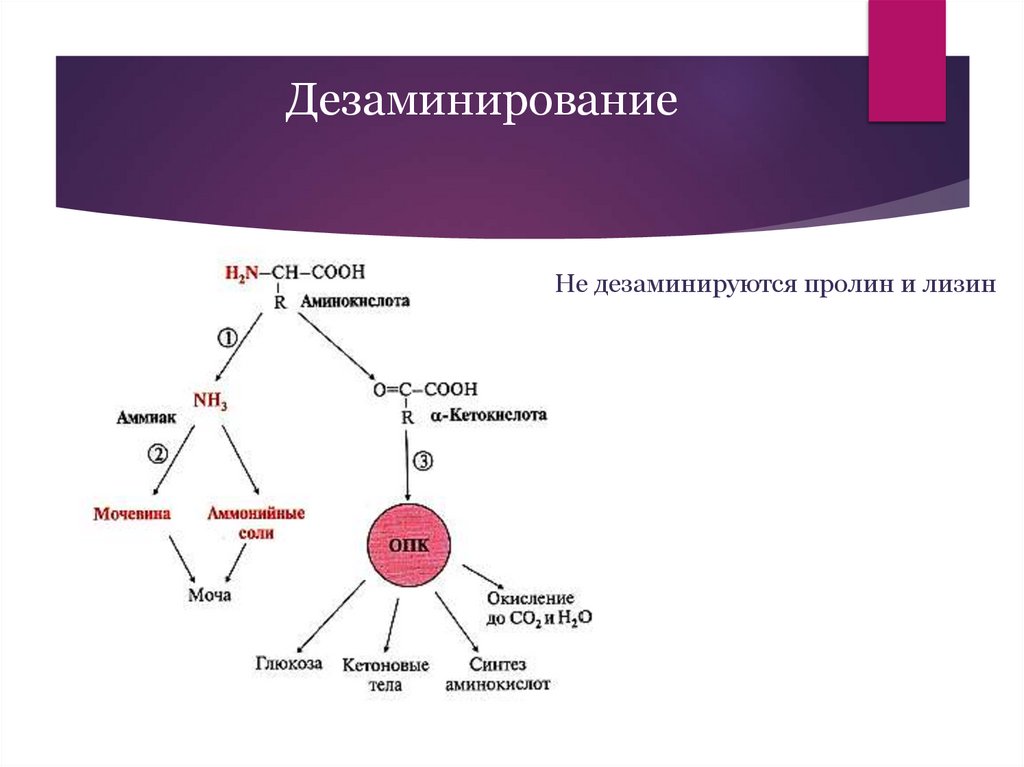
ДезаминированиеНе дезаминируются пролин и лизин
18.
Виды дезаминированияПрямое (напрямую, в ходе одной реакции при
участии одного фермента)
Окислительное (анаэробные дегидрогеназы,
окислитель НАД)
Неокислительное
Непрямое (путем нескольких реакций при
участии разных ферментов)
Окислительное
Неокислительное
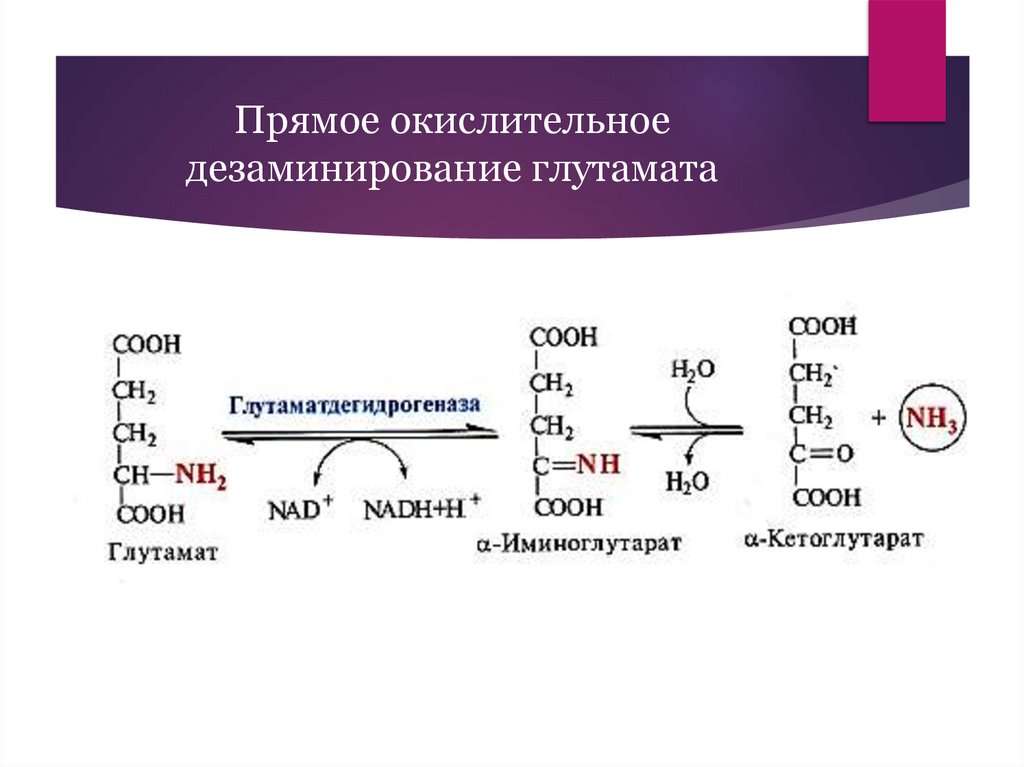
19.
Прямое окислительноедезаминирование глутамата
20.
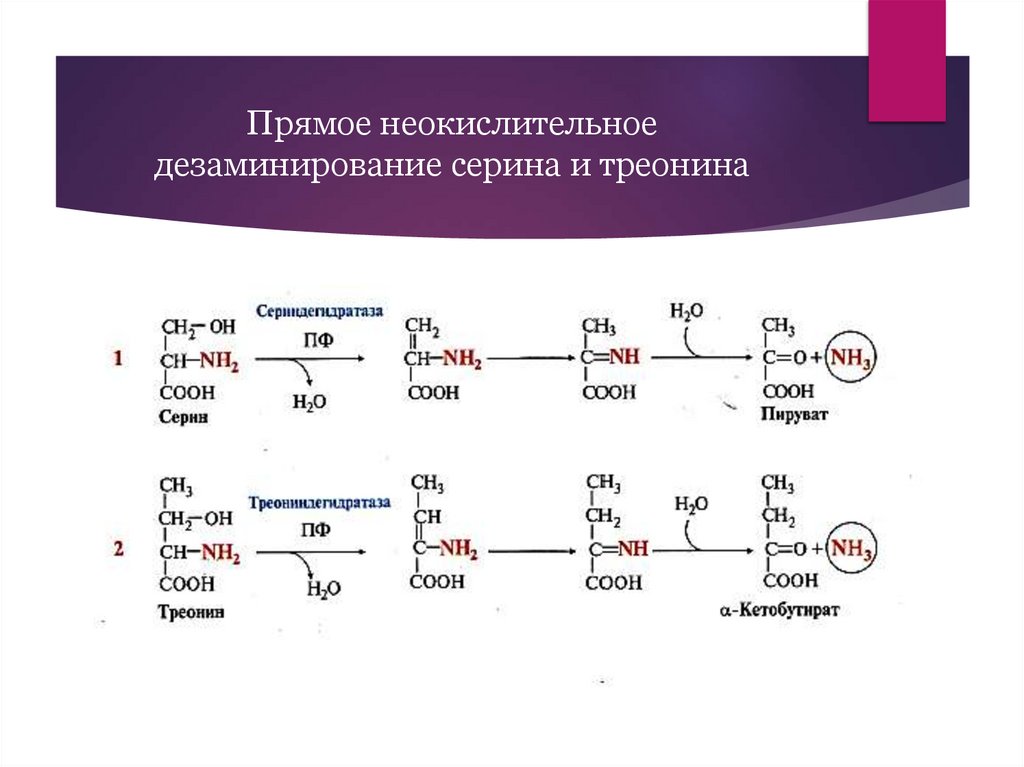
Прямое неокислительноедезаминирование серина и треонина
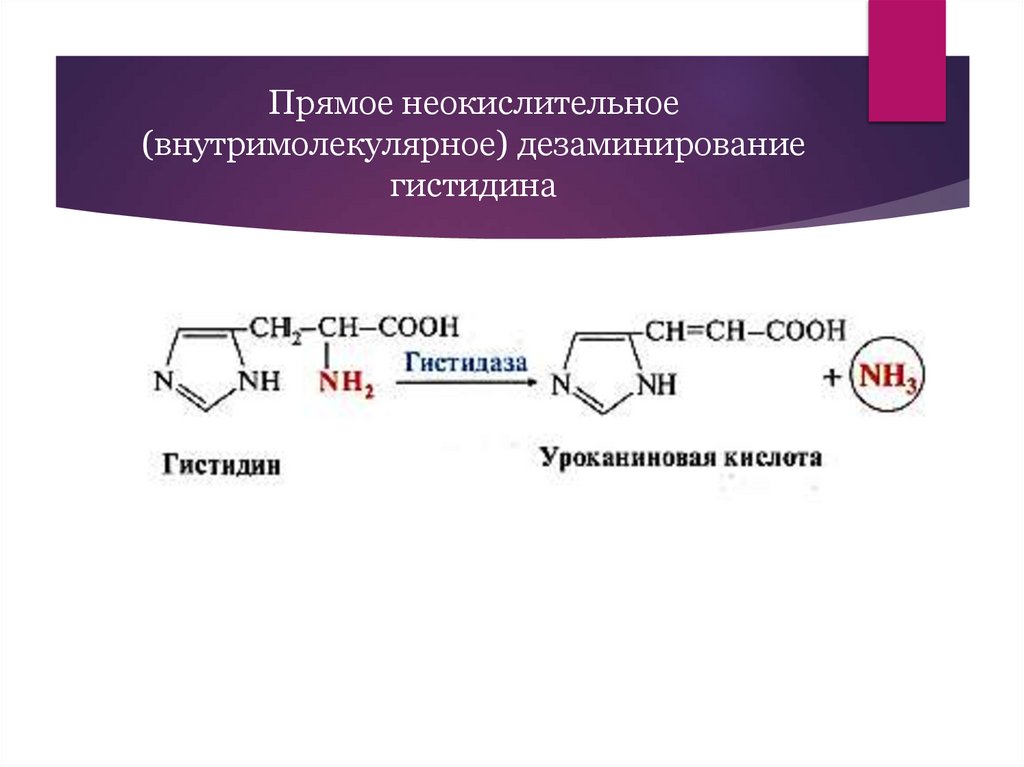
21.
Прямое неокислительное(внутримолекулярное) дезаминирование
гистидина
22.
Прямое неокислительное(гидролитическое) дезаминирование
глутамина в почках
Глутамин + Н2О → Глутамат + NH3
Фермент глутаминаза
Синтез фермента индуцируется при ацидозе
Значение реакции: таким образом почки
участвуют в поддержании кислотно-щелочного
баланса крови (NH3 нейтрализует кислые продукты
обмена, образуя аммонийные соли, которые
выводятся с мочой)
23.
Непрямое окислительное дезаминированиебольшинства аминокислот
1 этап – трансаминирование с альфа-
кетоглутаратом с образованием глутамата
2 этап – прямое окислительное
дезаминирование глутамата
24.
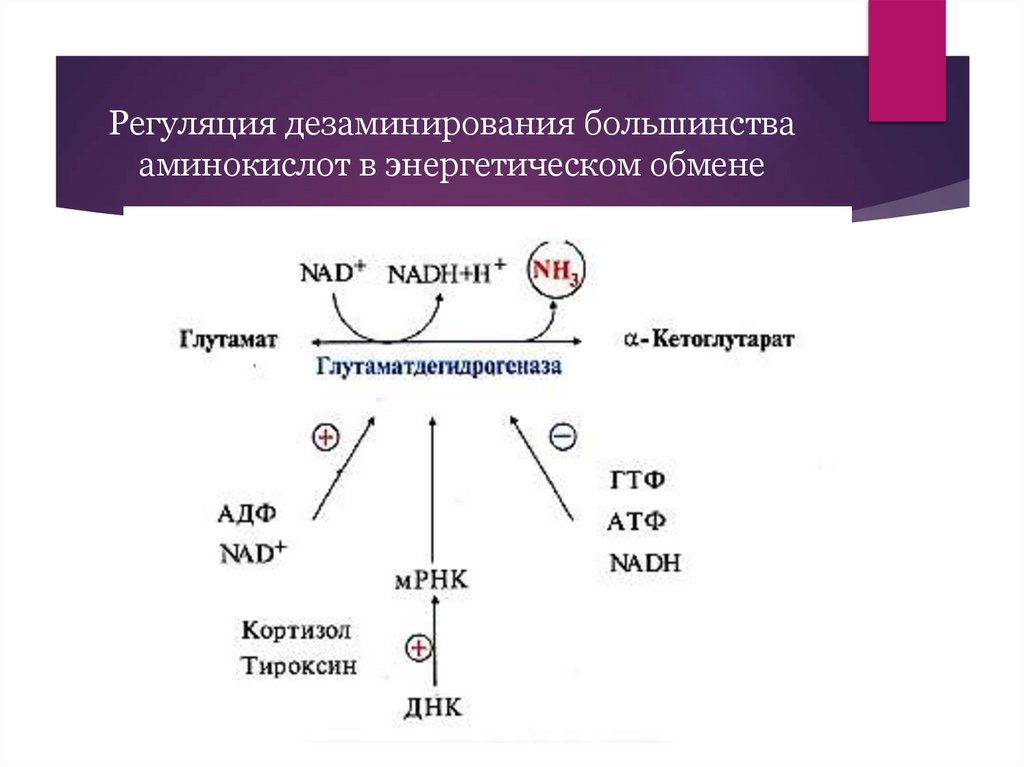
Регуляция дезаминирования большинствааминокислот в энергетическом обмене
25.
Непрямое неокислительное дезаминированиеПротекает в мышечной ткани, где активность
глутаматдегидрогеназы низкая. Связано с обменом пуринов.
Ход реакций:
трансаминирование с образованием аспартата
включение аминогруппы в инозинмонофосфат с
образованием аденозинмонофосфата (АМФ)
расщепление АМФ с гидролитическим дезаминированием
аденозина, образованием инозина и NH3
Изучив обмен нуклеотидов, составьте цепочку реакций
непрямого неокислительного дезаминирования аланина в
мышцах
26.
Самостоятельная работаИспользуя учебник, изучите особенности обмена и роль фенилаланина,
тирозина, метионина, цистеина, аргинина. Для этого ответьте на вопросы
и составьте конспект:
Какие нарушения обмена фенилаланина и тирозина вы знаете?
Что является причиной фенилкетонурии, альбинизма и алкаптонурии?
Как проявляются эти патологии?
Как образуется и используется активная форма метионина?
Как используется гомоцистеин, который образуется в процессе обмена
метионина?
Как происходит синтез цистеина?
27.
ОБРАЗОВАНИЕ АММИАКАОбразование и
обезвреживание
аммиака
МЕХАНИЗМ ТОКСИЧНОГО
ДЕЙСТВИЯ
ОБЕЗВРЕЖИВАНИЕ
АММИАКА:
УНИВЕРСАЛЬНАЯ
РЕАКЦИЯ И
ОРНИТИНОВЫЙ ЦИКЛ
28.
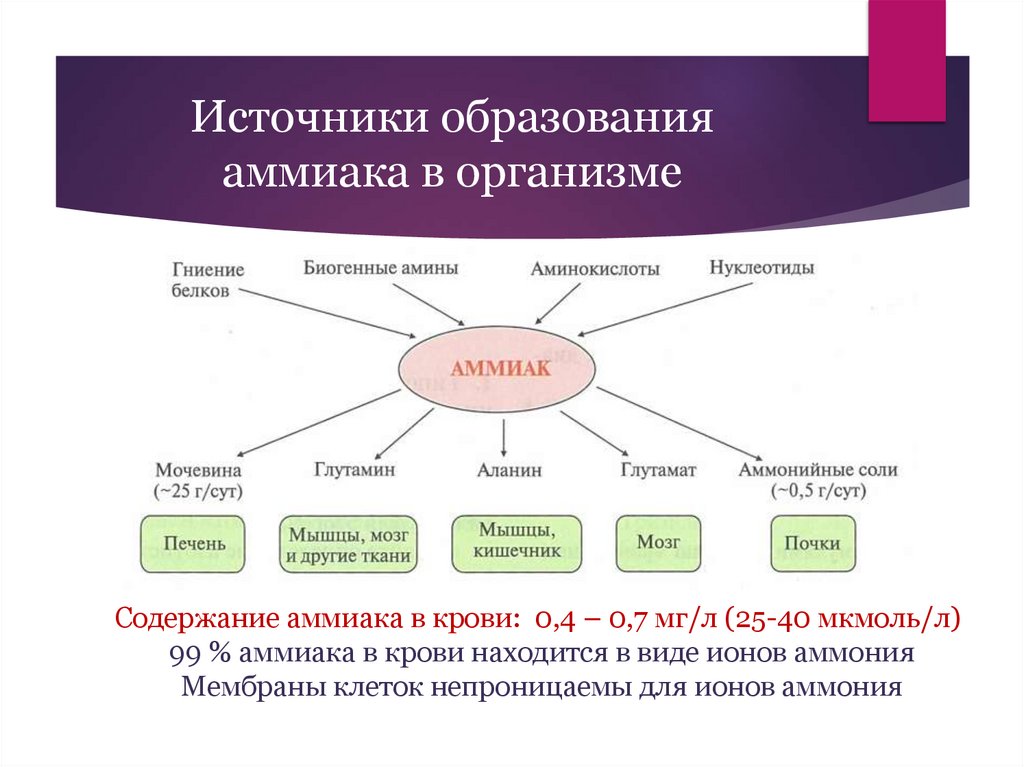
Источники образованияаммиака в организме
Содержание аммиака в крови: 0,4 – 0,7 мг/л (25-40 мкмоль/л)
99 % аммиака в крови находится в виде ионов аммония
Мембраны клеток непроницаемы для ионов аммония
29.
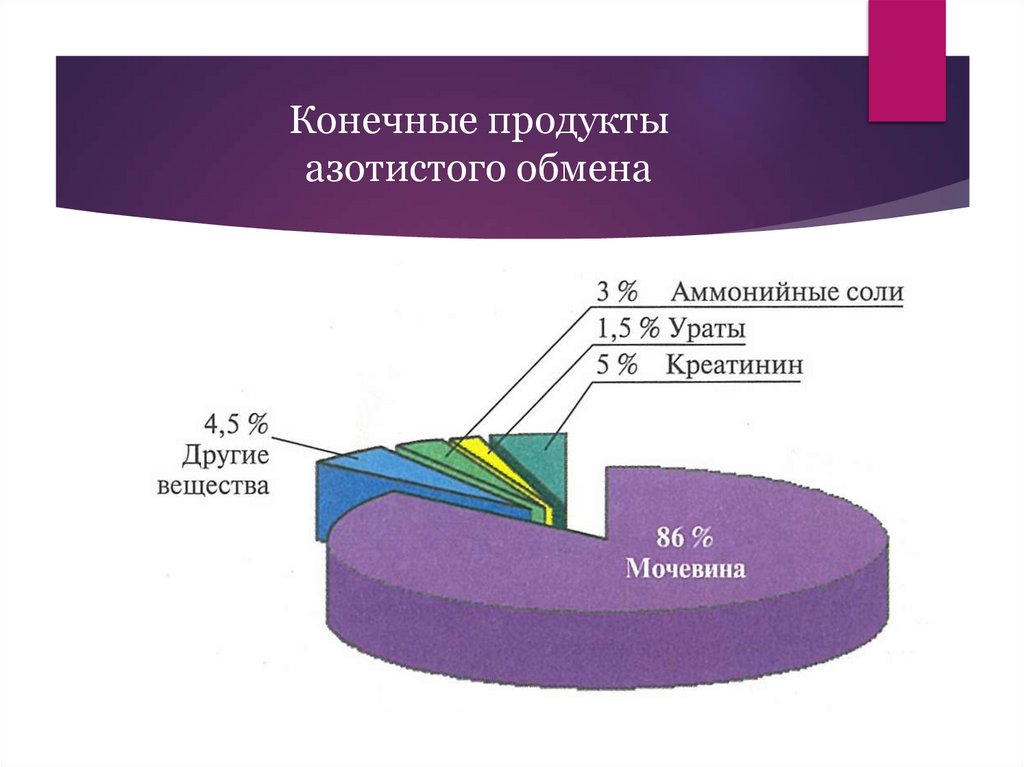
Конечные продуктыазотистого обмена
30.
Токсичность аммиака для ЦНС:механизм
Связывание Н+ → Алкалоз → Гипоксия (Н+ снижают сродство
гемоглобина к кислороду, за счет чего происходит отдача кислорода в
клетки, при дефиците протонов газообмен снижается) → Снижение
интенсивности тканевого дыхания и синтеза АТФ →
Гипоэнергетическое состояние
Снижение содержания α-КГ (т.к. он связывает аммиак) → Угнетение
обмена аминокислот и ЦТК (энергетического обмена)
Активация синтеза глутамина из глутамата → Снижение синтеза ГАМК
→ Повышение нервно-мышечной возбудимости, судороги
Нарушение транспорта ионов в нейроны
Накопление глутамина → Отек головного мозга
31.
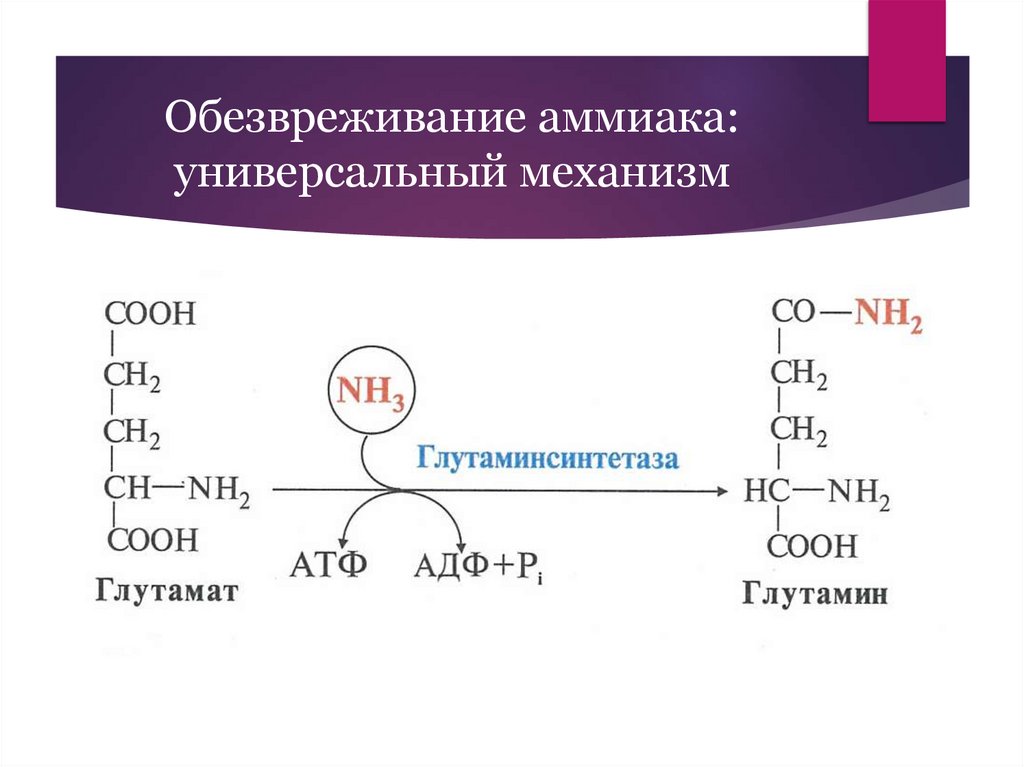
Обезвреживание аммиака:универсальный механизм
32.
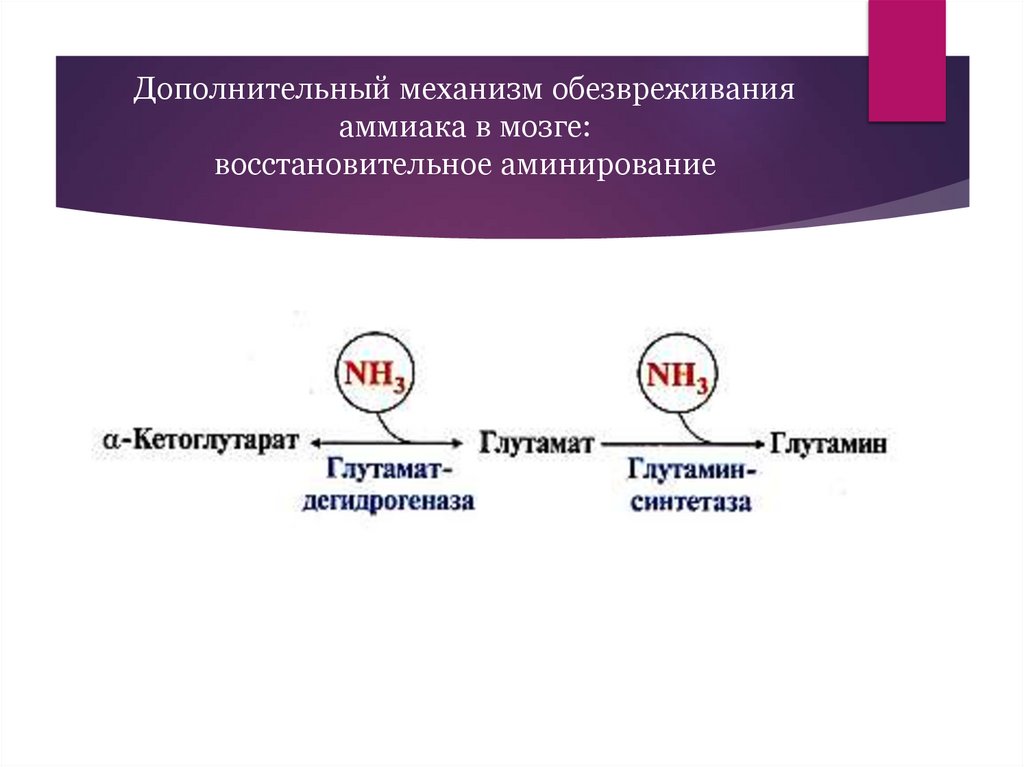
Дополнительный механизм обезвреживанияаммиака в мозге:
восстановительное аминирование
33.
Почему именно глутамат используется дляобезвреживания аммиака?
Наличие глутаминсинтетазы во всех клетках
Высокое сродство фермента к аммиаку
Глутамин – нейтральная аминокислота, переносится через
клеточные мембраны путем облегченной диффузии
o
Концентрация глутамина в крови:
7-2 мг/дл (больше чем других аминокислот)
o
Основной источник глутамина в крови – мышцы и мозг
o
Из крови глутамин поглощается почками и клетками
кишечника
34.
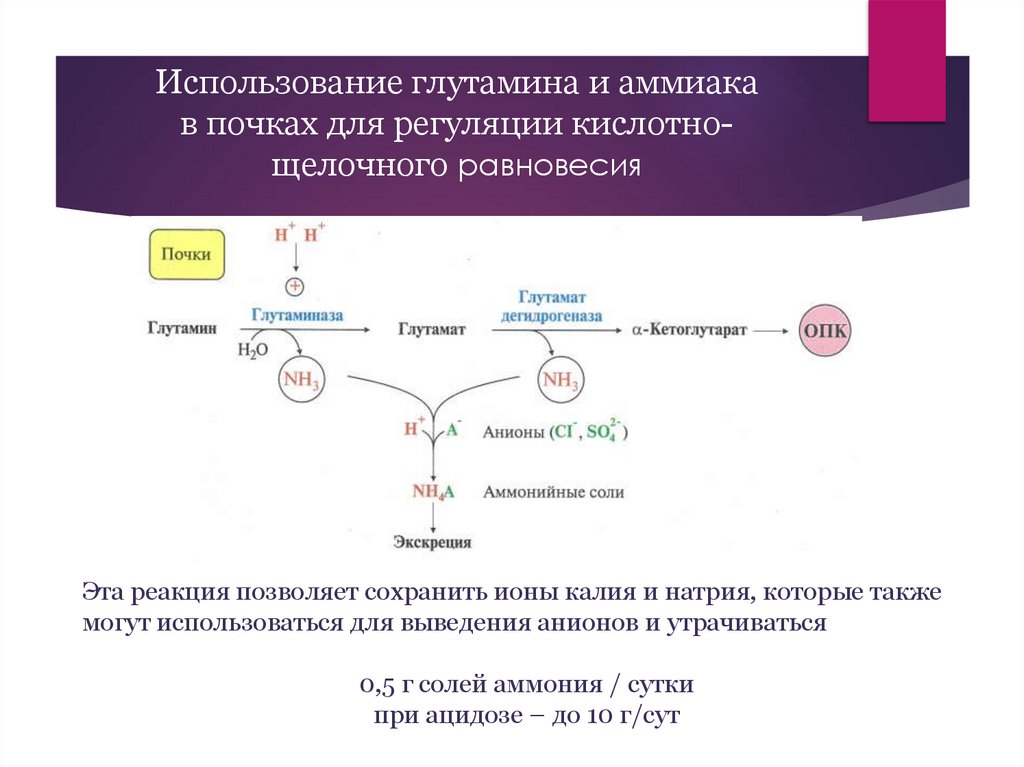
Использование глутамина и аммиакав почках для регуляции кислотнощелочного равновесия
Эта реакция позволяет сохранить ионы калия и натрия, которые также
могут использоваться для выведения анионов и утрачиваться
0,5 г солей аммония / сутки
при ацидозе – до 10 г/сут
35.
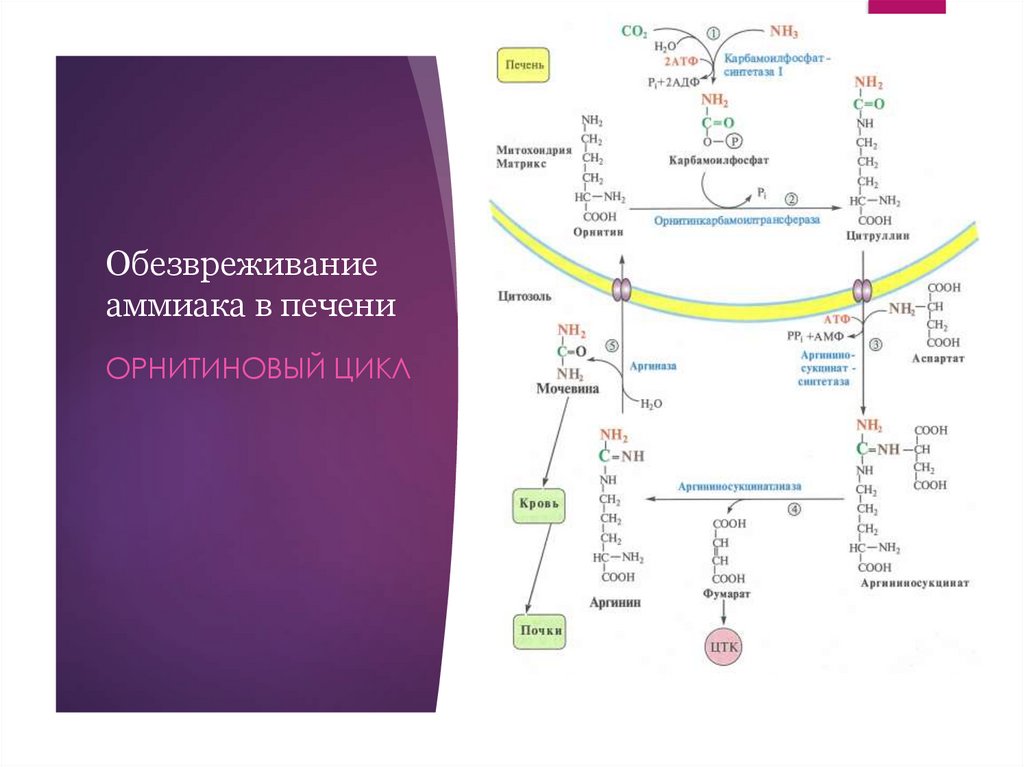
Обезвреживаниеаммиака в печени
ОРНИТИНОВЫЙ ЦИКЛ
36.
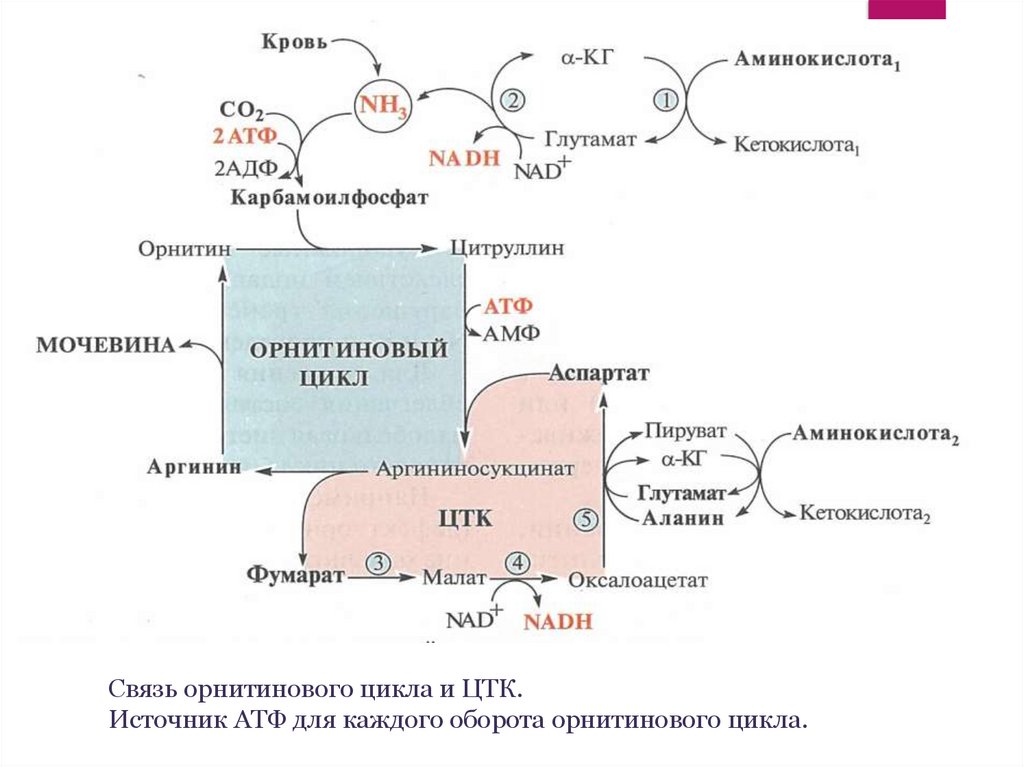
Связь орнитинового цикла и ЦТК.Источник АТФ для каждого оборота орнитинового цикла.
37.
Орнитиновый циклРоль орнитинового цикла:
обезвреживание аммиака
синтез аргинина
Эффективность работы цикла в обычных условиях: 60 %
Запас мощности необходим для предотвращения повышения
концентрации аммиака в крови
Скорость цикла увеличивается при голодании, длительных
физических нагрузках, избыточном белковом питании
Регуляция: индукция синтеза ферментов 1, 2, 5 реакции
38.
Мочевина – основной конечныйпродукт азотистого обмена
Хорошо растворима в воде, поэтому легко выводится в составе мочи
Мочевина фильтруется из крови в почечных клубочках; в канальцах
происходит пассивная реабсорбция
Норма мочевины в крови: 2,5 – 8 ммоль/л
Снижение уровня мочевины в крови – при патологии печени
Причины повышения уровня мочевины в крови:
патология почек (почечная недостаточность)
обезвоживание (при снижении объема жидкости и скорости тока мочи
усиливается реабсорбция в канальцах, даже если почки
функционируют нормально)
употребление больших количеств белка
активация катаболизма белков
39.
ГипераммониемияПовышенное содержание аммиака в крови
Причины:
заболевания печени (гепатит, цирроз)
наследственный дефект ферментов орнитинового цикла
вирус гриппа ингибирует Е1 (временные нарушения)
При увеличении аммиака в крови до 0,6 ммоль/л проявляется
его токсическое действие
40.
Наследственный дефект ферментоворнитинового цикла
Известны дефекты каждого из пяти ферментов орнитинового цикла
Патологии: гипераммониемия 1 и 2 типов (дефект Е1 и Е2),
цитрулинемия, аргининосукцинатная ацидурия, гипераргининемия
Частичная недостаточность активности ферментов характеризуется
задержкой умственного развития, рвотой, нарушением координации
движений, сонливостью, отвращением к белковой пище
Полное отсутствие активности хотя бы одного из ферментов приводит
к летального исходу
Все заболевания вызывают гипераммониемию различной степени
(наиболее выраженную при 1 и 2 типе), повышение уровня глутамина,
снижение содержания глутамата и альфа-кетоглутарата,
гипоэнергетическое состояние
41.
Как снизить концентрацию аммиака?Малобелковая диета
Введение глутамата для активации универсального механизма
обезвреживания аммиака
Введение цитрата для стимуляция образования альфакетоглутарата
При наследственных дефектах ферментов орнитинового
цикла, кроме того, введение аргинина, бензоата натрия с
целью увеличения экскреции промежуточных азотсодержащих метаболитов
Гемодиализ
42.
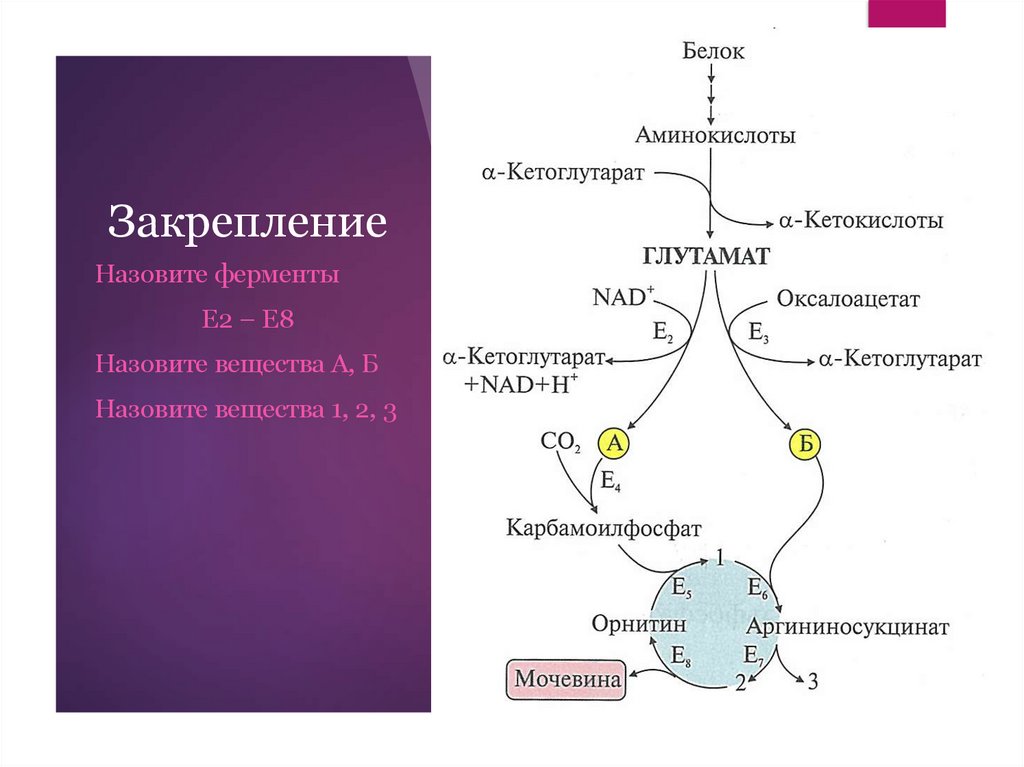
ЗакреплениеНазовите ферменты
Е2 – Е8
Назовите вещества А, Б
Назовите вещества 1, 2, 3
43.
ЗаключениеЗначение обмена белков и аминокислот обусловлено важной
ролью данных соединений в организме человека.
Метаболизм аминокислот включает общие и специфические
пути обмена. К общим реакциям обмена аминокислот относятся
трансаминирование, дезаминирование и декарбоксилирование.
При катаболизме аминокислот в реакциях дезаминирования
образуется токсичный для нервной системы аммиак,
обезвреживание которого происходит преимущественно в
печени.
44.
Литература1. Биологическая химия с упражнениями и задачами:
учебник / ред. С. Е. Северин. - М.: ГЭОТАР-Медиа,
2013. - 624 с. (С. 407 – 428)
2. Биохимия: учебник для ВУЗов / Е. С. Северин -М.:
ГЭОТАР-Медиа, 2007. -784 с. (С. 458-475)
В презентации использованы рисунки из учебника 2























 biology
biology








