Similar presentations:
Жёсткость воды и способы её устранения
1.
ХИМИЯ,9КЛАСС
ЖЁСТКОСТЬ ВОДЫ И
СПОСОБЫ ЕЁ УСТРАНЕНИЯ
2.
Такаявода…
Такая разная
разная вода…
3.
Общие сведенияКак утверждают ученые, жизнь на Земле возникла
в водной среде. Все живые организмы почти на
2/3 состоят из воды. Качество жизни людей
напрямую связано с запасами пресной воды,
которые составляют лишь 2,5% от общего
количества воды на Земле.
По данным ООН, 1.1 Млрд. человек испытывает
нехватку питьевой воды.
Политики утверждают, что 21 Век будет веком
войн за пресную воду.
Основными приоритетами ЮНЕСКО в ДОУР
(Десятилетие ООН по Образованию в интересах
Устойчивого Развития) названы образование для
всех, грамотность и водные ресурсы.
Вопрос заключается не только в наличии пресной
воды, но и в её качестве, безопасности для
потребления.
4.
Вода, прежде чем попасть в колодец иливодопроводную сеть, просачивается сквозь
почву и насыщается в ней растворимыми
солями.
Природные воды содержат сульфаты и
бикарбонаты кальция и магния, т.е. катионы
Са2+ и Мg2+, анионы SO42-, CL- и НСО3-.
5.
СЛОВАРЬЖесткость воды – это свойство
воды связанное с содержанием
растворимых в ней соединений
кальция и магния:гидрокарбонатов,
сульфатов, хлоридов.
6.
Единицы измерения жесткости воды:мг-экв/л
мягкая вода – до 3 мгэкв/л;
вода средней жесткости –
от 3 до 6 мг-экв/л;
жесткая вода – более
6 мг-экв/л;
очень жесткая вода –
более 9 мг-экв/л.
7.
Нормы жесткости водыРоссия
Европа
Не более 7 мг-экв/л
Не более 1,2 мг-экв/л
8.
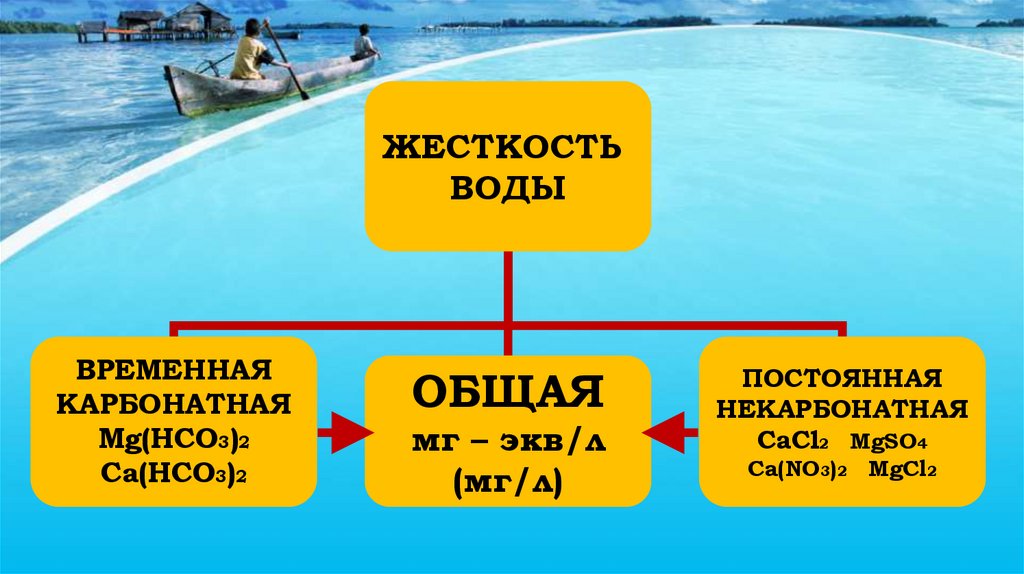
ЖЕСТКОСТЬВОДЫ
ВРЕМЕННАЯ
КАРБОНАТНАЯ
Mg(HCO3)2
Ca(HCO3)2
ОБЩАЯ
мг – экв/л
(мг/л)
ПОСТОЯННАЯ
НЕКАРБОНАТНАЯ
CaCl2 MgSO4
Ca(NO3)2 MgCl2
9.
Способы устранения жесткостиВременная жесткость устраняется
кипячением.
а) Ca(HCO3)2=СаСО3↓+СО2↑+Н2О;
Ca2+ + 2 HCO3- = СаСО3↓+СО2↑+Н2О.
б) Mg(HCO3)2 = (МgОН) 2 СО3↓ +3СО2↑ + Н2О;
Mg2+ +2 HCO3- = (МgОН) 2 СО3↓ +3СО2↑ + Н2О;
10.
Постоянная жесткость устраняется добавлением соды, но неустраняется кипячением.
а) CaSO4 + Na2CO3 = CaCO3↓ + Na2SO4;
CaSO4 +2Na+ + CO32- = CaCO3↓ + 2Na+ + SO42-;
CaSO4 + CO32- = CaCO3↓ + SO42-.
б)MgCl2 + Na2CO3 = MgCO3↓ + 2NaCl
Mg2+ + 2Cl- +2Na+ + CO32- = MgCO3↓ +2Na + + 2Cl-;
Mg2+ + CO32- = MgCO3↓ .
11.
Снижение жесткости водыв домашних условиях
Вымораживание
Кипячение
Торфование
12.
Вредное влияние жесткой воды в быту:Мыло плохо пенится и
отмывает загрязнения.
Образуются разводы и
твердый налет на
сантехнике и
поверхности посуды.
В водонагревательных
приборах образуется
осадок выпадает в виде
накипи.
На белье после стирки
появляются пятна,
разводы и грязные налет.
13.
Вредное влияние жесткой водына коммуникации:
Накипь истончает стенки
коммуникаций, разрушая их.
Выходят из строя крупные
водонагревательные
установки.
Соли закупоривают
коммуникационные сети и
увеличивают энергозатраты.
14.
Это интересно…Появлением понятия «жесткость» мы обязаны стирке.
Давным-давно женщины обнаружили интересный феномен:
после стирки в разных водоемах одна и та же одежда
бывает разной на ощупь. Всё дело в том, что волокна ткани
вбирают в себя растворенные в воде соли: чем больше
солей, тем жестче становится ткань. Соответственно, воду
с высоким содержанием солей стали называть жесткой, с
низким их содержанием - мягкой.













 chemistry
chemistry








