Similar presentations:
Белковый обмен в организме (лекция № 6)
1. ЛЕКЦИЯ №6.
1.Общая характеристика обмена белков.2. Переваривание белков при
пищеварении, транспорт аминокислот.
3.Внутриклеточный обмен аминокислот.
4.Катаболизм аминокислот.
5.Глюкогенные и кетогенные
аминокислоты
2. БЕЛКИ
• Органические, высокомолекулярные, азотсодержащие вещества(16%N)
• Мономер белка- аминокислота (20 протеиногенных)
3. Потребность в белках
• Физиологический минимум = 35 -50 г в сутки.• Оптимум – 85 -100 г в сутки
• Качество поступающего белка (биологическая ценность)
определяется его аминокислотным составом и биологической
доступностью (животный или растительный белок) и
растворимостью (способностью гидролизоваться). Наибольшей
биологической ценностью обладают яичный альбумин и
казеиноген молока.
• 400 – 500 г белка ежесуточно синтезируется в организме (до
300 г экзогенных и эндогенных аминокислот подвергается
реутилизации).
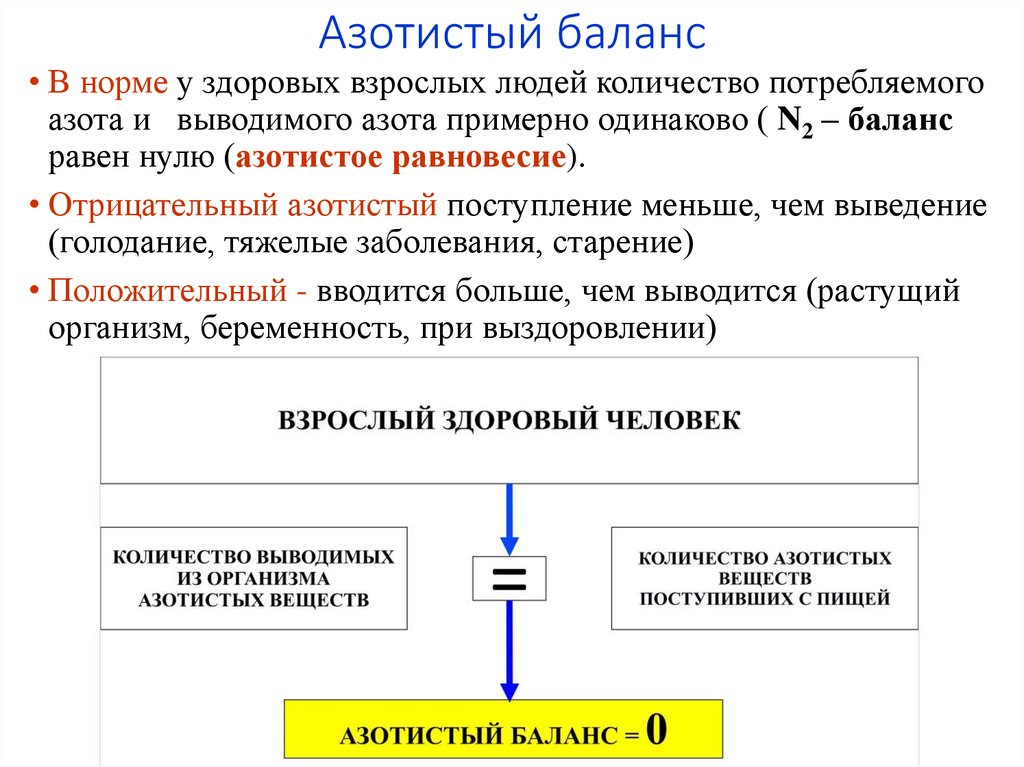
4. Азотистый баланс
• В норме у здоровых взрослых людей количество потребляемогоазота и выводимого азота примерно одинаково ( N2 – баланс
равен нулю (азотистое равновесие).
• Отрицательный азотистый поступление меньше, чем выведение
(голодание, тяжелые заболевания, старение)
• Положительный - вводится больше, чем выводится (растущий
организм, беременность, при выздоровлении)
5. Белковый обмен в организме протекает с высокой скоростью
• Предполагается, что в организме взрослого человека ежедневноразрушается до аминокислот 300-400 г белка (протеолиз)
• В тоже время примерно то же самое количество аминокислот
включается во вновь образованные молекулы белков (белковый
биосинтез).
• Высокий оборот белка в организме необходим потому, что многие
белки относительно недолговечны: биохимический полупериод
составляет 2-8 дней.
• Более
короткоживущими
оказываются
ключевые
ферменты промежуточного обмена. Они обновляются спустя
несколько часов после синтеза.
• Это постоянное разрушение и ресинтез позволяют клеткам быстро
приводить в соответствие с метаболическими потребностями
уровень и активность наиболее важных ферментов.
• В противоположность этому особенно долговечны структурные
белки, гистоны, гемоглобин или компоненты цитоскелета.
6. Белковый обмен в организме протекает с высокой скоростью
• Коэффициент Рубнера (коэффициент изнашивания) = 53мг N2 /кг массы тела.
23 г белка распадается ежесуточно.
• Т50 для белков всего тела = 80 суткам.
• Медленнее всего обновляются белки соединительной и
мышечной
ткани
(до полугода)
• Быстрее всего – белки крови (10-14 дней), ферменты,
гормоны, рецепторы
• Чувствительны к белковому голоданию нервная и
эндокринная системы (в первую очередь – кора головного
мозга).
7.
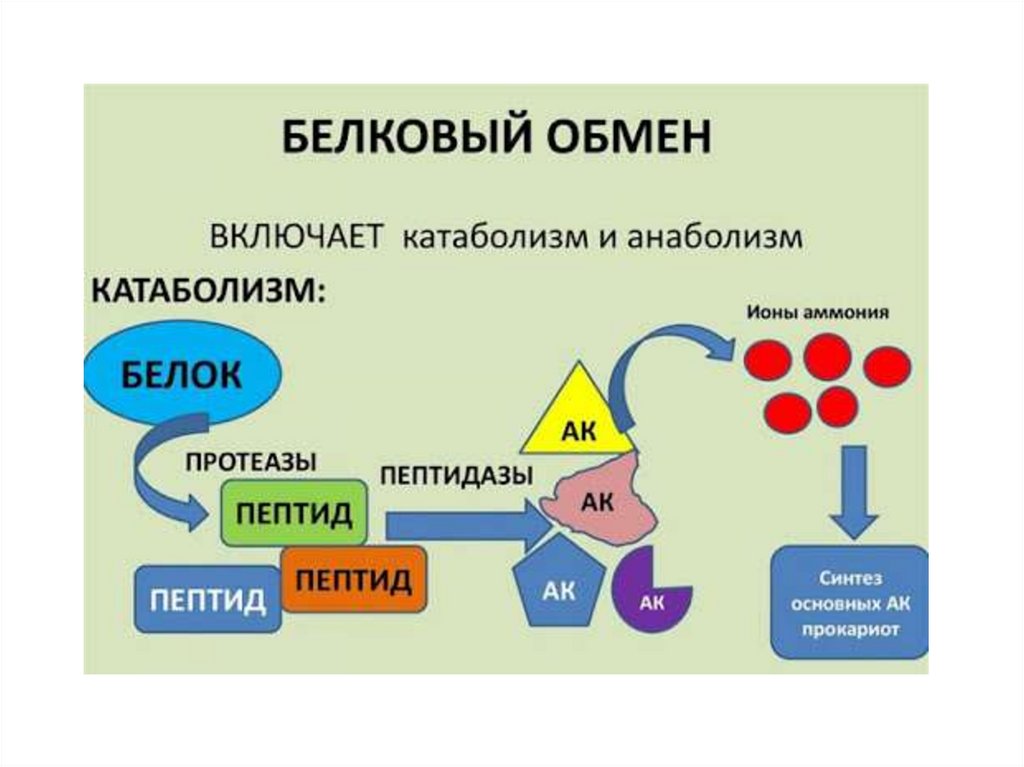
8. Обмен белка и аминокислот
• Катаболизм:• 1.гидролиз белка до аминокислот (внешний
этап в полости ЖКТ), в лизосомах,
протеасомах клеток.
• 2. дезаминирование, декарбоксилирование,
окисление углеродного скелета и
специфические превращения аминокислот по
радикалу.
• Анаболизм:
• 1.биосинтез аминокислот
• 2. биосинтез белков
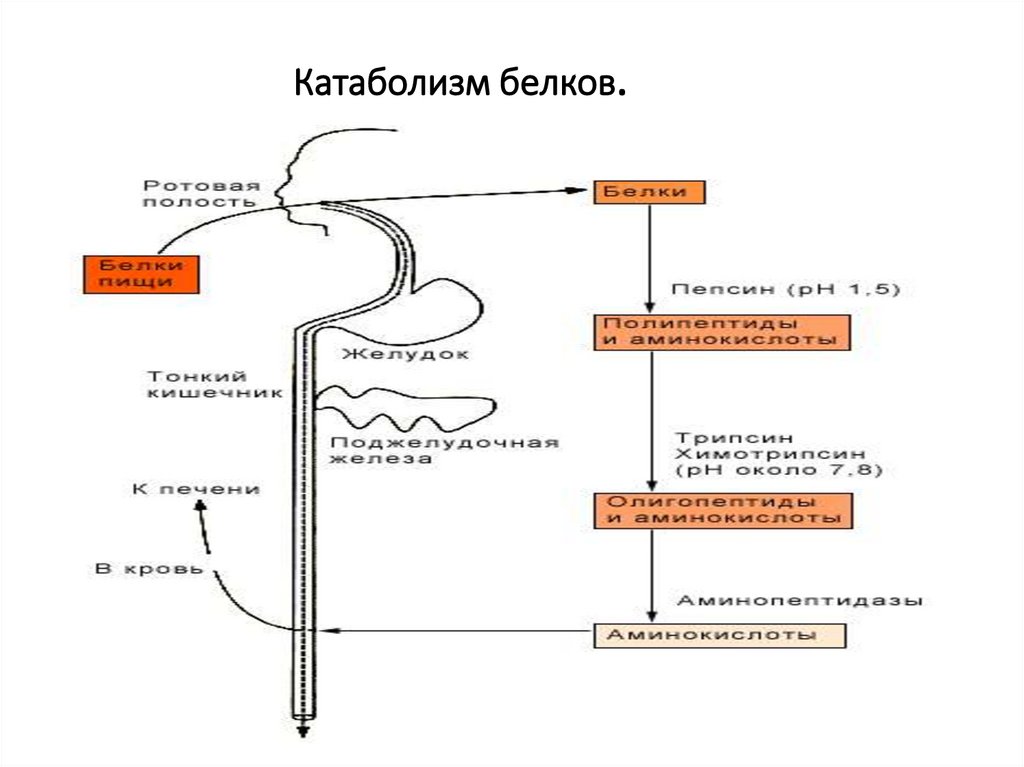
9. Катаболизм белков.
10.
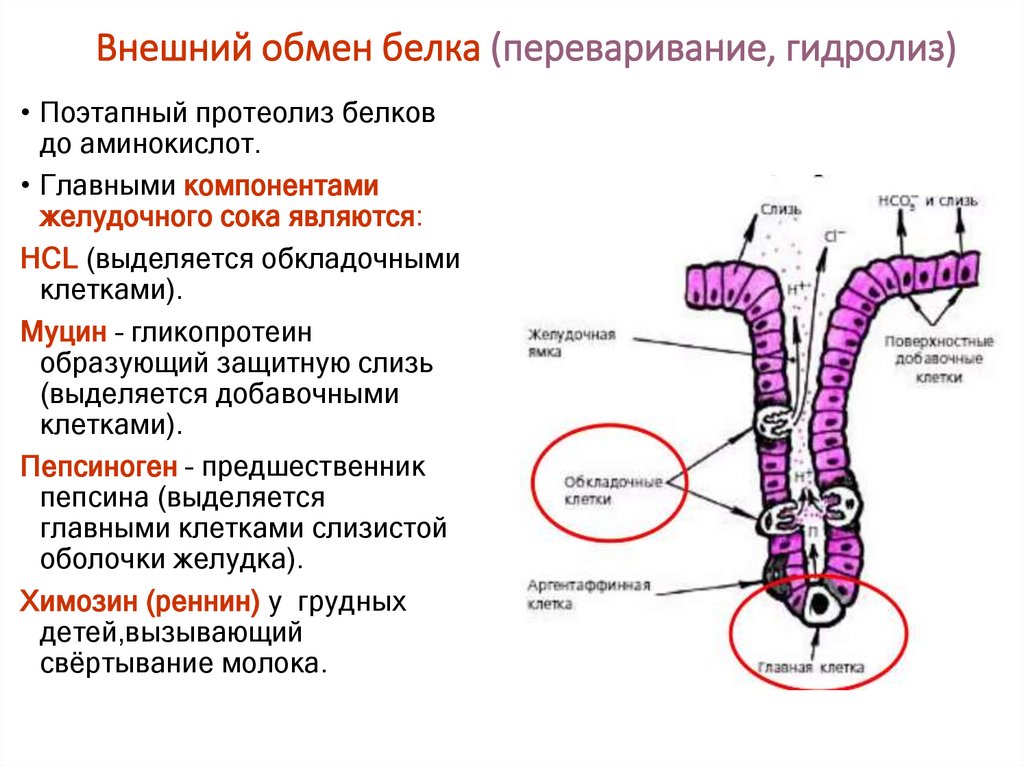
11. Внешний обмен белка (переваривание, гидролиз)
• Поэтапный протеолиз белковдо аминокислот.
• Главными компонентами
желудочного сока являются:
НСL (выделяется обкладочными
клетками).
Муцин – гликопротеин
образующий защитную слизь
(выделяется добавочными
клетками).
Пепсиноген – предшественник
пепсина (выделяется
главными клетками слизистой
оболочки желудка).
Химозин (реннин) у грудных
детей,вызывающий
свёртывание молока.
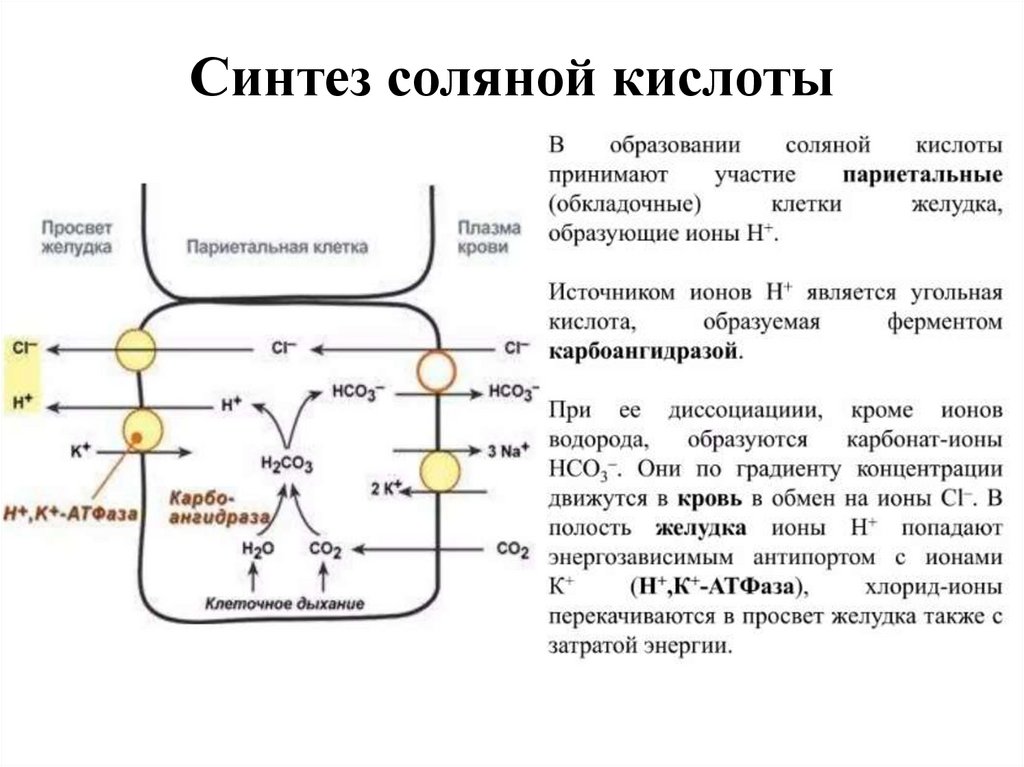
12. Роль соляной кислоты
1. Создает кислую среду в полости желудка (рН 1,5 2,условия для пепсина.2. Денатурирует пищевые белки, улучшая их
протеолиз.
3. Оказывает бактерицидное действие.
4. Регулирует поступление пищи из желудка в 12 –
перстную кишку.
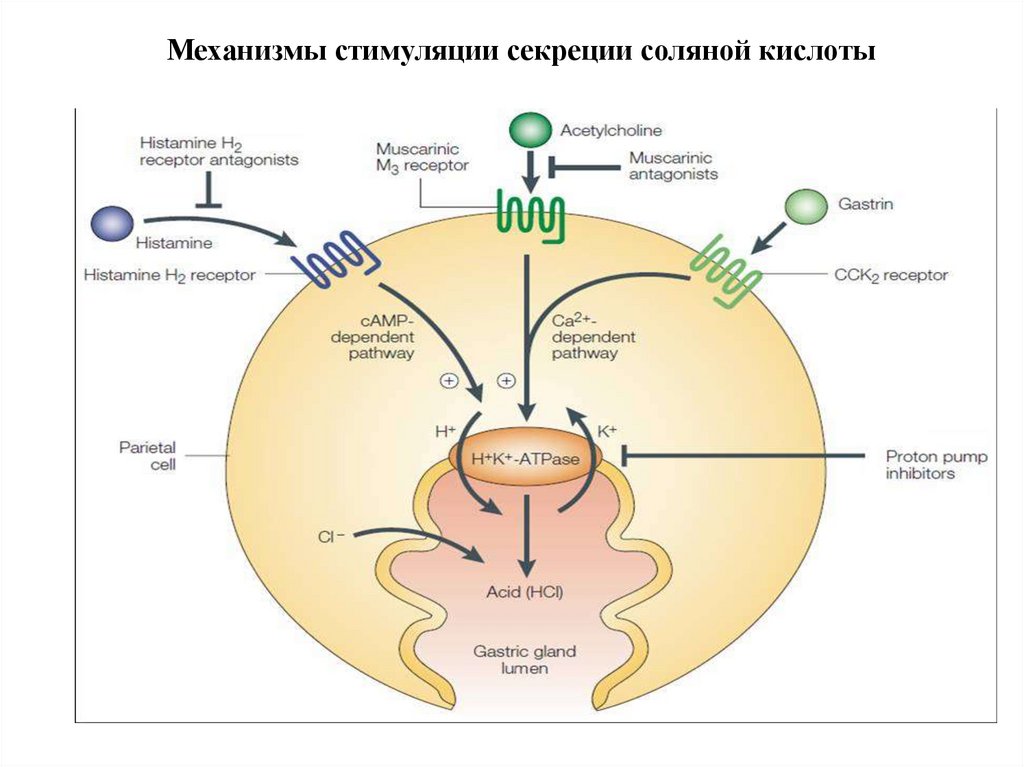
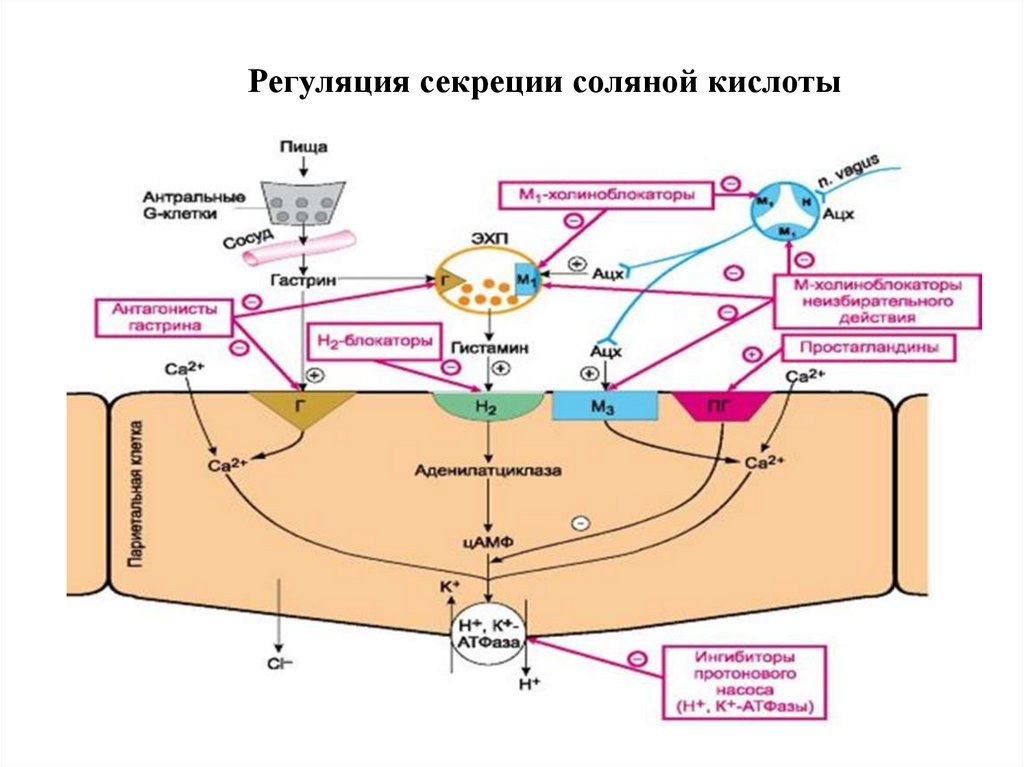
• Секреция НСl активируется гистамином
13. Синтез соляной кислоты
14. Механизмы стимуляции секреции соляной кислоты
15. Регуляция секреции соляной кислоты
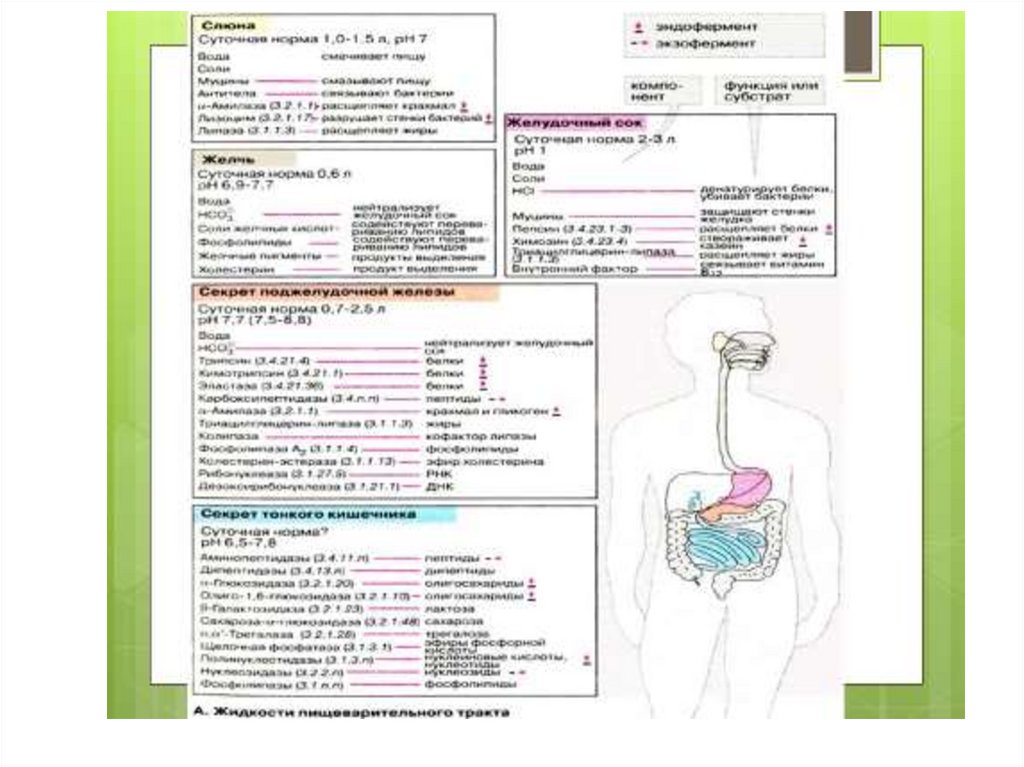
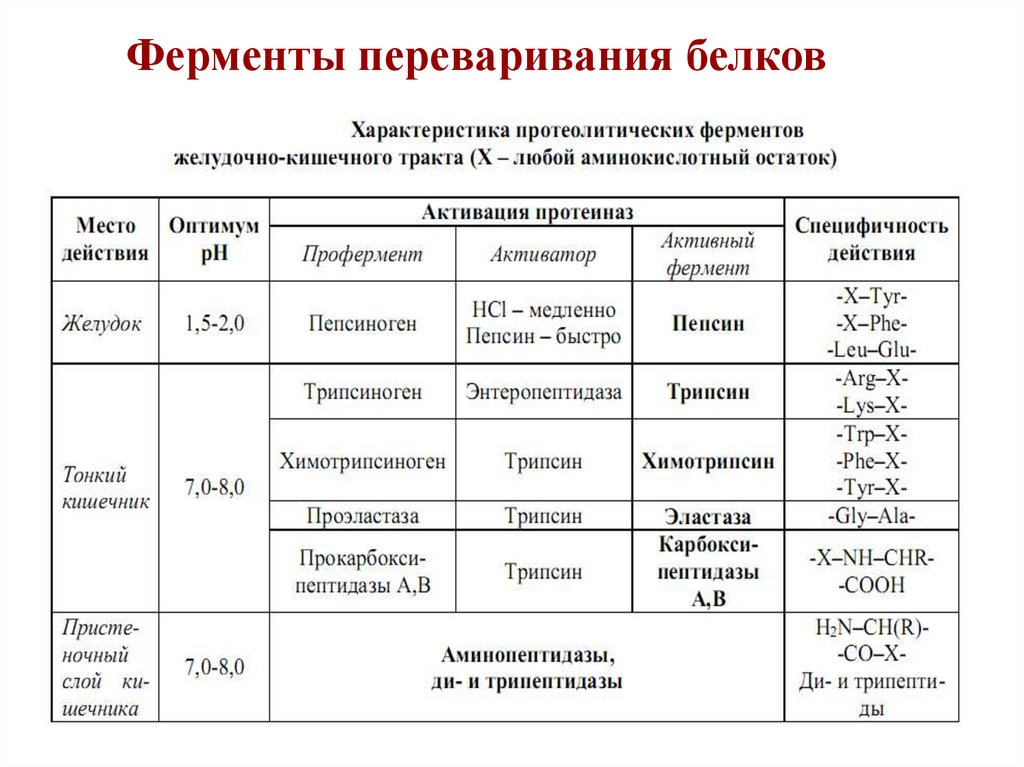
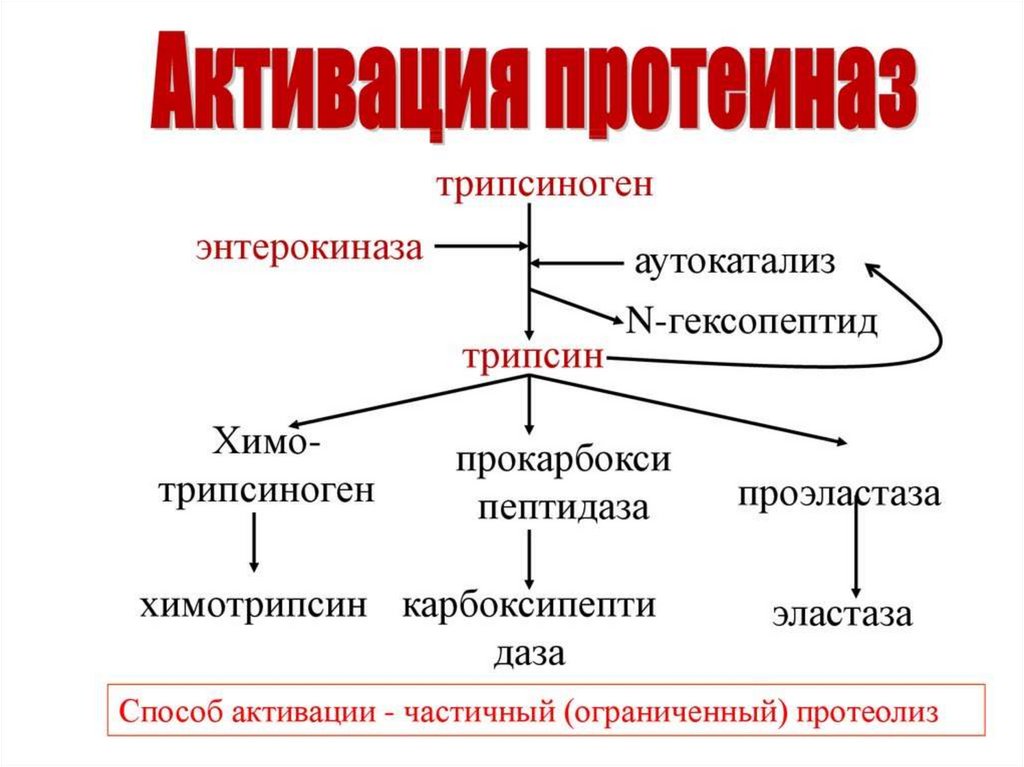
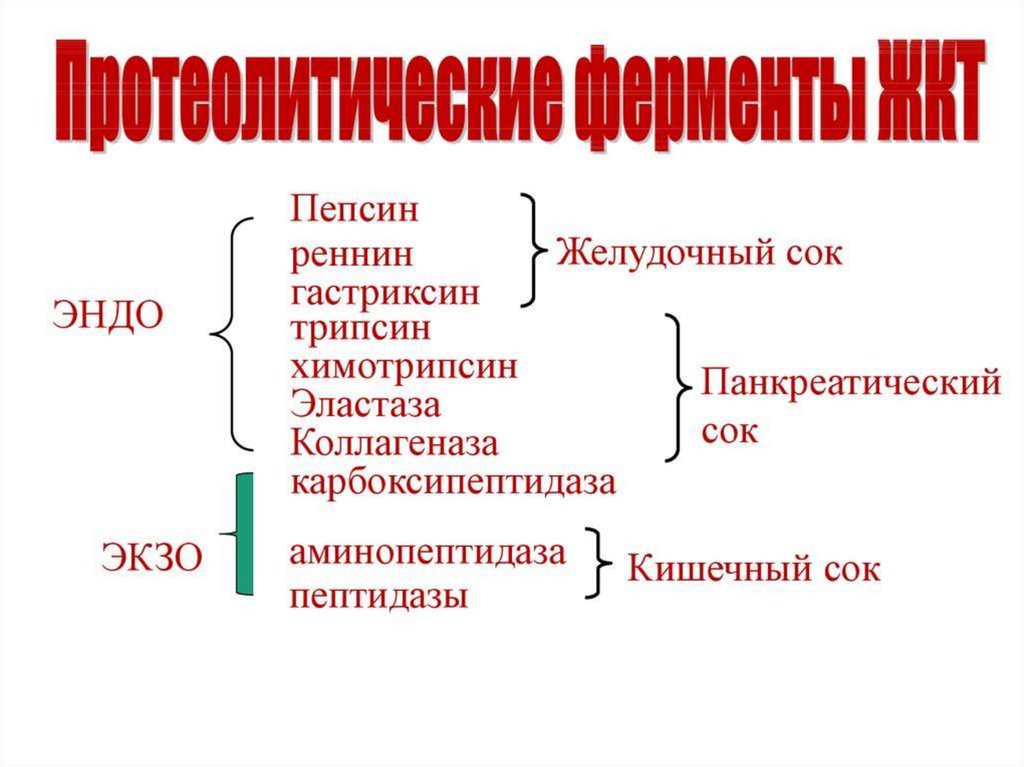
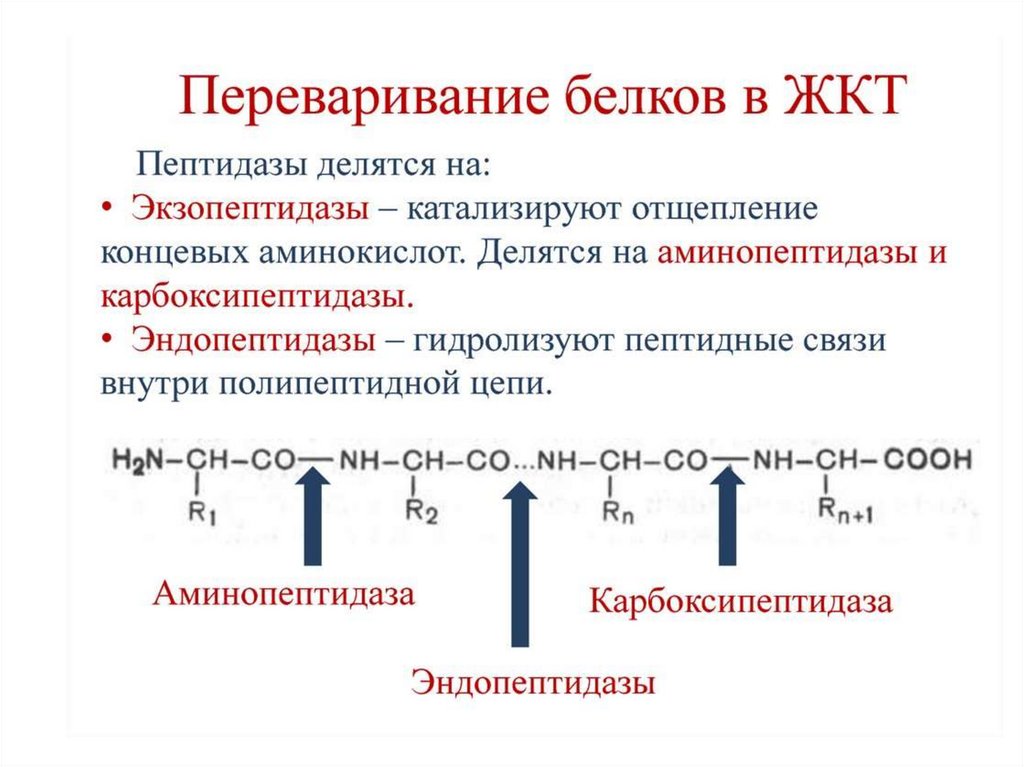
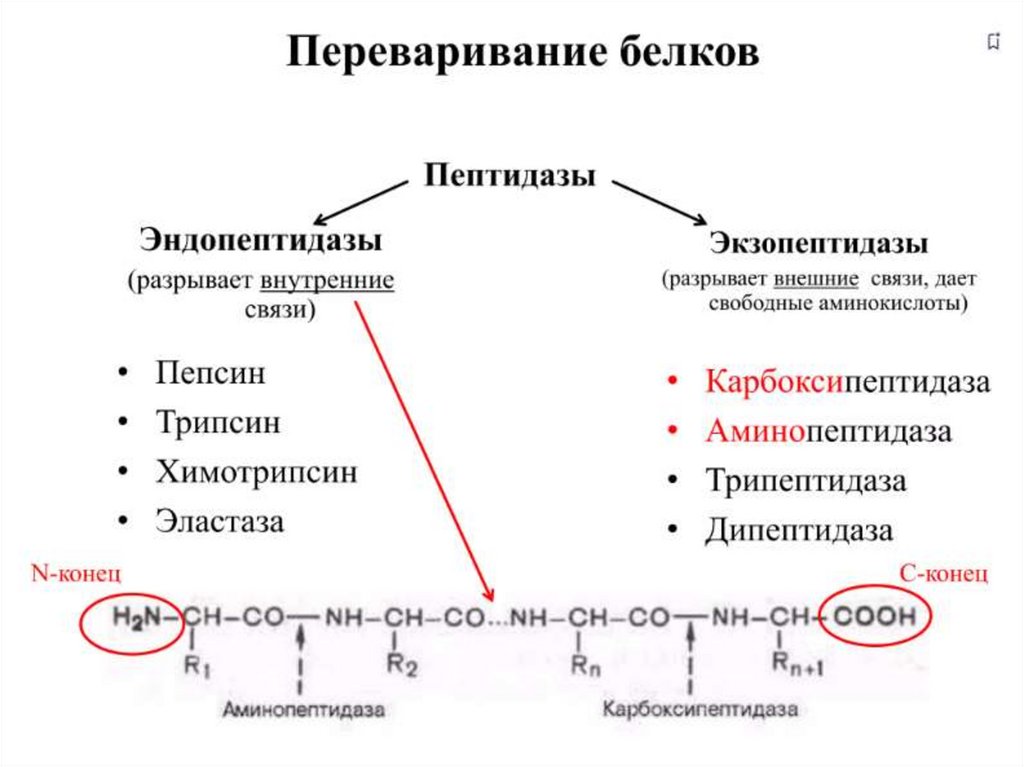
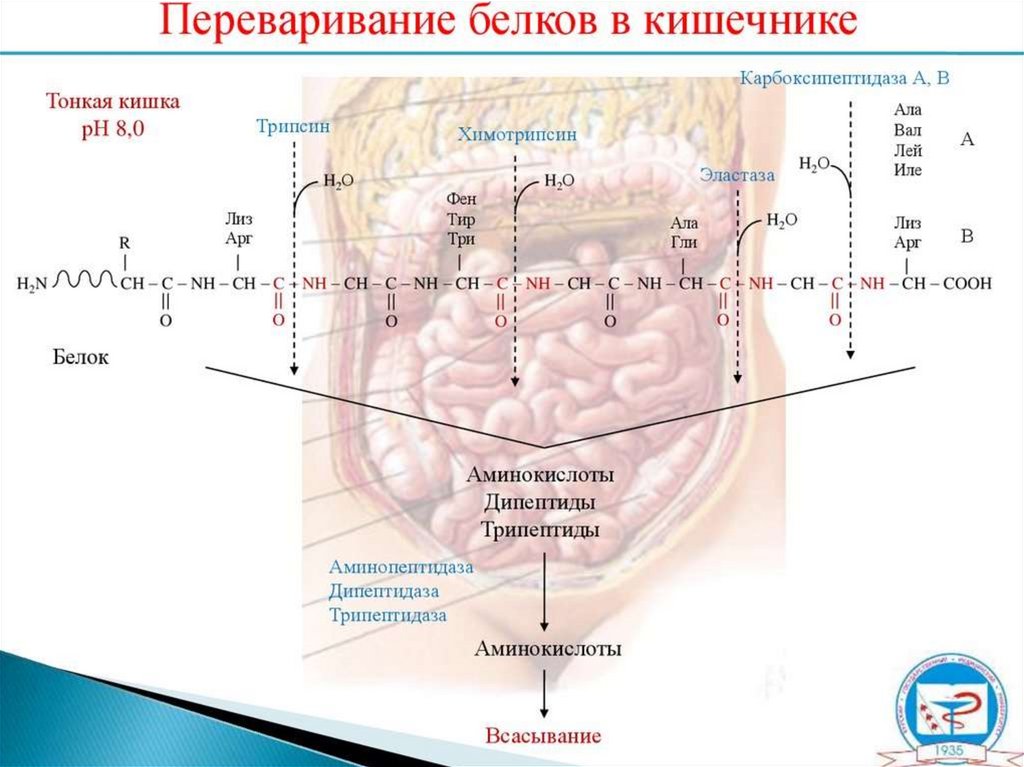
16. Ферменты переваривания белков
17.
18.
19.
20.
21.
22.
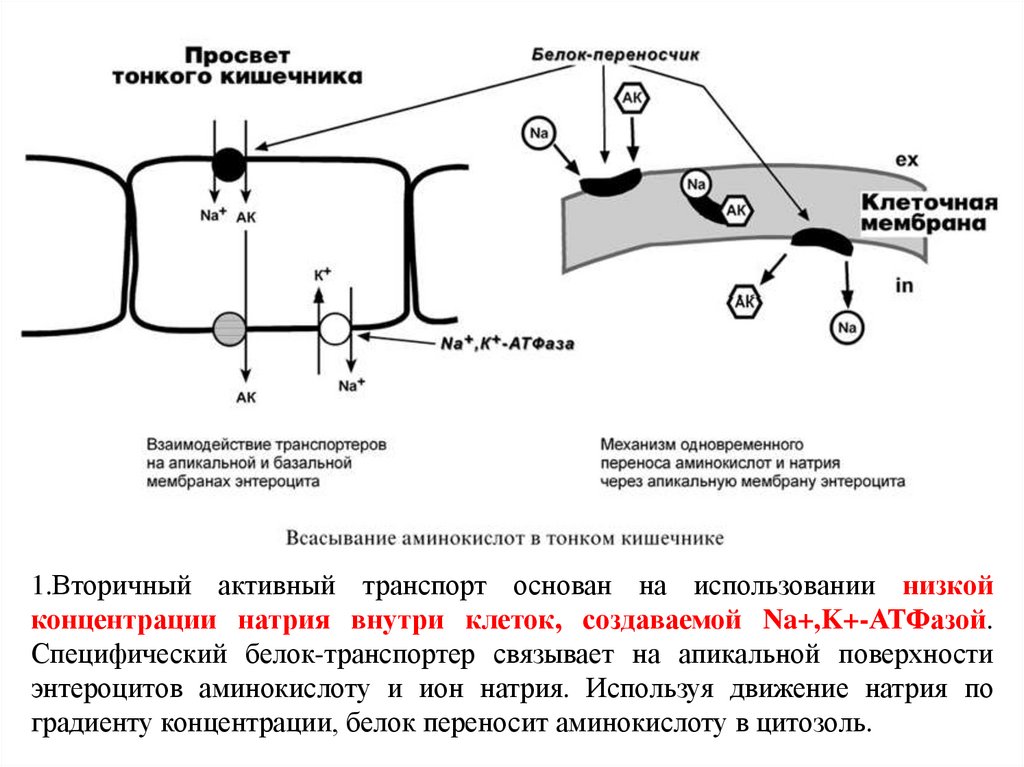
23. Всасывание аминокислот в кишечнике
в кровь (95%) и в лимфуПеренос аминокислот через мембраны клеток, как в
кишечнике, так и в других тканях, осуществляется при
помощи двух механизмов: вторичный активный
транспорт и глутатионовая транспортная система.
1) В мембранах энтероцитов кишечных ворсинок –
несколько систем активного транспорта (Na+зависимый симпорт), для аминокислот с различными
радикалами.
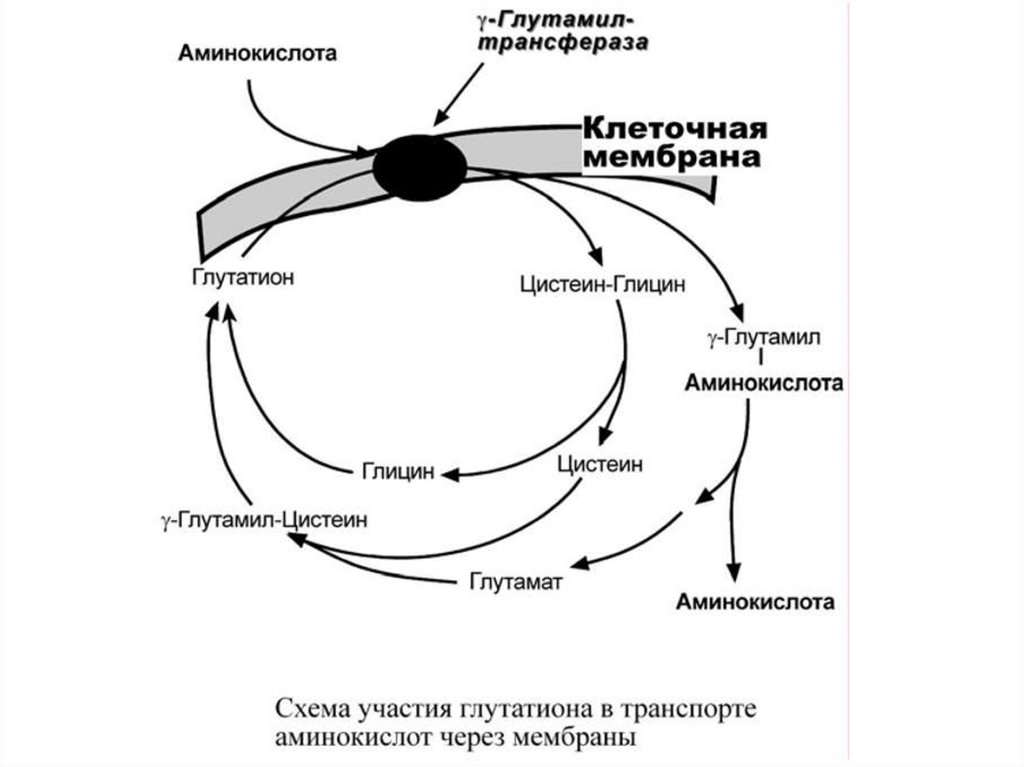
2)Глутамилтрансфераза
–
фермент, способный осуществлять трансмембранный
перенос аминокислот и пептидов.
24.
25.
1.Вторичный активный транспорт основан на использовании низкойконцентрации натрия внутри клеток, создаваемой Na+,K+-АТФазой.
Специфический белок-транспортер связывает на апикальной поверхности
энтероцитов аминокислоту и ион натрия. Используя движение натрия по
градиенту концентрации, белок переносит аминокислоту в цитозоль.
26.
2.Транспорт аминокислот в комплексе с глутатионом припомощи
фермента
γ-глутамил-трансферазы
–
для
нейтральных аминокислот.
• Переносчиком некоторых аминокислот (обычно нейтральных) по
этой
схеме
является
трипептид
глутатион
(γглутамилцистеилглицин).
• При взаимодействии глутатиона с аминокислотой на внешней
стороне
клеточной
мембраны
при
участии
глутамилтрансферазы -глутамильный остаток связывает
аминокислоту и происходит ее перемещение внутрь клетки.
Глутатион при этом распадается на составляющие
• После отделения аминокислоты происходит ресинтез
глутатиона.
27.
28. Оставшиеся аминокислоты
Примерно 5% АКПри ухудшении всасывания аминокислот, при избытке
белковой пищи, при нарушении деятельности
пищеварительных желез недопереваренные фрагменты
белков
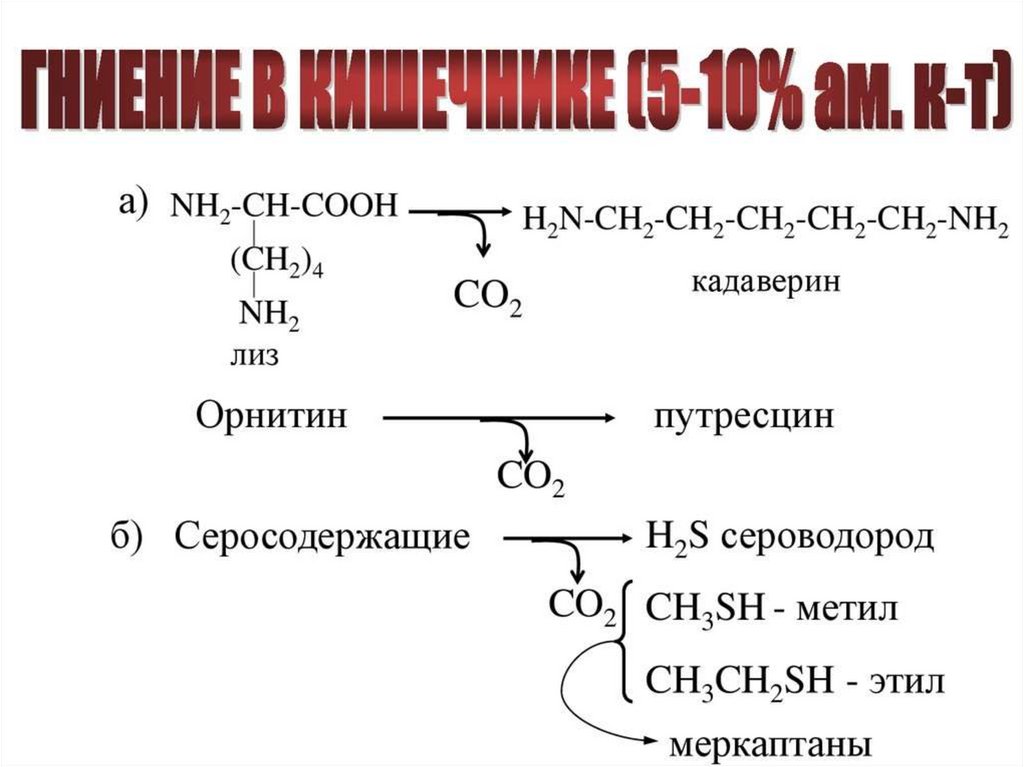
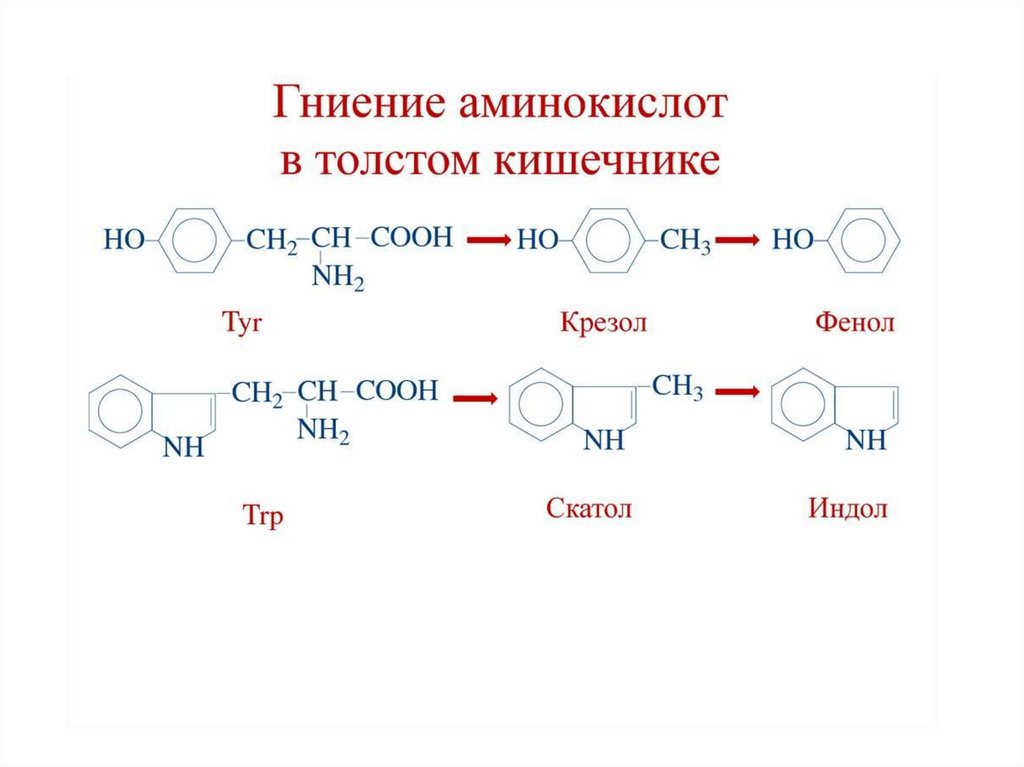
• При действии микрофлоры в толстом кишечнике
происходят превращения АК - гниение белков - с
образованием токсических продуктов:
• из тирозина → крезол, фенол,
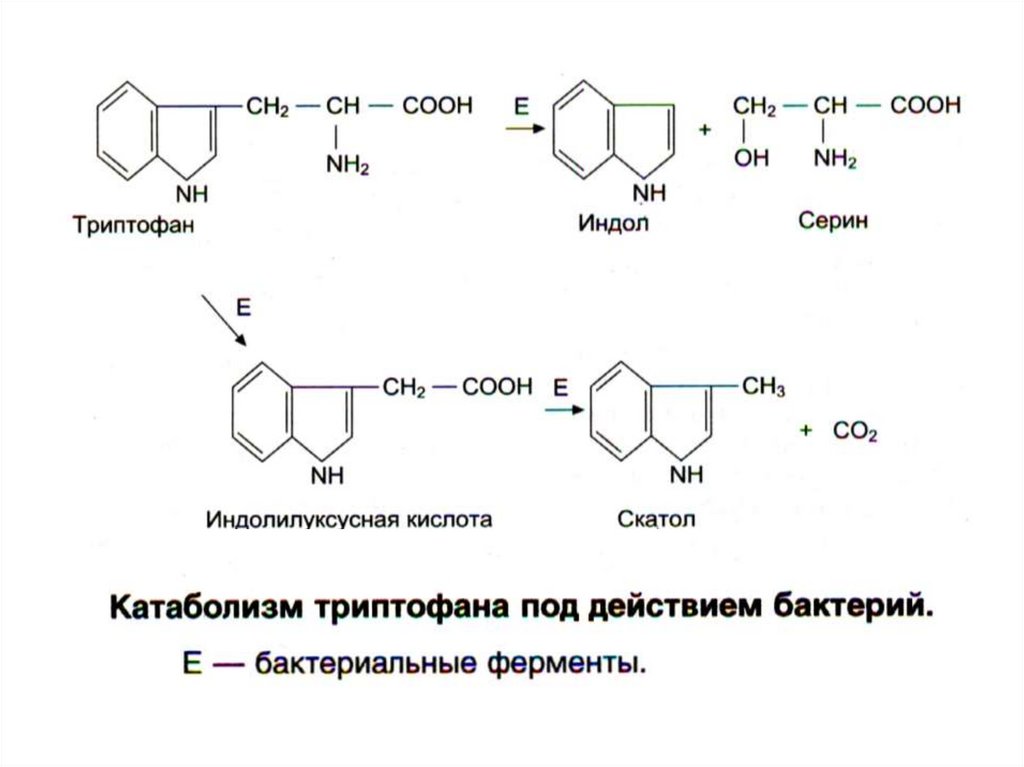
• из триптофана → скатол, индол,
• из орнитина → путресцин
• из лизина → кадаверин
• серосодержащие → сероводород, меркаптан,
• образуются также аммиак, СО2.
29.
30.
31.
32. Гниение белков в кишечнике
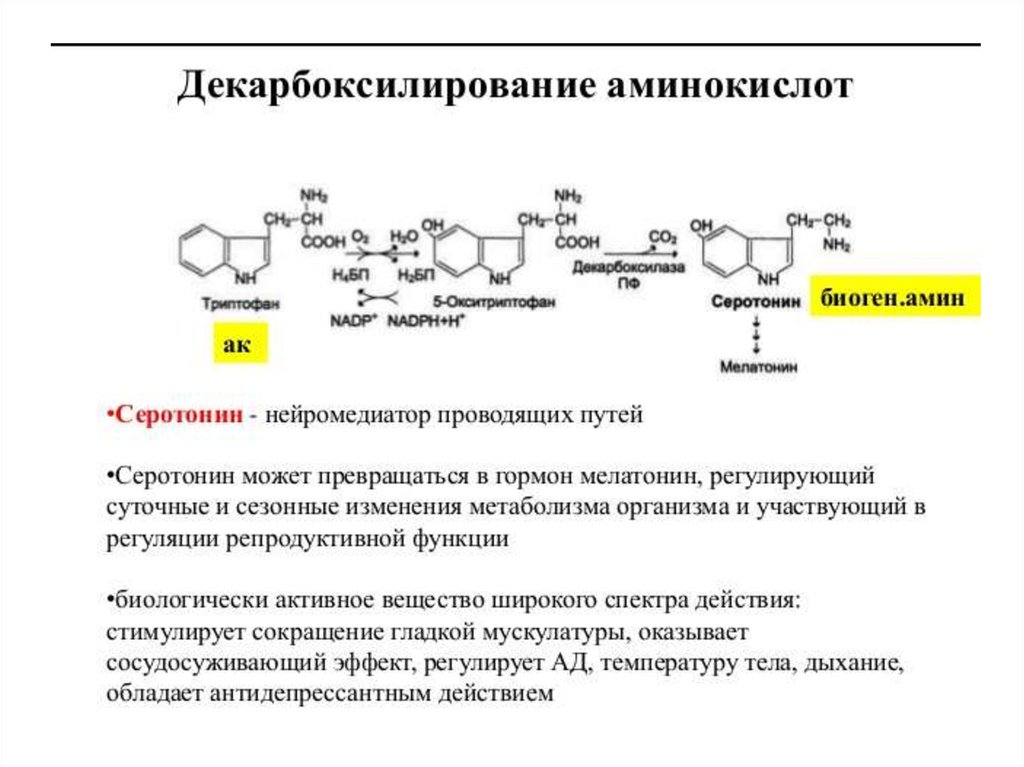
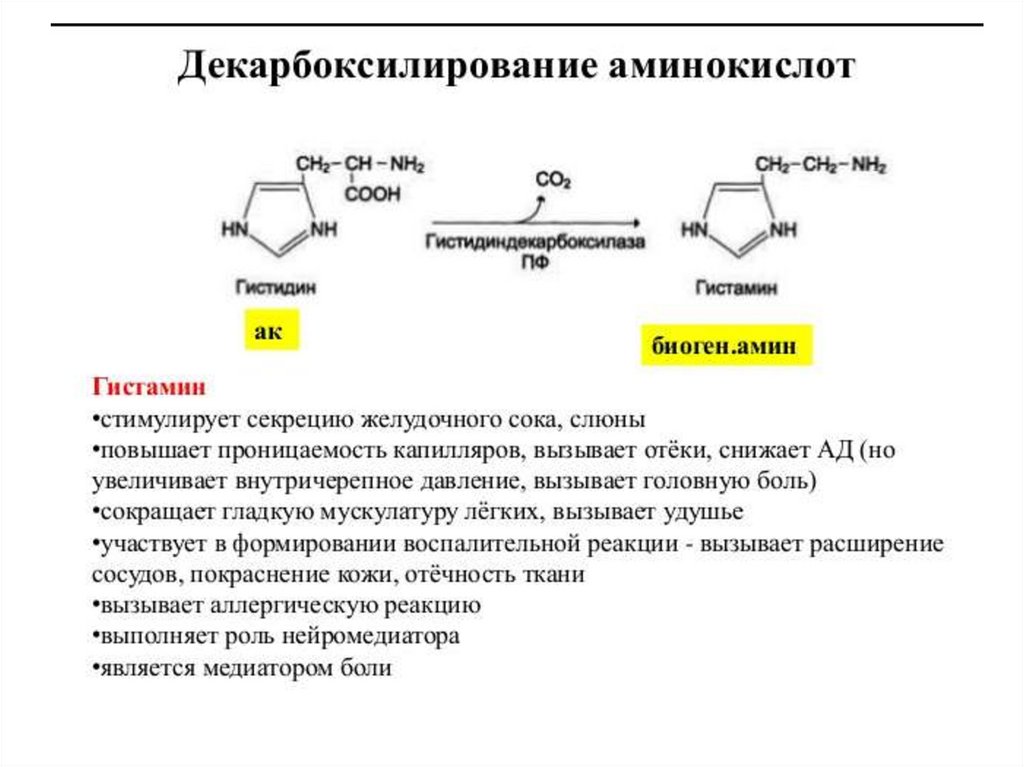
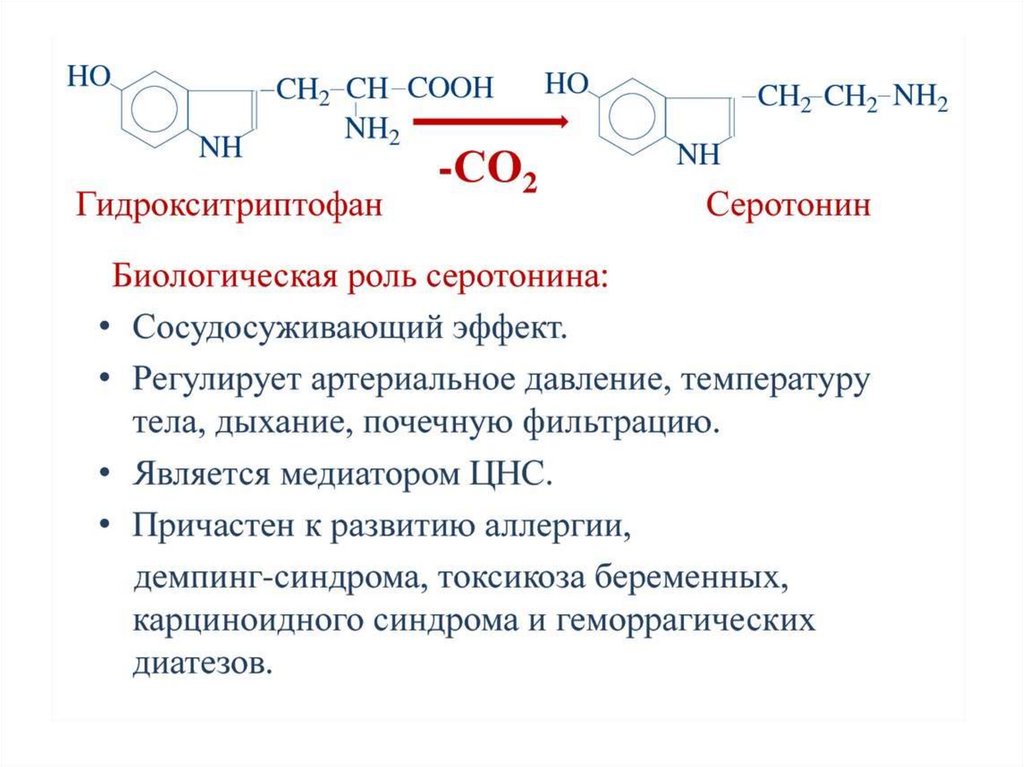
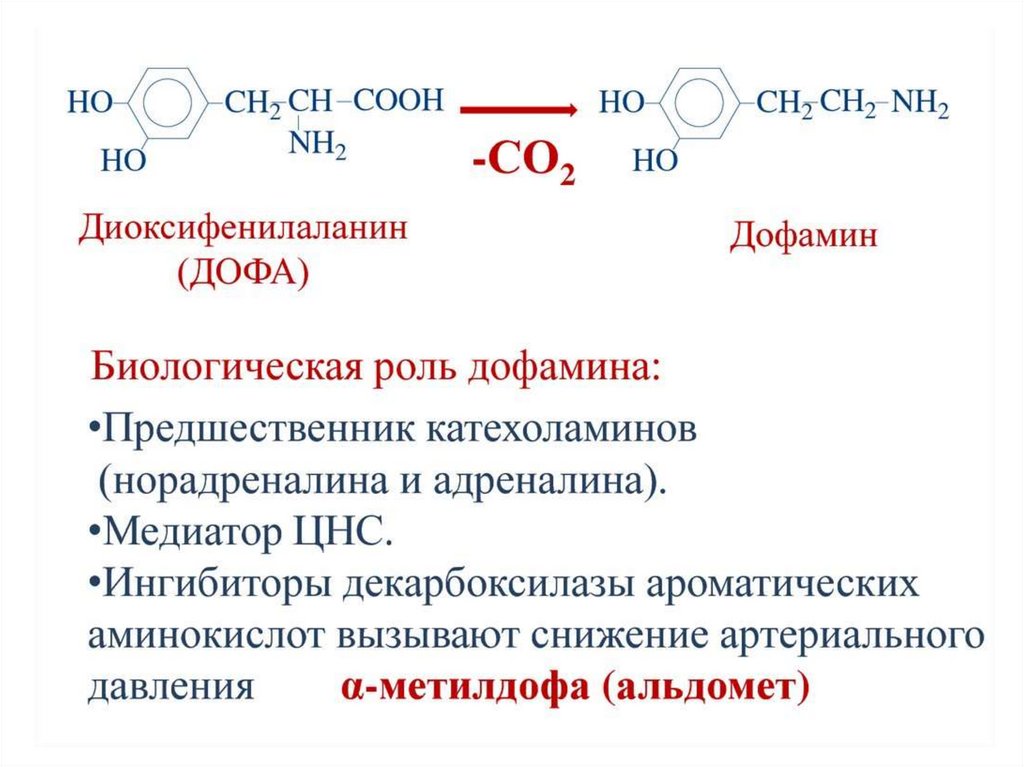
Кроме токсинов, также образуются продуктыразложения
нейромедиаторы
(серотонин,
гистамин, октопамин, тирамин).
• Cеротонин влияет на мозговое кровообращение,
изменяя тонус сосудов, и участвует в патогенезе
мигрени.
• Октопамин вызывает изменения на ЭЭГ, хлопающий
тремор, извращение сна.
• Тирамин способен провоцировать гипертензию.
Гниение белков также активируется при снижении
перистальтики кишечника (запоры).
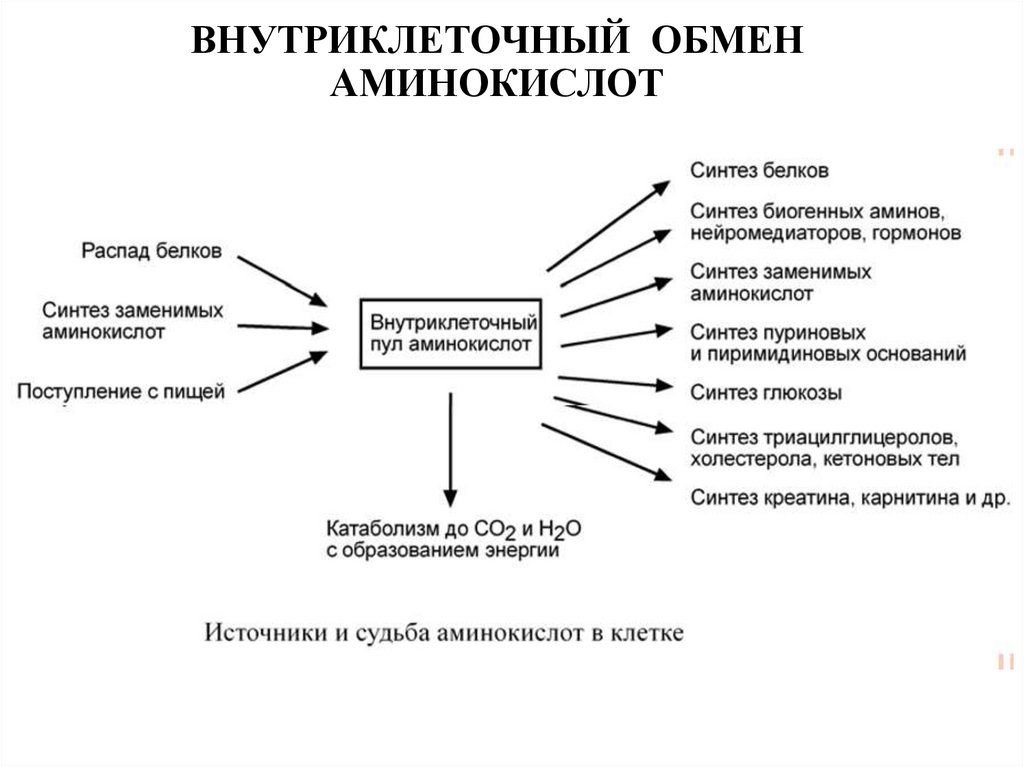
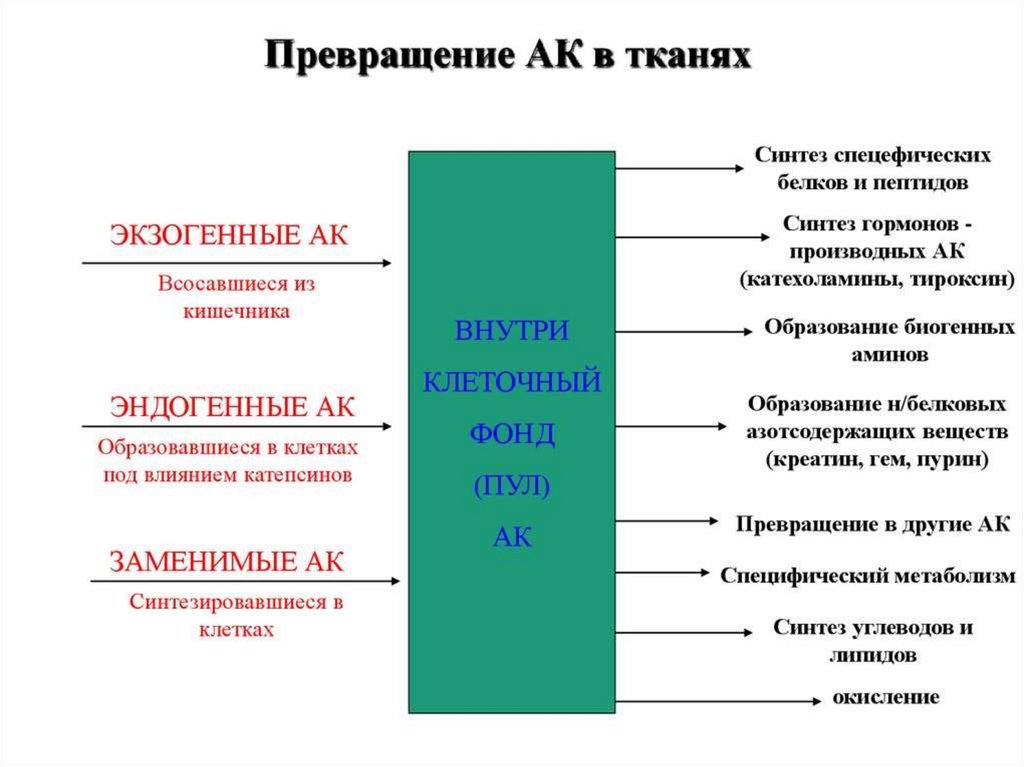
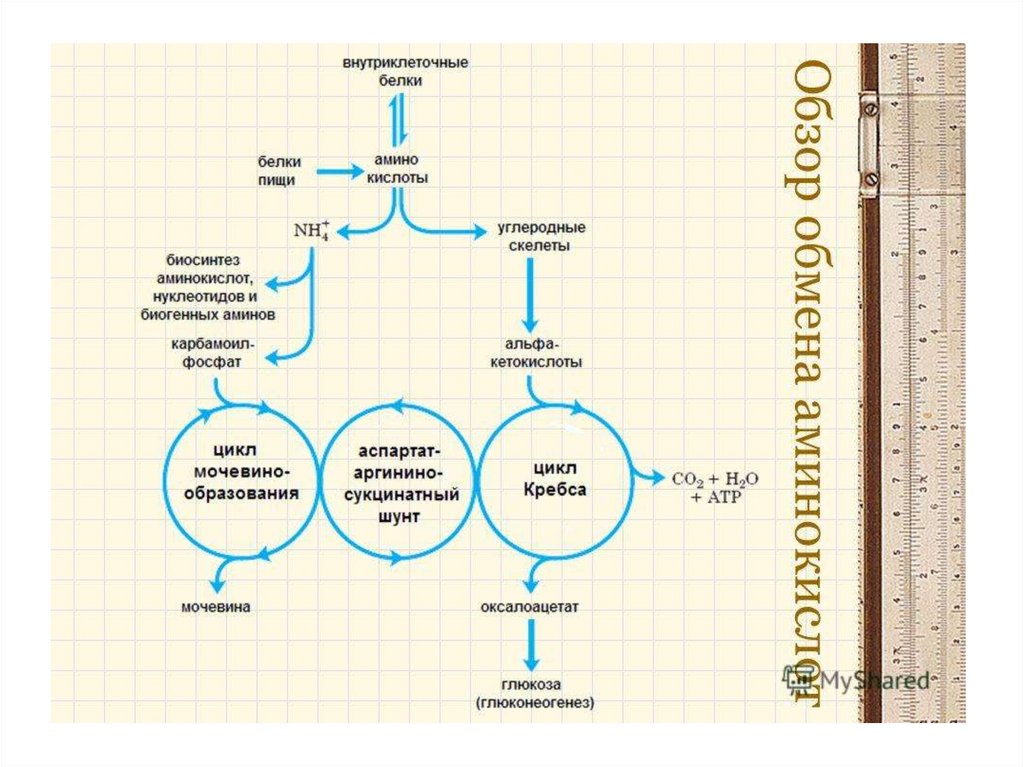
33. ВНУТРИКЛЕТОЧНЫЙ ОБМЕН АМИНОКИСЛОТ
34.
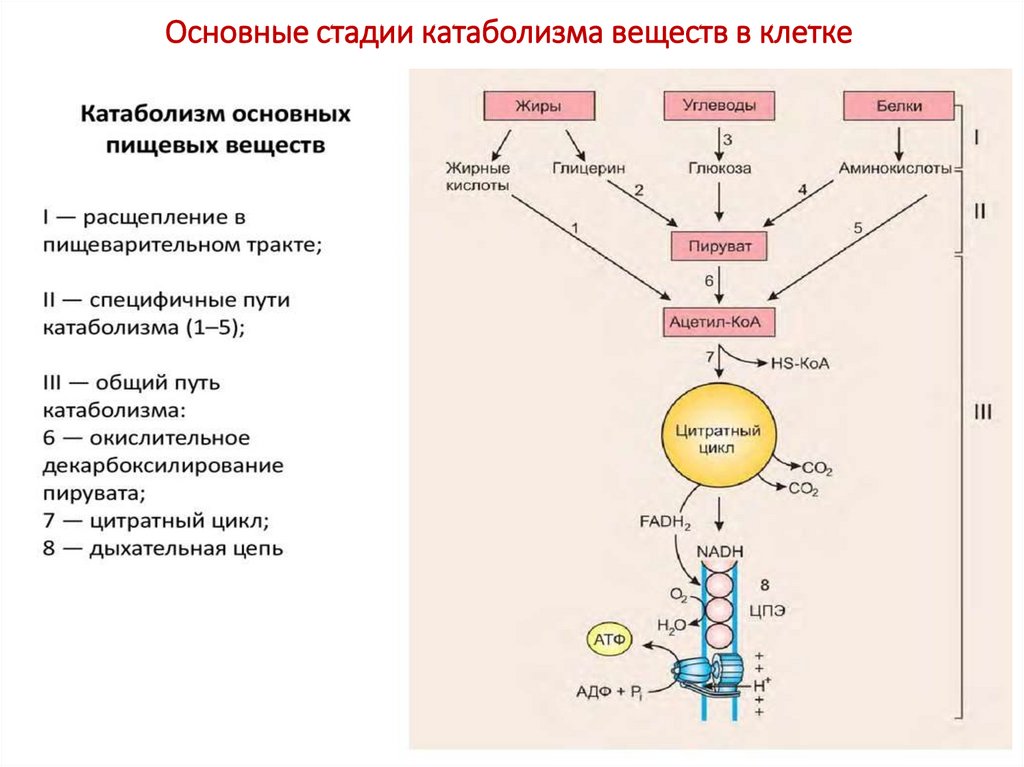
35. Основные стадии катаболизма веществ в клетке
36.
37.
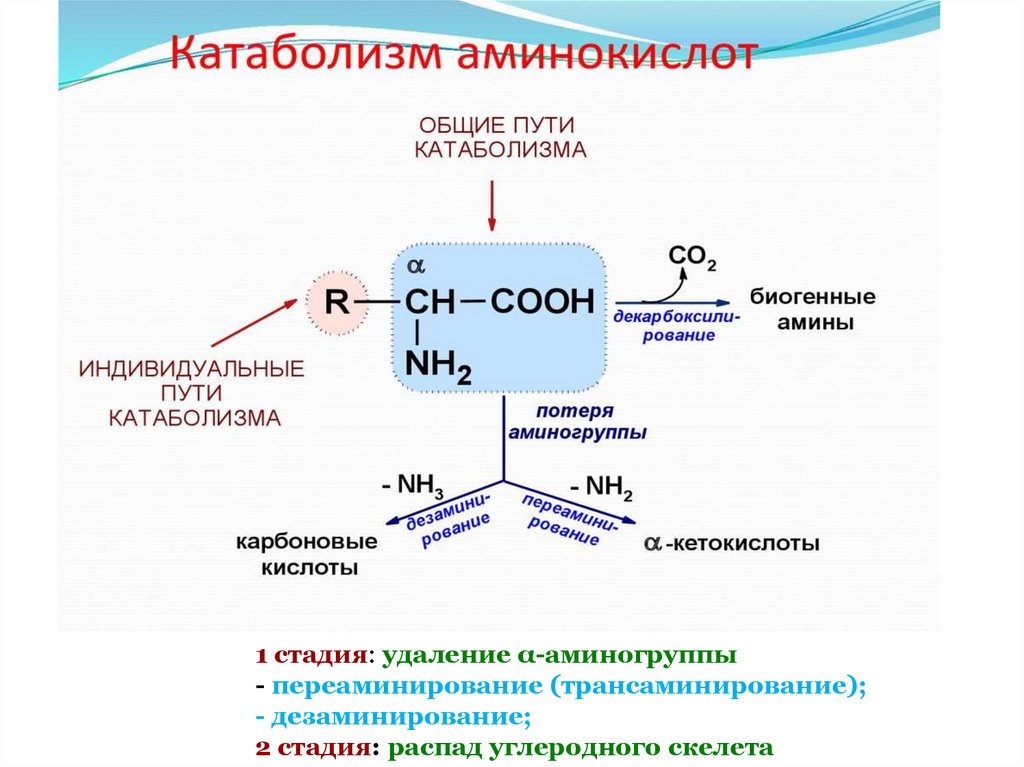
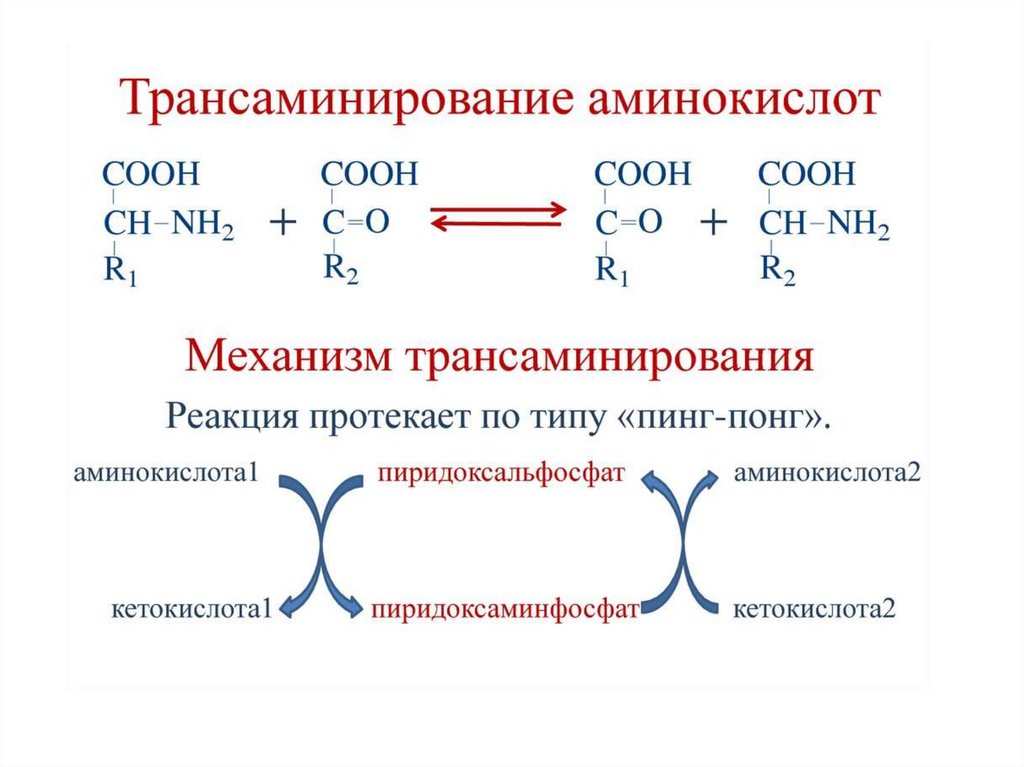
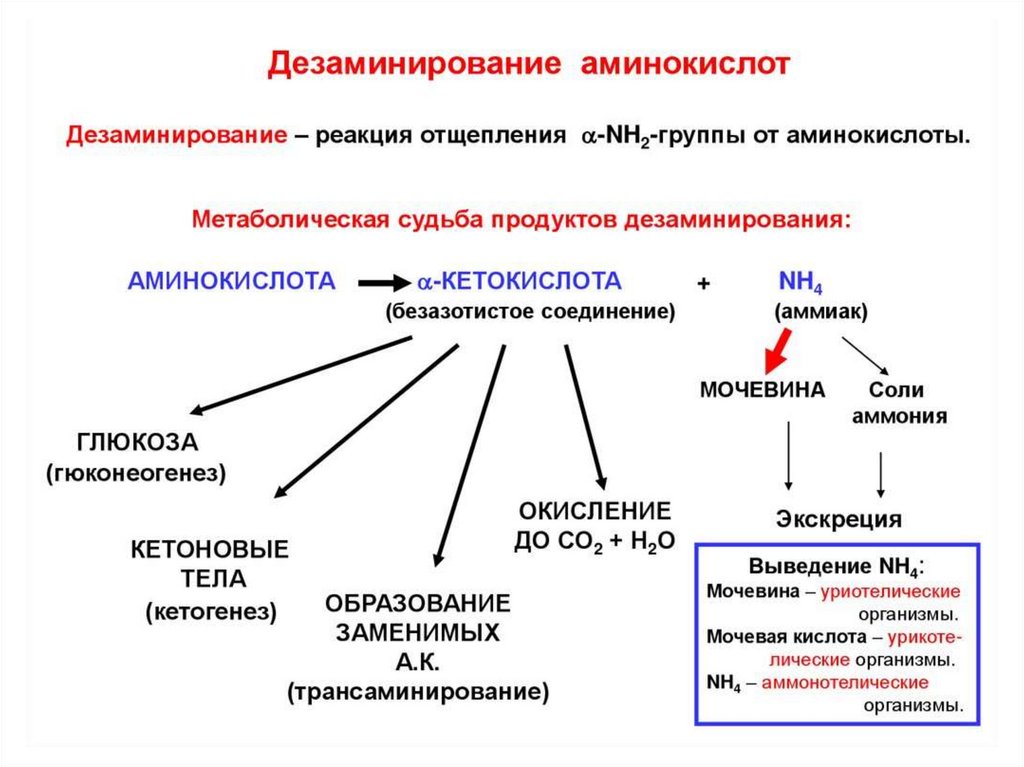
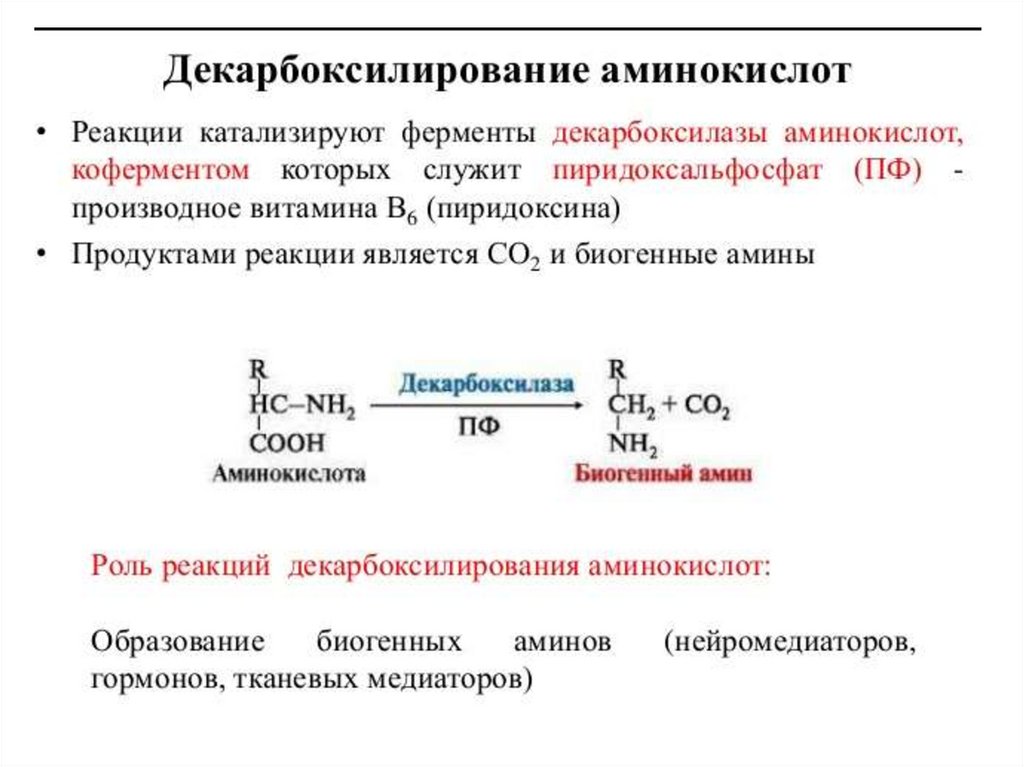
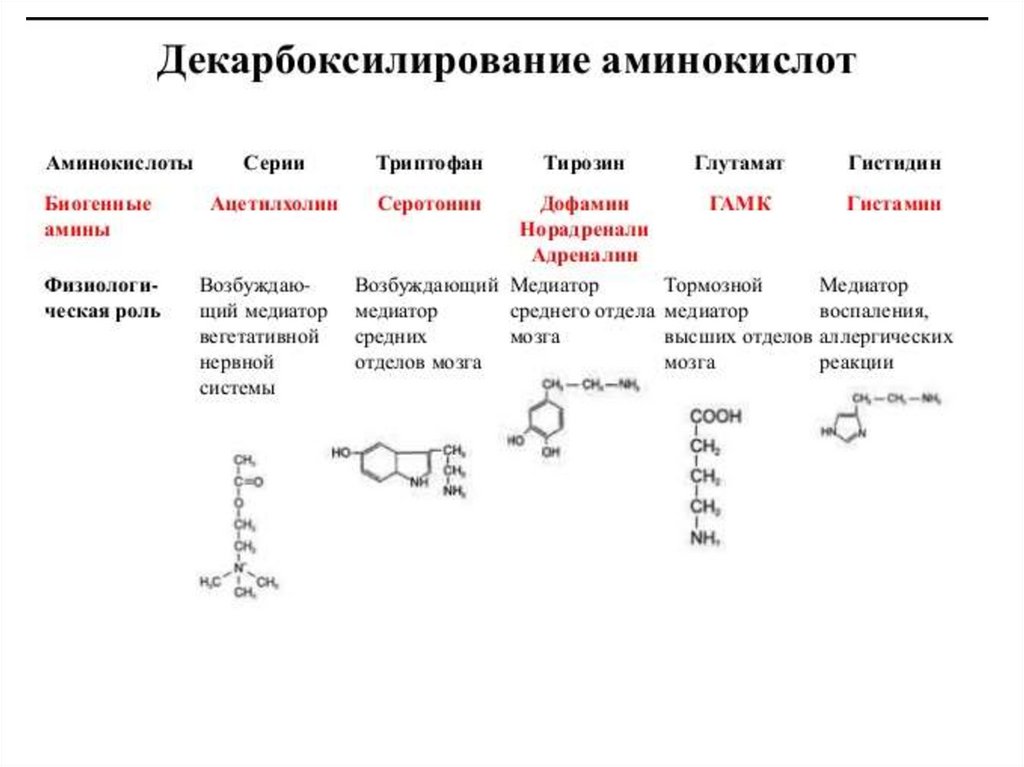
1 стадия: удаление α-аминогруппы- переаминирование (трансаминирование);
- дезаминирование;
2 стадия: распад углеродного скелета
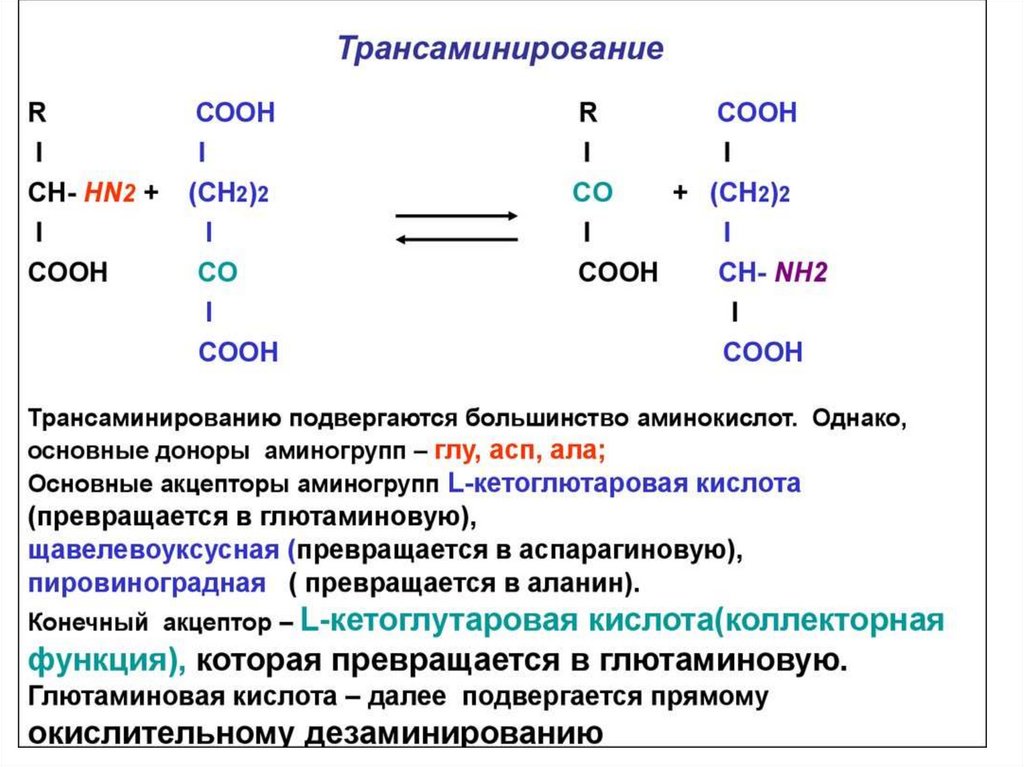
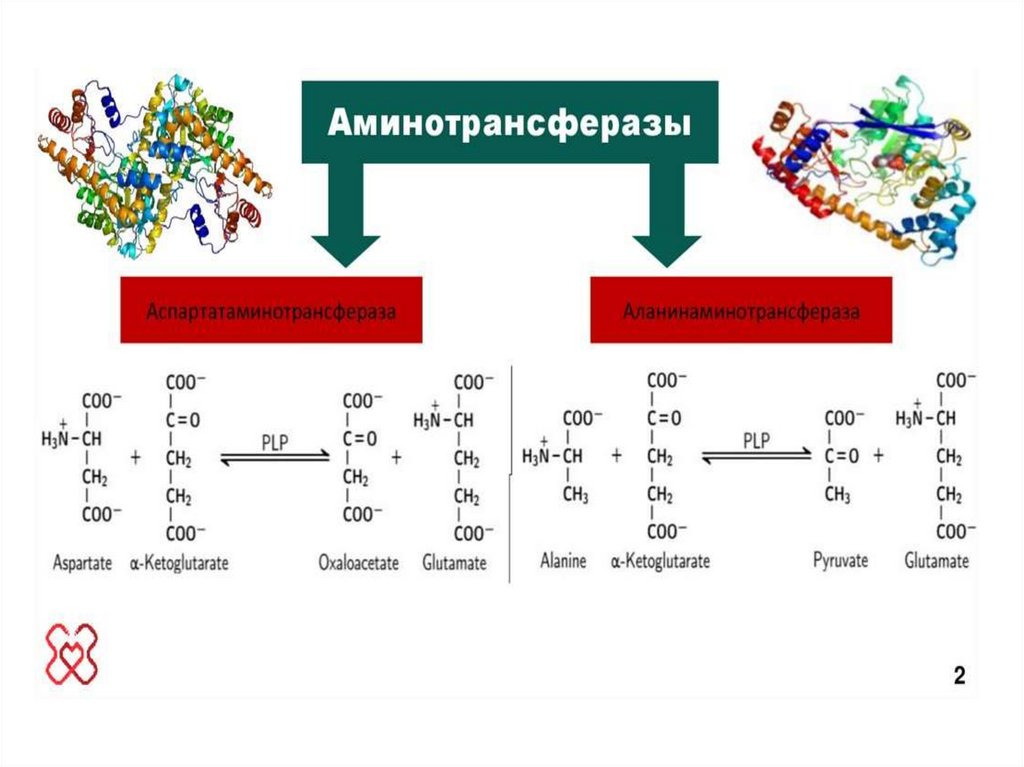
38. Реакции переаминирования (трансаминирования) аминокислот:
Трансаминирование - реакция переноса α-аминогруппы саминокислоты на α-кетокислоту, в результате чего
образуются новая кетокислота и новая аминокислота.
Реакции катализируют ферменты аминотрансферазы,
коферментом которых служит пиридоксальфосфат (ПФ) производное витамина В6
Аминотрансферазы обнаружены как в цитоплазме, так и в митохондриях клеток эукариот.
В клетках человека найдено более 10 аминотрансфераз, отличающихся по субстратной
специфичности.
39.
40.
41.
42.
43.
44.
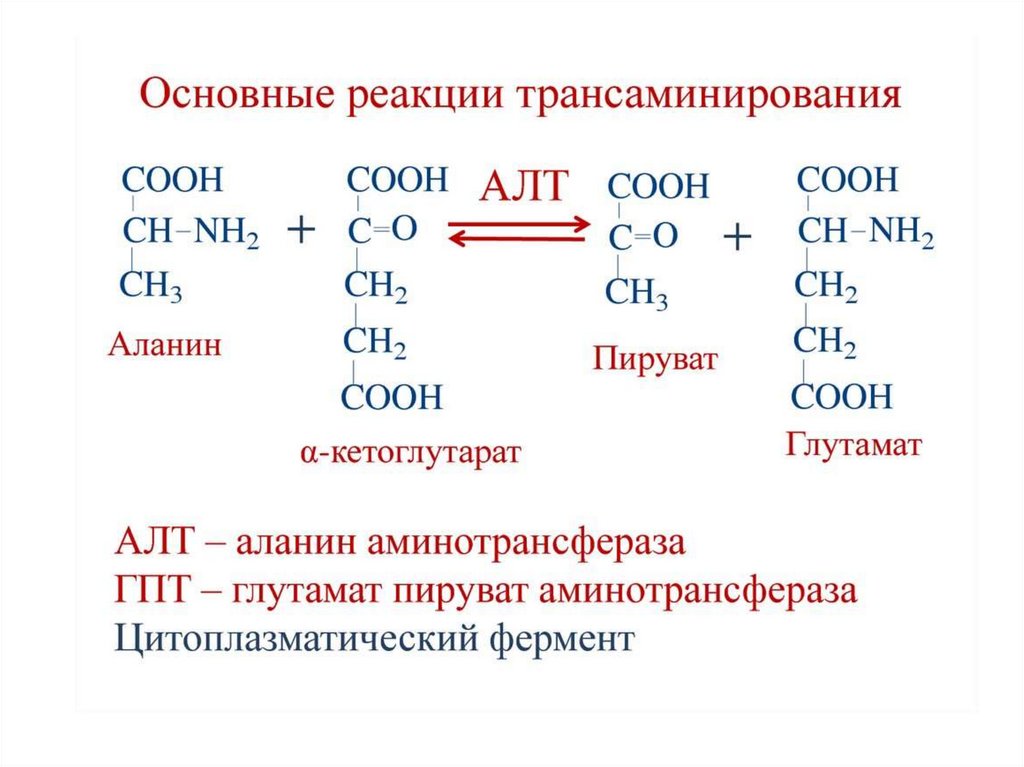
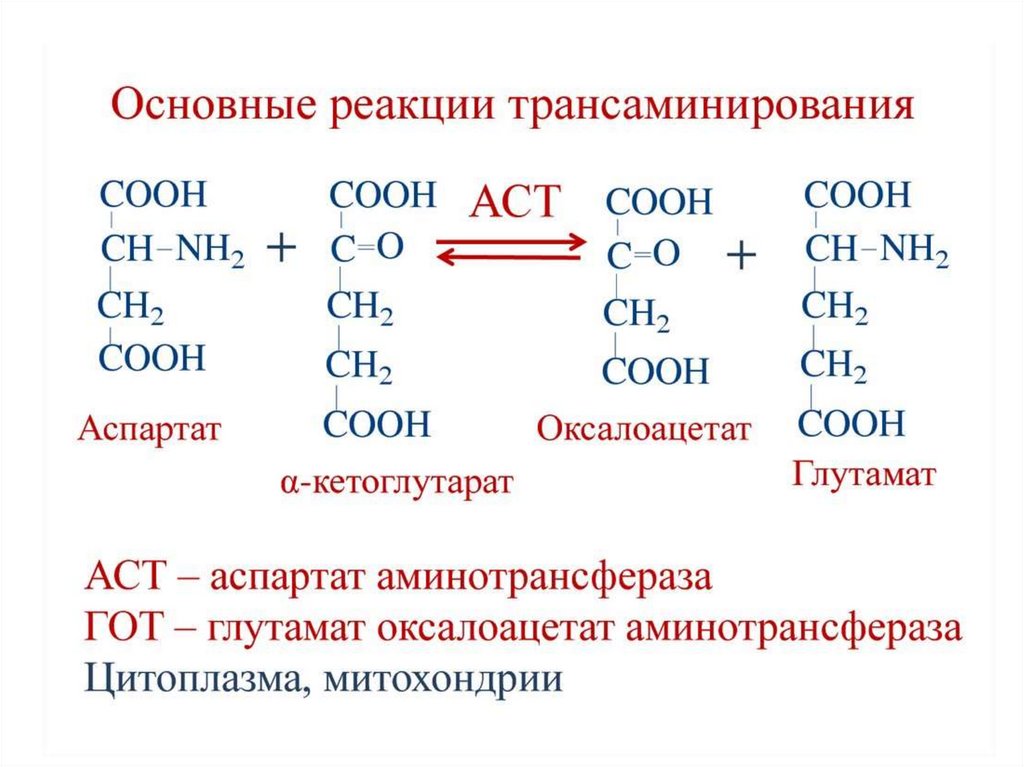
45. Клиническое значение аминотрансфераз
В лабораторной диагностике нашло практическое применениеопределение активности двух ферментов трансаминирования –
аланинаминотрансферазы
(АЛТ,АлАТ)
и
аспартатаминотрансферазы (АСТ,АсАТ).
Оба фермента обратимо взаимодействуют с α-кетоглутаровой
кислотой и переносят на нее аминогруппы от соответствующих
аминокислот с образованием глутаминовой кислоты и кетокислот.
Хотя активность обоих ферментов значительно возрастает при
заболеваниях сердечной мышцы и печени, при поражении клеток
миокарда наибольшая активность в сыворотке крови обнаруживается для
АСТ, при нарушении печени (гепатиты различного генеза) – для АЛТ.
46.
47.
48.
49. Биологическое значение трансаминирования
Реакции трансаминирования играют большую роль в обменеаминокислот. Поскольку этот процесс обратим, ферменты
аминотрансферазы функционируют как в процессах
катаболизма, так и биосинтеза аминокислот.
Трансаминирование – это заключительный этап синтеза
заменимых аминокислот из соответствующих αкетокислот, если они в данный момент необходимы клеткам.
В результате происходит перераспределение аминного азота
в тканях организма.
Трансаминирование - первая стадия дезаминирования
большинства аминокислот, т.е. начальный этап их
катаболизма. Образующиеся при этом кетокислоты
окисляются в ЦТК или используются для синтеза глюкозы и
кетоновых тел.
При трансаминировании общее количество аминокислот в
клетке не меняется.
50.
51.
52.
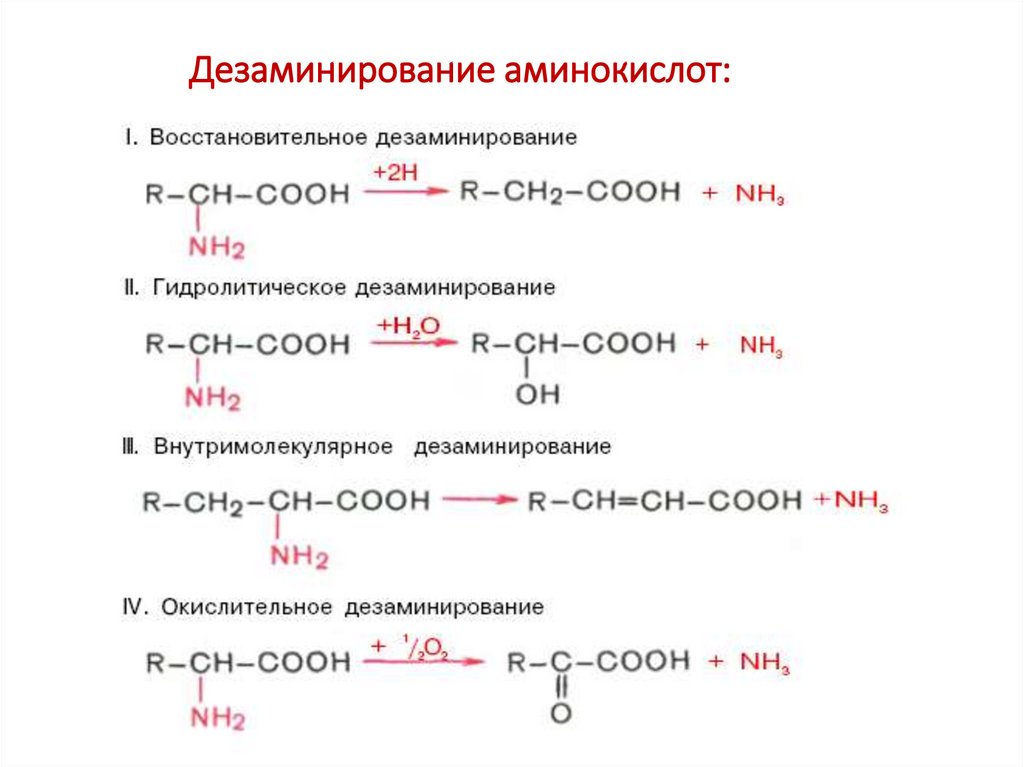
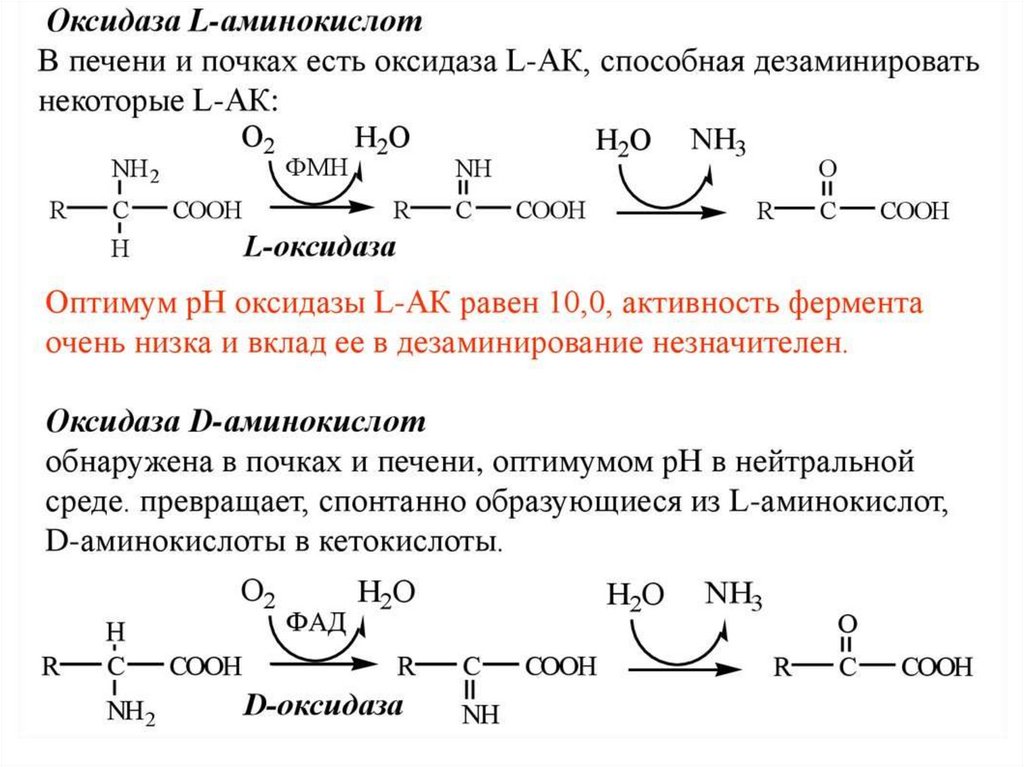
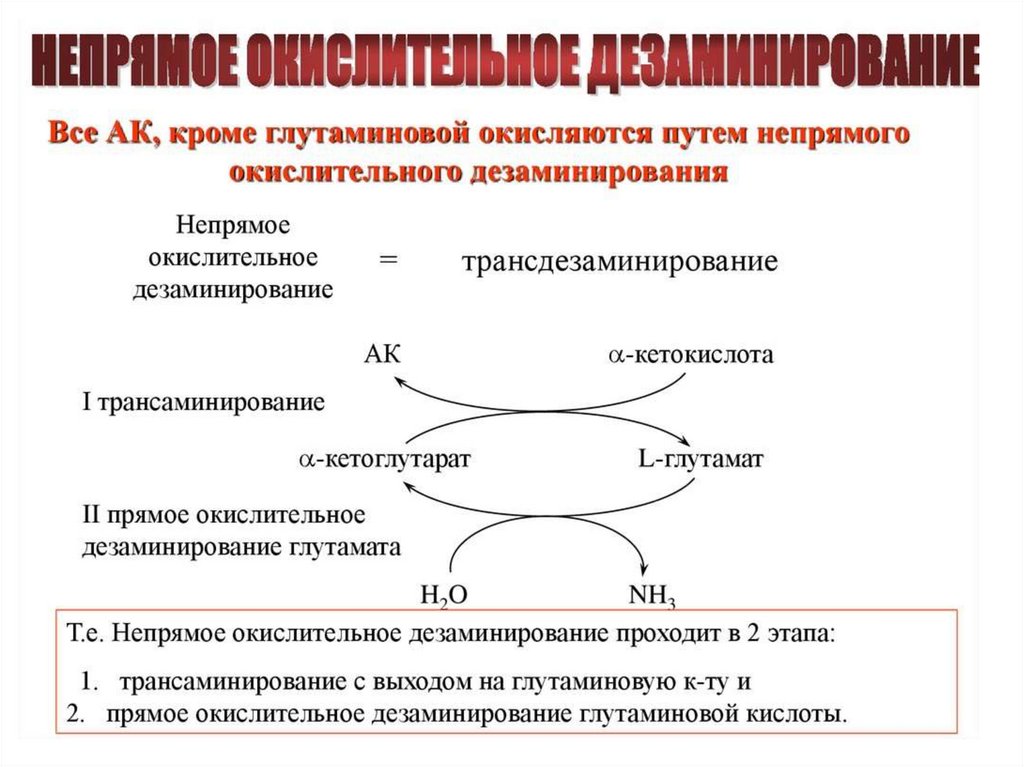
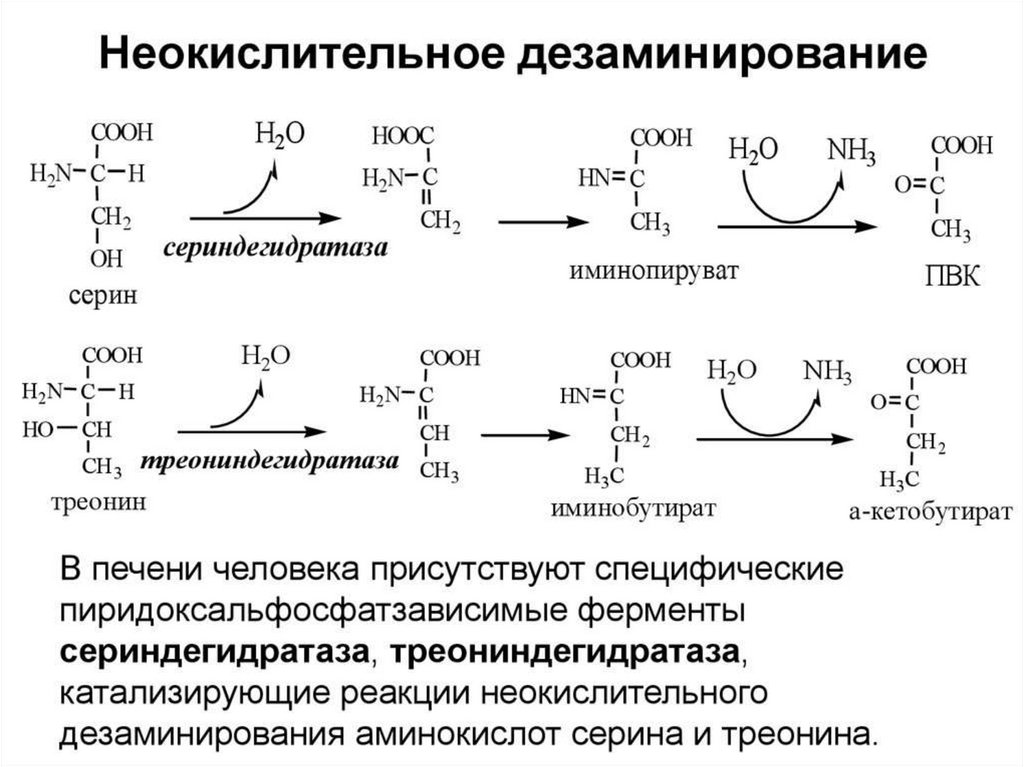
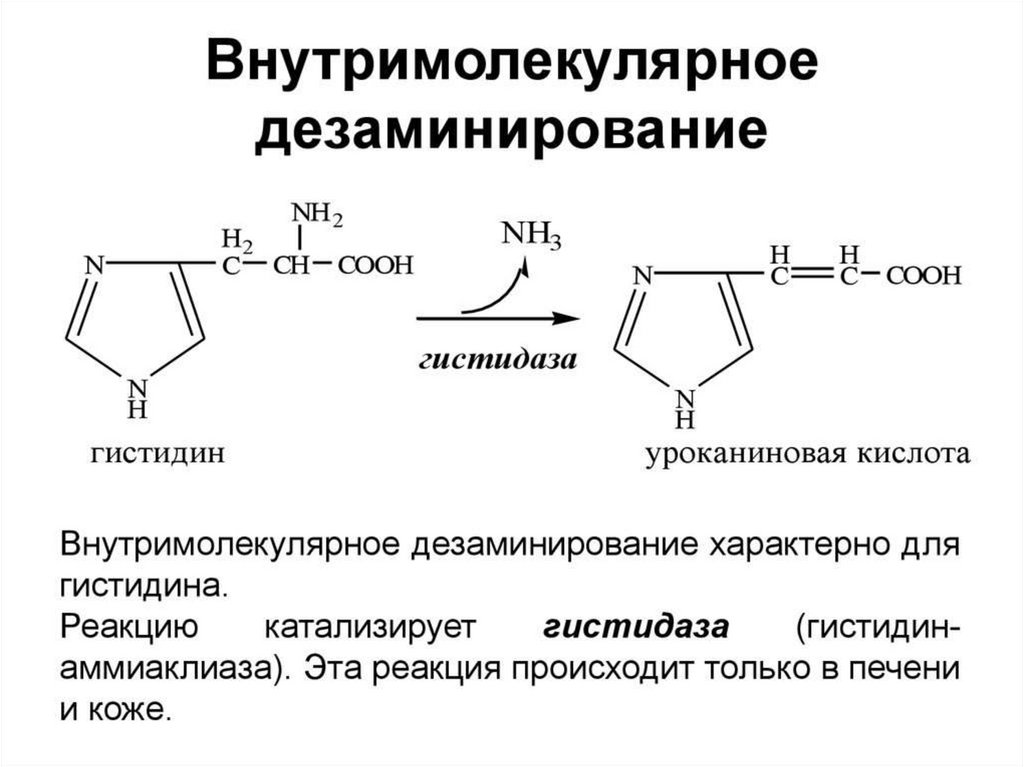
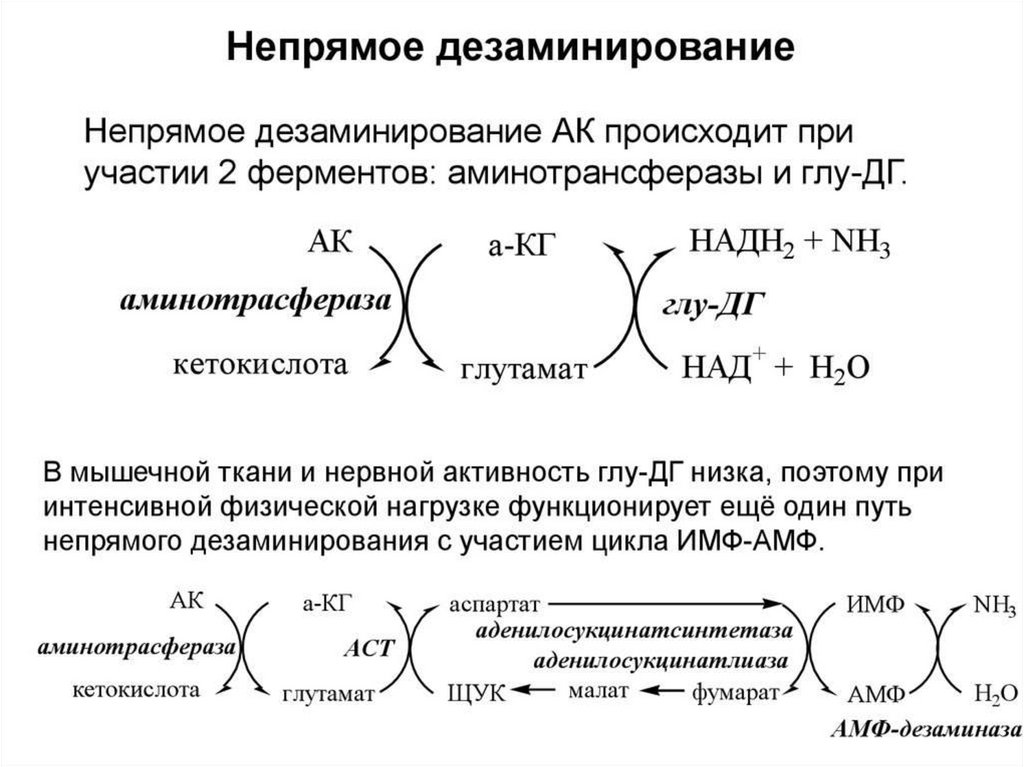
53. Дезаминирование аминокислот:
54.
55.
56.
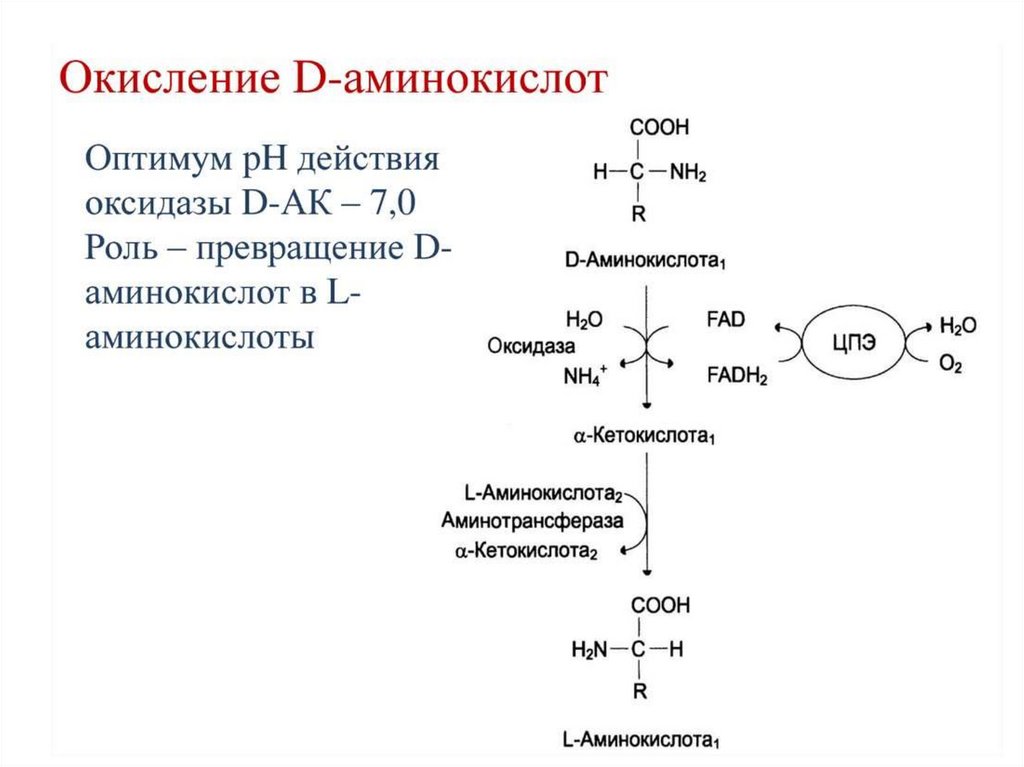
57. Источники D аминокислот в организме
• Аспарагиновые остатки в метаболически неактивных структурных белкахпретерпевают
медленную
самопроизвольную
неферментативную
рацемизацию: в белках дентина и эмали зубов L-аспартат переходит в Dформу со скоростью ~0,1 % в год, что может быть использовано для
определения возраста млекопитающих.
• Рацемизация аспартата также отмечена при старении коллагена.
•С
развитием
следового
аминокислотного
анализа
Dаминокислоты
были обнаружены сначала в составе клеточных
стенок некоторых бактерий (1966), а затем — и в тканях высших
организмов
• Так,
D-аспартат
и
D-метионин
предположительно
являются нейромедиаторами у млекопитающих.
• В состав некоторых пептидов входят D-аминокислоты, образующиеся
при посттрансляционной модификации. Например, D-метионин и Dаланин
входят
в
состав
опиоидных
гептапептидов
кожи
южноамериканских амфибий
58.
59.
60.
61.
62.
63.
64.
65.
66.
67.
68.
69.
70.
71.
72.
73.
74.
75.
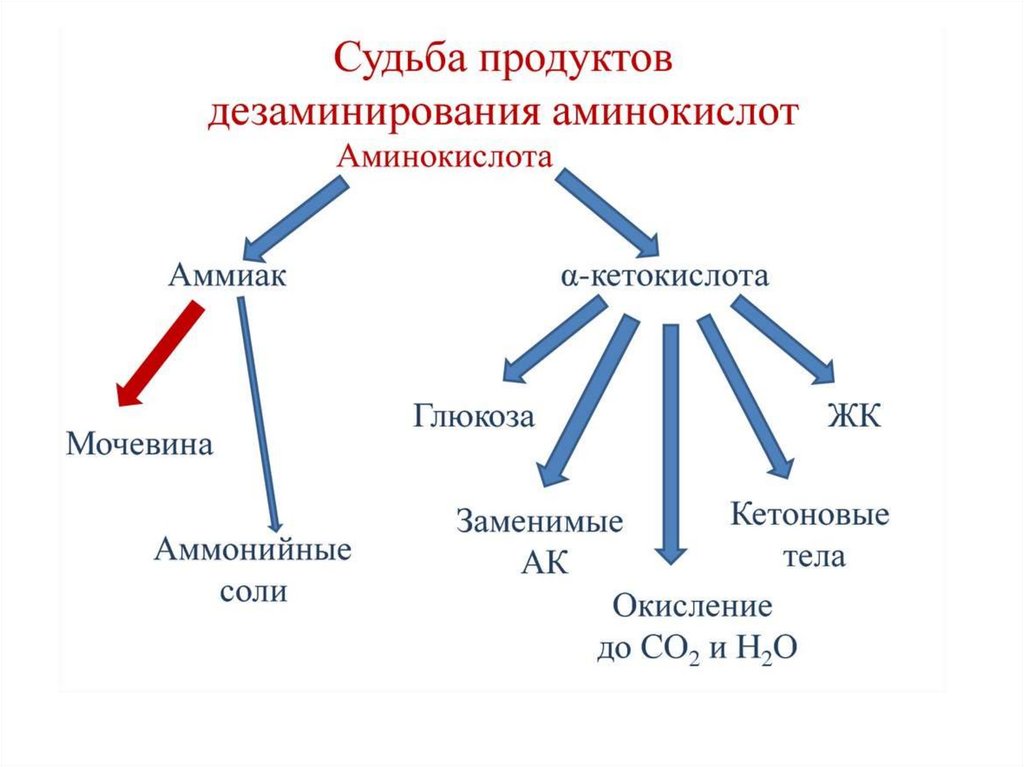
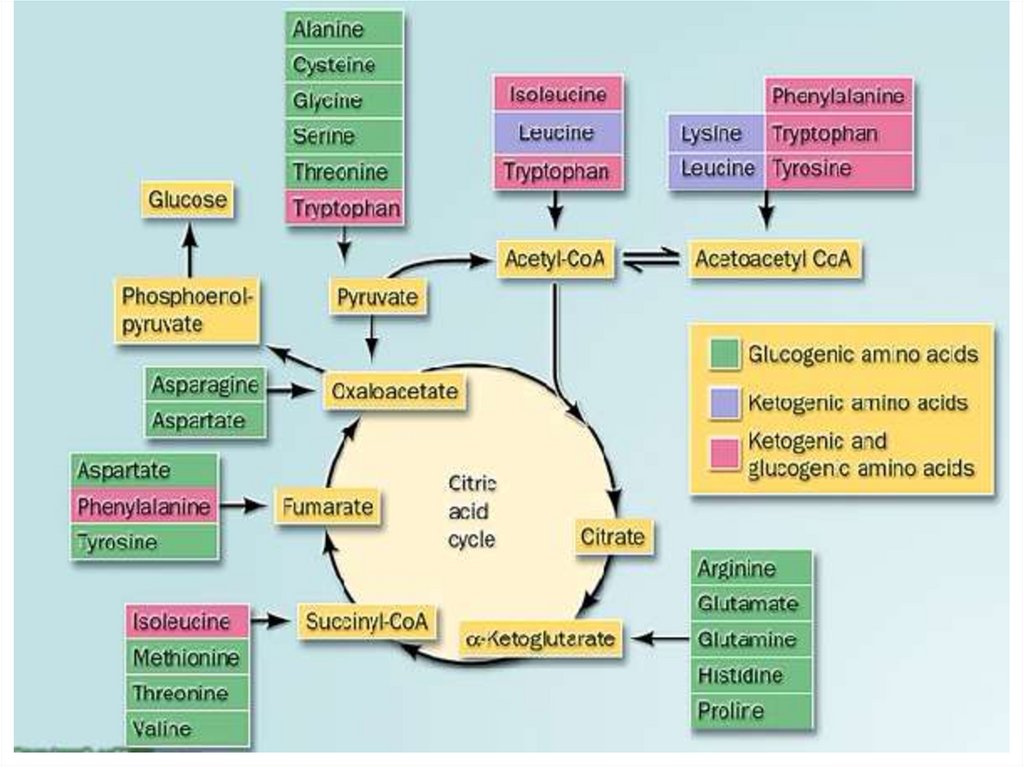
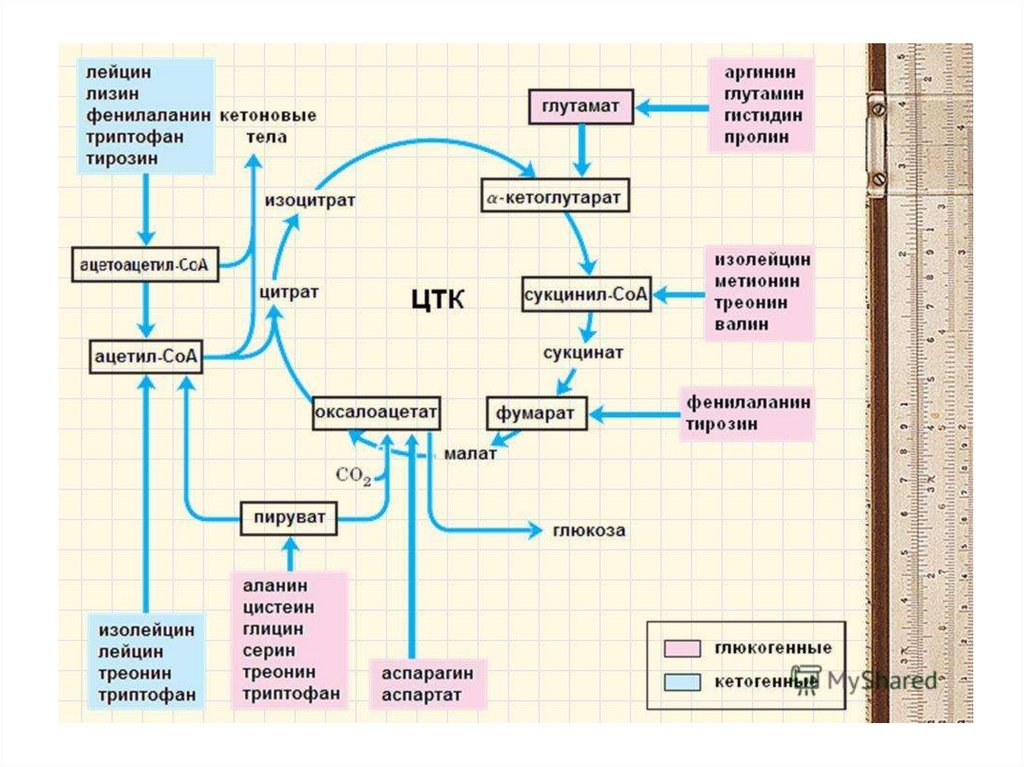
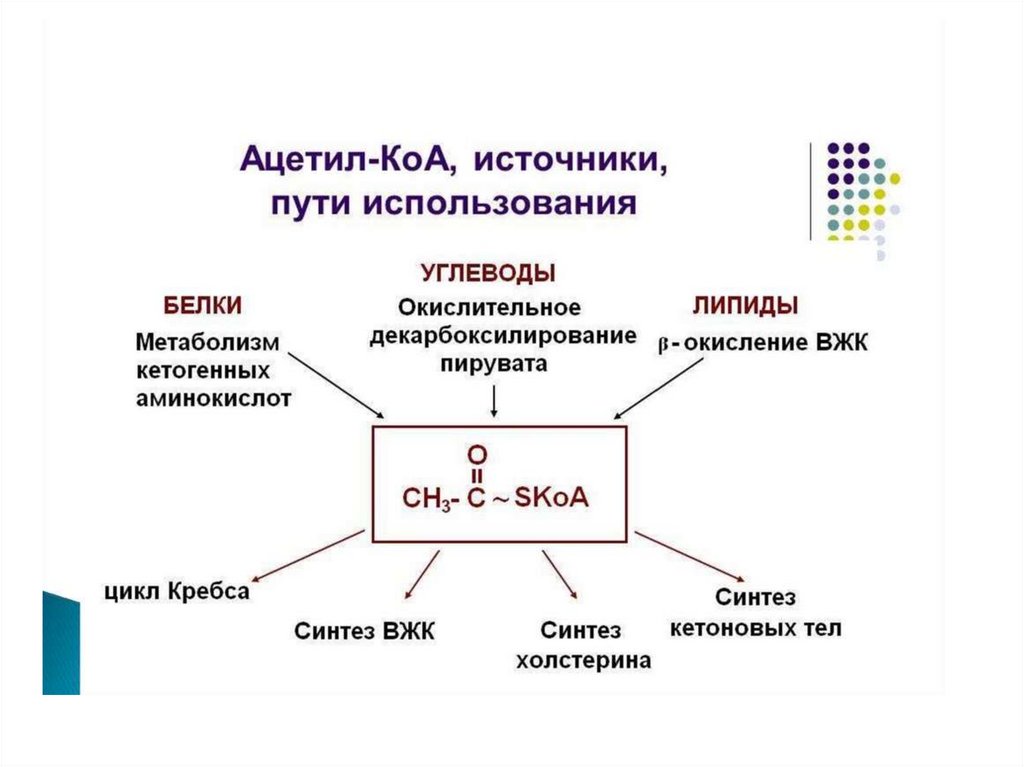
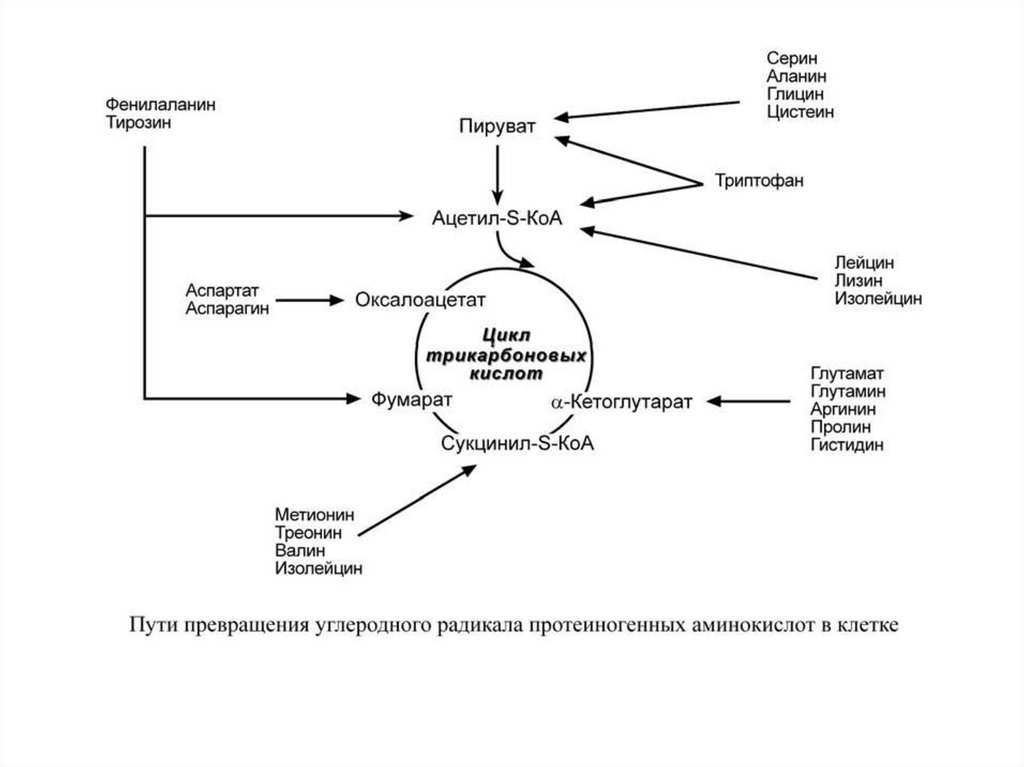
76. Судьба углеродного скелета аминокислот.
Из углеродного скелетаосновных продуктов:
аминокислот
образуются
• 1. пируват
• 2. ацетил-СоА (кетогенные )
• 3. ацетоацетил-СоА (кетогенные)
• 4. α-кетоглутарат
• 5. сукцинил-СоА
• 6. фумарат
• 7. оксалоацетат
7
77.
78.
79.
При определенных условиях углеродный скелет аминокислот нераспадается, а участвует в синтезе углеводов (глюкогенные
аминокислоты) и липидов (кетогенные аминокислоты).
К глюкогенным относятся аминокислоты (их большинство),
при распаде которых образуются пируват и метаболиты ЦТК,
например, оксалоацетат или α-кетоглутарат.
Кетогенными являются лизин и лейцин, при их окислении
образуется исключительно ацетил-S-КоА. Он принимает
участие в синтезе кетоновых тел, жирных кислот и холестерола.
Также выделяют небольшую группу смешанных аминокислот,
из них образуется пируват, метаболиты ЦТК и ацетил-S-КоА
(фенилаланин, тирозин, изолейцин, триптофан).


































 biology
biology








