Similar presentations:
Атрофия зрительного нерва Лебера
1.
Атрофия зрительного нерва Лебера(наследственная оптическая нейропатия Лебера)
(H47.2)
- идебенон
Федерального государственного бюджетного научного учреждения
“Медико-генетический научный центр имени академика Н.П. Бочкова”
Кадышев Виталий Викторович
Ведущий научный сотрудник, руководитель научно-клинического центра генетики глазных болезней,
заведующий кафедрой офтальмогенетики Института Высшего и Дополнительного профессионального образования,
врач-генетик, врач-офтальмолог Федерального государственного бюджетного научного учреждения “Медикогенетический научный центр имени академика Н.П. Бочкова”, кандидат медицинских наук, доцент
Маркова Елена Юрьевна
Заведующий отделом микрохирургии и функциональной реабилитации глаза у детей, профессор кафедры
офтальмологии ФГАУ "НМИЦ "МНТК «Микрохирургии глаза» им. С.Н. Фёдорова"
Минздрава России, доктор медицинских наук
Куцев Сергей Иванович
Директор Федерального государственного бюджетного научного учреждения
"Медико-генетический научный центр имени академика Н.П. Бочкова",
Главный внештатный специалист по медицинской генетике Минздрава России,
доктор медицинских наук, академик РАН
2024
2.
Этиология и эпидемиология наследственной оптическойнейропатии Лебера
Атрофия зрительного нерва Лебера (наследственная оптическая нейропатия Лебера) — наследственное
митохондриальное заболевание, характеризующееся двусторонней потерей зрения и атрофией зрительного нерва1,2
НОНЛ может манифестировать в любом возрасте, часто манифестирует в возрасте от 14 до 35 лет5
Частота встречаемости НОНЛ ~1 на 27 000 - 45 000 населения2,3
В России выявлено 147 пациентов с НОНЛ, в том числе более 50 больных являются детьми6
Инвалидность получают не менее 65% детей после установки диагноза согласно Постановлению Правительства РФ от 20 февраля
2006 г. N 95 «О Порядке и условиях признания лица инвалидом»7
Пациенты без терапии в 100% случаях по критериям установления ограничения жизнедеятельности имеют возможность получения
статуса инвалидности по зрению
НОНЛ входит в Перечень редких (орфанных) заболеваний МЗ РФ4
Код МКБ-10: H47.24
НОНЛ - Наследственная оптическая нейропатия Лебера
1.
2.
3.
4.
5.
6.
7.
Андреева Н.А., Шеремет Н.Л. Наследственная оптическая нейропатия Лебера с неврологическими проявлениями. Клинический случай. Офтальмология. 2021;18(3S):753–757
Carelli et al: J Neuro-Ophthalmol 2017; 37: 371-381
Mascialino B et al. Meta-analysis of the prevalence of Leber hereditary optic neuropathy mtDNA mutations in Europe. Eur J Ophthalmol. 2012;22:461–465
Электронный ресурс: https://minzdrav.gov.ru/documents/9641-perechen-redkih-orfannyh-zabolevaniy (дата доступа от 12.02.2023)
Fraser JA et al. Surv Ophthalmol. 2010; 55:299–334
По данным внутренней базы данных ФГБНУ «МГНЦ» (электронный ресурс, дата обращения 07.03.2023 г.)
Копаева В.Г. Глава 27. Медико-социальная экспертиза лиц с заболеваниями и повреждениями органа зрения Глазные болезни. Учебник / Под ред. проф. В.Г. Копаевой. - М.: Издательство «Офтальмология», 2018. - 495 с.: ил.
3.
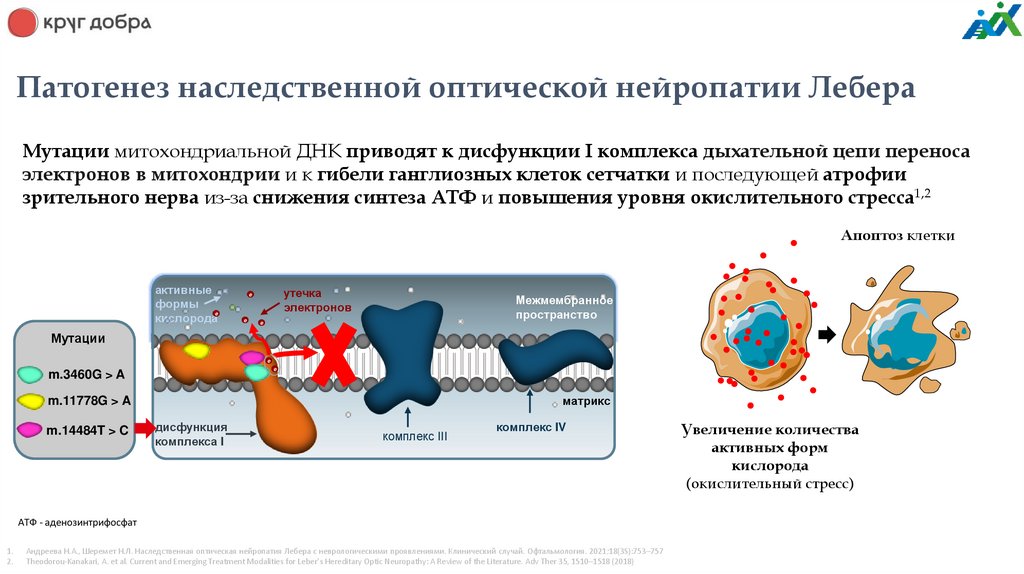
Патогенез наследственной оптической нейропатии ЛебераМутации митохондриальной ДНК приводят к дисфункции I комплекса дыхательной цепи переноса
электронов в митохондрии и к гибели ганглиозных клеток сетчатки и последующей атрофии
зрительного нерва из-за снижения синтеза АТФ и повышения уровня окислительного стресса1,2
Апоптоз клетки
активные
формы
e
кислорода
утечка
электронов
e
e
Межмембранное
пространство
e
Мутации
e
e
m.3460G > A
матрикс
m.11778G > A
m.14484T > C
дисфункция
комплекса I
комплекс III
комплекс IV
АТФ - аденозинтрифосфат
1.
2.
Андреева Н.А., Шеремет Н.Л. Наследственная оптическая нейропатия Лебера с неврологическими проявлениями. Клинический случай. Офтальмология. 2021;18(3S):753–757
Theodorou-Kanakari, A. et al. Current and Emerging Treatment Modalities for Leber’s Hereditary Optic Neuropathy: A Review of the Literature. Adv Ther 35, 1510–1518 (2018)
Увеличение количества
активных форм
кислорода
(окислительный стресс)
4.
Лечение наследственной оптической нейропатии ЛебераИдебенон представляет собой короткоцепочечный бензохинон1
Идебенон может переносить электроны непосредственно на комплекс III дыхательной цепи переноса электронов
в митохондриях в обход I комплекса, восстанавливая синтез АТФ внутри клетки1,2
Идебенон может реактивировать живые, но неактивные, ганглиозные клетки сетчатки у пациентов с НОНЛ1
утечка
электронов e
e
e
e
Идебенон обходит комплекс I
активные формы
кислорода
H+
H+
H+
H+
e
e
e
межмембранное пространство
межмембранное пространство
e
e
e
матрикс
матрикс
H+
дисфункция
комплекса I
H+
H+
H+
комплекс III
дисфункция
комплекса I
m.3460G > A
АТФ – аденозинтрифосфат, НОНЛ - наследственная оптическая нейропатия Лебера
1.
2.
3.
Hage R and Vignal-Clermont C (2021) Leber Hereditary Optic Neuropathy:Review of Treatment and Management.Front. Neurol. 12:651639
Raxone®SmPC https://www.ema.europa.eu/en/documents/product-information/raxone-epar-product-information_en.pdf (дата доступа 13.02.2023)
Gueven N & Faldu D. Expert Opin Orphan Drugs. 2013
H+
АТФ
комплекс III
m.11778G > A
m.14484T > C
5.
Лечение, лекарственный препаратМеждународное непатентованное
наименование
Идебенон
Торговое наименование
Raxone® (Раксон)
Лекарственная форма
Таблетки, покрытые пленочной оболочкой. Каждая таблетка содержит 150 мг идебенона. В
одном флаконе 180 таблеток.
Регистрация в ЕС
Да (EMA - 2015 г)
Регистрация в США
Нет
Регистрация в РФ
Нет
Показания к применению
EMA: Препарат Раксон показан для лечения нарушений зрения у подростков и взрослых
пациентов с наследственной оптической нейропатии Лебера
Наличие в перечне ЖНВЛП
Нет
Наличие в российских клинических
рекомендациях
Нет
Наличие в международных клинических
рекомендациях
Нет
Способ применения и дозы
Рекомендуемая доза идебенона составляет 900 мг/сутки (по 300 мг 3 раза в день)
Опыт использования в РФ у детей и взрослых – нет.
Наличие препарата Раксон в международном консенсусе: Carelli V et al. International Consensus Statement on the Clinical and Therapeutic Management of Leber Hereditary Optic
Neuropathy. J Neuroophthalmol. 2017 Dec;37(4):371-381
1.
2.
Raxone® SmPC https://www.ema.europa.eu/en/documents/product-information/raxone-epar-product-information_en.pdf (дата доступа 13.02.2023)
Carelli et al: J Neuro-Ophthalmol 2017; 37: 371-381
6.
Критерии назначения идебенона у пациентов с наследственнойоптической нейропатией Лебера
Подтвержденный клинико-инструментальными методами диагноз НОНЛ
Подтвержденный молекулярно-генетическими методами диагноз НОНЛ
12 лет и старше
Острота зрения с максимально возможной коррекцией выше 0,05 по Снеллену
Изменения
полей
зрения
(расширение
абсолютной
скотомы
и/или
формирование
парацентральных скотом)
Подострая фаза (< 6 месяцев с момента манифестации)/ динамическая фаза (6-12 месяцев с
момента манифестации)
НОНЛ - наследственная оптическая нейропатия Лебера
1.
2.
Carelli et al: J Neuro-Ophthalmol 2017; 37: 371-381
Raxone® SmPC https://www.ema.europa.eu/en/documents/product-information/raxone-epar-product-information_en.pdf (дата доступа 13.02.2023)
7.
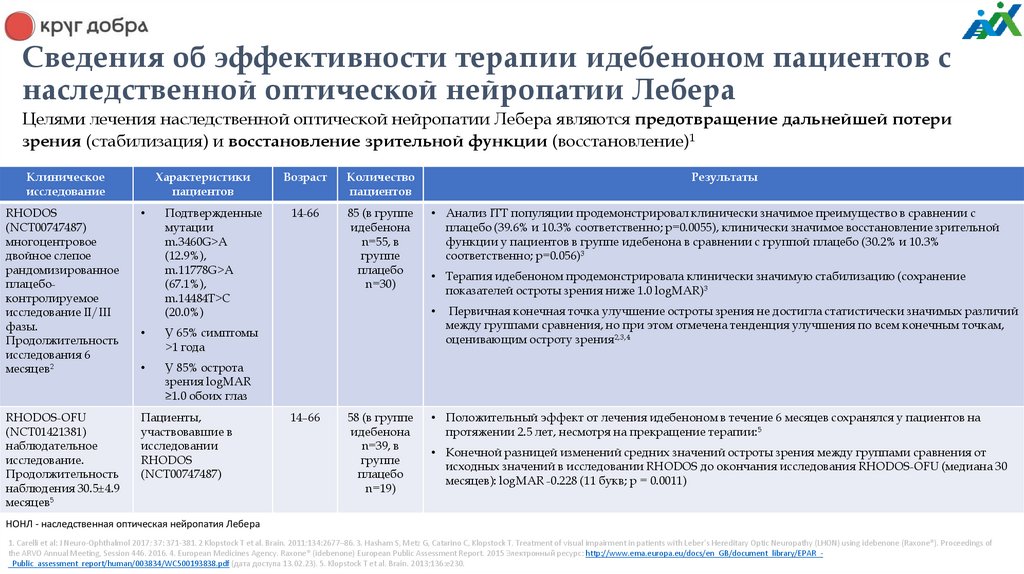
Сведения об эффективности терапии идебеноном пациентов снаследственной оптической нейропатии Лебера
Целями лечения наследственной оптической нейропатии Лебера являются предотвращение дальнейшей потери
зрения (стабилизация) и восстановление зрительной функции (восстановление)1
Клиническое
исследование
Характеристики
пациентов
RHODOS
(NCT00747487)
многоцентровое
двойное слепое
рандомизированное
плацебоконтролируемое
исследование II/III
фазы.
Продолжительность
исследования 6
месяцев2
Подтвержденные
мутации
m.3460G>A
(12.9%),
m.11778G>A
(67.1%),
m.14484T>C
(20.0%)
RHODOS-OFU
(NCT01421381)
наблюдательное
исследование.
Продолжительность
наблюдения 30.5±4.9
месяцев5
Пациенты,
участвовавшие в
исследовании
RHODOS
(NCT00747487)
У 65% симптомы
>1 года
У 85% острота
зрения logMAR
≥1.0 обоих глаз
Возраст
Количество
пациентов
14-66
85 (в группе
идебенона
n=55, в
группе
плацебо
n=30)
Результаты
• Анализ ITT популяции продемонстрировал клинически значимое преимущество в сравнении с
плацебо (39.6% и 10.3% соответственно; p=0.0055), клинически значимое восстановление зрительной
функции у пациентов в группе идебенона в сравнении с группой плацебо (30.2% и 10.3%
соответственно; p=0.056)3
• Терапия идебеноном продемонстрировала клинически значимую стабилизацию (сохранение
показателей остроты зрения ниже 1.0 logMAR)3
14–66
58 (в группе
идебенона
n=39, в
группе
плацебо
n=19)
Первичная конечная точка улучшение остроты зрения не достигла статистически значимых различий
между группами сравнения, но при этом отмечена тенденция улучшения по всем конечным точкам,
оценивающим остроту зрения2,3,4
• Положительный эффект от лечения идебеноном в течение 6 месяцев сохранялся у пациентов на
протяжении 2.5 лет, несмотря на прекращение терапии:5
• Конечной разницей изменений средних значений остроты зрения между группами сравнения от
исходных значений в исследовании RHODOS до окончания исследования RHODOS-OFU (медиана 30
месяцев): logMAR -0.228 (11 букв; р = 0.0011)
НОНЛ - наследственная оптическая нейропатия Лебера
1. Carelli et al: J Neuro-Ophthalmol 2017; 37: 371-381. 2 Klopstock T et al. Brain. 2011;134:2677–86. 3. Hasham S, Metz G, Catarino C, Klopstock T. Treatment of visual impairment in patients with Leber’s Hereditary Optic Neuropathy (LHON) using idebenone (Raxone®). Proceedings of
the ARVO Annual Meeting, Session 446. 2016. 4. European Medicines Agency. Raxone® (idebenone) European Public Assessment Report. 2015 Электронный ресурс: http://www.ema.europa.eu/docs/en_GB/document_library/EPAR__Public_assessment_report/human/003834/WC500193838.pdf (дата доступа 13.02.23). 5. Klopstock T et al. Brain. 2013;136:e230.
8.
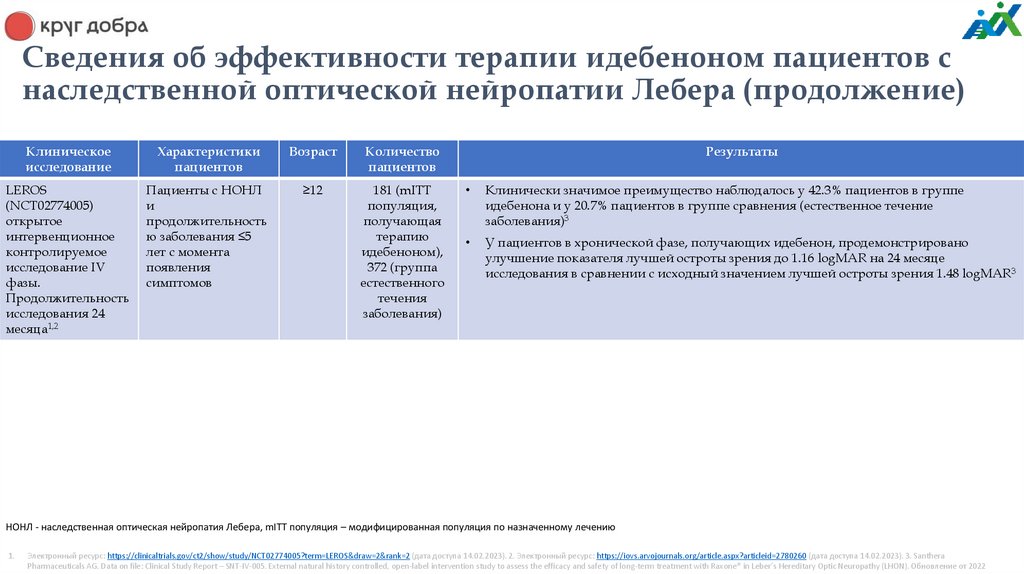
Сведения об эффективности терапии идебеноном пациентов снаследственной оптической нейропатии Лебера (продолжение)
Клиническое
исследование
Характеристики
пациентов
Возраст
Количество
пациентов
LEROS
(NCT02774005)
открытое
интервенционное
контролируемое
исследование IV
фазы.
Продолжительность
исследования 24
месяца1,2
Пациенты с НОНЛ
и
продолжительность
ю заболевания ≤5
лет с момента
появления
симптомов
≥12
181 (mITT
популяция,
получающая
терапию
идебеноном),
372 (группа
естественного
течения
заболевания)
Результаты
Клинически значимое преимущество наблюдалось у 42.3% пациентов в группе
идебенона и у 20.7% пациентов в группе сравнения (естественное течение
заболевания)3
У пациентов в хронической фазе, получающих идебенон, продемонстрировано
улучшение показателя лучшей остроты зрения до 1.16 logMAR на 24 месяце
исследования в сравнении с исходный значением лучшей остроты зрения 1.48 logMAR3
НОНЛ - наследственная оптическая нейропатия Лебера, mITT популяция – модифицированная популяция по назначенному лечению
1.
Электронный ресурс: https://clinicaltrials.gov/ct2/show/study/NCT02774005?term=LEROS&draw=2&rank=2 (дата доступа 14.02.2023). 2. Электронный ресурс: https://iovs.arvojournals.org/article.aspx?articleid=2780260 (дата доступа 14.02.2023). 3. Santhera
Pharmaceuticals AG. Data on file: Clinical Study Report – SNT-IV-005. External natural history controlled, open-label intervention study to assess the efficacy and safety of long-term treatment with Raxone® in Leber’s Hereditary Optic Neuropathy (LHON). Обновление от 2022
9.
Сведения о безопасности терапии идебеноном пациентов снаследственной оптической нейропатии Лебера
По данным клинических исследований наиболее часто встречаемыми нежелательными реакциями при приеме
идебенона являются:1
o назофарингит (≥1/10)
o кашель (≥1/10)
o диарея (обычно не требующая прекращения лечения) (≥1/100 - <1/10)
o боль в спине (≥1/100 - <1/10)
Клиническое
исследование
RHODOS
(NCT00747487)
многоцентровое
двойное слепое
рандомизированное
плацебоконтролируемое
исследование II/III
фазы.
Продолжительность
исследования 6
месяцев2
Характеристики
пациентов
Подтвержденные
мутации
m.3460G>A
(12.9%),
m.11778G>A
(67.1%),
m.14484T>C
(20.0%)
У 65% симптомы
>1 года
У 85% острота
зрения logMAR
≥1.0 обоих глаз
Возраст
Количество
пациентов
14-66
85 (в группе
идебенона
n=55, в
группе
плацебо
n=30)
Результаты
Приверженность к терапии была высокой в группе идебенона и плацебо, и составила 96.5%.2
4 пациента из группы плацебо (n=30) и 3 пациента из группы идебенона (n=55) досрочно
прекратили лечение, 1 пациент в группе плацебо и 1 пациент в группе идебенона досрочно
прекратили лечение в связи с возникновением НЯ2
В целом, частота всех НЯ и НЛР была низкой в обеих группах.2,3
НЯ, о которых сообщали ≥10,0% пациентов в группе идебенона, включали: назофарингит
(25,5%), головную боль (23,6%); гриппоподобное состояние и кашель (10,9%).3
Головная боль, назофарингит и кашель чаще встречались в группе идебенона, чем в группе
плацебо.3
НОНЛ - наследственная оптическая нейропатия Лебера, НЯ – нежелательные явления, НЛР - нежелательные лекарственные реакции
1.
2.
3.
Общая характеристика лекарственного препарата (Summary of Product Characteristics) Raxone®. Электронный ресурс: https://www.ema.europa.eu/en/documents/product-information/raxone-epar-product-information_en.pdf (дата обращения 13.02.2023)
Klopstock T et al. Brain. 2011;134:2677–86
Электронный ресурс: https://www.ema.europa.eu/en/documents/assessment-report/raxone-epar-public-assessment-report_en.pdf (дата обращения 15.03.23)
10.
Сведения для расчетов стоимости терапии идебеноном НОНЛСтоимость лекарственного препарата за упаковку и на год лечения для одного пациента1
Лекарственный
препарат
Raxone®/Раксон
(Идебенон) 150 мг
Регистрация в РФ
Стоимость упаковки по
цене производителя,
Российских рублей*
(без НДС)
Количество упаковок на 1 год
лечения
Стоимость 1 года лечения
по цене производителя,
Российских рублей*
(без НДС)
Нет
364 832,86 ₽
13
4 742 827,18 ₽
Препарат Идебенон принимается внутрь в суточной дозе 900 мг, из расчета по 300 мг 3 раза в день во время еды2
Рекомендуемый минимальный период терапии, позволяющий оценить эффективность лечения пациентов, не менее 12 месяцев3
В России, в настоящее время, выявлены более 30 пациентов в возрасте до 18 лет, которым возможно
назначить терапию препаратом Раксон в соответствии с выше обозначенными критериями4
Общая стоимость терапии препаратом Raxone®/Раксон (Идебенон) 150 мг 35 детей в год: 165 998 951,3
Российских рублей* (без НДС)
1.
2.
3.
4.
Информация для расчета стоимости по ценам ЛП получена от компании
производителя
Raxone®SmPC https://www.ema.europa.eu/en/documents/productinformation/raxone-epar-product-information_en.pdf (дата доступа 13.02.2023)
Carelli et al: J Neuro-Ophthalmol 2017; 37: 371-381
По данным внутренней базы данных ФГБНУ «МГНЦ» (электронный ресурс, дата
обращения 07.03.2023 г.)
Ожидаемое количество пациентов
до 18 лет с НОНЛ за ближайшие 10
лет
750
НОНЛ - наследственная оптическая нейропатия Лебера
* - по крусу ЦБ РФ на 03.02.2024 г – 1 Евро = 98,64 Российского рубля
11.
СПАСИБО ЗА ВНИМАНИЕ!vila2003@mail.ru








 medicine
medicine