Similar presentations:
Сера и ее соединения. 9 класс
1.
Сера и ее соединения9 класс
2.
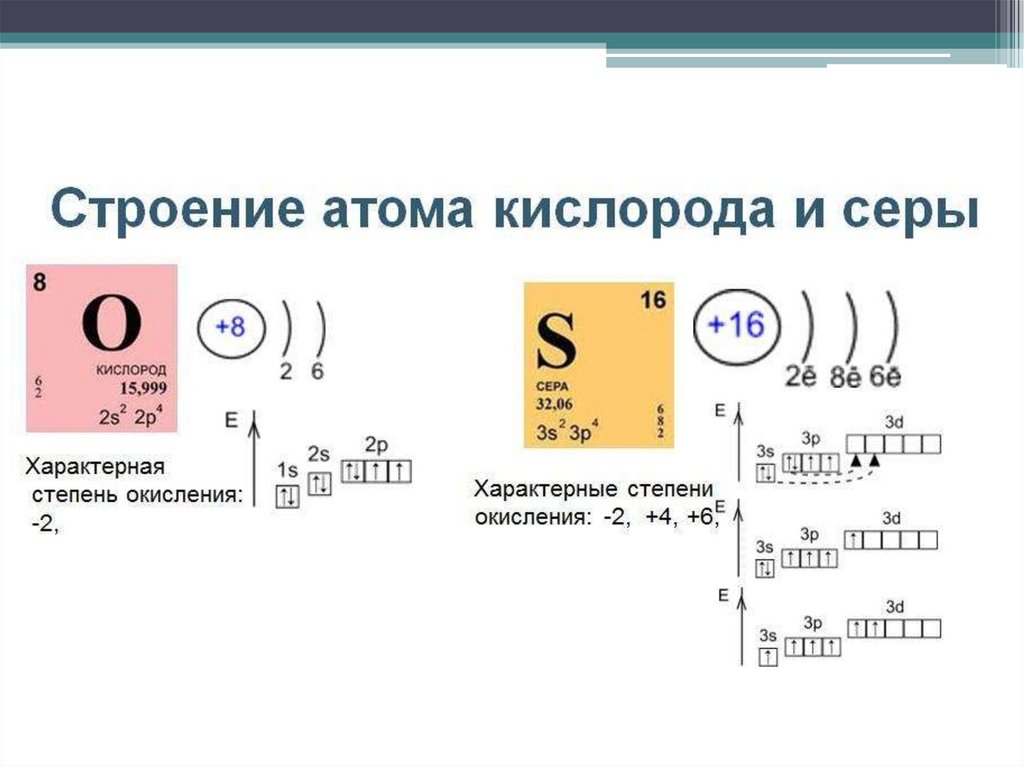
Сера – химический элемент• Находится в VIA подгруппе ПСХЭ
Д.И.Менделеева
• Порядковый номер 16
• Относительная атомная масса 32 а.е.м.
• Сера является 16-м по химической
распространённости х.э. в земной коре.
Встречается в свободном (самородном)
состоянии и в связанном виде.
3.
Сера в природе• FeS2 — железный колчедан, или пирит
• ZnS — цинковая обманка, или сфалерит
• PbS — свинцовый блеск, или галенит
• HgS — киноварь
• CuFeS2 — халькопирит
• Кроме того, присутствует в нефти,
природном угле, природных газах и сланцах,
природной воде.
• Жизненно важный элемент для высших
организмов, составная часть многих белков,
концентрируется в волосах.
4.
Нахождение в природе5.
6.
7.
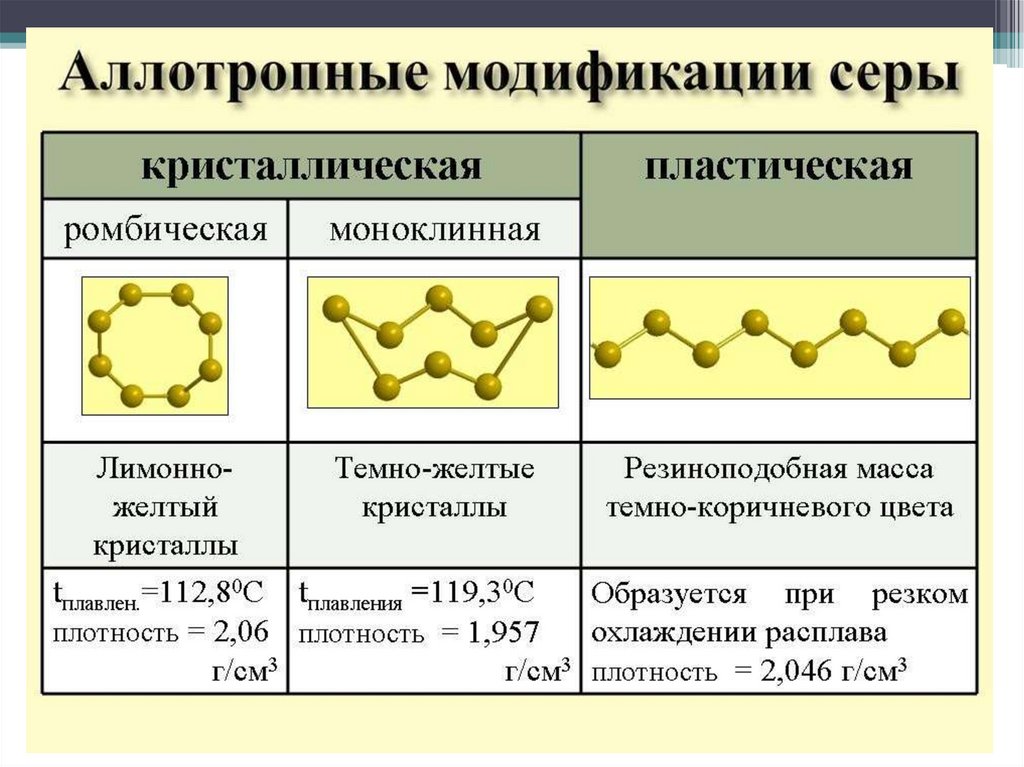
Аллотропия8.
Химические свойстваВзаимодействие с
•металлами,
•кислородом,
•водородом,
•конц. серной и азотной
кислотами
•щелочами
(диспропорционирование)
•другими веществами
9.
10.
11.
12.
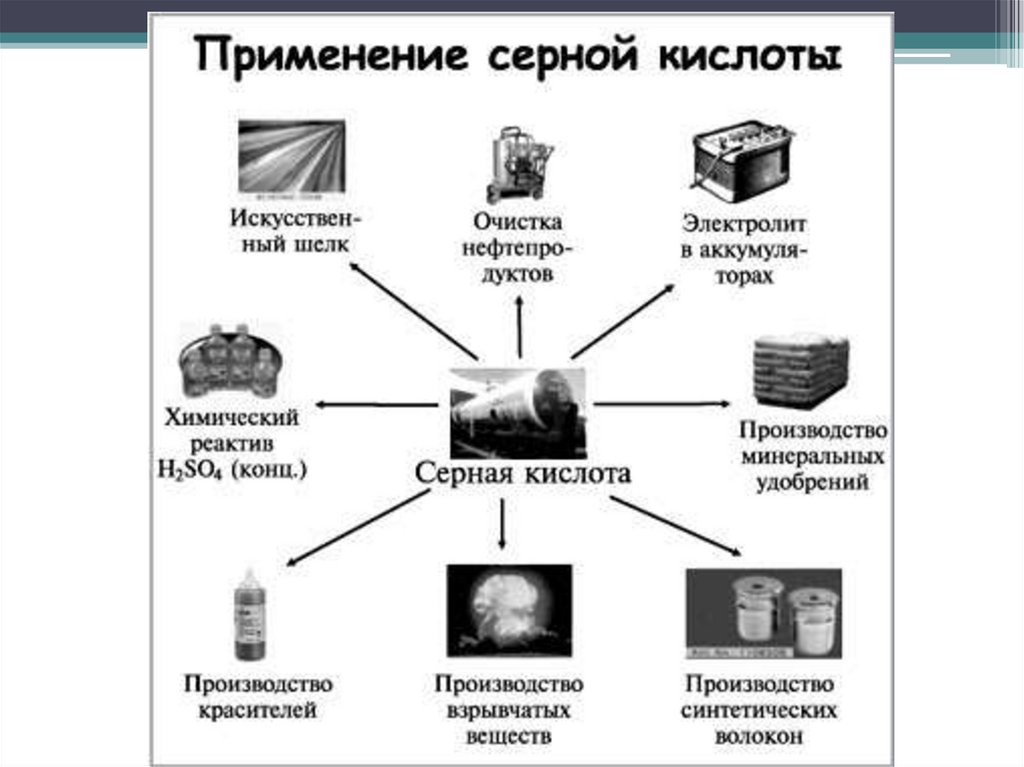
Применение серы• производство серной кислоты
• вулканизация каучука (получение резины)
• фунгицид в сельском хозяйстве
• лекарственный препарат (коллоидная сера)
• получение сероасфальта, серобетона
• производство пиротехнических составов
• производство спичек
• серная лампа — источник белого света,
очень близкого к солнечному, с высоким
КПД.
13.
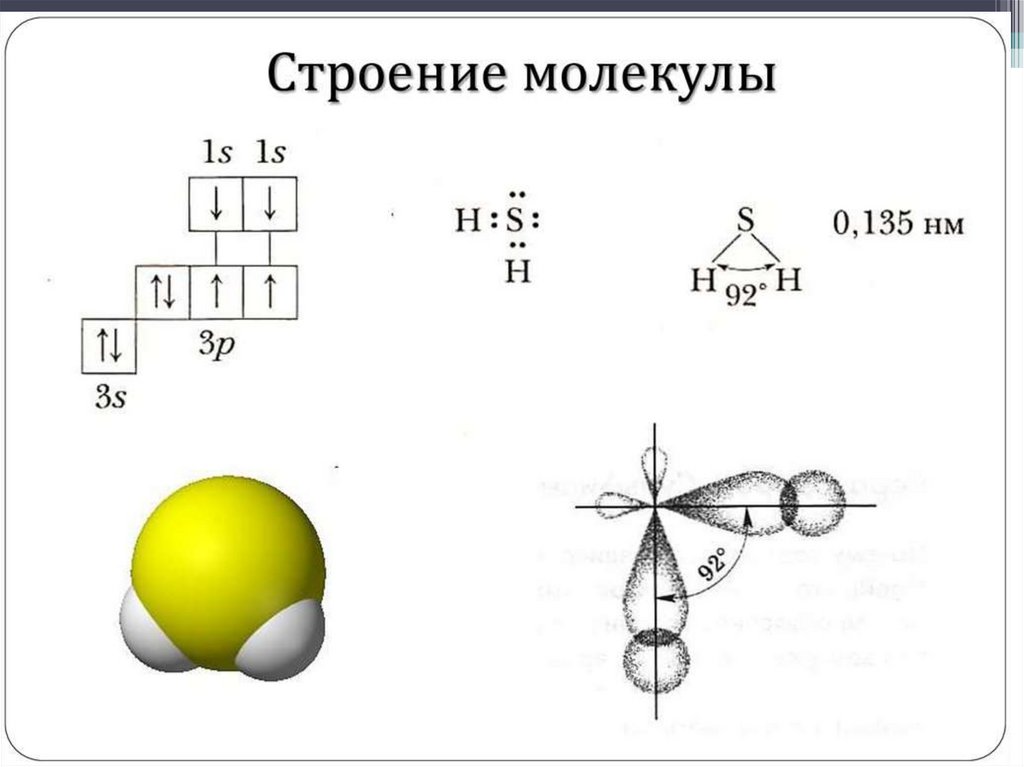
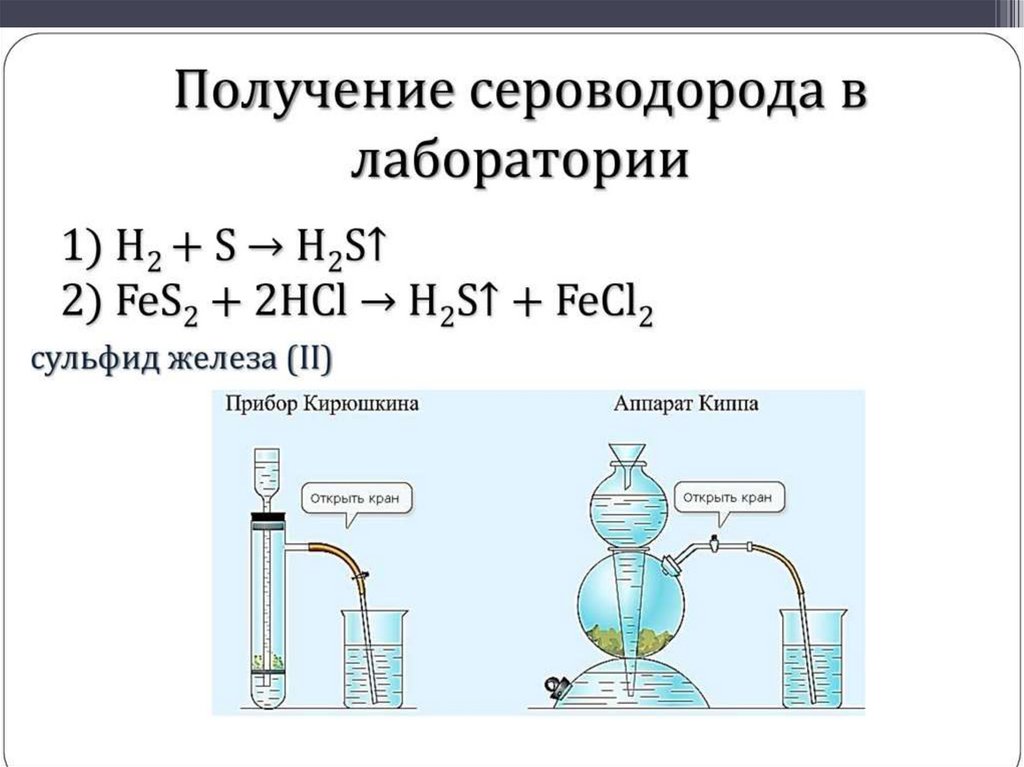
Соединения серы• Сероводород и сульфиды
• Оксид серы (IV), сернистая
кислота, сульфиты
• Оксид серы (VI), серная кислота,
сульфаты
14.
15.
16.
17.
18.
19.
Химические свойстваВосстановительные (ОВР):
• взаимодействие с кислородом,
галогенами, солями, кислотами
Кислотные свойства (без изменения
степени окисления серы):
• взаимодействие с основаниями,
солями
20.
21.
22.
23.
24.
Найдите ошибки вионных уравнениях.
25.
26.
27.
Применение сероводородаОграничено из-за его токсичности
• В медицине (в составе сероводородных ванн):
нормализует работу сердца и нервной
системы, артериальное давление, используют
при кожных заболеваниях
• В аналитической химии как реагент для
осаждения тяжелых металлов
• Для получения серы, серной кислоты,
органических производных (меркаптанов)
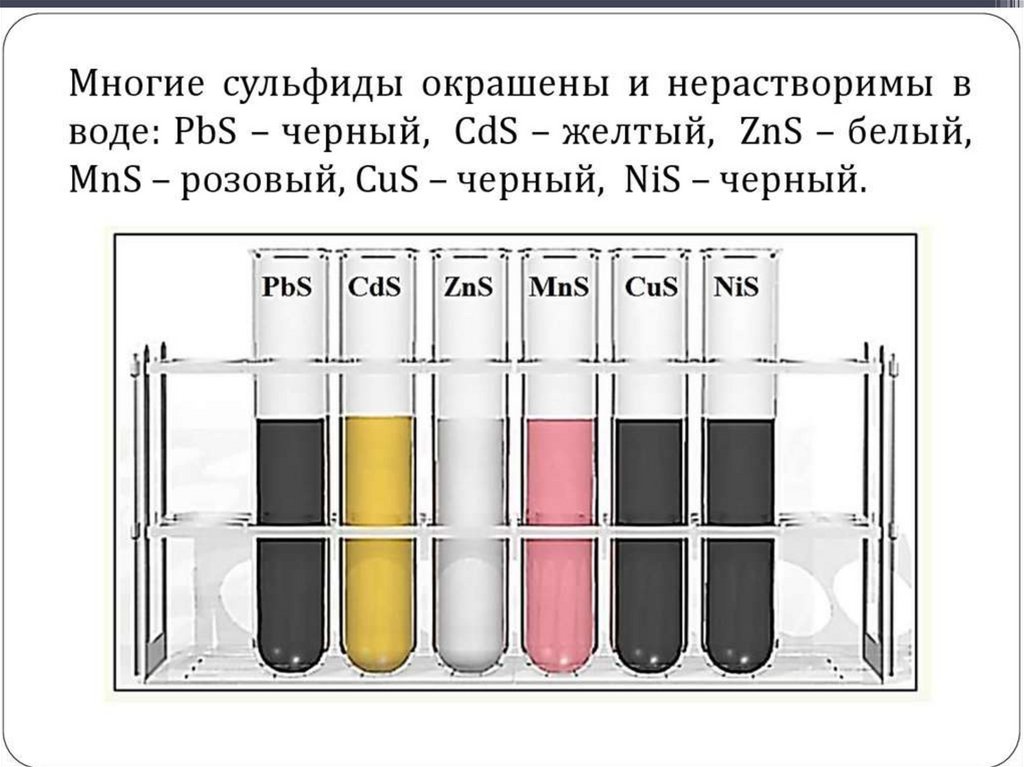
• Окрашенные сульфиды служат основой для
красок, в том числе светящихся
28.
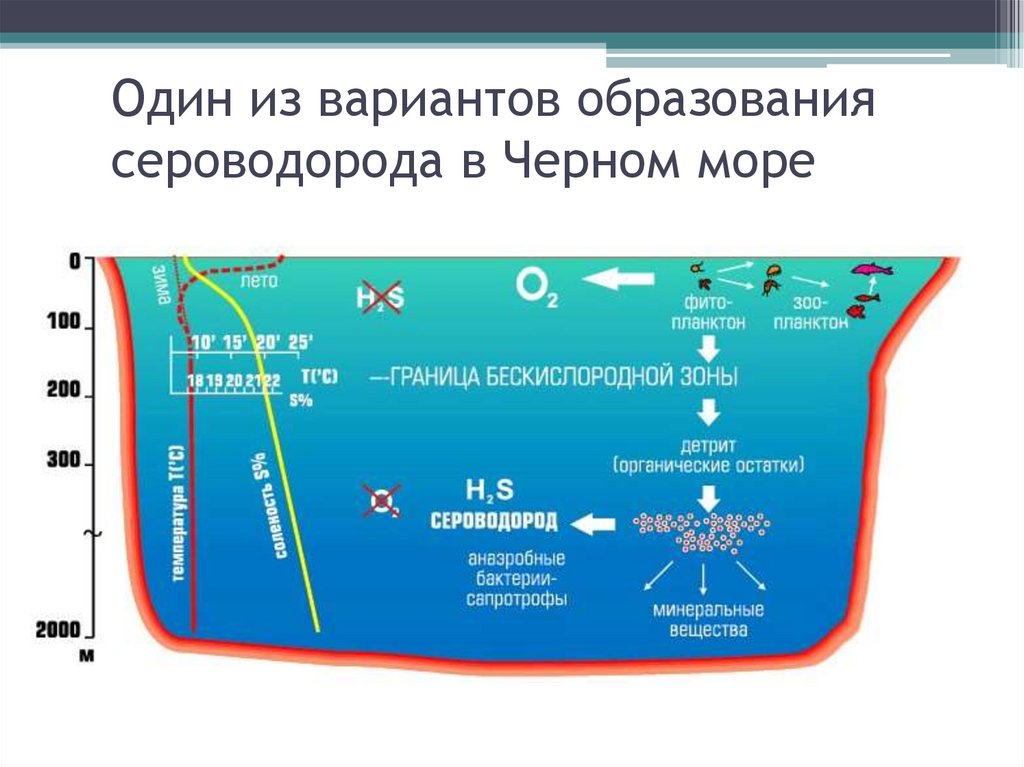
Один из вариантов образованиясероводорода в Черном море
29.
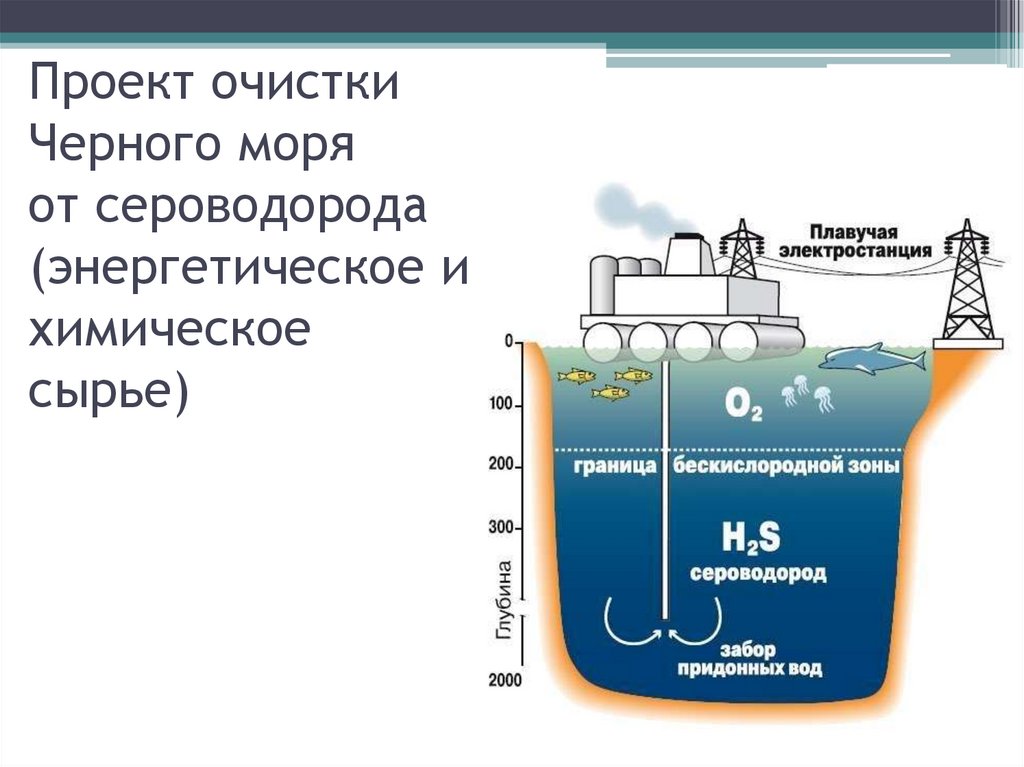
Проект очисткиЧерного моря
от сероводорода
(энергетическое и
химическое
сырье)
30.
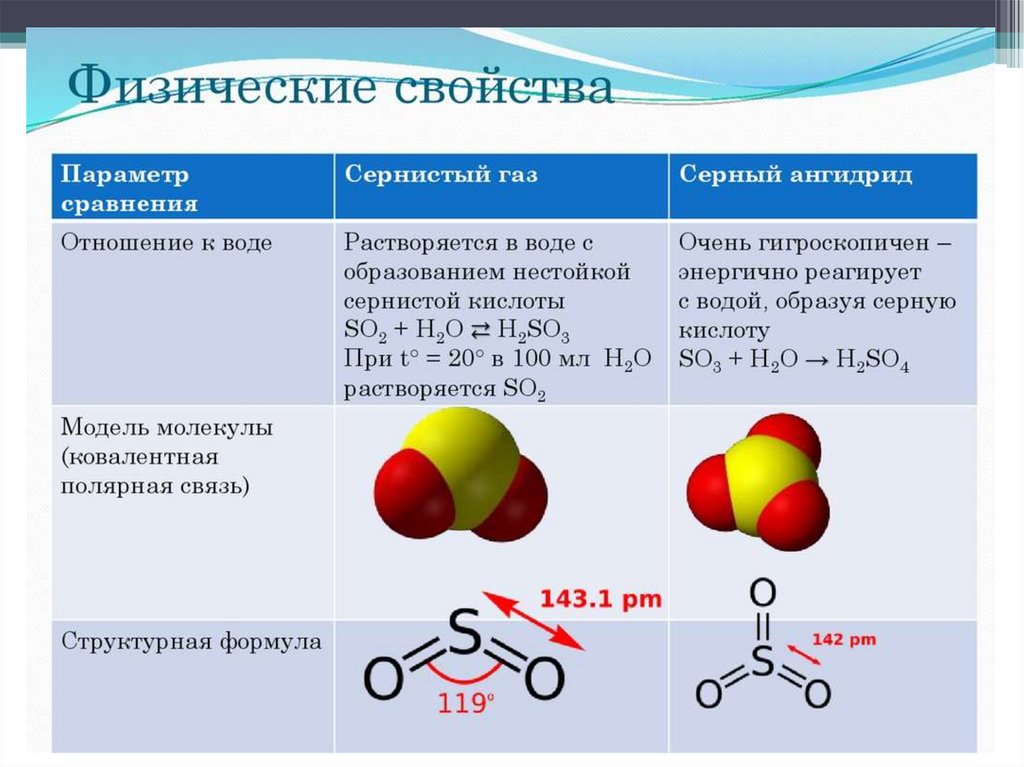
Оксид серы (IV) и оксид серы (VI) –кислотные оксиды
Как назвать SO2 ?
•Оксид серы (IV)
•Диоксид серы
•Сернистый газ
•Сернистый ангидрид
31.
32.
33.
34.
35.
36.
37.
Применение диоксида серы• Большая часть идет на производство
серной кислоты
• Консервант (пищевая добавка Е 220) в
виноделии, для плодов и фруктов
• Т.к. газ убивает микроорганизмы, им
окуривают овощехранилища и склады
• Для отбеливания шерсти, шелка, соломы
(материалов, которые нельзя отбеливать
хлором)
• Получение сульфитов
38.
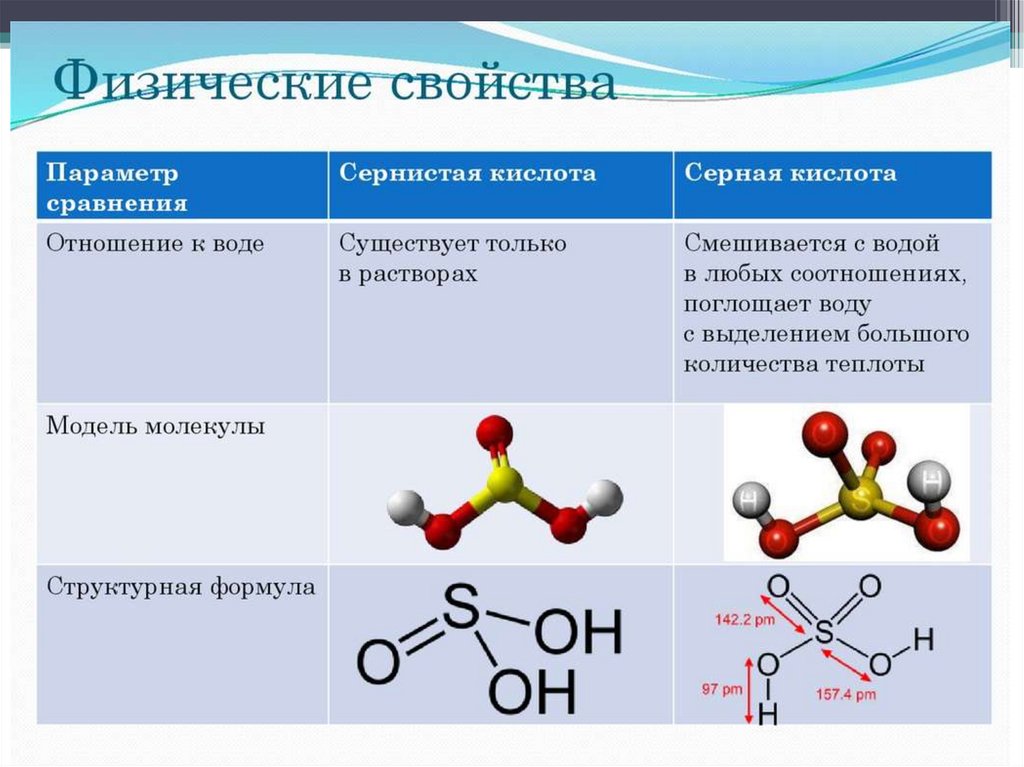
Сернистая и серная кислотыСернистая кислота H2SO3:
Слабая двухосновная кислота, проявляет
все свойства кислот.
Серная кислота H2SO4:
Сильная двухосновная кислота, в
разбавленном виде проявляет все
свойства кислот, в концентрированном –
особые свойства
39.
40.
41.
Разбавляем серную кислотуправильно!
42.
Особые свойстваконцентрированной H2SO4
• Вытесняет сильные, но летучие кислоты из их
солей
• Взаимодействует с металлами (в т.ч. после Н) с
образованием различных продуктов
восстановления серы +6.
• Окисляет некоторые неметаллы
• Вступает в ОВР с различными
восстановителями
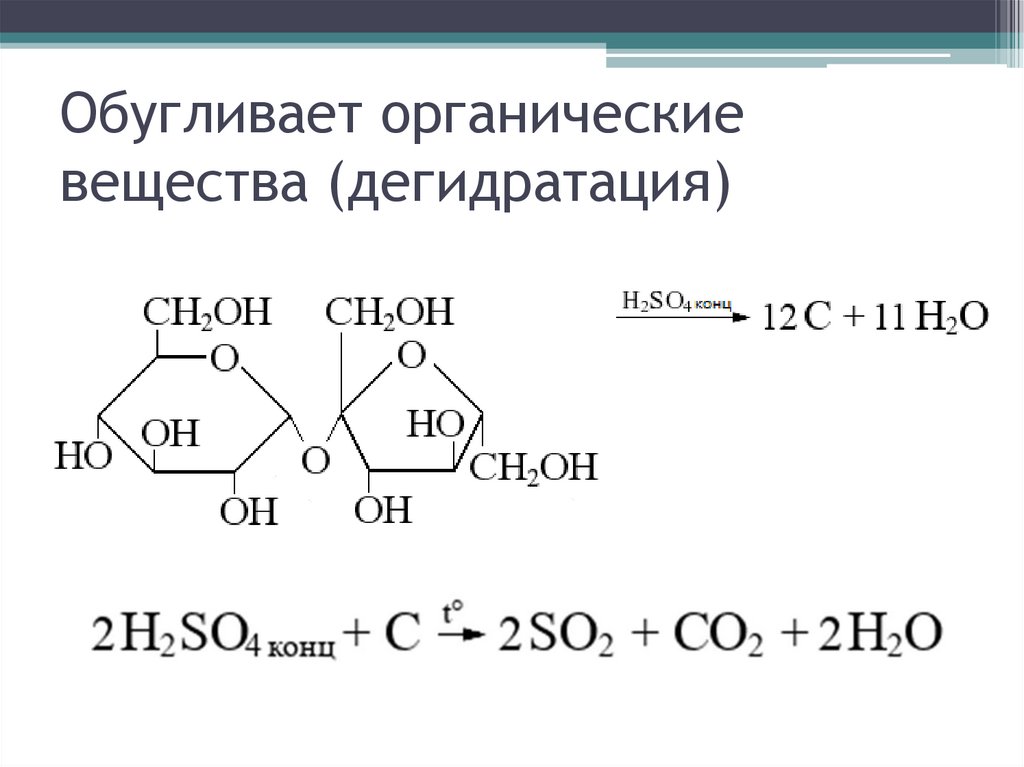
• Вступает в реакции дегидратации со многими
органическими веществами
43.
Сильная вытеснительнаяспособность
• Вытесняет хлороводород из хлоридов,
азотную кислоту - из нитратов
44.
Взаимодействие с металлами45.
Тренируемся•H2SO4 (конц.) + Cu →
•H2SO4 (конц.) + Zn →
•H2SO4 (конц.) + Mg →
46.
Взаимодействие с неметаллами(серой, фосфором, углеродом)
47.
Взаимодействие с галогенидами• С хлоридом – РИО, без изменения степеней
окисления
• С бромидом и иодидом – ОВР
48.
Обугливает органическиевещества (дегидратация)
49.
Обугливает органическиевещества (дегидратация)
50.
51.
52.
Качественные реакцииАнион
Реактив
Наблюдаемая реакция
S042-
Ва2+
Выпадение белого осадка, нерастворимого в
кислотах:
Ва2+ + S042BaS04
S2-
Н+
Рb2+
Запах сероводорода: 2Н+ + S2Н2S
Выпадение черного осадка: Pb2+ + S2-
Н+
Появление характерного запаха S02:
2Н+ + SO32Н20 + S02
SO32-
PbS
53.
Гидролиз солей• По аниону: сульфиды, сульфиты.
Среда щелочная.
• Сульфаты в водном растворе не
гидролизуются.
Среда нейтральная








































 chemistry
chemistry








