Similar presentations:
Металлы
1.
СРЕДНЯЯ ОБЩЕОБРАЗОВАТЕЛЬНАЯ ШКОЛА №2МУНИЦИПАЛЬНОЕ БЮДЖЕТНОЕ ОБЩЕОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
ПРЕЗЕНТАЦИЯ
НА ТЕМУ: «МЕТАЛЛЫ»
Выполнила:
ученица 9а класса
Чомаева Зарема
Руководитель:
Мишечкина С. А.
2.
Содержание1.
2.
3.
4.
5.
6.
7.
8.
9.
Понятие о металлах
Металлы в периодической системе химических элементов
Строение металлов
Металлическая связь. Зонная теория электронного строения
Физические свойства металлов
Химические свойства металлов
Металлы в природе
Получения металлов
Применение металлов
3.
Понятие о металлахМеталл ( от лат. metallum-шахта)- группа элементов, обладающая характерными
металлическими свойствами, такими как высокая тепло- и электроводность, высокая
пластичность и др.
Металлы- это химические элементы, атомы которых способны только отдавать электроны,
имеют низкие значения электроотрицательности (от 0,7 до 2.0), им соответствуют
простые вещества, металлы.
К металлам относятся примерно 80% всех химических элементов.
4.
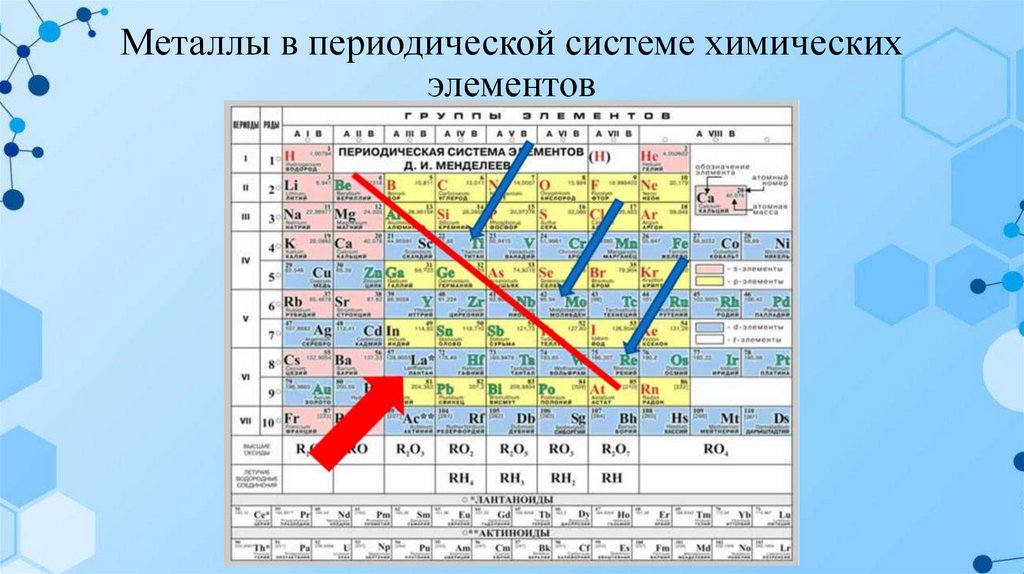
Металлы в периодической системе химическихэлементов
В Периодической системе химических элементов Д.И. Менделеева металлы
располагаются ниже диагонали бериллий – астат. Элементы, расположенные вблизи
диагонали, например, бериллий, алюминий, титан, германий, сурьма обладают
двойственным характером и относятся к металлоидам. Металлы располагаются в начале
периодов, к ним относятся s-элементы 1 и 2 групп, р-элементы 3 группы, все, кроме
бора, 4 группы: германий, олово, свинец, 5 группы: сурьма, висмут, а также все d- и fэлементы.
5.
Металлы в периодической системе химическихэлементов
6.
Строение металлов• Как известно, все вещества, в том числе и металлы, состоят из атомов. Каждый металл (химический
элемент) может находиться в газообразном, жидком или твердом агрегатных состояниях. Каждое
агрегатное состояние будет иметь свои особенности, отличные от других. В газообразном металле
расстояние между атомами велико, силы взаимодействия малы, и атомы хаотично перемещаются в
пространстве; газ стремится к расширению в сторону большего объема. При понижении температуры и
давления вещество переходит в жидкое состояние. Свойства жидкого вещества резко отличаются от
свойств газообразного. В жидком металле атомы сохраняют лишь так называемый ближний порядок
атомов, т.е. в объеме расположено наибольшее количество атомов, а не атомы всего объема. При
понижении температуры жидкий металл переходит в твердое состояние, которое имеет строгую
закономерность расположения атомов.
• Стремление атомов (ионов) металла расположиться возможно ближе друг к другу, плотнее (поэтому
металлы и обладают более высокой плотностью, чем неметаллы) приводит к тому, что число
встречающихся комбинаций взаимного расположения атомов металла в кристаллах невелико. При
описании правильной внутренней структуры кристаллов обычно пользуются понятием
«кристаллическая решетка».
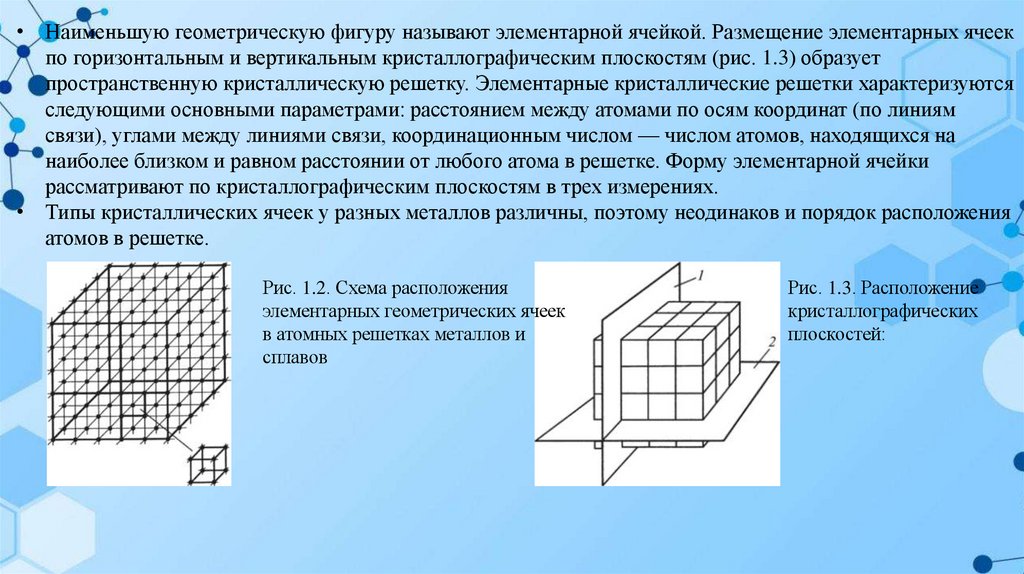
• Кристаллическая решетка представляет собой пространственную сетку, в узлах которой располагаются
частицы (атомы, ионы или молекулы), образующие кристалл. Если условно провести вертикальные и
горизонтальные линии связей через центры атомов, можно увидеть, что у металлов в твердом
состоянии атомы расположены в строго определенном порядке и представляют собой множество раз
повторяющихся элементарных геометрических фигур — параллелепипедов (рис. 1.2).
7.
• Наименьшую геометрическую фигуру называют элементарной ячейкой. Размещение элементарных ячеекпо горизонтальным и вертикальным кристаллографическим плоскостям (рис. 1.3) образует
пространственную кристаллическую решетку. Элементарные кристаллические решетки характеризуются
следующими основными параметрами: расстоянием между атомами по осям координат (по линиям
связи), углами между линиями связи, координационным числом — числом атомов, находящихся на
наиболее близком и равном расстоянии от любого атома в решетке. Форму элементарной ячейки
рассматривают по кристаллографическим плоскостям в трех измерениях.
• Типы кристаллических ячеек у разных металлов различны, поэтому неодинаков и порядок расположения
атомов в решетке.
Рис. 1.2. Схема расположения
элементарных геометрических ячеек
в атомных решетках металлов и
сплавов
Рис. 1.3. Расположение
кристаллографических
плоскостей:
8.
1 и 2 — соответственно горизонтальная и вертикальная кристаллографические плоскостиБольшинство металлов образуют кристаллические решетки, элементарными ячейками которых являются:
объемно-центрированная кубическая (ОЦК), гранецентрированная кубическая (ГЦК) и гексагональная
плотноупакованная (ГПУ).
Простая кубическая ячейка (рис. 1.4, а) характерна для неметаллов, которые обладают наибольшими
плотностью и удельным весом, и имеет восемь атомов, которые расположены в каждой вершине куба.
Объемно-центрированная кубическая ячейка (рис. 1.4, б) состоит из восьми атомов, расположеных по
одному в каждой вершине куба, и еще одного — находящегося в центре куба на равных расстояниях от его
граней. Эту форму атомной кристаллической ячейки имеют железо модификации Бе-а, ванадий, вольфрам,
молибден, тантал и хром, т.е. в основном черные металлы.
Гранецентрированная кубическая ячейка (рис. 1.4, в) имеет 14 атомов — по одному атому в каждой вершине
куба (восемь атомов) и по одному атому в центре каждой грани (шесть атомов). Гранецент-рированную
кубическую ячейку имеют алюминий, железо модификации Бе-у, золото, кобальт, медь, никель, платина и
серебро, в основном это цветные металлы и часть черных металлов.
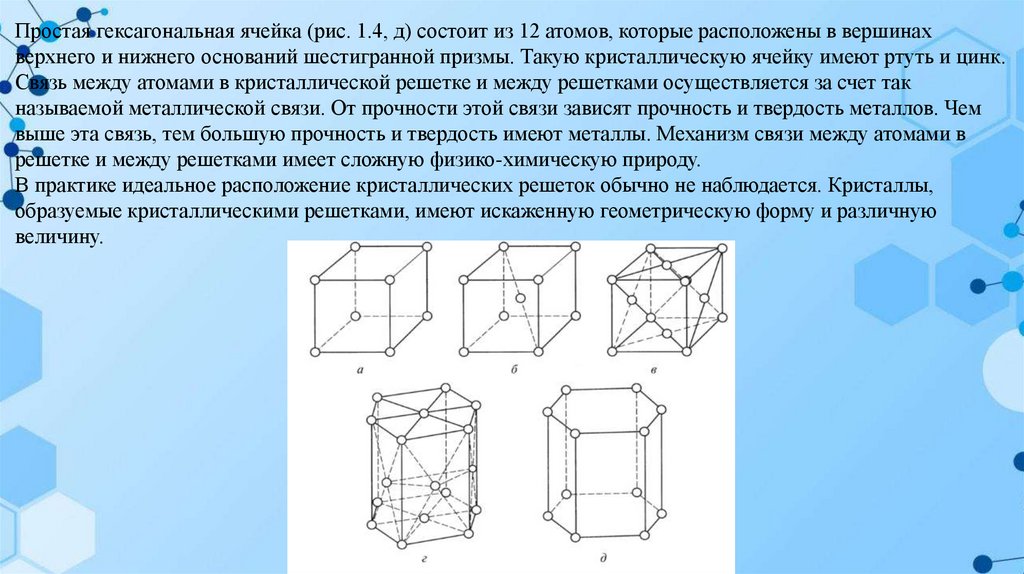
Гексагональная плотноупакованная ячейка (рис. 1.4, г) состоит из 17 атомов. Формой геометрического тела,
которую образуют эти атомы, является шестигранная призма. При этом по шесть атомов расположены в
каждой вершине верхнего и нижнего оснований, по одному атому в центре этих оснований и три атома в
центре одной их трех граней (через грань). Гексагональную плотноупакованную ячейку имеют бериллий,
кадмий, магний, ванадий, тантал.
9.
Простая гексагональная ячейка (рис. 1.4, д) состоит из 12 атомов, которые расположены в вершинахверхнего и нижнего оснований шестигранной призмы. Такую кристаллическую ячейку имеют ртуть и цинк.
Связь между атомами в кристаллической решетке и между решетками осуществляется за счет так
называемой металлической связи. От прочности этой связи зависят прочность и твердость металлов. Чем
выше эта связь, тем большую прочность и твердость имеют металлы. Механизм связи между атомами в
решетке и между решетками имеет сложную физико-химическую природу.
В практике идеальное расположение кристаллических решеток обычно не наблюдается. Кристаллы,
образуемые кристаллическими решетками, имеют искаженную геометрическую форму и различную
величину.
10.
Металлическая связь. Зонная теория электронногостроения
Металлическая связь-связь между положительными ионами металлов и общими электронами, которые
свободно движутся по всему объёму.
Металлическая связь существует в простых веществах металлах (в твёрдом или расплавленном состоянии),
сплавах металлов. Металлическая связь может существовать только в веществах, но не между отдельными
атомами.
Рассмотрим механизм образования металлической связи. Атомы металлов легко отдают внешние электроны
в общее пользование, в результате чего образуются катионы металлов и обобществлённые электроны,
которые легко перемещаются по всему объёму. Между ионами и свободными электронами возникают
электростатические взаимодействия, которые и являются причиной возникновения металлической связи.
Свободно перемещающиеся электроны обусловливают электрическую проводимость металлов.
Рис. 1. Схема металлической связи
11.
Следует отметить, что в действительности атомы в металлах ионизованы частично, электронные облака,которые они отдают в общее пользование, принадлежат и данному атому.
Металлическая связь имеет сходство как с ионной, так и с ковалентной связью. Сходство с ионной связью
заключается в том, ионная связь образуется за счёт взаимодействия между заряженными частицами:
электронами и ионами. Как и в случае ковалентной связи, при образовании металлической связи
происходит обобществление электронов. Однако в отличие от ковалентной связи, где электроны
локализованы около определенных атомов, электроны в металлах обобществляются между всеми
атомами кристалла, т. е. металлическая связь делокализована.
Металлическая связь, в отличие от ковалентной связи, ненасыщаема, так как она объединяет большое
число атомов, и ненаправлена, что обусловлено сферической формой -электронных орбиталей,
перекрывание которых зависит только от расстояний между ними и не зависит от направлений, по
которым они сближаются.
12.
Физические свойства металловТвёрдость
Все металлы (кроме ртути и, условно, франция) при нормальных условиях находятся в твёрдом состоянии,
однако обладают различной твёрдостью. Ниже в таблице приводится твёрдость некоторых металлов по
шкале Мооса.
Температура плавления
Температуры плавления чистых металлов лежат в диапазоне от −39 °C (ртуть) до 3410 °C (вольфрам).
Температура плавления большинства металлов (за исключением щелочных) высока, однако некоторые
металлы, например, олово и свинец, могут расплавиться на обычной электрической или газовой плите.
Плотность
В зависимости от плотности, металлы делят на лёгкие (плотность 0,53 ÷ 5 г/см³) и тяжёлые (5 ÷ 22,5 г/см³).
Самым лёгким металлом является литий (плотность 0,53 г/см³). Самый тяжёлый металл в настоящее время
назвать невозможно, так как плотности осмия и иридия — двух самых тяжёлых металлов — почти равны
(около 22,6 г/см³ — ровно в два раза выше плотности свинца), а вычислить их точную плотность крайне
сложно: для этого нужно полностью очистить металлы, ведь любые примеси снижают их плотность.
Пластичность
Большинство металлов пластичны, то есть металлическую проволоку можно согнуть, и она не сломается.
Это происходит из-за смещения слоёв атомов металлов без разрыва связи между ними. Самыми пластичными
являются золото, серебро и медь. Из золота можно изготовить фольгу толщиной 0,003 мм, которую
13.
ПластичностьБольшинство металлов пластичны, то есть металлическую проволоку можно согнуть, и она не сломается. Это
происходит из-за смещения слоёв атомов металлов без разрыва связи между ними. Самыми пластичными
являются золото, серебро и медь. Из золота можно изготовить фольгу толщиной 0,003 мм, которую
используют для золочения изделий. Однако не все металлы пластичны. Проволока из цинка или олова
хрустит при сгибании; марганец и висмут при деформации вообще почти не сгибаются, а сразу ломаются.
Пластичность зависит и от чистоты металла; так, очень чистый хром весьма пластичен, но, загрязнённый
даже незначительными примесями, становится хрупким и более твёрдым. Некоторые металлы, такие, как
золото, серебро, свинец, алюминий, осмий, могут срастаться между собой, но на это могут уйти десятки лет.
Электропроводность
Все металлы хорошо проводят электрический ток; это обусловлено наличием в их кристаллических решётках
подвижных электронов, перемещающихся под действием электрического поля. Серебро, медь и алюминий
имеют наибольшую электропроводность; по этой причине последние два металла чаще всего используют в
качестве материала для проводов. Очень высокую электропроводность имеет также натрий, в
экспериментальной аппаратуре известны попытки применения натриевых токопроводов в форме
тонкостенных труб из нержавеющей стали, заполненных натрием. Благодаря малому удельному весу натрия,
при равном сопротивлении натриевые «провода» получаются значительно легче медных и даже несколько
легче алюминиевых.
Теплопроводность
Высокая теплопроводность металлов также зависит от подвижности свободных электронов. Поэтому ряд
теплопроводностей похож на ряд электропроводностей, и лучшим проводником тепла, как и электричества,
является серебро. Натрий также находит применение как хороший проводник тепла.
14.
15.
Химические свойства металловВзаимодействие с неметаллами
Щелочные металлы сравнительно легко реагируют с кислородом, но каждый металл проявляет свою индивидуальность:
оксид образует только литий 4Li + O2 = 2Li2O
натрий образует пероксид 2Na + O2 = Na2O2
калий, рубидий и цезий — надпероксид K + O2 = KO2
Остальные металлы с кислородом образуют оксиды:
2Mg + O2 = 2MgO
2Al + O2 = Al2O3
2Zn + O2 = 2ZnO (при нагревании)
4Cr + 3O2 = 2Cr2O3
Металлы, которые в ряду активности расположены левее водорода, при контакте с кислородом воздуха образуют
ржавчину. Например, так делает железо:
4Fe + 3O2 (воздух) + 6H2O(влага) = 4Fe(OH)3
С галогенами металлы образуют галогениды:
2Na + Cl2 = 2NaCl
16.
Mg + Cl2 = MgCl22Al + 3Br2 = 2AlBr3
Zn + Cl2 =ZnCl2
2Cr + 3Cl2 = 2CrCl3
Медный порошок реагирует с хлором и бромом (в эфире):
Cu + Cl2 = CuCl2
Cu + Br2 = CuBr2
При взаимодействии с водородом образуются гидриды:
2Na + H2 = 2NaH
Ca + H2 +СaH2
Zn + H2 =ZnH2
Взаимодействие с серой приводит к образованию сульфидов (реакции протекают при нагревании):
2K + S = K2S
Сa + S = CaS
2Al + 3S = Al2S3
2Cr + 3S = Cr2S3
Cu +S = CuS
Реакции с фосфором протекают до образования фосфидов (при нагревании):
3K + P = K3P
3Zn + 2P = Zn3P2
3Mg + 2P = Mg3P2
Основной продукт взаимодействия металла с углеродом — карбид (реакции протекают при нагревании).
Из щелочноземельных металлов с углеродом карбиды образуют литий и натрий:
2Li + 2C = Li2C2
Калий, рубидий и цезий карбиды не образуют, могут образовывать соединения включения с графитом:
Ca + 2C = CaC2
17.
С азотом из металлов IA группы легко реагирует только литий. Реакция протекает при комнатной температуре собразованием нитрида лития:
6Li + N2 = 2Li3N
3Mg + N2 = Mg3N2
2Al + N2 = 2AlN
2Cr + N2 = 2CrN
Взаимодействие с водой
Все металлы I A и IIA группы реагируют с водой, в результате образуются растворимые основания и выделяется H2.
Литий реагирует спокойно, держась на поверхности воды, натрий часто воспламеняется, а калий, рубидий и цезий
реагируют со взрывом:
2Li + 2H2O = 2LiOH + H2
Ca + 2H2O = Ca(OH)2 + H2
Металлы средней активности реагируют с водой только при условии, что металл нагрет до высоких температур. Результат
данной реакции — образование оксида.
Cr + H2O = Cr2O3 + H2
Zn + H2O = ZnO + H2
Неактивные металлы с водой не взаимодействуют.
Взаимодействие с кислотами
Если металл расположен в ряду активности левее водорода, то происходит вытеснение водорода из разбавленных кислот.
Данное правило работает в том случае, если в реакции с кислотой образуется растворимая соль.
2Na + 2HCl = 2NaCl + H2
При взаимодействии с кислотами-окислителями, например, азотной, образуется продукт восстановления кислоты, хотя
протекание реакции также неоднозначно.
Металлы IА группы:
2K + H2SO4 (раствор) = K2SO4 + H2
18.
8K + 5H2SO4 (конц) = 4K2SO4 + H2S + 4H2O8Na + 10HNO3 (раствор) = 8NaNO3 + NH4NO3 + 3H2O
3Na + 4HNO3 (конц) = 3NaNO3 + NO + 2H2О
Металлы IIА группы
Mg + H2SO4 (раствор) = MgSO4 + H2
4Mg + 5H2SO4 (конц) = 4MgSO4 + H2S + 4H2O
Mg+ 4HNO3 (конц) = Mg(NO3)2 + 2NO2 + 2H2O
4Mg + 10HNO3 (раствор) = 4Mg(NO3)2 + 2N2O + 5H2O
Такие металлы, как железо, хром, никель, кобальт на холоде не взаимодействуют с серной кислотой, но при нагревании
реакция возможна.
Взаимодействие с солями
Металлы способны вытеснять из растворов солей другие металлы, стоящие в ряду напряжений правее, и могут быть
вытеснены металлами, расположенными левее:
Zn + CuSO4 = ZnSO4 + Cu
На металлы IА и IIА группы это правило не распространяется, так как они реагируют с водой.
Реакция между металлом и солью менее активного металла возможна в том случае, если соли — как вступающие в
реакцию, так и образующиеся в результате — растворимы в воде.
Взаимодействие с аммиаком
Щелочные металлы реагируют с аммиаком с образованием амида натрия:
2Li + 2NH3 = 2LiNH2 + H2
Взаимодействие с органическими веществами
Металлы IА группы реагируют со спиртами и фенолами, которые проявляют в данном случае кислотные свойства:
2Na + 2C2H5OH = 2C2H5ONa + H2
2K + 2C6H5OH = 2C6H5OK + H2
19.
Также они могут вступать в реакции с галогеналканами, галогенпроизводными аренов и другими органическимивеществами.
Взаимодействие металлов с оксидами
Для металлов при высокой температуре характерно восстановление неметаллов или менее активных металлов из их
оксидов.
8Al + 3Fe3O4 = 4Al2O3 + 9Fe (алюмотермия)
3Са + Cr2O3 = 3СаО + 2Cr (кальциетермия)
20.
Металлы в природеМногие металлы широко распространены в природе. Так, содержание некоторых металлов в земной коре
следующее:
алюминия — 8,2%
железа — 4,1%
кальция — 4,1%
натрия — 2,3%
магния — 2,3%
калия - 2,1 %
титана — 0,56%
Большое количество натрия и магния содержится в морской воде: — 1,05%, — 0,12%.
В природе металлы встречаются в различном виде:
— в самородном состоянии: серебро , золото , платина , медь , иногда ртуть
— в виде оксидов: магнетит Fe3O4, гематит Fe2О3 и др.
— в виде смешанных оксидов: каолин Аl2O3 • 2SiO2 • 2Н2О, алунит (Na,K)2O • АlО3 • 2SiO2 и др.
— различных солей:
сульфидов: галенит PbS, киноварь НgS,
хлоридов: сильвин КС1, галит NaCl, сильвинит КСl• NаСl, карналлит КСl • МgСl2 • 6Н2О, сульфатов: барит
ВаSO4, ангидрид Са8О4 фосфатов: апатит Са3(РО4)2, карбонатов: мел, мрамор СаСО3, магнезит МgСО3.
Многие металлы часто сопутствуют основным природным минералам: скандий входит в состав оловянных,
вольфрамовых руд, кадмий — в качестве примеси в цинковые руды, ниобий и тантал — в оловянные.
Железным рудам всегда сопутствуют марганец, никель, кобальт, молибден, титан, германий, ванадий.
21.
22.
Получения металлов. Применение металловПолучения металлов
Основные способы получения металлов: пирометаллургия, гидрометаллургия, электрометаллургия.
Пирометаллургия — восстановление металлов из руд при высоких температурах с помощью углерода,
оксида углерода (II), водорода, металлов — алюминия, магния. Например, медь восстанавливают из
куприта Cu 2 O прокаливанием с углем (коксом): SnО 2 + 2С = Sn + 2СО↑; Cu 2 O + С = 2Cu+ СО ↑.
Применение металлов
Конструкционные материалы
Металлы и их сплавы — одни из главных конструкционных материалов современной цивилизации. Это
определяется, прежде всего, их высокой прочностью, однородностью и непроницаемостью для жидкостей
и газов. Кроме того, меняя рецептуру сплавов, можно менять их свойства в очень широких пределах.
Электротехнические материалы
Металлы используются как в качестве хороших проводников электричества (медь, алюминий), так и в
качестве материалов с повышенным сопротивлением для резисторов и электронагревательных элементов
(нихром и т. п.).
Инструментальные материалы
Металлы и их сплавы широко применяются для изготовления инструментов (их рабочей части). В
основном, это инструментальные стали и твёрдые сплавы. В качестве инструментальных материалов
применяются также алмаз, нитрид бора, керамика.
23.
Литература• https://studfile.net/preview/6327913/#2
• https://studref.com/436218/tehnika/stroenie_metallov
• https://infourok.ru/prezentaciya-metally-obshaya-harakteristika-9-klass-6494594.html
• https://ru.wikipedia.org/wiki/Металлы
• https://foxford.ru/wiki/himiya/metallicheskaya-svyaz-i-ee-harakteristiki




















 chemistry
chemistry








