Similar presentations:
Вольтамперометрия. Вольтамперограмма
1. Вольтамперометрия
Метод анализа, основанный наизучении поляризационных
(вольтамперных) кривых, полученных
в электролитической ячейке с
поляризующимся индикаторным
электродом и неполяризующимся
электродом сравнения.
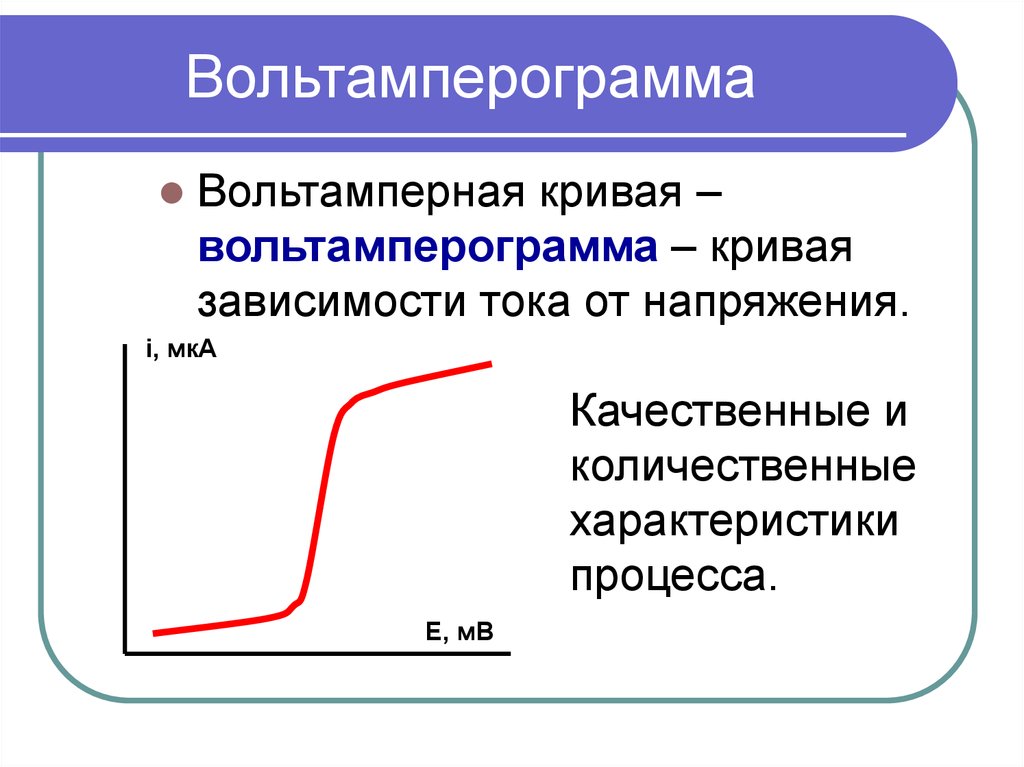
2. Вольтамперограмма
Вольтамперная кривая –вольтамперограмма – кривая
зависимости тока от напряжения.
i, мкА
Качественные и
количественные
характеристики
процесса.
Е, мВ
3. Ячейка
Анод – процессы окисленияКатод – процессы восстановления
Напряжение, наложенное на ячейку:
Е = ЕА – ЕК + iR
iR – падение напряжения при
прохождении тока через раствор
Для ↓iR – добавление индифферентного
электролита (фона).
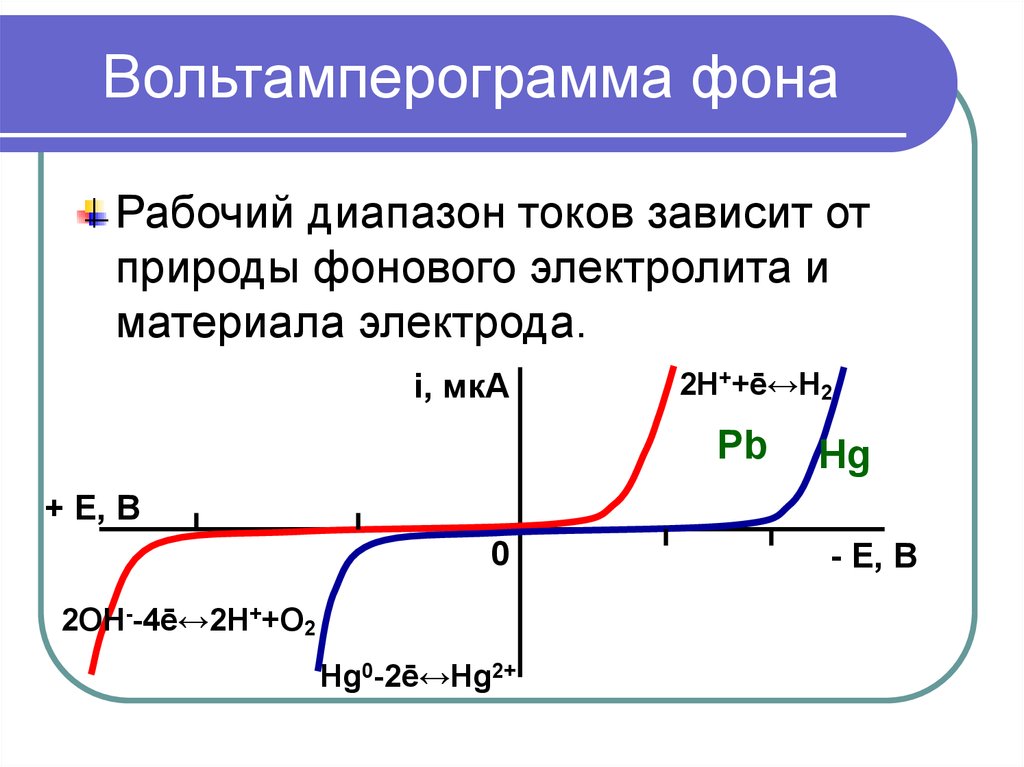
4. Вольтамперограмма фона
Рабочий диапазон токов зависит отприроды фонового электролита и
материала электрода.
i, мкА
2H++ē↔H2
Pb
Hg
+ Е, В
0
2OH--4ē↔2H++O2
Hg0-2ē↔Hg2+
- Е, В
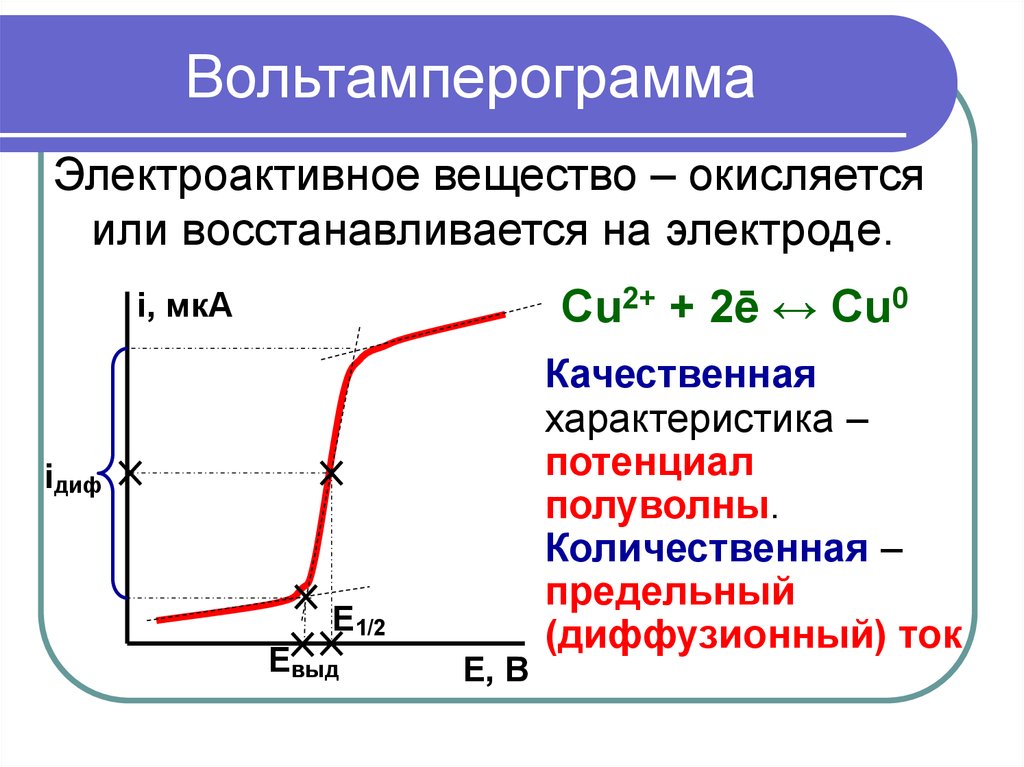
5. Вольтамперограмма
Электроактивное вещество – окисляетсяили восстанавливается на электроде.
Cu2+ + 2ē ↔ Cu0
i, мкА
iдиф
Е1/2
Евыд
E, В
Качественная
характеристика –
потенциал
полуволны.
Количественная –
предельный
(диффузионный) ток
6. Вольтамперограмма
Остаточный ток:- емкостный ток (формирование ДЭС у
поверхности электрода)
- восстановление электроактивных
примесей
После Е выделения – деполяризация
электрода, вещество – деполяризатор
Предельный ток – зависит от
диффузии частиц деполяризатора из
глубины раствора (диффузионный ток)
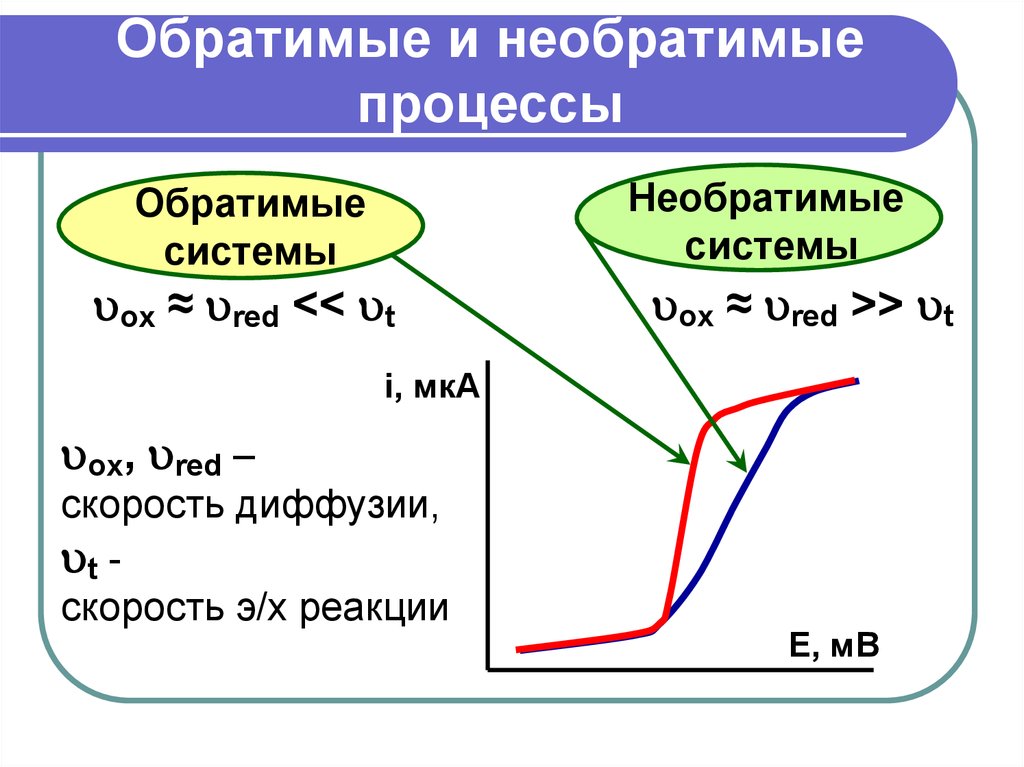
7. Обратимые и необратимые процессы
Необратимыесистемы
Обратимые
системы
ox ≈ red << t
ox ≈ red >> t
i, мкА
ox, red –
скорость диффузии,
t скорость э/х реакции
Е, мВ
8. Уравнение волны
E = E1/2Критерий
обратимости:
tgα = 0.059/n
i
- —— lg ——
n
iдиф-i
0.059
lgi/(iдиф-i)
E1/2
α
Δlg
-E
tgα = ΔE/Δlg
ΔE
9. Классическая полярография
Полярография – использование ртутно-капающего электрода (РКЭ). Скорость
развертки потенциала – мВ/c.
Проблемы: чем выше фоновый ток, тем
ниже чувствительность определения.
_
резервуар со ртутью
РКЭ
ртутная капля
раствор
+
слой ртути
i, мкА
Е
t
Е, мВ
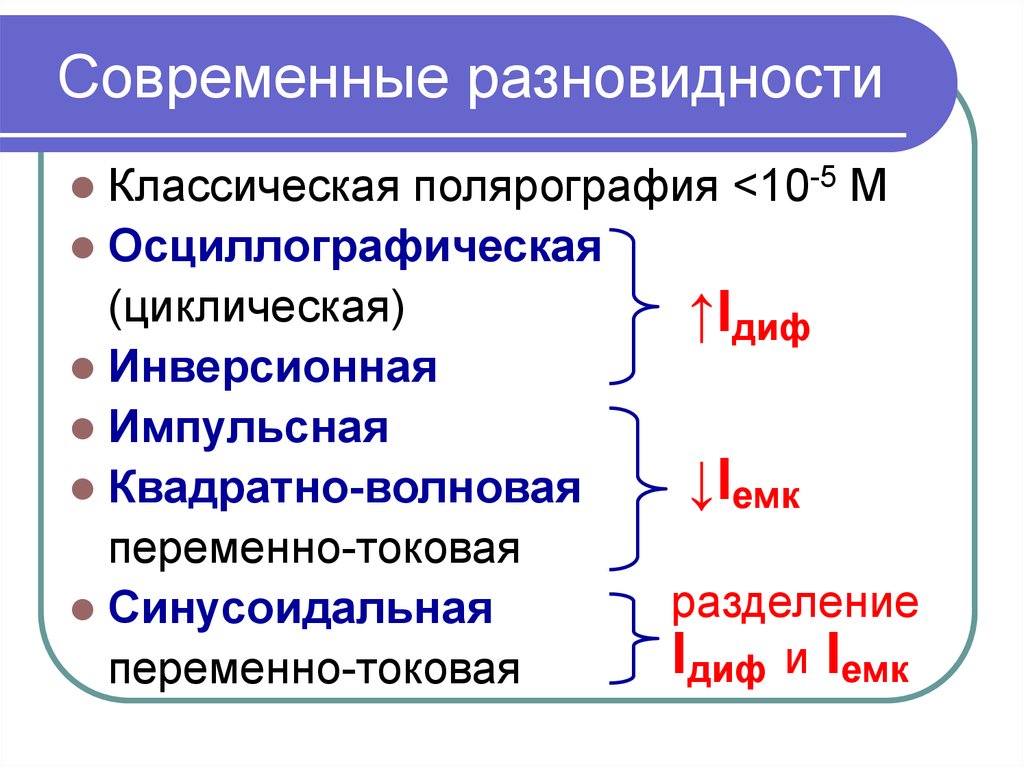
10. Современные разновидности
Классическая полярография <10-5 МОсциллографическая
(циклическая)
↑Iдиф
Инверсионная
Импульсная
↓Iемк
Квадратно-волновая
переменно-токовая
разделение
Синусоидальная
Iдиф и Iемк
переменно-токовая
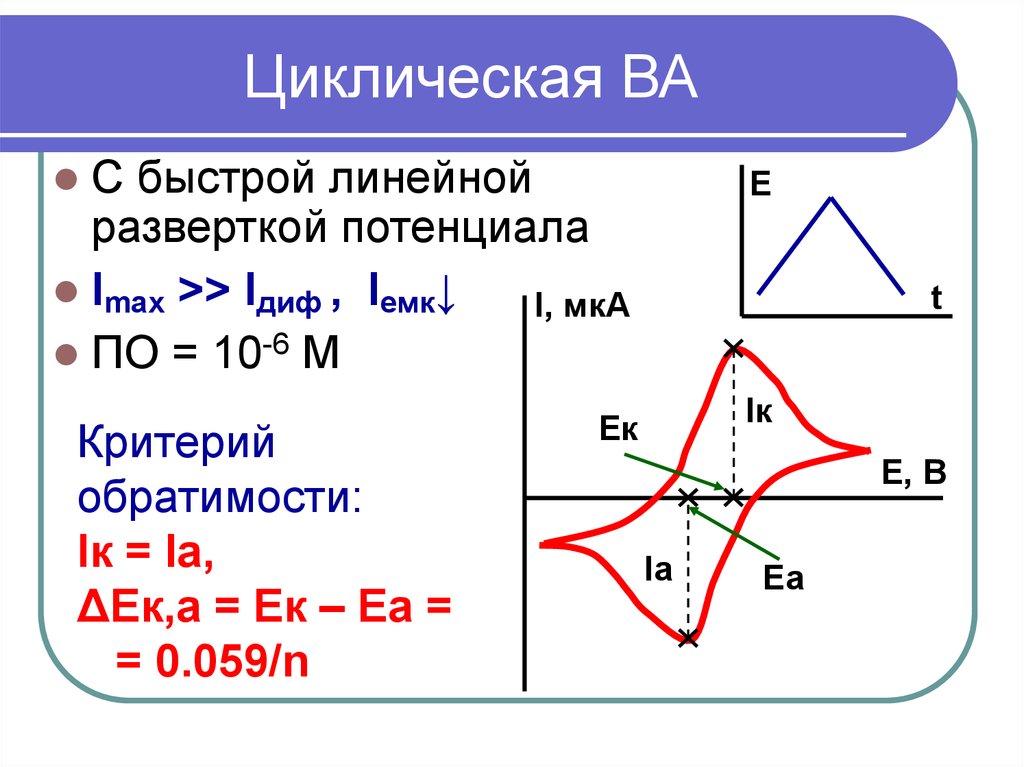
11. Циклическая ВА
С быстрой линейнойразверткой потенциала
Imax >> Iдиф , Iемк↓
I, мкА
ПО = 10-6 М
Е
Ек
Iк
Критерий
обратимости:
Iк = Iа,
ΔЕк,а = Ек – Еа =
= 0.059/n
t
Е, В
Iа
Еа
12. Импульсная ВА
Нормально-импульсная вольтамперометрияПО = 5×10-7 М
i, мкА
Е
Енач
t
Е, мВ
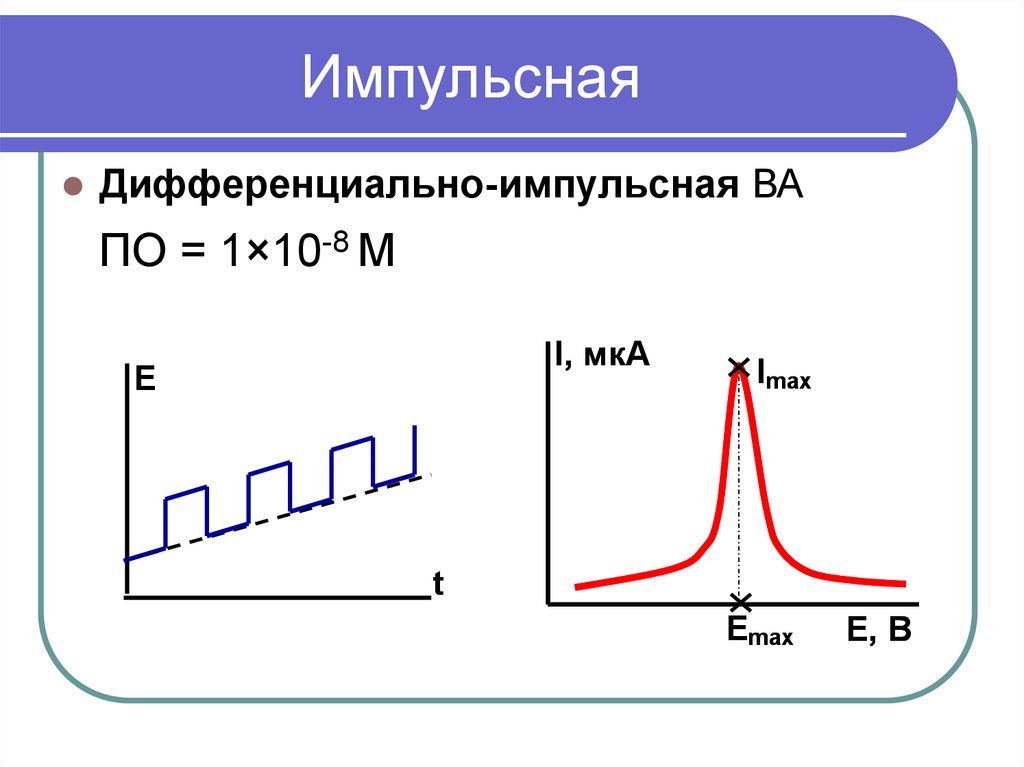
13. Импульсная
Дифференциально-импульсная ВАПО = 1×10-8 М
I, мкА
Е
Imax
t
Еmax
E, В
14. Переменно-токовая ВА
СинусоидальнаяI, мкА
Imax
Еmax
ПО = 5×10-7 М
E, В
Квадратно-волновая ПО = 5×10-8 М
15. Синусоидальная переменно-токовая ВА
Еmax = Е1/2I~
σ - полуширина пика (ширина
на половине высоты)
Imax
Критерий
обратимости:
σ
Imax/2
σ = 90/n
Еmax
E,В
16. Инверсионная ВА (ИВА)
ПО = 1×10-10 МПредварительное концентрирование на ИЭ
Концентрирование – при потенциале Iпред
Если процесс накопления вещества на
электроде – восстановление, то развертка
потенциала (растворение вещества с электрода)
– окисление → анодная ИВА
Накопление – окисление, развертка –
восстановление → катодная ИВА
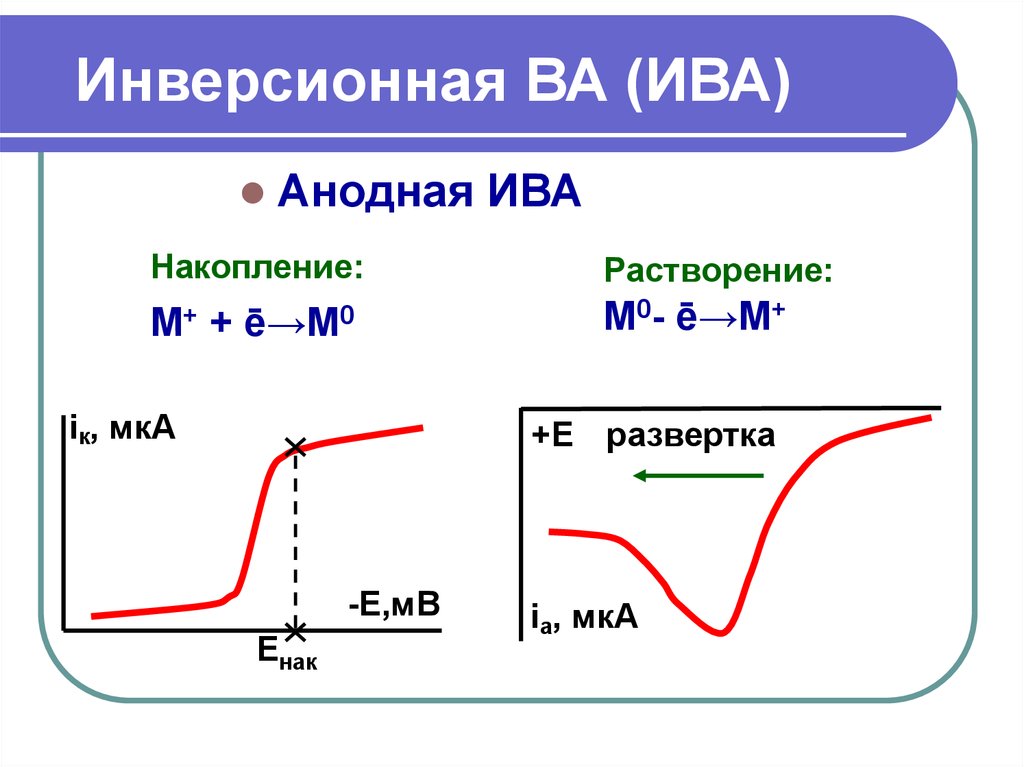
17. Инверсионная ВА (ИВА)
Анодная ИВАНакопление:
Растворение:
М+ + ē→М0
М0- ē→М+
iк, мкА
+Е развертка
-Е,мВ
Енак
iа, мкА
18. Амперометрическое титрование
За процессом титрования следят поизменению предельного тока, который
зависит от концентрации Х, R или Р:
X + R → P, где
Х – определяемое вещество
R - титрант
Р - продукт
19. Амперометрическое титрование
Вид кривых титрования, еслиэлектроактивен
1)
Х
i,мкА
VR, мл
i,мкА
2) R
VR, мл
i,мкА
3) Ркя
VR, мл
4) Х и R, Х > R
5) R и Р, R > Р
6) Х и Р, Х > Р
7) Х и R, Х < R
8) R и Р, R < Р
9) Х и Р, Х < Р
20. Кондуктометрия и кулонометрия
Кондуктометрия - измерениеэлектропроводности раствора
Кулонометрия - измерение количества
электричества, затраченного на
электрохимическое окисление или
восстановление вещества.
Закон Фарадея: m = AQ/Fn, где Q=It
21. Варианты прямой кулонометрии
Потенциостатическая (Е=const)Электролиз при постоянном потенциале. Сила
тока в процессе электролиза уменьшается.
Гальваностатическая (I=const).
Хронометрический метод Q=It, потому что
фиксируется время электролиза. Потенциал
электрода растет в процессе электролиза.
Более чувствительный метод.













 physics
physics








