Similar presentations:
Основные понятия и законы химии
1.
МИНИСТЕРСТВО СЕЛЬСКОГО ХОЗЯЙСТВА РОССИЙСКОЙ ФЕДЕРАЦИИфедеральное государственное бюджетное учреждение высшего образования
«Санкт-Петербургский государственный аграрный университет»
___________________________________________________________________
Царскосельский аграрно-технологический колледж
Тема: «Основные понятия и
законы химии.»
АВТОР: к.х.н. ЧУМАЧЕНКО Е.В.
2.
ЦЕЛЬ ЗАНЯТИЯ:сформировать понятие о веществе,
атоме, элементе, молекуле;
рассмотреть качественный и
количественный состав молекулы;
расширить представление
обучающихся о многообразии
веществ
3.
1)2)
3)
4)
УЧЕБНЫЕ ВОПРОСЫ:
Вещества, атом, молекула, химический
элемент, аллотропные модификации.
Состав вещества. Качественный и
количественный состав химических
веществ.
Химическая формула. Индекс.
Молекулярная формула. Графическая
формула.
Валентность.
4.
Химия — наука о веществах, закономерностях ихпревращений (физических и химических свойствах)
и применении.
Вещество – это то, из чего состоит физическое
тело.
Физическое тело – это предмет, который состоит
из вещества и имеет определённый объём,
определённую массу и форму.
Каждому веществу присущи свои свойства.
5.
СВОЙСТВА ВЕЩЕСТВАВода – жидкое вещество, без запаха,
вкуса, цвета, .
Сахар – твердое вещество белого
цвета, хорошо растворяется в воде,
сладкое на вкус.
Углекислый газ – газообразное
вещество, без цвета.
6.
СВОЙСТВА ВЕЩЕСТВК свойствам веществ относятся: агрегатное
состояние(жидкое, твердое, газообразное), в котором
находится вещество при данных условиях, цвет, блеск,
запах, вкус, растворимость и многие другие.
Свойства веществ – признаки, по которым вещества
отличаются друг от друга.
Все вещества под действием внешних условий
изменяются: вода превращается в пар или лед, медь
теряет свой блеск во влажном воздухе.
Явления – все изменения, которые происходят в
окружающем нас мире.
Явления, при которых не происходит
образование новых веществ, называют
физическими
7.
химические явленияЯвления,
при
которых
происходит
образование новых веществ, называют
химическими явлениями или химическими
реакциями.
(CuOH)2CO3=2CuO
+
CO2
+
H2O(нагреваем)
Малахит
S +O2 = SO2 (нагреваем)
Сера – жёлтое кристаллическое вещество.
Сернистый газ – бесцветный газ
неприятным запахом.
с
8.
Съезд химиков в Карлсруэ с 3 по 5 сентября 1860 года9.
От русских ученых-химиковприняли участие в работе
Первого международного химического конгресса: Зинин Н.Н.,
Бородин А.П., Менделеев Д.И.
На нём был наведён относительный порядок в химической
номенклатуре, чётко определены фундаментальные понятия,
такие как атом, молекула и атомные веса. Утверждены
основные положения атомно-молекулярного учения.
10.
Молекула – это наименьшая электронейтральная частица вещества,обладающая определенной массой и всеми химическими свойствами
этого вещества.
Атом – это наименьшая химически неделимая частица вещества.
Атом – это электронейтральная частица, состоящая из положительно
заряженного ядра и отрицательно заряженных электронов.
Ядро атома состоит из элементарных частиц – протонов p+
(положительно заряженных частиц) и нейтронов n0 (незаряженных –
нейтральных частиц). Положительный заряд ядра атома равен числу
протонов. Число протонов равно числу электронов в атоме.
Химический элемент – это совокупность атомов с одинаковым
зарядом ядра.
11.
АМОМНО-МОЛЕКУЛЯРНОЕ УЧЕНИЕОСНОВНЫЕ ПОЛОЖЕНИЯ
1. Все вещества состоят из молекул, атомов или ионов.
Молекула является наименьшей частицей вещества,
которая сохраняет все свойства данного вещества.
2. Молекулы находятся в постоянном движении. С
повышением ТоС скорость увеличивается.
3. Молекулы разных веществ отличаются друг от друга
массой, размером, составом, строением и химическими
свойствами.
4. Молекулы могут состоять из атомов одного
химического элемента (простые в-ва) либо атомов
разных химических элементов(сложные в-ва).
12.
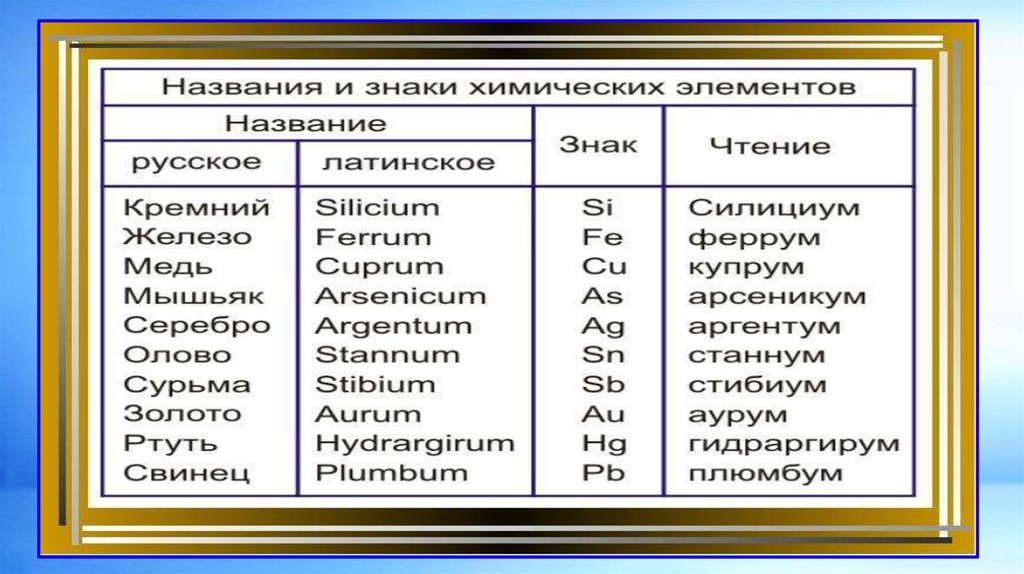
ХИМИЧЕСКИЙ ЭЛЕМЕНТ – ЭТО СОВОКУПНОСТЬ АТОМОВ СОДИНАКОВЫМ ЗАРЯДОМ ЯДРА.
13.
14.
Заряд комплексного иона легко подсчитать, зная степень окисления составляющих его частей.ФОРМЫ СУЩЕСТВОВАНИЯ
ХИМИЧЕСКОГО ЭЛЕМЕНТА
1.Свободные атомы. Атомарный Н
водород – главная составляющая
звезд и звездного пространства.
2. Простые вещества. Например, молекулярный водород
H2 – газообразное вещество без цвета, без запаха; самый
лёгкий из всех газов; мало растворим в воде; активно
вступает в химические реакции.
3. В составе сложных веществ. Например: химический
элемент Н входит в состав сложных веществ H2O, CH4
NH3
15.
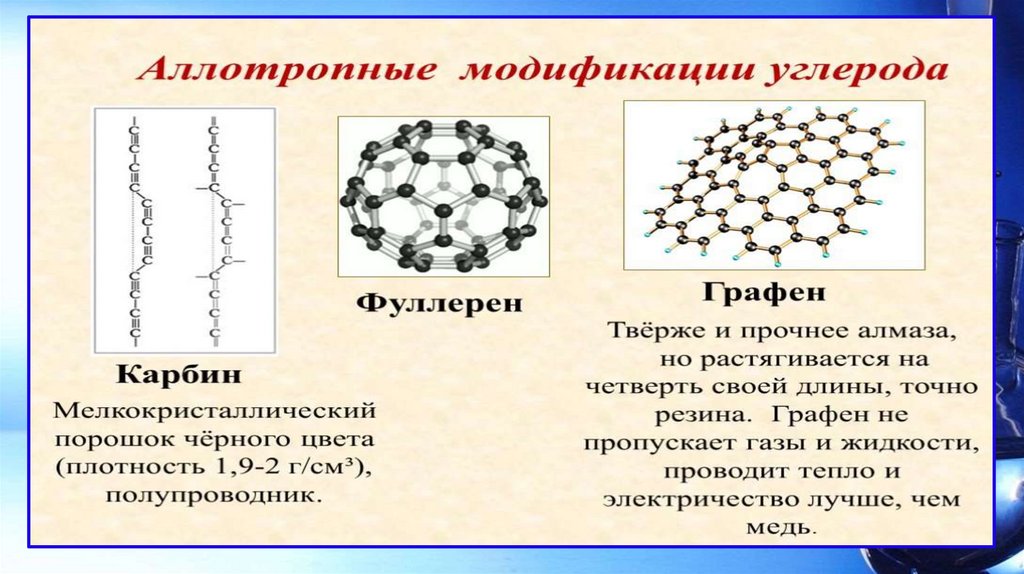
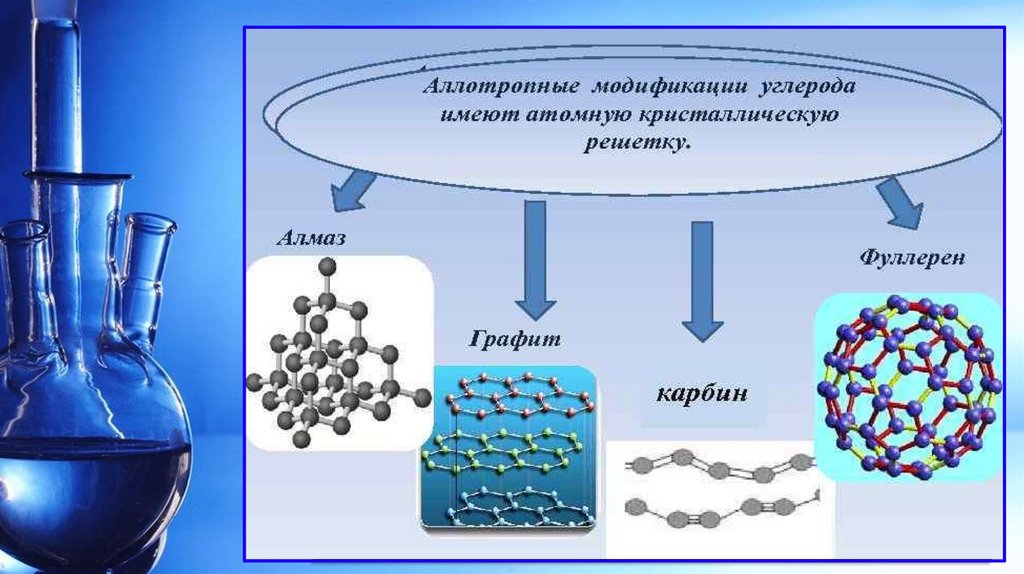
АЛЛОТРОПИЯДля простых веществ характерно явление аллотропии.
Явление аллотропии наглядно доказывает зависимость
физических и химических свойств от их состава и строения.
Аллотропия – это способность атомов одного химического
элемента образовывать простые вещества разного состава
или разного строения.
Аллотропные модификации (видоизменения) – это
простые вещества, образованные одним и тем же
химическим элементом, но имеющие разный состав или
разное строение, а значит, и разные физические и
химические свойства
16.
АЛЛОТРОПНЫЕ МОДИФИКАЦИИ КИСЛОРОДА, УГЛЕРОДА И ОЛОВАКислород О2 — газ без цвета, вкуса и запаха, немного тяжелее воздуха. Плохо
растворим в воде, активный окислитель.
Применяется в химической
промышленности, металлургии, при сварке и резки тугоплавких металлов, в
медицине (кислородная подушка). Жидкий кислород – голубоватая жидкость,
кипящая при -183оС, служит окислителем ракетного топлива.
Озон О3 — при нормальных условиях газ голубого цвета со специфическим
запахом, молекула которого состоит из трёх атомов кислорода. В 1,5 раза тяжелее
воздуха; в воде растворим в 10 раз лучше, чем кислород; гораздо более сильный
окислитель, чем кислород. Очень ядовит! Как сильный и экологически чистый
окислитель применяется для обеззараживания питьевой воды, воздуха (озон
быстро разрушается с образованием безопасного кислорода)
17.
18.
19.
20.
21.
ГрафенДвумерный материал – свободный
слой графита толщиной в один атом,
обладающий уникально высокой
электрической проводимостью,
значительной механической
прочностью и теплопроводностью.
Получен в 2004 г. Группой ученых из
Манчестера под руководством Гейма и
Новоселова, которые в 2010 году стали
лауреатами Нобелевской премии по
физике за новаторские эксперименты
по исследованию двумерного
материала графена.
22.
СОСТАВ ВЕЩЕСТВАРазличают качественный и количественный состав
химических веществ.
Качественный состав вещества показывает, из атомов
каких элементов оно состоит.
Число атомов каждого элемента в составе мельчайшей
частицы вещества характеризует его количественный
состав.
23.
Химическая формула24.
На практике чаще всего используют химическиеформулы двух видов
25.
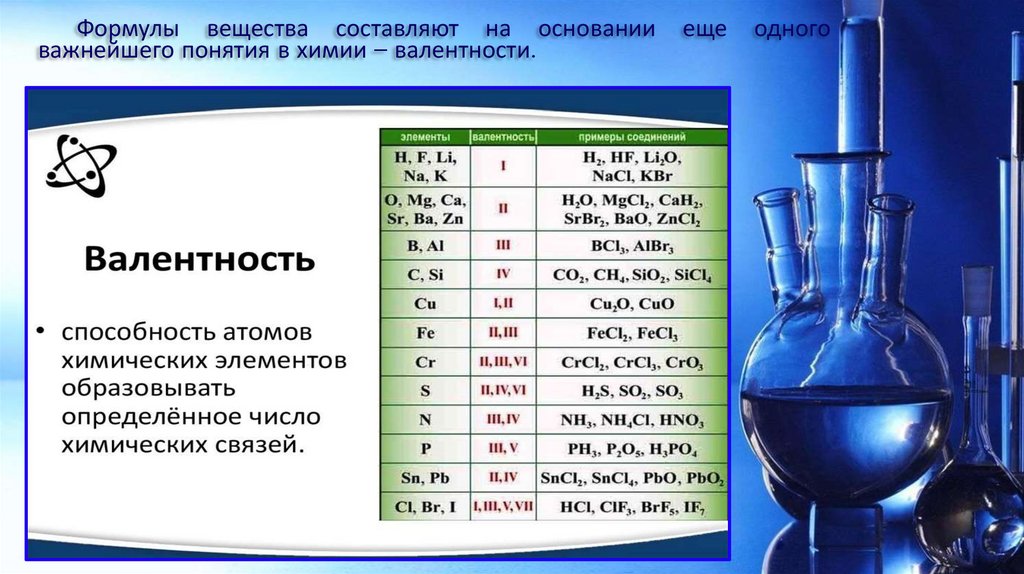
Формулы вещества составляют на основанииважнейшего понятия в химии – валентности.
еще
одного
26.
27.
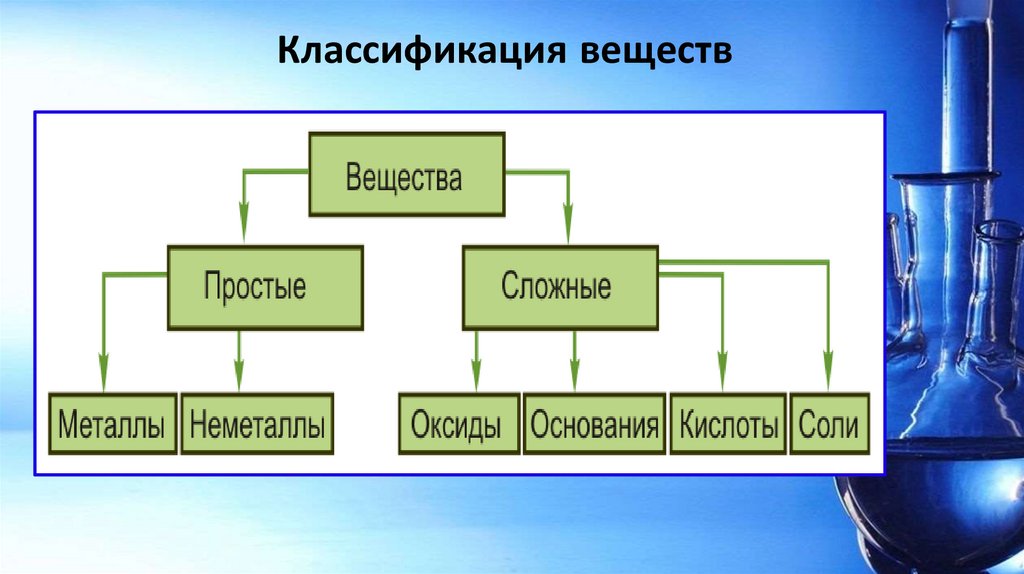
Классификация веществ28.
СПАСИБО ЗАВНИМАНИЕ























 chemistry
chemistry








