Similar presentations:
Удосконалення надання фармацевтичної допомоги пацієнтам з рідкісними генетичними захворюваннями. Мета і завдання дослідження
1.
МІНІСТЕРСТВО ОХОРОНИ ЗДОРОВ’Я УКРАЇНИНАЦІОНАЛЬНИЙ ФАРМАЦЕВТИЧНИЙ УНІВЕРСИТЕТ
Кафедра соціальної фармації
Удосконалення надання фармацевтичної
допомоги пацієнтам з рідкісними генетичними
захворюваннями
Виконала: здобувач групи 226Фм19(5,5з)-01б
спеціальності: 226 Фармація, промислова фармація
Вікторія ЛОМОВА
Керівник:д.фарм.н., проф. Вікторія НАЗАРКІНА
Рецензент: д.фарм.н., проф. Ірина ПЕСТУН
Харків 2024
2.
Мета і завдання дослідженняМетою роботи є дослідити сучасний стан і визначити основні напрями
удосконалення надання фармацевтичної допомоги пацієнтам з
рідкісними генетичними захворюваннями
Завдання:
аналіз сучасних підходів до організації діагностики та лікування РЗ;
дослідження шляхів забезпечення доступу і доступності орфанних ЛЗ у різних країнах світу;
аналіз можливостей використання технологій ШІ у діагностиці й лікуванні РЗ;
аналіз стану та проблем надання фармацевтичної допомоги пацієнтам, що страждають на
рідкісні генетичні розлади (на прикладі спінальної мязової атрофії (СМА));
аналіз медичних технологій лікування СМА, доступних у світі ц на європейському ринку;
дослідження основних проблем фарм. забезпечення пацієнтів зі СМА в Україні;
аналіз госпітальних закупівель ЛЗ для лікування СМА;
визначення напрямів удосконалення допомоги пацієнтам зі СМА та іншими РЗ в Україні
Обʾєкт
Предмет
Методи :
• наукові публікації, ресурси Orphanet,
статистичні дані нормативні
документи тощо
• організаційно-економічні аспекти
забезпечення доступності
фармацевтичної допомоги
пацієнтам, що страждають на Р(О)З
• аналіз, синтез, історичний, логічний,
графічний, математико-статистичний
методи, системний підхід
2
3.
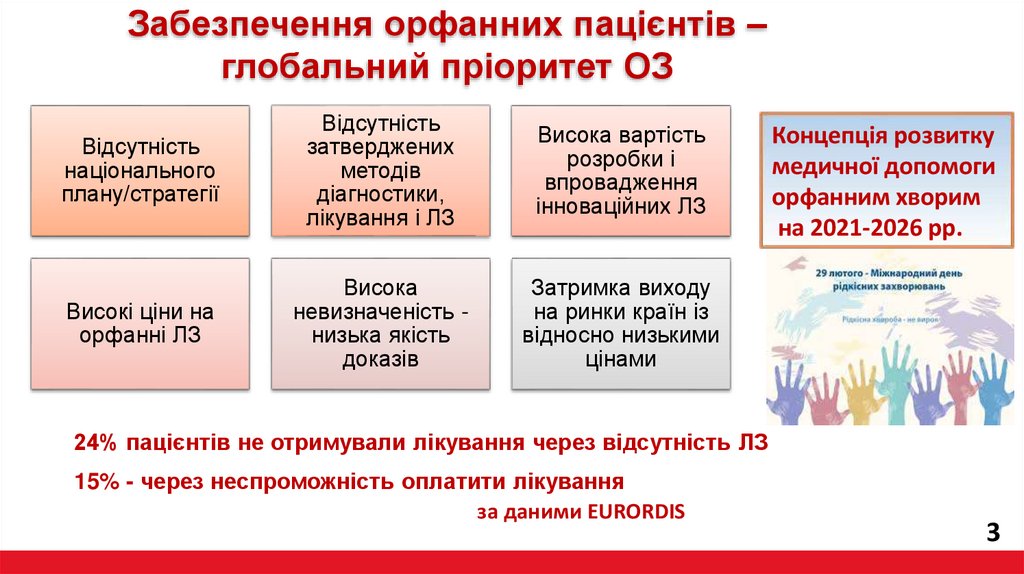
Забезпечення орфанних пацієнтів –глобальний пріоритет ОЗ
Відсутність
національного
плану/стратегії
Відсутність
затверджених
методів
діагностики,
лікування і ЛЗ
Висока вартість
розробки і
впровадження
інноваційних ЛЗ
Високі ціни на
орфанні ЛЗ
Висока
невизначеність низька якість
доказів
Затримка виходу
на ринки країн із
відносно низькими
цінами
24% пацієнтів не отримували лікування через відсутність ЛЗ
15% - через неспроможність оплатити лікування
за даними EURORDIS
Концепція розвитку
медичної допомоги
орфанним хворим
на 2021-2026 рр.
3
4.
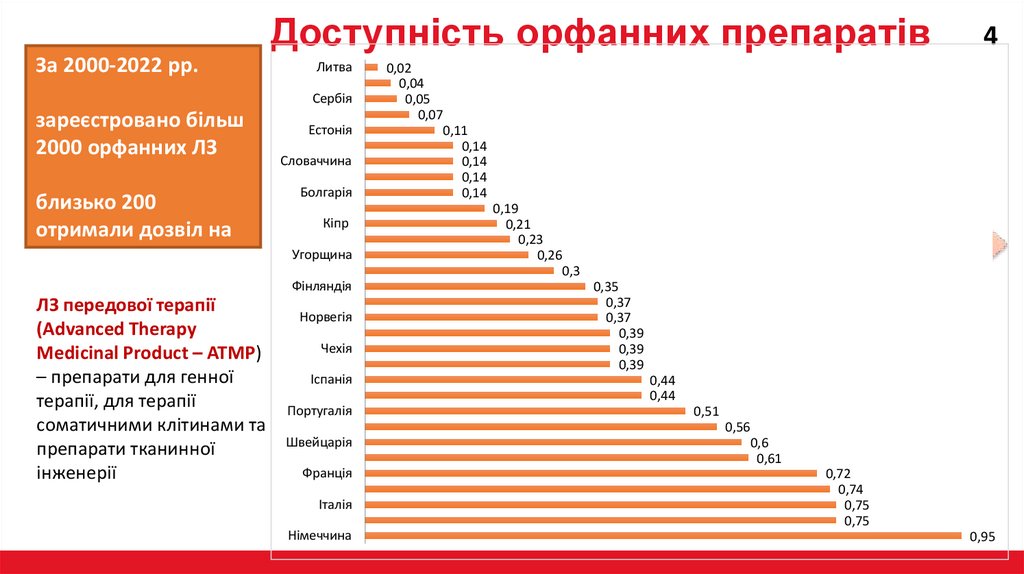
Доступність орфанних препаратівЗа 2000-2022 рр.
Литва
Сербія
зареєстровано більш
2000 орфанних ЛЗ
близько 200
отримали дозвіл на
продаж
Естонія
Словаччина
Болгарія
Кіпр
Угорщина
Фінляндія
ЛЗ передової терапії
(Advanced Therapy
Medicinal Product – ATMP)
– препарати для генної
терапії, для терапії
соматичними клітинами та
препарати тканинної
інженерії
Норвегія
Чехія
Іспанія
Португалія
Швейцарія
Франція
Італія
Німеччина
0,02
0,04
0,05
0,07
0,11
0,14
0,14
0,14
0,14
0,19
0,21
0,23
0,26
0,3
0,35
0,37
0,37
0,39
0,39
0,39
4
доступ інноваці
ї
0,44
0,44
0,51
0,56
0,6
0,61
0,72
0,74
0,75
0,75
0,95
5.
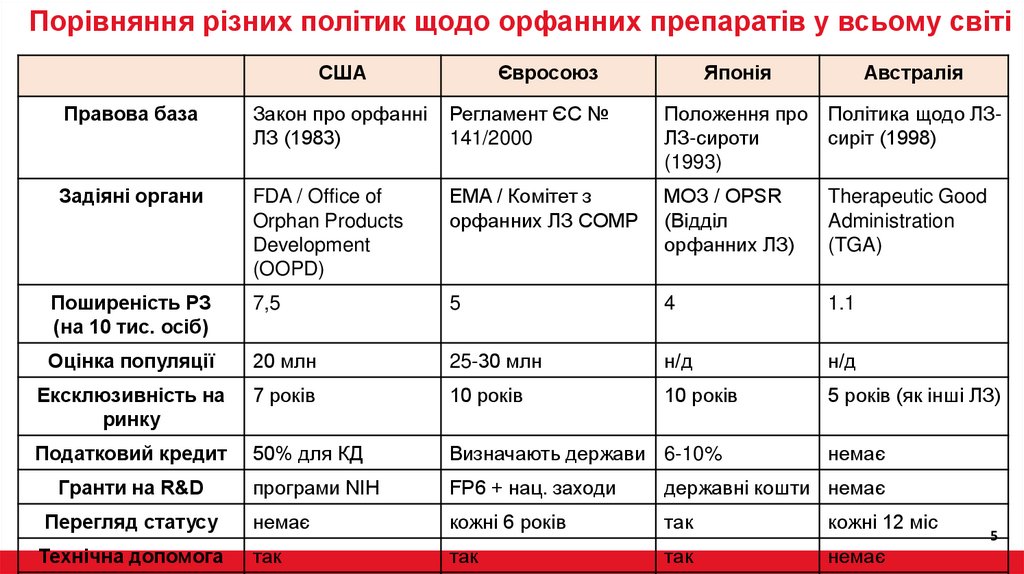
Порівняння різних політик щодо орфанних препаратів у всьому світіСША
Євросоюз
Японія
Австралія
Правова база
Закон про орфанні
ЛЗ (1983)
Регламент ЄС №
141/2000
Положення про Політика щодо ЛЗЛЗ-сироти
сиріт (1998)
(1993)
Задіяні органи
FDA / Office of
Orphan Products
Development
(OOPD)
EMA / Комітет з
орфанних ЛЗ COMP
МОЗ / OPSR
(Відділ
орфанних ЛЗ)
Therapeutic Good
Administration
(TGA)
Поширеність РЗ
(на 10 тис. осіб)
7,5
5
4
1.1
Оцінка популяції
20 млн
25-30 млн
н/д
н/д
Ексклюзивність на
ринку
7 років
10 років
10 років
5 років (як інші ЛЗ)
Податковий кредит
50% для КД
Визначають держави 6-10%
Гранти на R&D
програми NIH
FP6 + нац. заходи
державні кошти немає
Перегляд статусу
немає
кожні 6 років
так
кожні 12 міс
Технічна допомога
так
так
так
немає
немає
5
6.
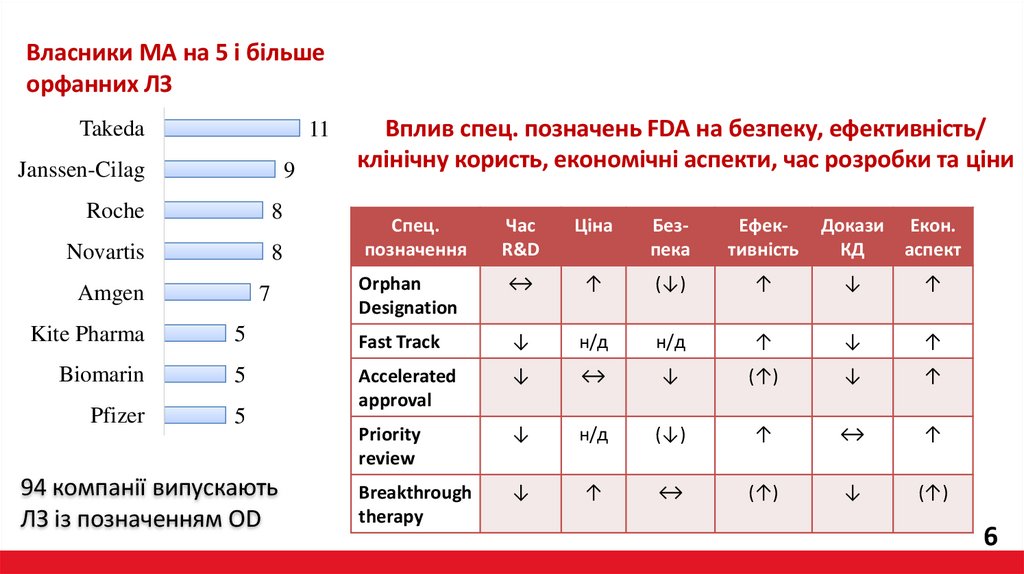
Власники МА на 5 і більшеорфанних ЛЗ
Takeda
11
Janssen-Cilag
9
Roche
8
Novartis
8
Amgen
7
Вплив спец. позначень FDA на безпеку, ефективність/
клінічну користь, економічні аспекти, час розробки та ціни
Спец.
позначення
Час
R&D
Ціна
Безпека
Ефективність
Докази Екон.
КД
аспект
Orphan
Designation
↔
↑
(↓)
↑
↓
↑
Kite Pharma
5
Fast Track
↓
н/д
н/д
↑
↓
↑
Biomarin
5
↓
↔
↓
(↑)
↓
↑
Pfizer
5
Accelerated
approval
Priority
review
↓
н/д
(↓)
↑
↔
↑
Breakthrough
therapy
↓
↑
↔
(↑)
↓
(↑)
94 компанії випускають
ЛЗ із позначенням OD
6
7.
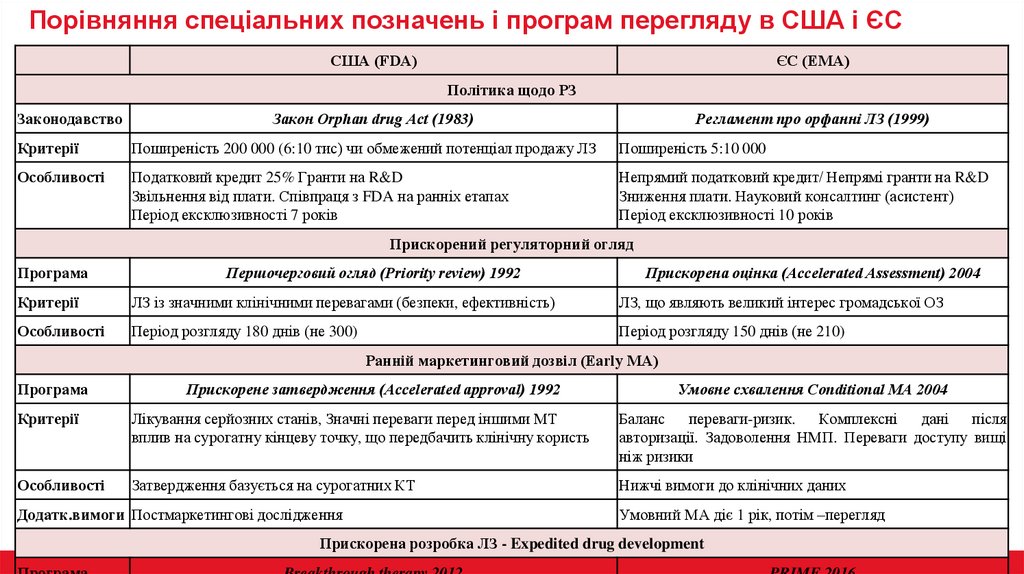
Порівняння спеціальних позначень і програм перегляду в США і ЄССША (FDA)
ЄС (EMA)
Політика щодо РЗ
Законодавство
Закон Orphan drug Act (1983)
Регламент про орфанні ЛЗ (1999)
Критерії
Поширеність 200 000 (6:10 тис) чи обмежений потенціал продажу ЛЗ
Поширеність 5:10 000
Особливості
Податковий кредит 25% Гранти на R&D
Звільнення від плати. Співпраця з FDA на ранніх етапах
Період ексклюзивності 7 років
Непрямий податковий кредит/ Непрямі гранти на R&D
Зниження плати. Науковий консалтинг (асистент)
Період ексклюзивності 10 років
Прискорений регуляторний огляд
Програма
Першочерговий огляд (Priority review) 1992
Прискорена оцінка (Accelerated Assessment) 2004
Критерії
ЛЗ із значними клінічними перевагами (безпеки, ефективність)
ЛЗ, що являють великий інтерес громадської ОЗ
Особливості
Період розгляду 180 днів (не 300)
Період розгляду 150 днів (не 210)
Ранній маркетинговий дозвіл (Early MA)
Програма
Прискорене затвердження (Accelerated approval) 1992
Умовне схвалення Conditional MA 2004
Критерії
Лікування серйозних станів, Значні переваги перед іншими МТ
вплив на сурогатну кінцеву точку, що передбачить клінічну користь
Баланс переваги-ризик. Комплексні дані після
авторизації. Задоволення НМП. Переваги доступу вищі
ніж ризики
Особливості
Затвердження базується на сурогатних КТ
Нижчі вимоги до клінічних даних
Додатк.вимоги Постмаркетингові дослідження
Умовний МА діє 1 рік, потім –перегляд
Прискорена розробка ЛЗ - Expedited drug development
7
8.
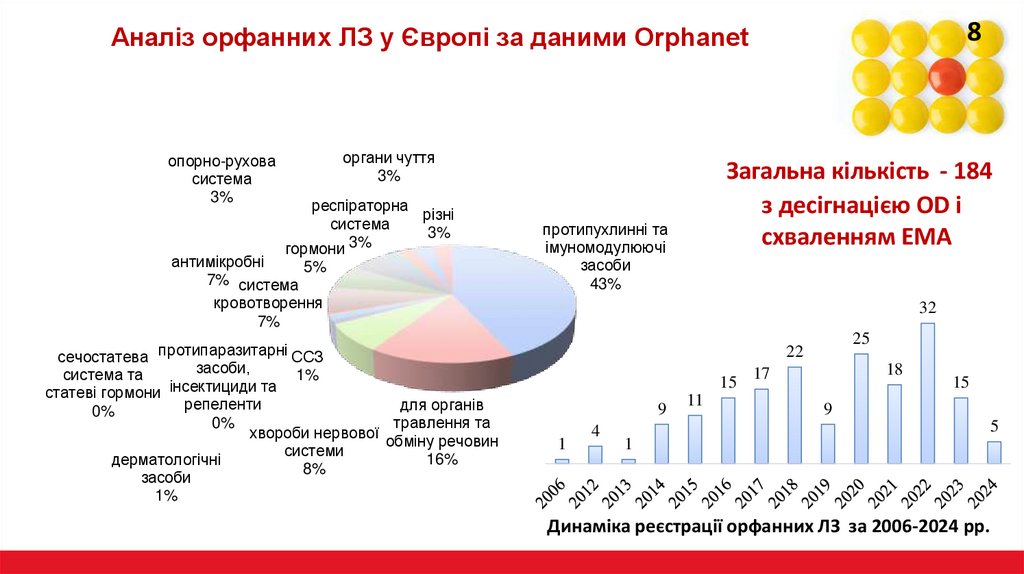
8Аналіз орфанних ЛЗ у Європі за даними Orphanet
опорно-рухова
система
3%
органи чуття
3%
респіраторна
різні
система
3%
гормони 3%
антимікробні
5%
7% система
кровотворення
7%
сечостатева протипаразитарні ССЗ
засоби,
система та
1%
інсектициди
та
статеві гормони
репеленти
для органів
0%
0%
травлення та
хвороби нервової
обміну речовин
системи
16%
дерматологічні
8%
засоби
1%
Загальна кількість - 184
з десігнацією OD і
схваленням EMA
протипухлинні та
імуномодулюючі
засоби
43%
32
25
22
15
9
1
4
11
18
17
15
9
5
1
Динаміка реєстрації орфанних ЛЗ за 2006-2024 рр.
9.
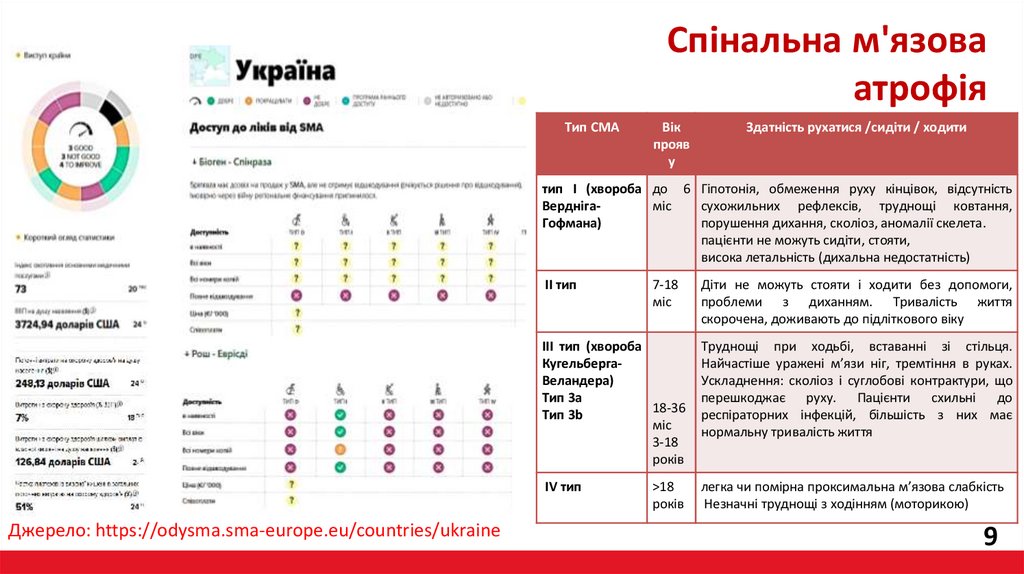
Спінальна м'язоваатрофія
Тип СМА
Вік
прояв
у
Здатність рухатися /сидіти / ходити
тип I (хвороба до 6 Гіпотонія, обмеження руху кінцівок, відсутність
Верднігасухожильних рефлексів, труднощі ковтання,
міс
Гофмана)
порушення дихання, сколіоз, аномалії скелета.
пацієнти не можуть сидіти, стояти,
висока летальність (дихальна недостатність)
7-18
міс
Діти не можуть стояти і ходити без допомоги,
проблеми з диханням. Тривалість життя
скорочена, доживають до підліткового віку
III тип (хвороба
КугельбергаВеландера)
Тип 3a
18-36
Тип 3b
міс
3-18
років
Труднощі при ходьбі, вставанні зі стільця.
Найчастіше уражені м’язи ніг, тремтіння в руках.
Ускладнення: сколіоз і суглобові контрактури, що
перешкоджає руху. Пацієнти схильні до
респіраторних інфекцій, більшість з них має
нормальну тривалість життя
>18
років
легка чи помірна проксимальна м’язова слабкість
Незначні труднощі з ходінням (моторикою)
II тип
IV тип
Джерело: https://odysma.sma-europe.eu/countries/ukraine
9
10.
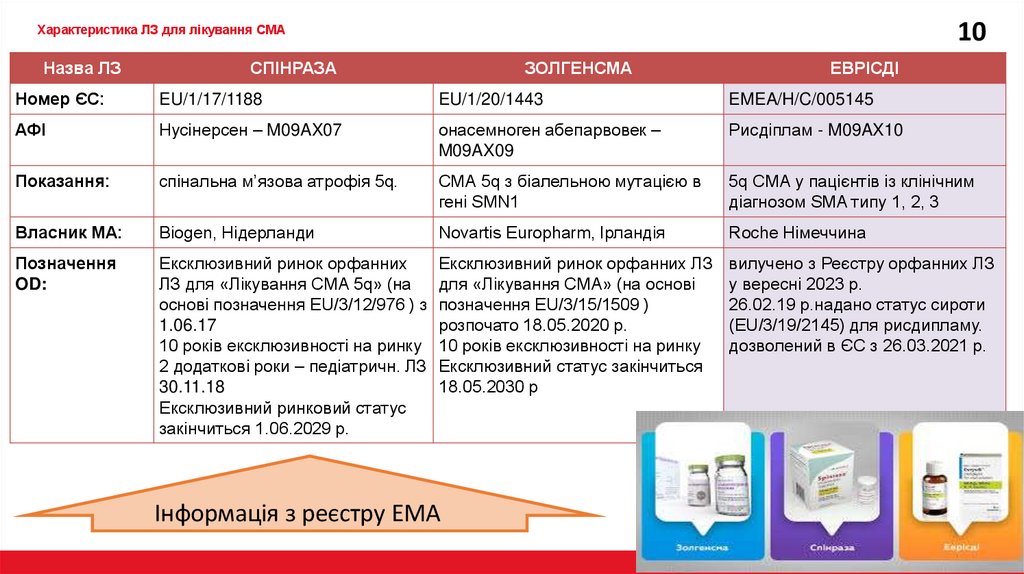
10Характеристика ЛЗ для лікування СМА
Назва ЛЗ
СПІНРАЗА
ЗОЛГЕНСМА
ЕВРІСДІ
Номер ЄС:
EU/1/17/1188
EU/1/20/1443
EMEA/H/C/005145
АФІ
Нусінерсен – M09AX07
онасемноген aбeпарвовек –
M09AX09
Рисдіплам - M09AX10
Показання:
спінальна м’язова атрофія 5q.
СМА 5q з біалельною мутацією в
гені SMN1
5q СМА у пацієнтів із клінічним
діагнозом SMA типу 1, 2, 3
Власник МА:
Biogen, Нідерланди
Novartis Europharm, Ірландія
Roche Німеччина
Позначення
OD:
Ексклюзивний ринок орфанних
Ексклюзивний ринок орфанних ЛЗ
ЛЗ для «Лікування СМА 5q» (на
для «Лікування СМА» (на основі
основі позначення EU/3/12/976 ) з позначення EU/3/15/1509 )
1.06.17
розпочато 18.05.2020 р.
10 років ексклюзивності на ринку 10 років ексклюзивності на ринку
2 додаткові роки – педіатричн. ЛЗ Ексклюзивний статус закінчиться
30.11.18
18.05.2030 р
Ексклюзивний ринковий статус
закінчиться 1.06.2029 р.
Інформація з реєстру ЕМА
вилучено з Реєстру орфанних ЛЗ
у вересні 2023 р.
26.02.19 р.надано статус сироти
(EU/3/19/2145) для рисдипламу.
дозволений в ЄС з 26.03.2021 р.
11.
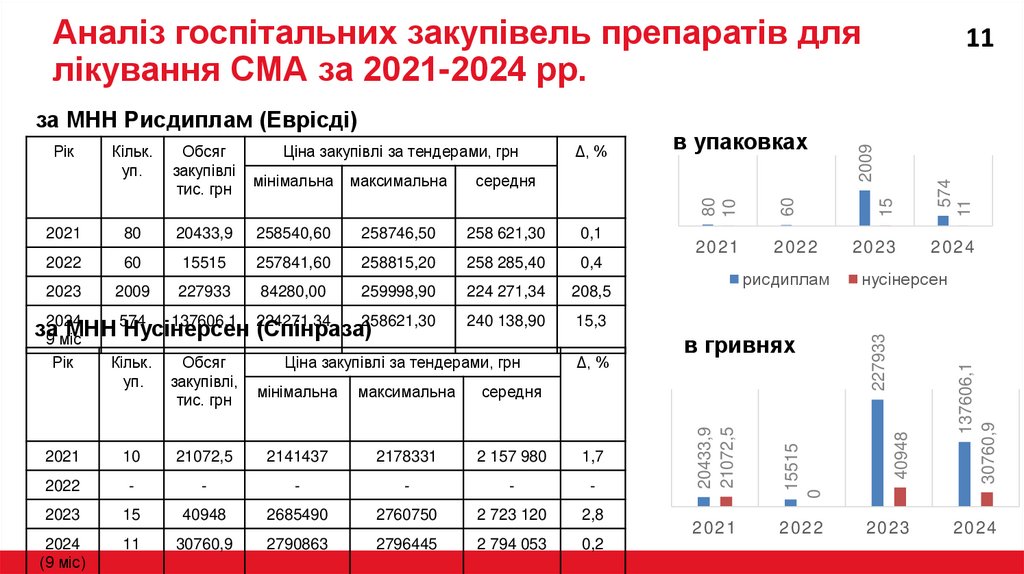
Аналіз госпітальних закупівель препаратів длялікування СМА за 2021-2024 рр.
258540,60
258746,50
258 621,30
0,1
60
15515
257841,60
258815,20
258 285,40
0,4
2009
227933
84280,00
259998,90
224 271,34
208,5
2024
137606,1 224271,34
за
МНН 574
Нусінерсен
(Спінраза)258621,30
9 міс
240 138,90
15,3
Рік
Кільк.
уп.
Обсяг
закупівлі,
тис. грн
2021
10
2022
Ціна закупівлі за тендерами, грн
Δ, %
мінімальна
максимальна
середня
21072,5
2141437
2178331
2 157 980
1,7
-
-
-
-
-
-
2023
15
40948
2685490
2760750
2 723 120
2,8
2024
(9 міс)
11
30760,9
2790863
2796445
2 794 053
0,2
2021
2022
рисдиплам
в гривнях
2021
2022
2023
2024
нусінерсен
137606,1
30760,9
20433,9
574
11
середня
15
2023
максимальна
40948
2022
мінімальна
в упаковках
2009
80
Δ, %
227933
2021
Ціна закупівлі за тендерами, грн
60
Обсяг
закупівлі
тис. грн
15515
0
Кільк.
уп.
80
10
Рік
20433,9
21072,5
за МНН Рисдиплам (Еврісді)
11
2023
2024
12.
Апробація результатів дослідження12
13.
Висновки1. Проведено аналіз сучасних підходів до організації діагностики та
лікування РЗ. За даними мережі Орфанет, у світі наразі ідентифіковано від
6000 до 8000 рідкісних розладів та станів. Причому у різних країнах
відрізнаються як критерії віднесення захворювання до рідкісного, так і
політика щодо забезпечення пацієнтів необхідними ЛЗ й іншими
медичними технологіями (забезпечення раннього доступу, договори
керованого доступу для збору клінічних даних тощо).
2. Разом з тим, у багатьох країнах, як і в Україні, через недофінансування цієї
сфери, відсутність належної інфраструктури медичних закладів
(референтних центрів) і навченого персоналу спостерігаються проблеми з
доступом і доступністю відповідної медичної та фармацевтичної допомоги.
наразі МТ для лікування РЗ існують лише для 5% випадків. При цьому
спостерігається потужна робота у сфері розробки таких препаратів, що
обумовлено різними чинниками, насамперед, сприятливими умовами та
наданням відповідних преференцій на ринку, грантових програм, знижок і
пільг по оподаткуванню. Результатами такої активної роботи є створення і
затвердження проривних препаратів, як правило, у сфері біотехнології,
генної та клітинної терапії тощо.
3. Проведено аналіз загальної ситуації щодо забезпечення доступності
медичних технологій для лікування РЗ, зокрема, у країнах Європи.
Встановлено, що незважаючи на те, що в ЄС працюють єдині механізми
схвалення ЛЗ та надання статусу орфанного препарату, що надає йому
певні привілеї, у різних країнах суттєв відрізняється політика щодо
забезпечення доступу і доступності таких ЛЗ. І це пов’язано насамперед з
рівнем соіально-економічного розвитку країни, особливостей організації
системи ОЗ і медичного страхування, розвитку фармацевтичної
промисловості та її інноваційного потенціалу, інфраструктури галузі та ін.
Значну роль також має політика ОЗ та роль в її формуванні та прийнятті
рішень громадських пацієнтських організацій, що дозволяє впливати на
певні процеси щодо удосконалення ситеми фармацевтичного
забезпечення. Підтверджено, що для сфери РЗ особливо важливим є
використання адекватних методів державного регулювання для
досягнення балансу доступності, ефективності, безпеки й розвитку
інновацій у сфері орфанних захворювань. У цьому контексті проведено
порівняльний аналіз заходів регулювання доступності орфанних
препаратів в ЄС, США та Японії. Досліджені можливості та перспективи
використання технологій штучного інтелекту у діагностиці й лікуванні
РЗ.
4. Проведено аналіз стану та проблем надання фармацевтичної допомоги
пацієнтам, що страждають на рідкісні генетичні розлади на прикладі
СМА, що являє собою тяжке захворювання, що має значний вплив на
якість життя хворого, потребує особливого догляду і піклування і тягне
за собою високі витрати.
5. Проаналізовані наявні на даний момент медичні технології для
лікування СМА, які доступні на світовому та вітчизняному ринку.
Визначені основні проблеми фармацевтичного забезпечення пацієнтів,
що страждають на СМА в Україні та на підставі цього окреслені
пріритетні напрями удосконалення допомоги пацієнтам зі СМА в
Україні. Однією з ключових проблем є дефіцит коштів, але окрім цього
виникає багато організаційних, юридичних та інших питань. Це,
насамперед, відсутність клінічних протоколів, офіційного визнаного
МОЗ реєстру пацієнтів, що унеможливлює правильне формування
потреби, а також критерії включення пацієнтів до відповідних переліків,
що потребують лікування певними препаратами.
13
14.
ДЯКУЮЗА УВАГУ!
Національний фармацевтичний університет
вул. Григорія Сковороди (вул. Пушкінська), 53, м. Харків, 61002
E-maіl: mail@nuph.edu.ua
https://nuph.edu.ua





 medicine
medicine








