Similar presentations:
Квантові постулати Бора. Досліди Резерфорда
1.
2.
ПЛАН1. Будова атома. Досліди резерфорда.
2. Квантові постулати Бора.
3.
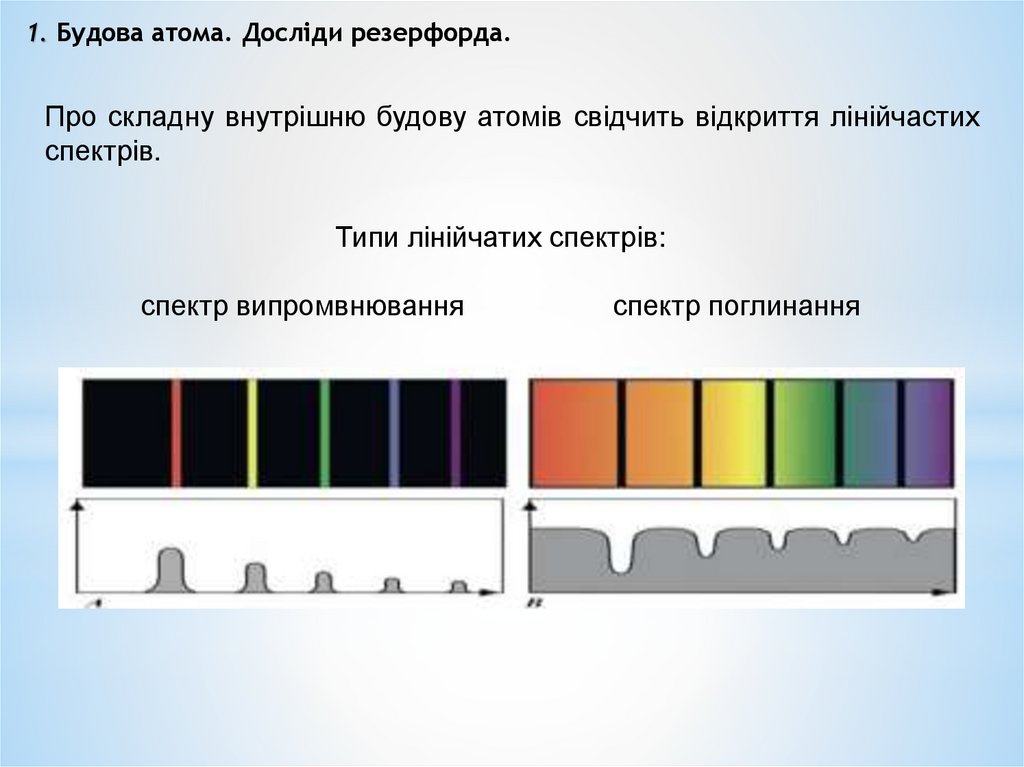
1. Будова атома. Досліди резерфорда.Про складну внутрішню будову атомів свідчить відкриття лінійчастих
спектрів.
Типи лінійчатих спектрів:
спектр випромвнювання
спектр поглинання
4.
Під час нагрівання до високої температури пара будь-якогохімічного елемента випускає світло, вузький пучок якого розкладається
призмою на кілька вузьких пучків світла різного кольору. Сукупність
спостережуваних при цьому різнокольорових ліній називається
лінійчастим спектром випромінювання
Кожна окрема лінія утворюється світлом з однією довжиною хвилі таке джерело випускає електромагнітні хвилі лише з кількома цілком
певними ν1, ν2, … νп
При пропусканні білого світла з суцільним спектром крізь пару
речовини спостерігається виникнення темних ліній на фоні суцільного
спектра випромінювання. Такий спектр називається лінійчастим
спектром поглинання.
5.
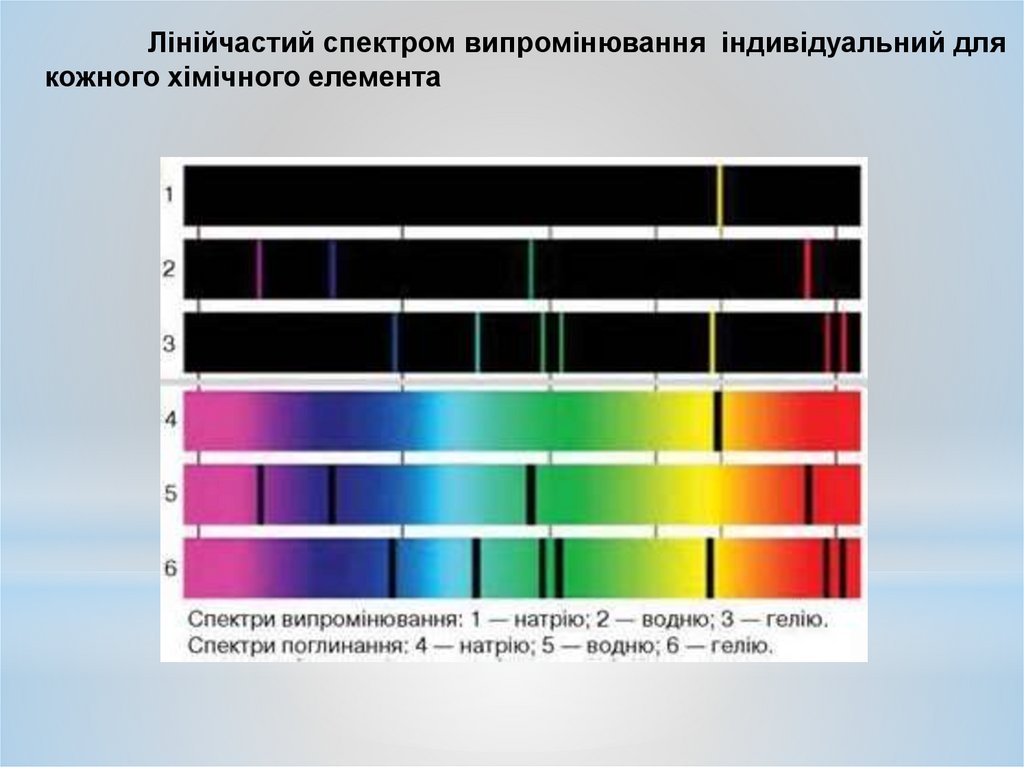
Лінійчастий спектром випромінювання індивідуальний длякожного хімічного елемента
6.
Смугастий спектр — це дискретні групи численних спектральнихліній, що складаються з безлічі тісно розташованих
монохроматичних випромінювань (молекулярні спектри)
Смугастий спектр видимого випромінювання азоту
Якщо світло випромінюють тверді тіла, рідини чи дуже сильно
стиснені гази, то на випромінювання кожного з атомів істотно
впливають сусідні атоми. Унаслідок цього можна спостерігати
розмивання ліній у спектрі випромінювання і плавний перехід від
одного кольору до іншого. Так виглядає суцільний спектр.
Суцільний спектр випромінюють розжарені тверді тіла й розігріті
рідини, які перебувають при певній температурі у стані
термодинамічної рівноваги з випромінюванням
7.
Індивідуальність лінійчастихспектрального аналізу сполук.
спектрів
використовують
для
Кількісний вміст елемента в досліджуваному зразку
визначають порівнянням інтенсивності окремих
ліній спектра цього елемента з інтенсивністю ліній
іншого хімічного елемента.
Спектральний аналіз – це метод визначення якісного і кількісного
складу речовини за допомогою спектра. Спектри спостерігають за
допомогою спектроскопа
8.
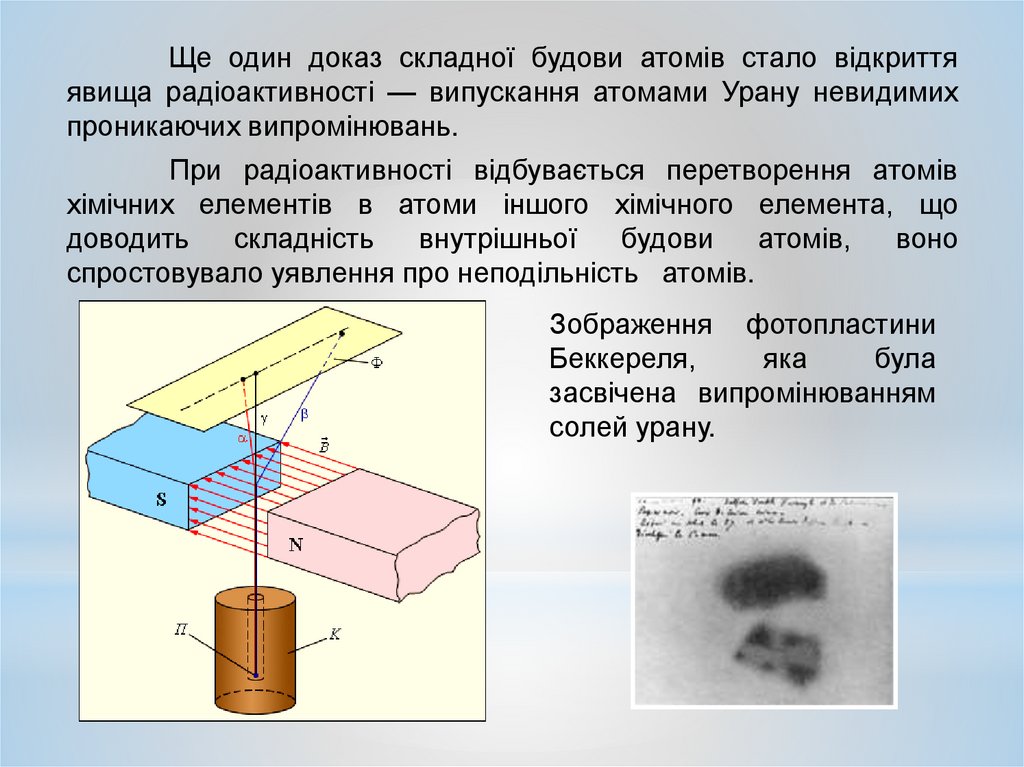
Ще один доказ складної будови атомів стало відкриттяявища радіоактивності — випускання атомами Урану невидимих
проникаючих випромінювань.
При радіоактивності відбувається перетворення атомів
хімічних елементів в атоми іншого хімічного елемента, що
доводить
складність
внутрішньої
будови
атомів,
воно
спростовувало уявлення про неподільність атомів.
Зображення фотопластини
Беккереля,
яка
була
засвічена випромінюванням
солей урану.
9.
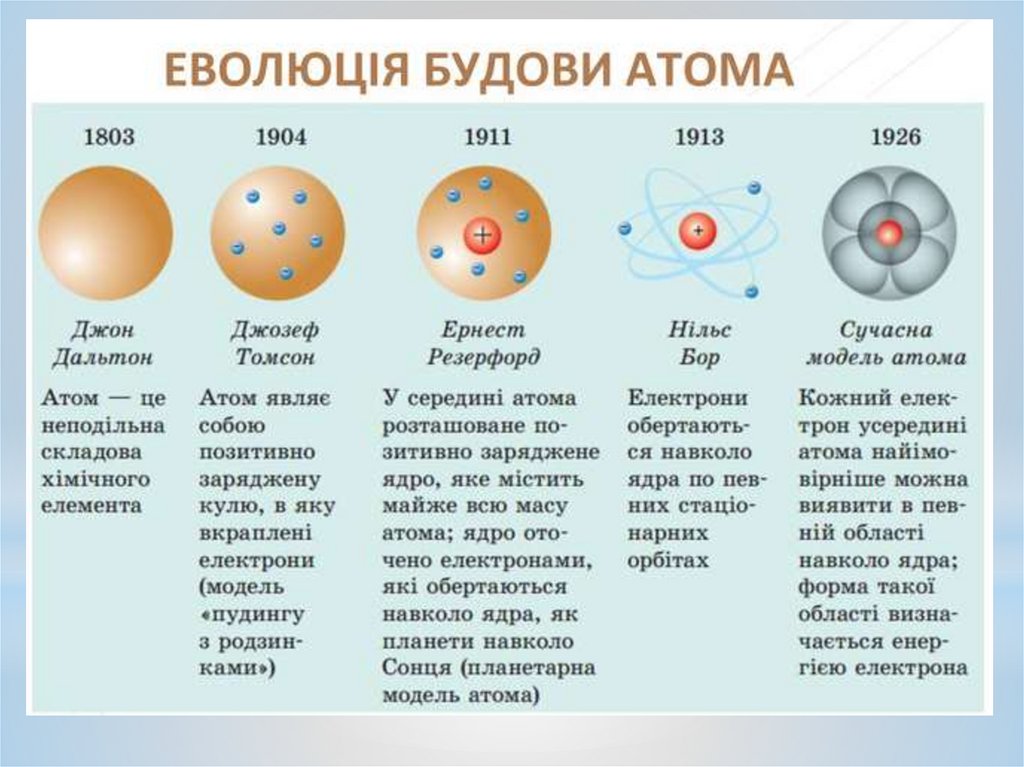
Будова атома ТомсонаДжозеф Томсон
1856-1940
1904 рік. Томсон: атоми елементів складаються з декількох від'ємно
заряджених корпускул, поміщених у сферу, що має однорідно
розподілений позитивний електричний заряд (Пудинг або кекс з
родзинками)
Електрони значно менші ніж атоми
(оцінки показували, що радіус електрона
менший за 10-15 м)
10.
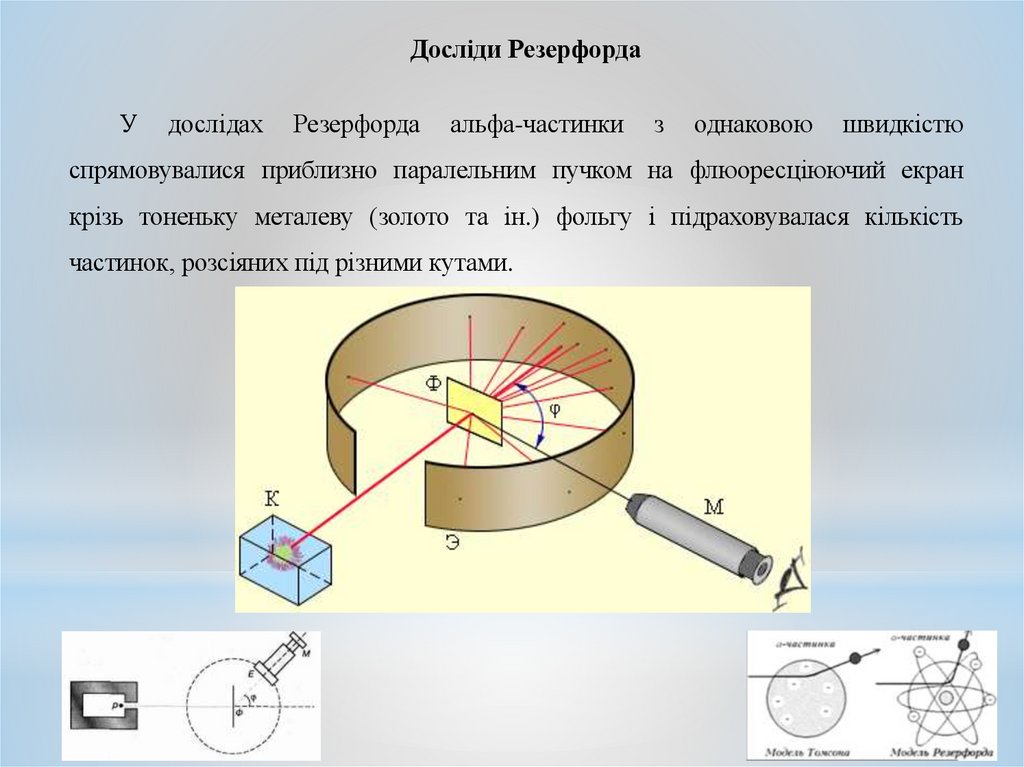
Досліди РезерфордаУ
дослідах
Резерфорда
альфа-частинки
з
однаковою
швидкістю
спрямовувалися приблизно паралельним пучком на флюоресціюючий екран
крізь тоненьку металеву (золото та ін.) фольгу і підраховувалася кількість
частинок, розсіяних під різними кутами.
11.
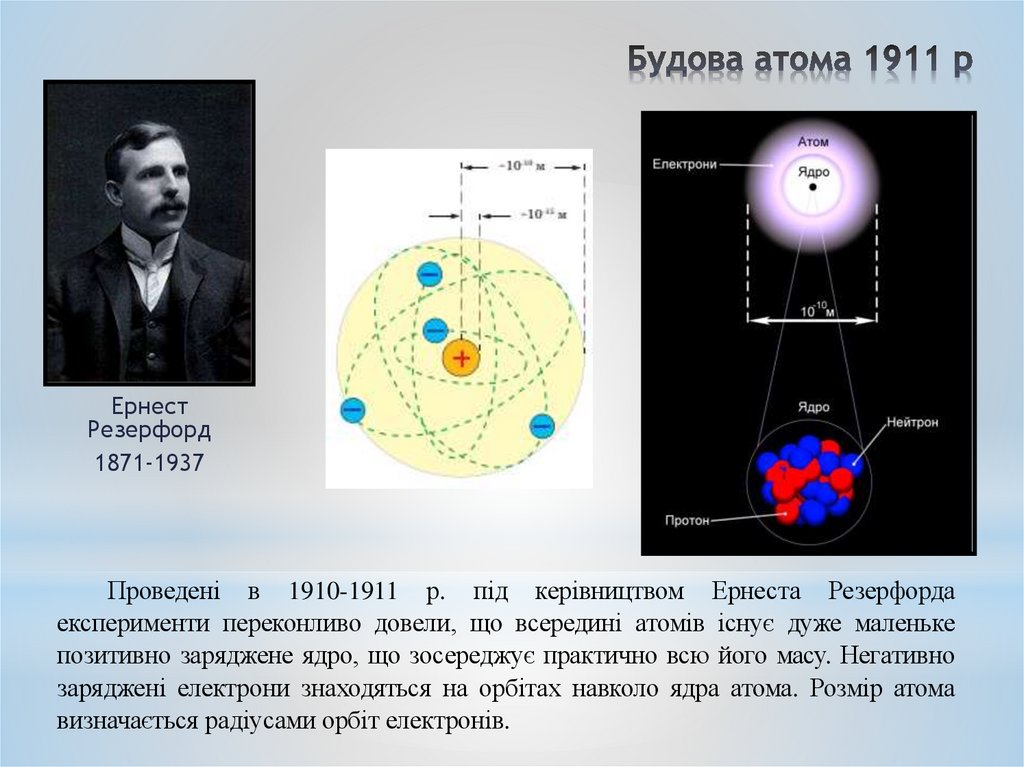
ЕрнестРезерфорд
1871-1937
Проведені в 1910-1911 р. під керівництвом Ернеста Резерфорда
експерименти переконливо довели, що всередині атомів існує дуже маленьке
позитивно заряджене ядро, що зосереджує практично всю його масу. Негативно
заряджені електрони знаходяться на орбітах навколо ядра атома. Розмір атома
визначається радіусами орбіт електронів.
12.
2. Квантові постулати Бора.Перший постулат Бора:
атом може
перебувати тільки в особливих стаціонарних,
або
квантових,
станах, кожному з яких
відповідає певна енергія Еп. В стаціонарному
стані
атом
не
випромінює
електромагнітних хвиль
Нільс Бор
1885 - 1962
Другий
У стаціонарному стані електрон рухається по орбіті
радіусом r і енергію не випромінює.
постулат
Бора:
при
переході
атома
з
одного
стаціонарного стану в інший випромінюється або поглинається
квант електромагнітної енергії.
13.
Схема переходів атома з одного енергетичного стану в інший (переходи показанострілками): у разі переходу на нижчий енергетичний рівень атом випромінює квант
електромагнітної енергії (перехід 1), а поглинувши квант, атом стрибком переходить на
вищий енергетичний рівень (перехід 2)
14.
Енергія фотона дорівнює різниці енергій атома в двох його стаціонарних станах:де к і n — номери його стаціонарних станів.
відбувається випромінювання фотона
поглинання
Частота коливань, яка відповідає випущеному (чи поглинутому) кванту
випромінювання, визначається формулою:
Для атома дійсно стійким є тільки стаціонарний стан із найнижчим рівнем енергії
— основний стан
Всі стаціонарні стани атома, крім основного, називають збудженими станами.
15.
Теорія Бора розв'язала проблему будови атома Гідрогену і спектра йоговипромінювання.
Енергію електрона, що покинув атом (міститься на нескінченній відстані від
ядра), приймають за нуль. Зрозуміло, що енергія будь-якого електрона, який
знаходиться ближче до ядра, буде меншою від і, отже, від’ємною. У нормальному (не
збудженому) стані енергія атома буде мінімальною і для атома Гідрогену її значення
Е1 = –13,55 еВ. У першому збудженому стані (другий енергетичний рівень) атом
Гідрогену матиме енергію Е2 = –3,38 еВ, у третьому — Е3= –1,5 еВ. Постулати Бора
дають змогуь визначити частоти випромінювання атомів гідрогену під час переходу
між різними станами. Усі частоти випромінювань атома Гідрогену складають низку
серій, кожна з яких виникає під час переходу атома з одного енергетичного стану в
інший.
16.
Частоти електромагнітних хвиль атомів, щовипромінюють визначають формулою:
де R = 3,27·1015 c-1 — стала Рідберґа
Під час переходів на перший рівень (n = 1) з другого, третього тощо. виникає
ультрафіолетове випромінювання (серія Лаймана), під час переходів на другий рівень з
вищих рівнів — випромінювання оптичного діапазону (серія Бальмера) і під час
переходів на третій рівень — інфрачервоне випромінювання (серія Пашена).
17.
18.
Д/з: Фізика 11 кл. Бар’яхтар В. Г. § 36, вправа 36 с. 214Питання:
Що таке частота коливань?
Що таке фотони?
Як визначити енергію фотона?
Переведіть 5 еВ в Дж
1 еВ=1,6х10-19Дж












 physics
physics








