Similar presentations:
Важнейшие понятия и законы химии
1.
ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ОБРАЗОВАНИЯ«КРАСНОЯРСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ
ИМЕНИ ПРОФЕССОРА В.Ф. ВОЙНО-ЯСЕНЕЦКОГО»
МИНИСТЕРСТВА ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
ФАРМАЦЕВТИЧЕСКИЙ КОЛЛЕДЖ
«ВАЖНЕЙШИЕ ПОНЯТИЯ
И ЗАКОНЫ ХИМИИ»
Преподаватель химии: Агафонова Н.В.
2.
План лекции1. Предмет и задачи химии
2. Основные понятия химии
3. Основные законы химии
3.
Предмет и задачи химии4.
Предмет и задачи химииОсновная задача химии – изучить явления,
связанные с превращением вещества.
Химия – наука о веществах, их строении,
свойствах и превращениях.
5.
Предмет и задачи химииВещества – то из чего состоят
физические тела
6.
Предмет и задачи химииПризнаки, по которым вещества
различаются между собой, называются
свойствами.
7.
Предмет и задачи химииФизические свойства вещества:
Агрегатное состояние
Плотность
Растворимость
Температура кипения и плавления
Цвет
Вкус
Запах
Электропроводность
8.
Предмет и задачи химииХимические свойства заключаются в
способности веществ взаимодействовать
между собой и при этом превращаться в
новые вещества.
Превращения одних веществ в другие
называются химическими реакциями.
9.
Предмет и задачи химииПризнаками протекания химических
реакций являются:
изменение цвета раствора
выделение газа
выпадение осадка
Cd(NO3)2 + Na2S = CdS↓+ 2NaNO3
выделение теплоты
образование воды
10.
Основные понятия химииНа понятиях «атом» и «молекула» основано
атомно-молекулярное учение, являющееся
фундаментом современных представлений о
веществе – главном объекте изучения химии.
11.
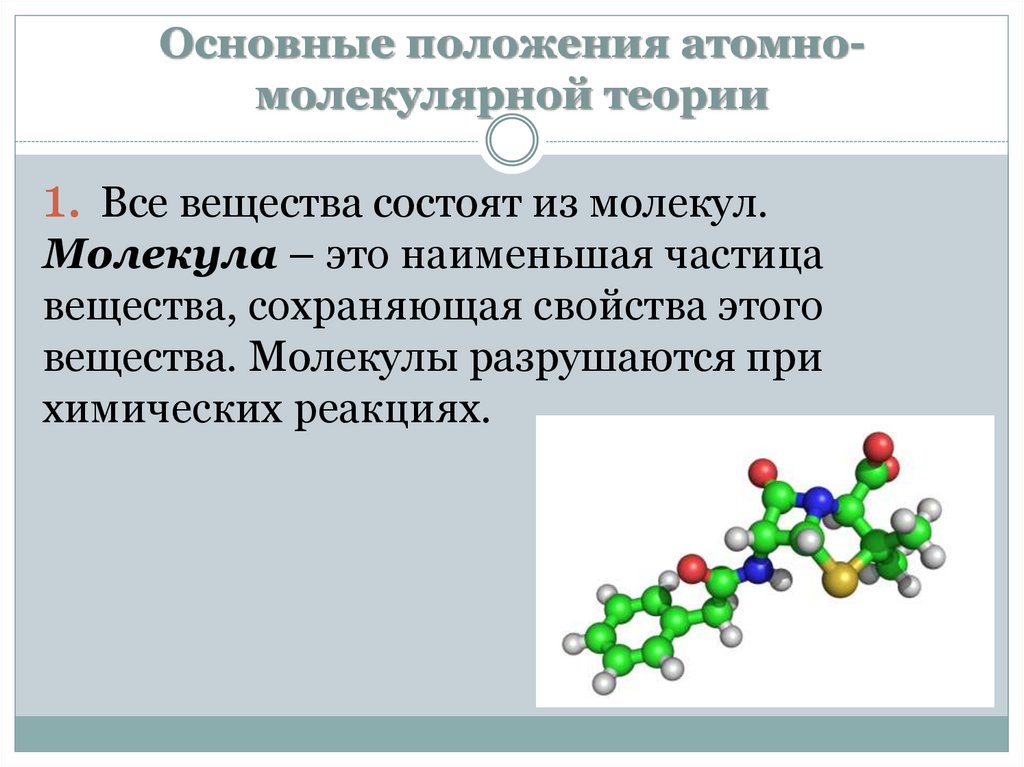
Основные положения атомномолекулярной теории1. Все вещества состоят из молекул.
Молекула – это наименьшая частица
вещества, сохраняющая свойства этого
вещества. Молекулы разрушаются при
химических реакциях.
12.
Основные положения атомномолекулярной теории2.Между молекулами имеются промежутки: у
газов – самые большие, у твердых веществ –
самые маленькие.
3.Молекулы двигаются беспорядочно и
непрерывно.
4.Молекулы одного вещества имеют
одинаковый состав и свойства, молекулы
разных веществ отличаются друг от друга по
составу и свойствам.
13.
Основные положения атомномолекулярной теории5. Молекулы состоят из атомов.
Атом – это электронейтральная частица,
состоящая из положительно заряженного
ядра и электронов.
14.
Основные положения атомномолекулярной теории6. Химический элемент – вид атомов с
одинаковым положительным зарядом ядра.
7. Атомы одного элемента образуют
молекулы простых веществ (О2, Н2, О3, Fe ...).
Атомы разных элементов образуют молекулы
сложных веществ (H2O, Na2SO4, FeCl3 …).
15.
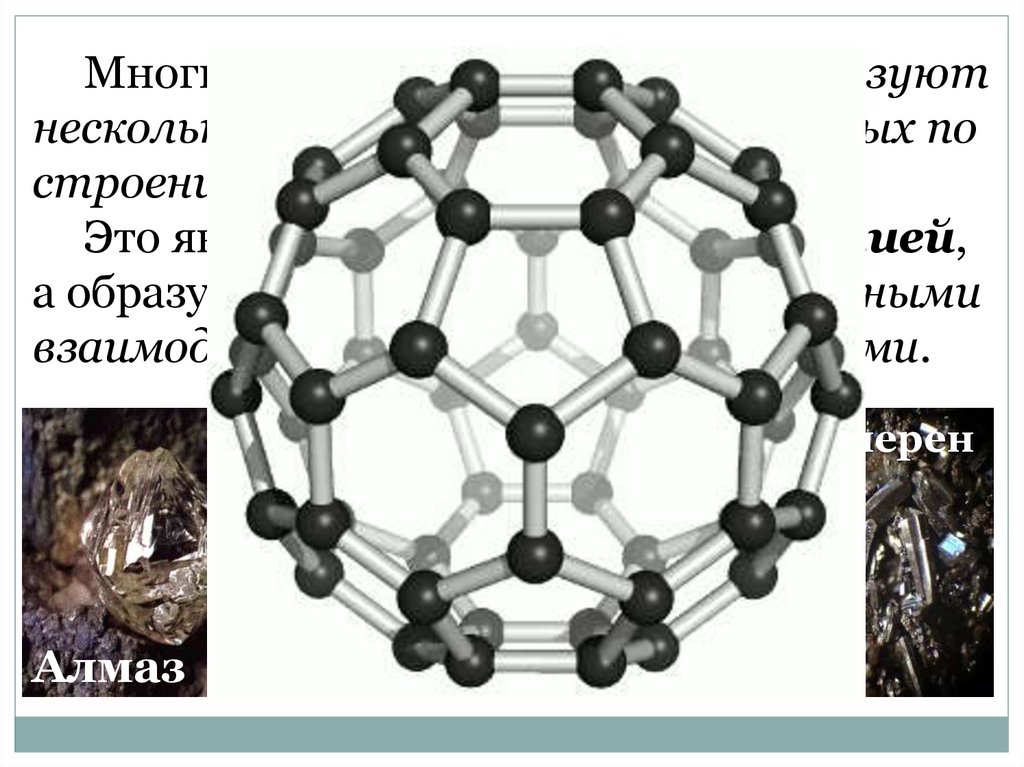
Многие химические элементы образуютнесколько простых веществ, различных по
строению и свойствам.
Это явление называется аллотропией,
а образующиеся вещества – аллотропными
взаимодействиями или модификациями.
Фуллерен
Графит
Алмаз
Карбин
16.
ВалентностьВалентность – это число связей, которое
образует данный атом с другими атомами в
соединении. Некоторые элементы имеют
постоянную валентность.
Элементы с постоянной валентностью
– это элементы, которые во всех
соединениях проявляют одинаковую
валентность.
17.
Элементами с постояннойвалентностью I являются: водород Н,
фтор F, щелочные металлы: литий Li,
натрий Na, калий К и др.
Элементами с постоянной
валентностью II: кислород О, магний
Mg, кальций Са, стронций Sr, барий Ва,
цинк Zn.
Элементами с постоянной
валентностью III – алюминий Al.
18.
ВалентностьЭлементы с переменной валентностью –
это элементы, которые в различных
соединениях могут иметь различные
значения валентности.
(Н2S)
(SO2)
H–S–H
валентность серы II
O=S=O
валентность серыIV
H–O
O
(H2SO4)
S
валентность серы VI
H–O
O
19.
Относительная атомная массаМассы атомов являются очень малыми
величинами. Массы атомов которые выражены в
обычных единицах массы (кг или г), называются
абсолютными атомными массами и
обозначаются символом ma. Самую маленькую
массу имеет атом водорода:
ma (Н) = 1,67 10-27 кг = 1,67 10-24 г
Абсолютные массы атомов углерода и кислорода
имеют следующие значения:
ma (С) = 19,93 10-27 кг;
ma (О) = 26,67 10-27 кг
20.
Относительная атомная массаВ химии вместо абсолютных атомных
масс обычно используют относительные
атомные массы.
Относительная
масса
За единицу атомныхатомная
масс принимается
1/ r)часть
(A
–
число,
показывающее
во
сколько
абсолютной
массы
атома
12
раз
абсолютная
углерода
С. масса атома данного
элемента больше 1/12 части абсолютной
массы атома углерода.
21.
Относительная атомная массаОтносительные атомные массы элементов
приведены в периодической системе Д.И.
Менделеева.
22.
Относительная молекулярная массаМасса любой молекулы равна сумме масс
образующих ее атомов.
Если при расчете массы молекулы используются
относительные атомные массы, то получается
относительная молекулярная масса, которая
обозначается символом Mr
Например, относительная молекулярная
масса воды Н2О равна:
Mr (Н2О) = 2Ar(Н) + Ar(О) = 2 1 + 16 = 18
23.
Относительная молекулярная массаОтносительная молекулярная масса
вещества (Mr) – это число, которое
показывает, во сколько раз абсолютная масса
молекулы данного вещества больше 1/12 части
абсолютной массы атома углерода.
Mr (Н2О) = 2Ar(Н) + Ar(О) = 2 1 + 16 = 18
Относительные молекулярные массы, как и
относительные атомные массы, являются
величинами безразмерными.
24.
Моль. Молярная массаМоль – количество вещества, которое содержит
столько молекул (томов) этого вещества, сколько
атомов содержится в 12г (0,012 кг) углерода.
Определение моля базируется на числе
структурных единиц, содержащихся в 12 г углерода.
Установлено, что данная масса углерода содержит
6,02 1023 атомов углерода. Следовательно, любое
вещество количеством вещества 1 моль содержит
6,02 1023 структурных единиц (атомов, молекул,
ионов).
Число частиц 6,02 1023 называется числом
Авогадро, или постоянной Авогадро и
обозначается NA.
25.
Молярная массаМолярная масса – это масса одного моля
вещества. Обозначается буквой М. Молярная масса
численно равна относительной молекулярной
массе и имеет единицы измерения г/моль.
Молярная масса вещества представляет собой
отношение его массы к количеству веществ:
М=m/n
Зная молярную массу вещества, можно
рассчитать количество вещества (число молей) n в
любой данной массе m этого вещества:
n=m/М (моль)
26.
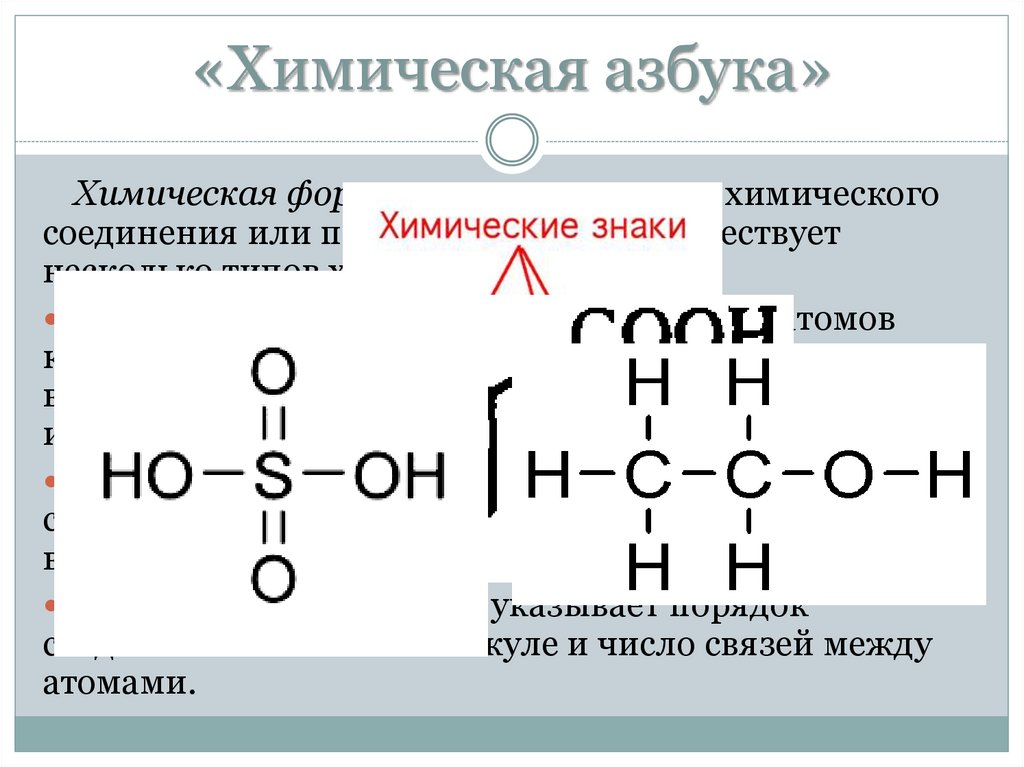
«Химическая азбука»Химическая формула отражает состав химического
соединения или простого вещества. Существует
несколько типов химических формул.
Молекулярная формула указывает число атомов
каждого элемента в молекуле. Она описывает только
вещества с молекулярным строением (газы, жидкости
и некоторые твердые вещества).
Эмпирическая формула указывает простейшее
соотношение между числом атомов разных элементов
в веществе.
Структурная формула указывает порядок
соединения атомов в молекуле и число связей между
атомами.
27.
Химическая азбукаХимическая реакция – превращение веществ,
сопровождающееся изменением их состава и
строения.
Схема реакции – запись химической реакции с
помощью формул исходных веществ и продуктов
реакции.
Химическое уравнение – запись химической
реакции с помощью формул реагентов и продуктов с
указанием их относительных количеств (в молях).
Числа перед химическими формулами, которые
указывают относительные количеств веществ,
называются стехиометрическими коэффициентами.
28.
Основные законы химииСтехиометрическими называются законы,
устанавливающие количественные соотношения
между массами и объемами реагирующих
веществ.
Стехиометрическими законами являются:
Закон сохранения массы веществ.
Закон постоянства состава.
Закон кратных отношений.
Закон Авогадро.
29.
З. сохранения массы веществВ 1748 г. М.В. Ломоносов и в 1789 г. А. Лавуазье
независимо друг от друга открыли закон: масса
веществ, вступивших в реакцию, равна
массе веществ, получившихся в результате
реакции.
Для реакции:
NaOH + HCl = NaCl + H2O
m1
m2
m3
m4
по закону сохранения массы:
m1 + m2 = m3 + m4
30.
З. постоянства состава веществаЖ. Пруст 1801 г.: каждое чистое вещество,
независимо от способа его получения
имеет постоянный качественный и
количественный состав.
Например: качественный и количественный состав
углекислого газа, полученного разными способами,
сохраняется постоянным:
C + O2 = CO2
CaCO3 = CaO + CO2
Na2CO3 + 2HCl = 2NaCl + H2O + CO2
CH4 + 2O2 = CO2 + 2H2O
31.
З. кратных отношенийДальтон, 1803г: если два элемента
могут образовывать между собой
несколько соединений, то массовые
доли любого из элементов в этих
соединениях относятся друг к другу
как небольшие целые числа.
32.
З. АвагадроАвогадро, 1811г: в равных
объемах различных газов
при одинаковых температуре
и давлении содержится одно
и тоже число молекул.
33.
З. АвогадроПервое следствие из закона Авогадро
При одинаковых условиях равные
количества различных газов занимают
равные объемы.
В частности, при нормальных условиях
(температура Т= 273К (0С), давление 101,325
кПа (1 атм)) любой газ, количество
которого равно 1 моль, занимает
объем 22,4 л. Этот объем называется
молярным объемом газа пи н.у.
Vм (газа) ну = 22,4 л/моль
34.
З. АвогадроВторое следствие из закона Авогадро
Относительная плотность одного газа по другому
газу равна отношению их молярных или
относительных молекулярный масс (так как М и Mr
численно равны):
DY(X) = M(X)/M(Y) = Mr(X)/ Mr(Y)
Часто плотность различных газов определяется по
отношению к водороду, который является самым легким
из всех газов, и по отношению к воздуху.
Относительная плотность любого газа Х по
водороду равна:
DН2(X) = M(X)/M(Н2) = Mr(X)/ 2
Относительная плотность любого газа Х по
воздуху равна:
Dвозд.(X) = M(X)/M(возд.) = Mr(X)/ 29
35.
Контрольные вопросы1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
12.
13.
Дайте определение химии как науки.
Что такое физические и химические свойства вещества?
Что называется химическими реакциями?
Перечислите основные положения атомно-молекулярной теории.
Что показывают химические формулы?
Как формулируется закон постоянства состава?
Чему равна относительная атомная масса?
Что такое относительная молекулярная масса?
Что такое моль?
Как обозначается и чему равно число Авогадро?
Что такое валентность?
Как формулируется закон сохранения массы вещества?
Что показывают коэффицкнты перед формулами веществ в
уравнении химической реакции?
14. Как формулируется закон Авогадро?
15. Сформулируйте первое и второе следствие из закона Авогадро.
16. Какой еще закон является основным законом химии?































 chemistry
chemistry








