Similar presentations:
Металлы. Физические свойства металлов
1.
МЕТАЛЛЫ2.
ФИЗИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВФизические свойства металлов определяются особым строением их кристаллической
решетки и наличием свободных электронов.
Металлам свойственна пластичность – способность изменять форму при ударе,
прокатываться в тонкие листы, вытягиваться в проволоку:
В ряду Au →Ag →Cu → Pb → Sn → Zn → Fe
пластичность уменьшается.
Электропроводность металлов при нагревании уменьшается, т.к. термические
колебания ионов в кристаллической решетки рассеивает направленное движение
электронов. В ряду Ag →Cu → Au → Al → Fe удельная электропроводность
уменьшается.
Высокая теплопроводность металлов также при нагревании уменьшается: за счет
движения делокализованных
электронов происходит быстрое выравнивание
температуры в массе металла.
Высокий коэффициент отражения металлов – «металлический блеск» – способность
хорошо отражать световые лучи, определяется электронным строением металлических
кристаллов.
Плотность металлов меняется от ρ = 0,53 г/см3 у лития до 22,6 г/см3 у осьмия (Os).
Температура плавления меняется в очень широких пределах: - 39 0С у ртути (Hg),
цезий (Cs) плавится при 28,6оС, галлий (Ga) при 30оС (оба плавятся в руках), а самый
тугоплавкий металл вольфрам (W) с Тпл. = 3410оС
Твердость: самые твердые металлы – иридий (Ir), бериллий (Ве), вольфрам (W) и хром
(Cr) имеют твердость по шкале Мооса ок.9 (против 10 у алмаза). Самые мягкие –
калий (К), рубидий (Rb), цезий (Cs) – легко режутся ножом.
3.
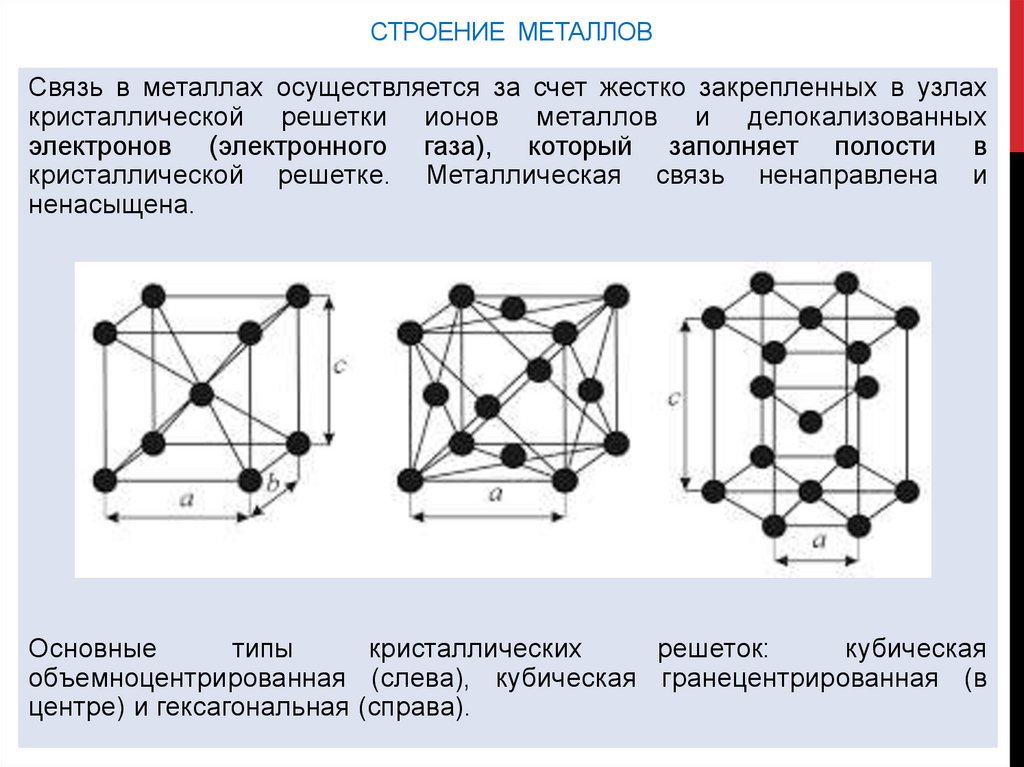
СТРОЕНИЕ МЕТАЛЛОВСвязь в металлах осуществляется за счет жестко закрепленных в узлах
кристаллической решетки ионов металлов и делокализованных
электронов (электронного газа), который заполняет полости в
кристаллической решетке. Металлическая связь ненаправлена и
ненасыщена.
Основные
типы
кристаллических
решеток:
кубическая
объемноцентрированная (слева), кубическая гранецентрированная (в
центре) и гексагональная (справа).
4.
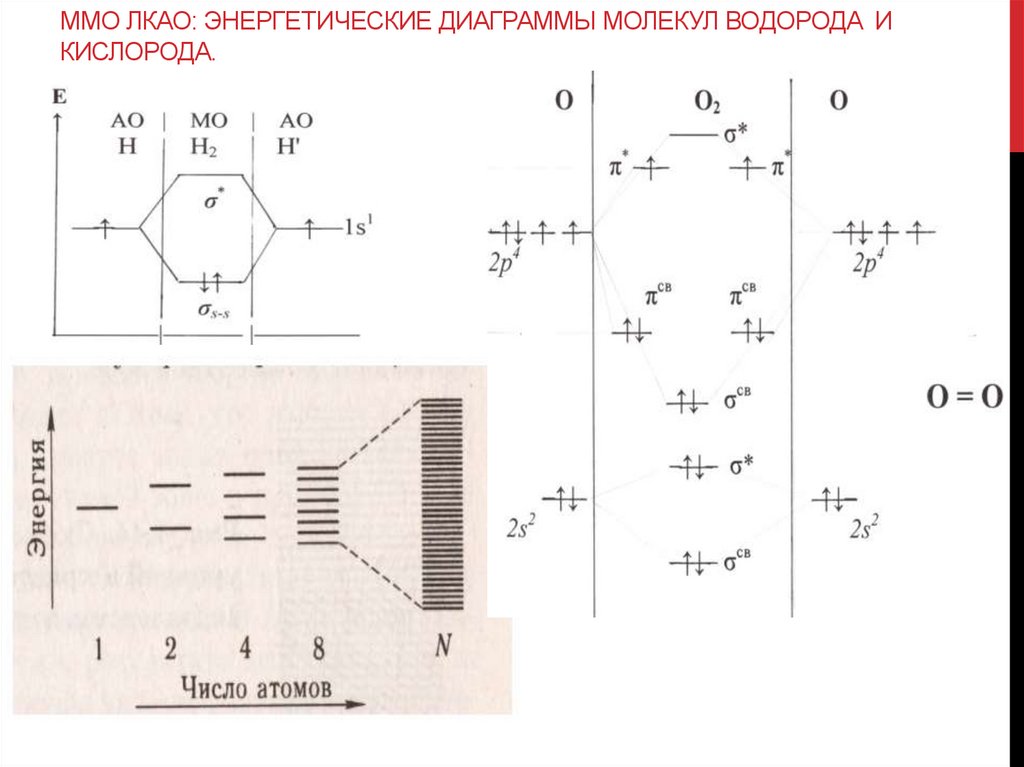
ММО ЛКАО: ЭНЕРГЕТИЧЕСКИЕ ДИАГРАММЫ МОЛЕКУЛ ВОДОРОДА ИКИСЛОРОДА.
5.
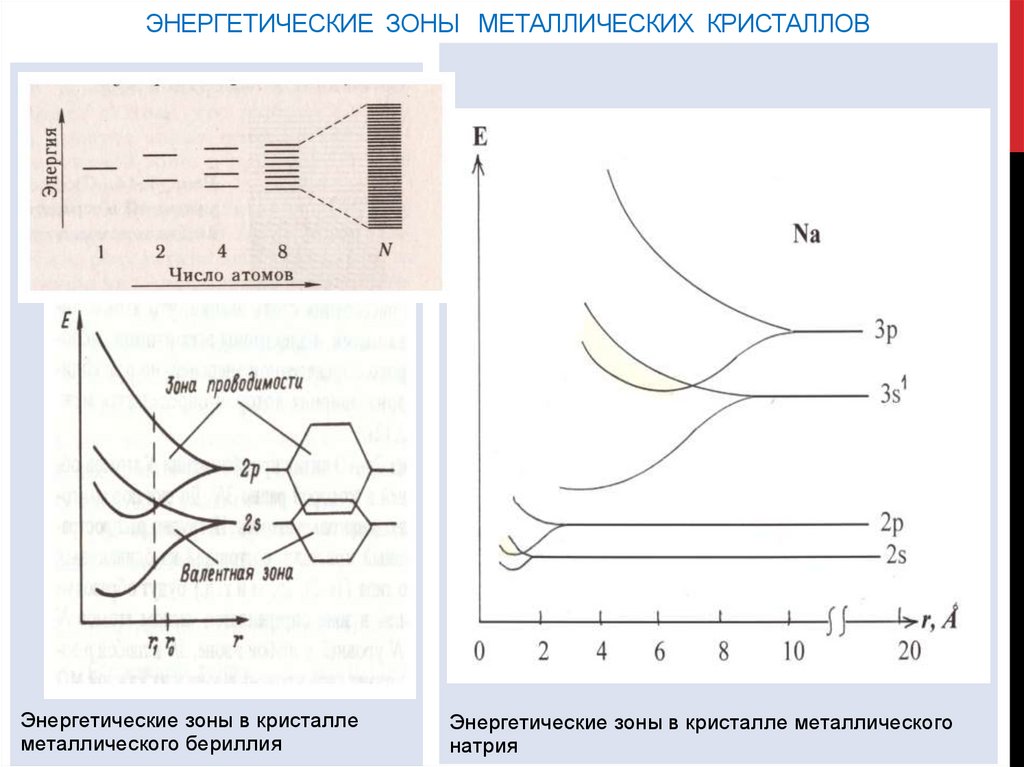
ЭНЕРГЕТИЧЕСКИЕ ЗОНЫ МЕТАЛЛИЧЕСКИХ КРИСТАЛЛОВЭнергетические зоны в кристалле
металлического бериллия
Энергетические зоны в кристалле металлического
натрия
6.
ЭЛЕКТРОХИМИЯ – НАУКА, ИЗУЧАЮЩАЯЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ И ФИЗИКОХИМИЧЕСКИЕ СВОЙСТВА ИОННЫХ СИСТЕМ.
Электрохимическая система, возникающая при контакте
электронного и ионного проводников, называется электрод.
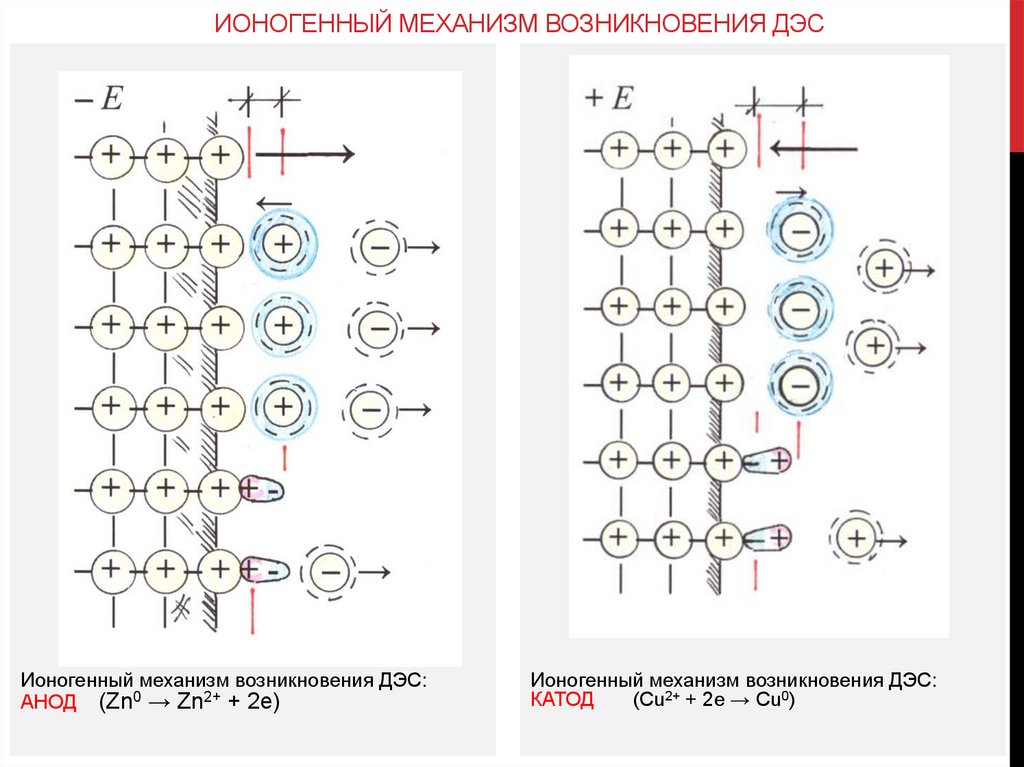
Ионогенный механизм возникновения двойного электрического слоя (ДЭС): при
взаимодействии металла и раствора его соли, может происходить как окисление металла
с переходом ионов Men+в раствор, так и восстановление катионов Men+из раствора в виде
Ме0. При равенстве скоростей обоих процессов устанавливается динамическое
равновесие вида: Me0 + mH2O ↔ Men+•mH2O + ne или Me0 ↔ Men+ + ne.
Смещение точки равновесия (при T = const ) зависит от природы металла и концентрации
раствора. При погружении металлического электрода в раствор его соли может
происходить один из двух процессов.
В случае активного металла (сильного восстановителя) протекает процесс окисления:
Me0 → Men+ + ne. Избыточный заряд оставшихся на пластинке электронов не
компенсируется положительно заряженными ионами в узлах кристаллической решетки,
поэтому поверхность металла приобретает отрицательный заряд относительно раствора.
На границе металл–раствор образуется ДЭС, электрод приобретает отрицательный
потенциал относительно раствора и называется анодом.
Если металл малоактивен, его катионы обладают окислительной способностью и
частично восстанавливаются на поверхности электрода: Men++ ne → Me0. В этом случае
электрод получает положительный потенциал относительно раствора и называется
катодом.
7.
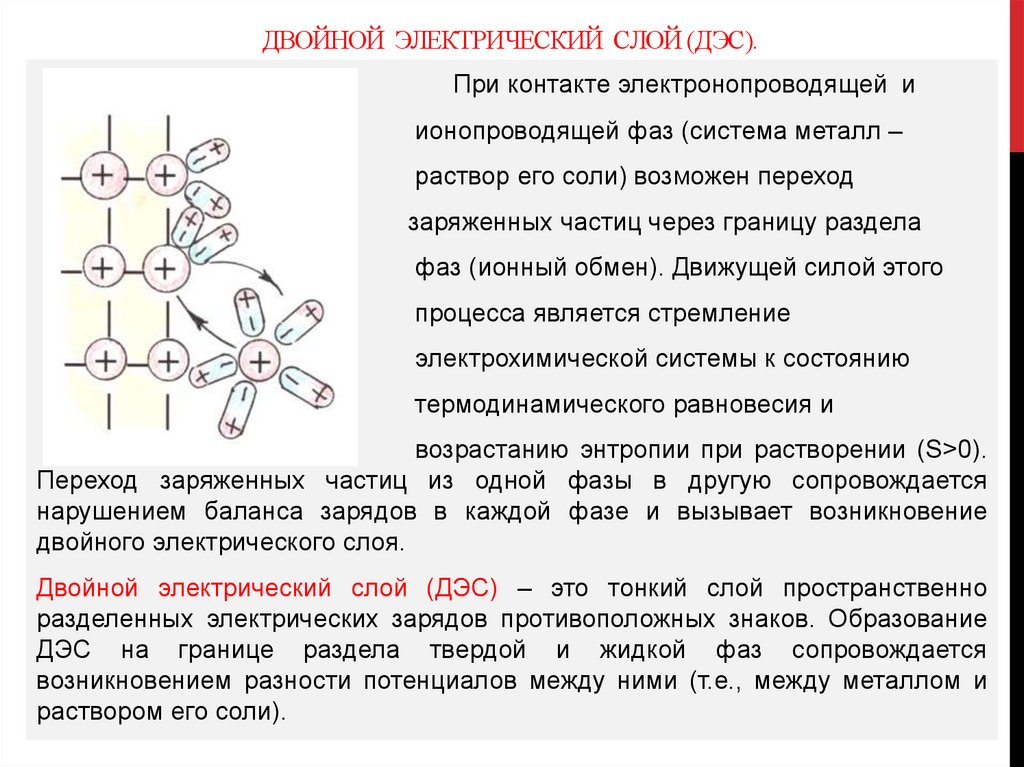
ДВОЙНОЙ ЭЛЕКТРИЧЕСКИЙ СЛОЙ (ДЭС).При контакте электронопроводящей и
ионопроводящей фаз (система металл –
раствор его соли) возможен переход
заряженных частиц через границу раздела
фаз (ионный обмен). Движущей силой этого
процесса является стремление
электрохимической системы к состоянию
термодинамического равновесия и
возрастанию энтропии при растворении (S>0).
Переход заряженных частиц из одной фазы в другую сопровождается
нарушением баланса зарядов в каждой фазе и вызывает возникновение
двойного электрического слоя.
Двойной электрический слой (ДЭС) – это тонкий слой пространственно
разделенных электрических зарядов противоположных знаков. Образование
ДЭС на границе раздела твердой и жидкой фаз сопровождается
возникновением разности потенциалов между ними (т.е., между металлом и
раствором его соли).
8.
ИОНОГЕННЫЙ МЕХАНИЗМ ВОЗНИКНОВЕНИЯ ДЭСИоногенный механизм возникновения ДЭС:
АНОД (Zn0 → Zn2+ + 2e)
Ионогенный механизм возникновения ДЭС:
КАТОД
(Cu2+ + 2e → Cu0)
9.
ДЭС состоит из плотного слоя адсорбционная часть – ближайшая кметаллу плоскость (толщиной ~10–10м),
которая
характеризуется
меньшей
диэлектрической проницаемостью, чем
объем раствора. В плотном слое к
поверхности металла притянуты жестко
ориентированные диполи воды и ионы, с
частично
нарушенной
гидратной
оболочкой;
Диффузная часть ДЭС (~10–9-10–5м). В
этом
месте
концентрация
ионов
противоположного поверхности металла
знака
уменьшается,
но
стабилизирующее эти ионы воздействие
поверхности сохраняется. Суммарный
заряд этих ионов нейтрализует заряд
поверхности: за пределами слоя на
раствор заряд поверхности не действует.
Степень диффузности слоя возрастает с
повышением температуры, уменьшением
концентрации
раствора
и
заряда
металла.
ДВОЙНОЙ ЭЛЕКТРИЧЕСКИЙ
СЛОЙ
Падение потенциала электрода по
мере удаления от его поверхности.
10.
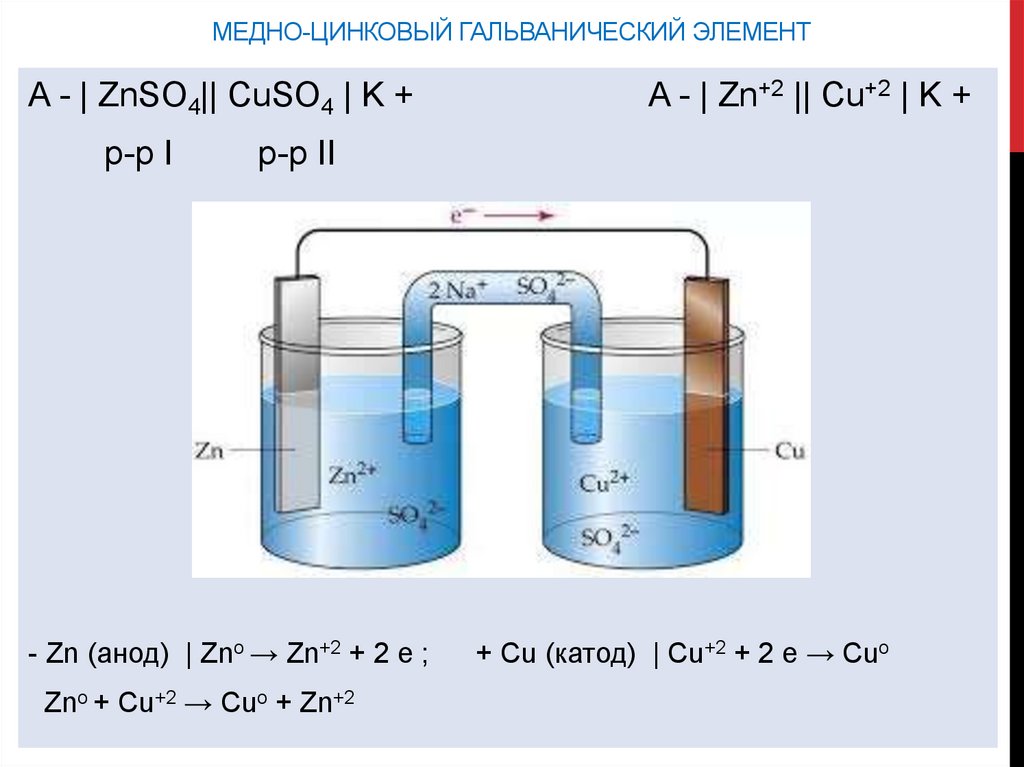
МЕДНО-ЦИНКОВЫЙ ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТA - | ZnSO4|| CuSO4 | K +
р-р I
A - | Zn+2 || Cu+2 | K +
p-p II
- Zn (анод) | Zno → Zn+2 + 2 e ;
Zno + Cu+2 → Cuo + Zn+2
+ Cu (катод) | Cu+2 + 2 e → Cuo
11.
12.
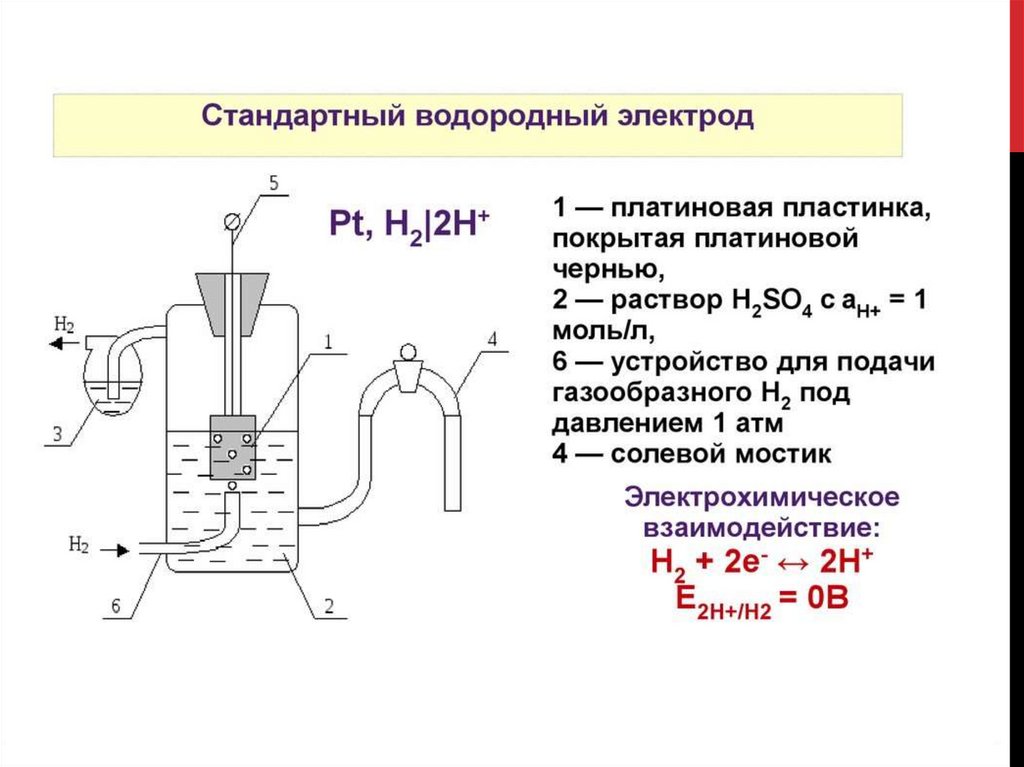
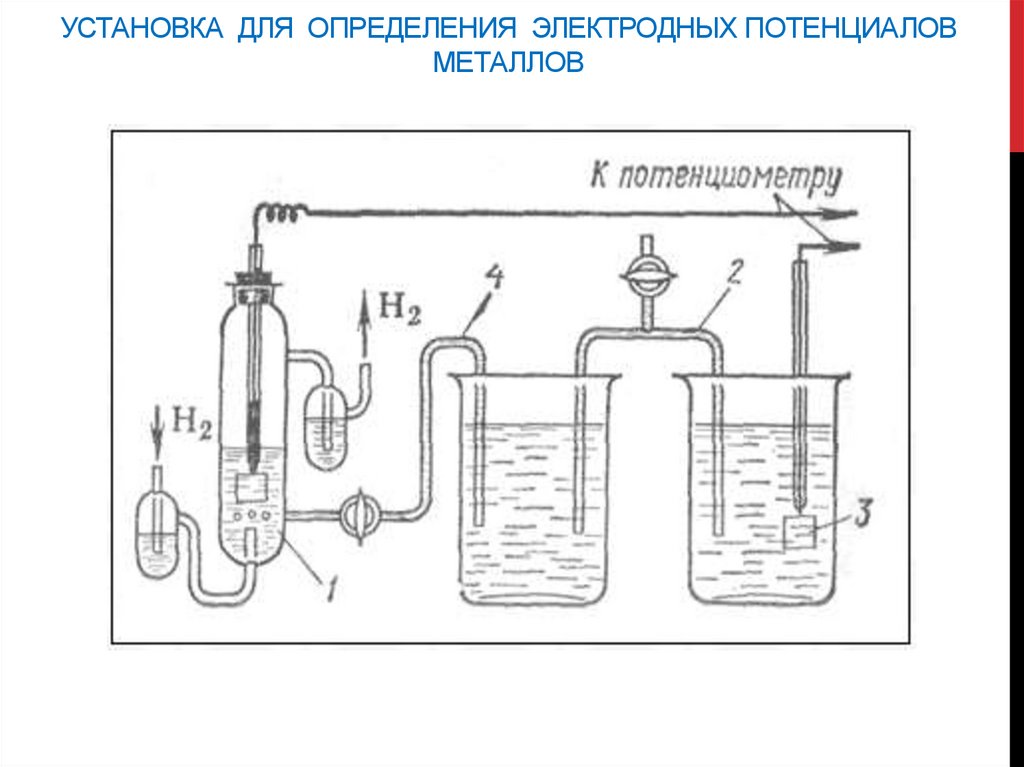
УСТАНОВКА ДЛЯ ОПРЕДЕЛЕНИЯ ЭЛЕКТРОДНЫХ ПОТЕНЦИАЛОВМЕТАЛЛОВ
13.
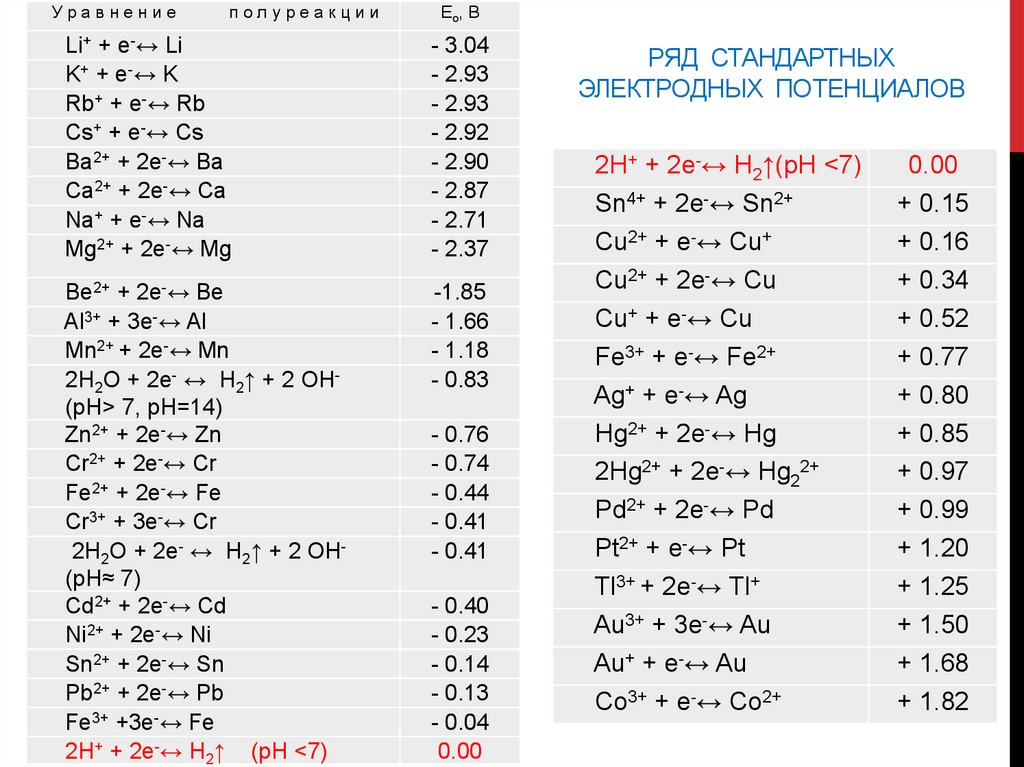
Уравнениеполуреакции
Ео, В
Li+ + e-↔ Li
K+ + e -↔ K
Rb+ + e-↔ Rb
Cs+ + e-↔ Cs
Ba2+ + 2e-↔ Ba
Ca2+ + 2e-↔ Ca
Na+ + e-↔ Na
Mg2+ + 2e-↔ Mg
- 3.04
- 2.93
- 2.93
- 2.92
- 2.90
- 2.87
- 2.71
- 2.37
Be2+ + 2e-↔ Be
Al3+ + 3e-↔ Al
Mn2+ + 2e-↔ Mn
2H2O + 2e- ↔ H2↑ + 2 OH(pH> 7, рН=14)
Zn2+ + 2e-↔ Zn
Cr2+ + 2e-↔ Cr
Fe2+ + 2e-↔ Fe
Cr3+ + 3e-↔ Cr
2H2O + 2e- ↔ H2↑ + 2 OH(pH≈ 7)
Cd2+ + 2e-↔ Cd
Ni2+ + 2e-↔ Ni
Sn2+ + 2e-↔ Sn
Pb2+ + 2e-↔ Pb
Fe3+ +3e-↔ Fe
2H+ + 2e-↔ H2↑ (pH <7)
-1.85
- 1.66
- 1.18
- 0.83
- 0.76
- 0.74
- 0.44
- 0.41
- 0.41
- 0.40
- 0.23
- 0.14
- 0.13
- 0.04
0.00
РЯД СТАНДАРТНЫХ
ЭЛЕКТРОДНЫХ ПОТЕНЦИАЛОВ
2H+ + 2e-↔ H2↑(pH <7)
Sn4+ + 2e-↔ Sn2+
Cu2+ + e-↔ Cu+
Cu2+ + 2e-↔ Cu
Cu+ + e-↔ Cu
Fe3+ + e-↔ Fe2+
Ag+ + e-↔ Ag
Hg2+ + 2e-↔ Hg
2Hg2+ + 2e-↔ Hg22+
Pd2+ + 2e-↔ Pd
Pt2+ + e-↔ Pt
Tl3+ + 2e-↔ Tl+
Au3+ + 3e-↔ Au
Au+ + e-↔ Au
Co3+ + e-↔ Co2+
0.00
+ 0.15
+ 0.16
+ 0.34
+ 0.52
+ 0.77
+ 0.80
+ 0.85
+ 0.97
+ 0.99
+ 1.20
+ 1.25
+ 1.50
+ 1.68
+ 1.82
14.
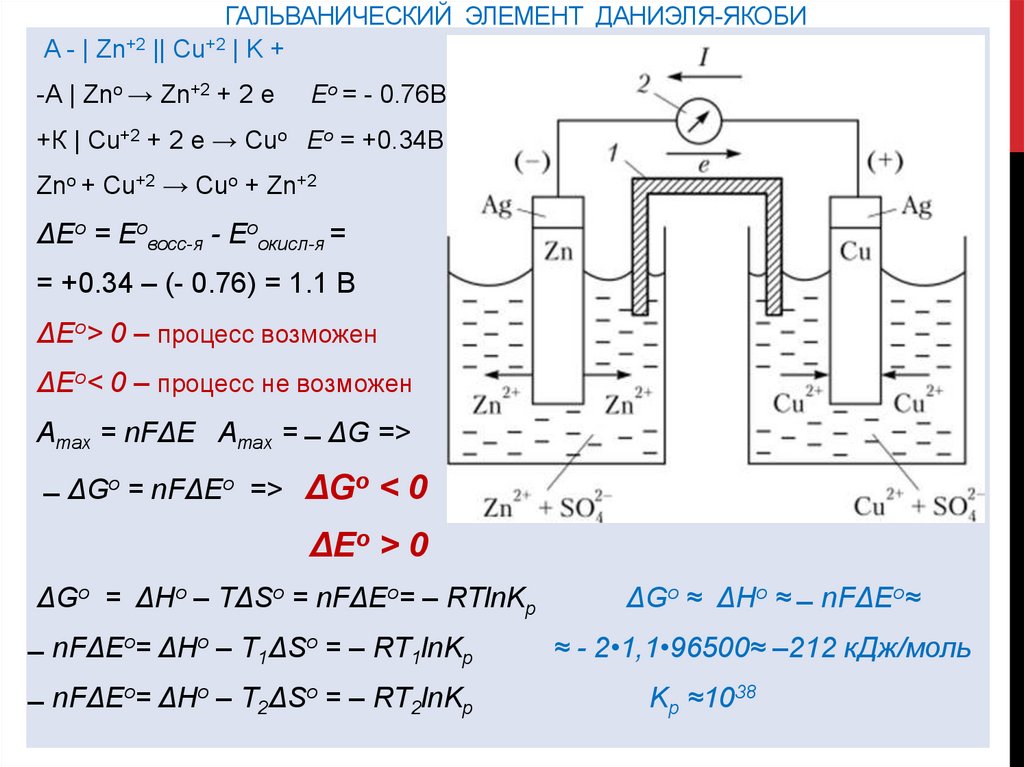
ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ ДАНИЭЛЯ-ЯКОБИA - | Zn+2 || Cu+2 | K +
-А | Zno → Zn+2 + 2 e
Ео = - 0.76В
+К | Cu+2 + 2 e → Cuo Ео = +0.34В
Zno + Cu+2 → Cuo + Zn+2
ΔЕо = Еовосс-я - Еоокисл-я =
= +0.34 – (- 0.76) = 1.1 В
ΔЕо˃ 0 – процесс возможен
ΔЕо˂ 0 – процесс не возможен
Amax = nFΔЕ Amax = ̶ ΔG =˃
̶ ΔGo = nFΔЕo =˃ ΔGo ˂ 0
ΔЕo ˃ 0
ΔGo = ΔHo – TΔSo = nFΔЕo= – RTlnKp
̶ nFΔЕo= ΔHo – T1ΔSo = – RT1lnKp
̶ nFΔЕo= ΔHo – T2ΔSo = – RT2lnKp
ΔGo ≈ ΔHo ≈ ̶ nFΔЕo≈
≈ - 2•1,1•96500≈ –212 кДж/моль
Kp ≈1038
15.
ВЗАИМОДЕЙСТВИЕ МЕТАЛЛОВ С КИСЛОТАМИЛюбая окислительно-восстановительная реакция идет в сторону ΔЕo ˃ 0 (что
соответствует ΔGo ˂ 0). Если ΔE ˃ 0, процесс возможен; если ΔE ˂ 0, процесс
не возможен в принципе, а возможен встречный процесс.
HCl + Ag
→×
ΔE = Eвосс-я ̶ Еок-я = 0 – (+0.80) = – 0.80 В ˂ 0
2HCl + Fe
→ FeCl2 + Н2↑
Fe0/ Fe+3
ΔE = Eвосс-я ̶ Еок-я = 0 – (–0.04) = + 0.04 В ˃ 0
Fe0/ Fe+2
ΔE = Eвосс-я ̶ Еок-я = 0 – (–0.44) = + 0.44 В ˃ 0
H2SO4 (конц.) → SO2 → S → H2S
2H2SO4 (конц.) + Cu → SO2↑ + CuSO4 + 2H2O
4H2SO4 (конц.) + 3Zn → S↓ + 3ZnSO4 + 4H2O
5H2SO4 (конц.) + 4Mg → H2S↑ + 4MgSO4 + 4H2O
5H2SO4 (конц.) + 2 P → 5SO2↑ + 2H3PO4 + 2H2O
2H2SO4 (конц.) + C → 2SO2↑ + 2CO2↑+ 2H2O
16.
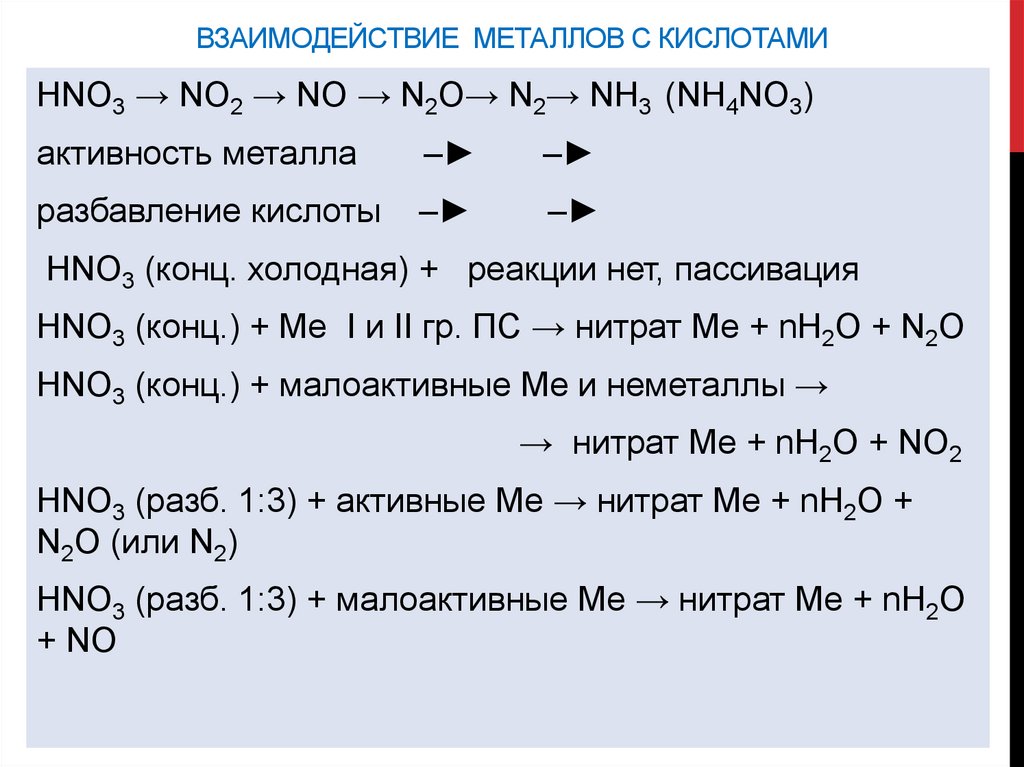
ВЗАИМОДЕЙСТВИЕ МЕТАЛЛОВ С КИСЛОТАМИHNO3 → NO2 → NO → N2O→ N2→ NH3 (NH4NO3)
активность металла
–
–
разбавление кислоты
–
–
HNO3 (конц. холодная) + реакции нет, пассивация
HNO3 (конц.) + Ме I и II гр. ПС → нитрат Ме + nН2О + N2O
HNO3 (конц.) + малоактивные Ме и неметаллы →
→ нитрат Ме + nН2О + NO2
HNO3 (разб. 1:3) + активные Ме → нитрат Ме + nН2О +
N2O (или N2)
HNO3 (разб. 1:3) + малоактивные Ме → нитрат Ме + nН2О
+ NO
17.
ВЗАИМОДЕЙСТВИЕ МЕТАЛЛОВ С ВОДОЙ И РАСТВОРАМИ ЩЕЛОЧЕЙПотенциал восстановления водорода из воды – 0.41 В. Следовательно, в
воде могут растворяться металлы, потенциал которых меньше – 0.41 В.
1.
2H2O + 2Na
→ 2NaOH + H2↑
ΔE = Eвосс-я ̶ Еок-я = – 0.41 – (– 2.73) = + 2.32 В ˃ 0
2.
H2O + Ni –×→
ΔE = Eвосс-я ̶ Еок-я = – 0.41 – (– 0.23) = – 0.18 В ˂ 0
3.
Mg(MgO) + H2O –×→
ΔE = Eвосс-я ̶ Еок-я = – 0.41 – (– 2.37) = + 1.96 В ˃ 0
Потенциал восстановления водорода из водных растворов щелочей – 0.83 В.
Следовательно, в воде могут растворяться металлы, потенциал которых
меньше – 0.83 В.
Al(Al2O3) + H2O + NaOH →
a) Al2O3
+ 2NaOH + 3 H2O → 2 Na [Al(OH)4]
b) 2 Al + 6 H2O → 2 Al(OH)3 + 3 H2↑
ΔE = Eвосс-я ̶ Еок-я = – 0.83 – (– 1.66) = + 0.83 В ˃ 0
18.
ВЗАИМОДЕЙСТВИЕ МЕТАЛЛОВ С РАСТВОРАМИ СОЛЕЙ1.
Zn + CuCl2 → Cu + ZnCl2
ΔE = Eвосс-я ̶ Еок-я = + 0.34 – (– 0.76) = + 1.1 В ˃ 0
ZnCl2 + HOH → ZnOHCl + HCl
Zn+2 + HOH → ZnOH+ + H+
Cu + HCl –×
pH ˂ 7
ΔE = Eвосс-я ̶ Еок-я = 0 – (+0.34) = – 0.34 В ˂ 0
2. Al(Al2O3) + H2O + Na2CO3 →
Al + Na2CO3 –×
ΔE = Eвосс-я ̶ Еок-я = –2.71–( –1.66) = – 1.05 В ˂ 0
Na2CO3 + HOH → NaHCO3 + NaOH
CO32- + HOH → HCO3- + OH-
pH ˃ 7
Al2O3 + 2NaOH + 3 H2O → 2 Na [Al(OH)4]
d) 2 Al + 6 H2O = 2 Al(OH)3 + 3 H2↑
ΔE = Eвосс-я ̶ Еок-я = – 0.83 – (– 1.66) = + 0.83 В ˃ 0
19.
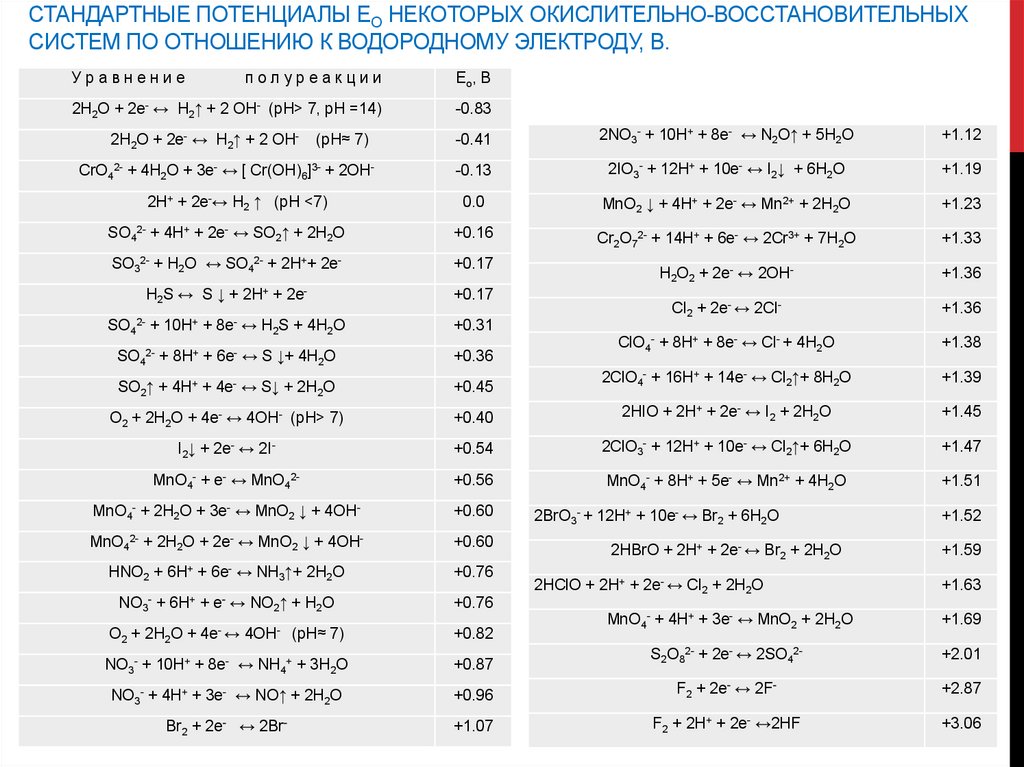
СТАНДАРТНЫЕ ПОТЕНЦИАЛЫ ЕО НЕКОТОРЫХ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХСИСТЕМ ПО ОТНОШЕНИЮ К ВОДОРОДНОМУ ЭЛЕКТРОДУ, В.
Уравнение
полуреакции
Ео, В
2H2O + 2e- ↔ H2↑ + 2 OH- (pH> 7, рН =14)
-0.83
(pH≈ 7)
-0.41
2NO3- + 10H+ + 8e- ↔ N2O↑ + 5H2O
+1.12
CrO42- + 4H2O + 3e- ↔ [ Cr(OH)6]3- + 2OH-
-0.13
2IO3- + 12H+ + 10e- ↔ I2↓ + 6H2O
+1.19
2H+ + 2e-↔ H2 ↑ (pH <7)
0.0
MnO2 ↓ + 4H+ + 2e- ↔ Mn2+ + 2H2O
+1.23
SO42- + 4H+ + 2e- ↔ SO2↑ + 2H2O
+0.16
Cr2O72- + 14H+ + 6e- ↔ 2Cr3+ + 7H2O
+1.33
SO32- + H2О
↔ SO42- + 2H++ 2e-
+0.17
H2O2 + 2e- ↔ 2OH-
+1.36
S ↓ + 2H+ + 2e-
+0.17
Cl2 + 2e- ↔ 2Cl-
+1.36
ClO4- + 8H+ + 8e- ↔ Cl- + 4H2O
+1.38
2H2O + 2e- ↔ H2↑ + 2 OH-
H2S ↔
SO42- + 10H+ + 8e- ↔ H2S + 4H2O
+0.31
SO42- + 8H+ + 6e- ↔ S ↓+ 4H2O
+0.36
SO2↑ + 4H+ + 4e- ↔ S↓ + 2H2O
+0.45
2ClO4- + 16H+ + 14e- ↔ Cl2↑+ 8H2O
+1.39
O2 + 2H2O + 4e- ↔ 4OH- (pH> 7)
+0.40
2HIO + 2H+ + 2e- ↔ I2 + 2H2O
+1.45
I2↓ + 2e- ↔ 2I-
+0.54
2ClO3- + 12H+ + 10e- ↔ Cl2↑+ 6H2O
+1.47
MnO4- + e- ↔ MnO42-
+0.56
MnO4- + 8H+ + 5e- ↔ Mn2+ + 4H2O
+1.51
MnO4- + 2H2O + 3e- ↔ MnO2 ↓ + 4OH-
+0.60
MnO42- + 2H2O + 2e- ↔ MnO2 ↓ + 4OH-
+0.60
HNO2 + 6H+ + 6e- ↔ NH3↑+ 2H2O
+0.76
NO3- + 6H+ + e- ↔ NO2↑ + H2O
+0.76
O2 + 2H2O + 4e- ↔ 4OH-
(pH≈ 7)
+0.82
NO3- + 10H+ + 8e- ↔ NH4+ + 3H2O
2BrO3- + 12H+ + 10e- ↔ Br2 + 6H2O
2HBrO + 2H+ + 2e- ↔ Br2 + 2H2O
2HClO + 2H+ + 2e- ↔ Cl2 + 2H2O
+1.52
+1.59
+1.63
MnO4- + 4H+ + 3e- ↔ MnO2 + 2H2O
+1.69
+0.87
S2O82- + 2e- ↔ 2SO42-
+2.01
NO3- + 4H+ + 3e- ↔ NO↑ + 2H2O
+0.96
F2 + 2e- ↔ 2F-
+2.87
Br2 + 2e- ↔ 2Br-
+1.07
F2 + 2H+ + 2e- ↔2HF
+3.06
20.
НАПРАВЛЕННОСТЬ РЕАКЦИЙ ОКИСЛЕНИЯ-ВОССТАНОВЛЕНИЯ2KMnO4 + 5K2SO3 + 3H2SO4 → 2MnSO4 + 6K2SO4 + 3H2O
2│MnO4‒ + 8H+ + 5e → Mn2+ + 4H2O (восстановление) E0= + 1.51B
5│SO32‒ + H2O – 2e → SO42‒ + 2H+ (окисление)
E0 = + 0.17 B
ΔE0 = E0восс-я ̶ Е0ок-я = +1.51 –(+0.17) = +1.34 B˃0
2FeCl2 + I2 + 2KCl ← 2FeCl3 + 2 KI
I2 + 2e → 2I(восстановление)
Fe+2 – e → Fe+3
(окисление)
ΔE0 = E0восс-я ̶ Е0ок-я = +0.54 – (+0.77) = ̶ 0.23 B˂0
E0 = + 0.54 B
E0 = + 0.77 B
2H2S + SO2 → 3S↓ + 2H2O
SO2 +4 e + 4H+ → S↓ + 2H2O (восстановление) E0 = + 0.45 B
H2S - 2e ↔ S↓ + 2H+
(окисление)
E0 = + 0.17 B
ΔE0 = E0восс-я ̶ Е0ок-я = +0.45 – (+0.17) = + 0.28 B˃0








 chemistry
chemistry








