Similar presentations:
Биохимия крови. Основы гистологии крови
1.
Биохимия крови2.
Основы гистологии кровиКровь состоит из: плазмы (55%) и форменных элементов (45%)
Плазма включает в себя: вода, белки, электролиты, питательные
вещества, продукты обмена, газы, биологически активные
вещества
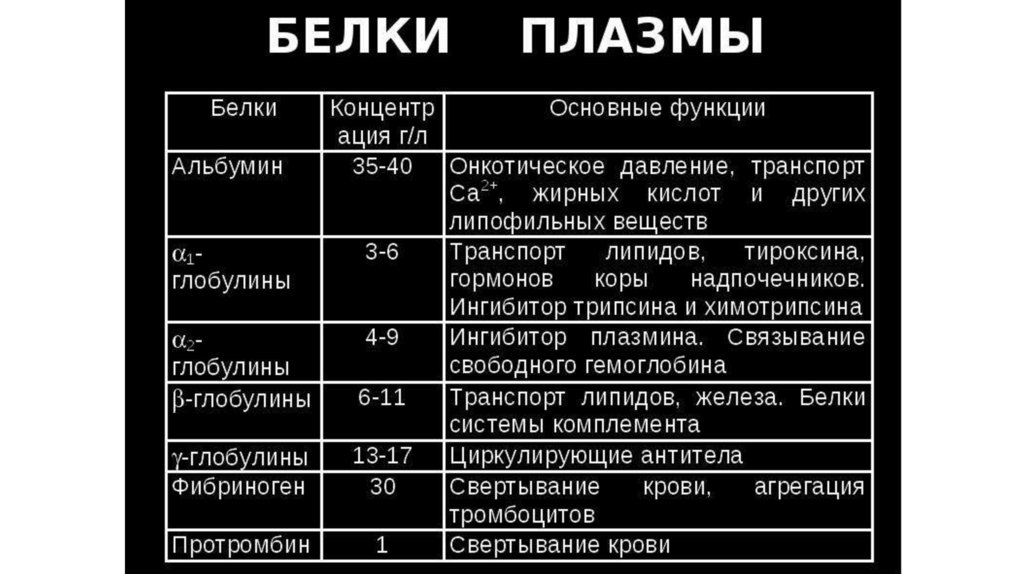
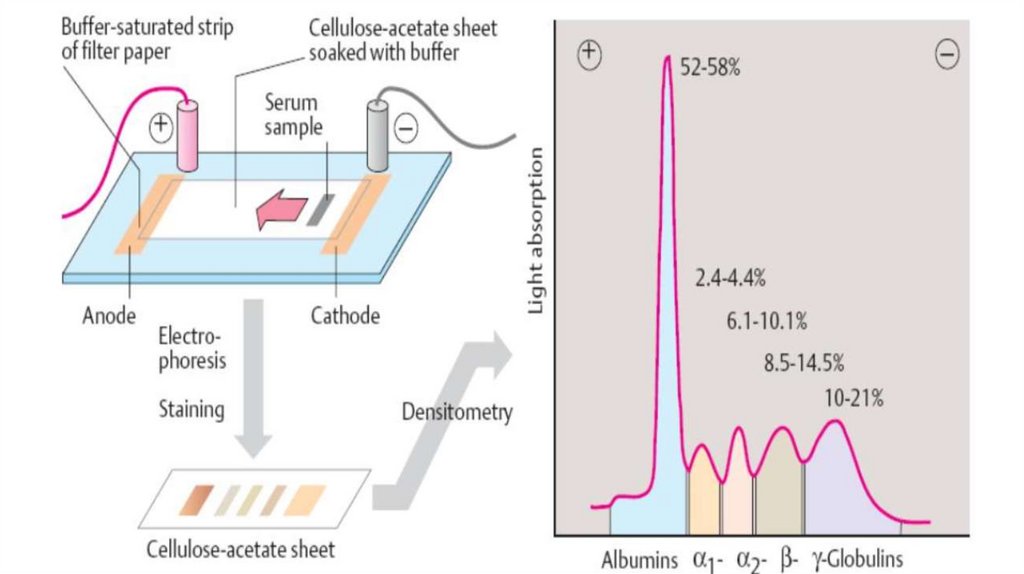
Белки плазмы крови: альбумины — 55—65 %, α1-глобулины —
2—4 %, α2-глобулины 6—12 %, β-глобулины 8 — 12 %, γглобулины — 2-4 % и фибриноген — 0,2—0,4 %.
3.
4.
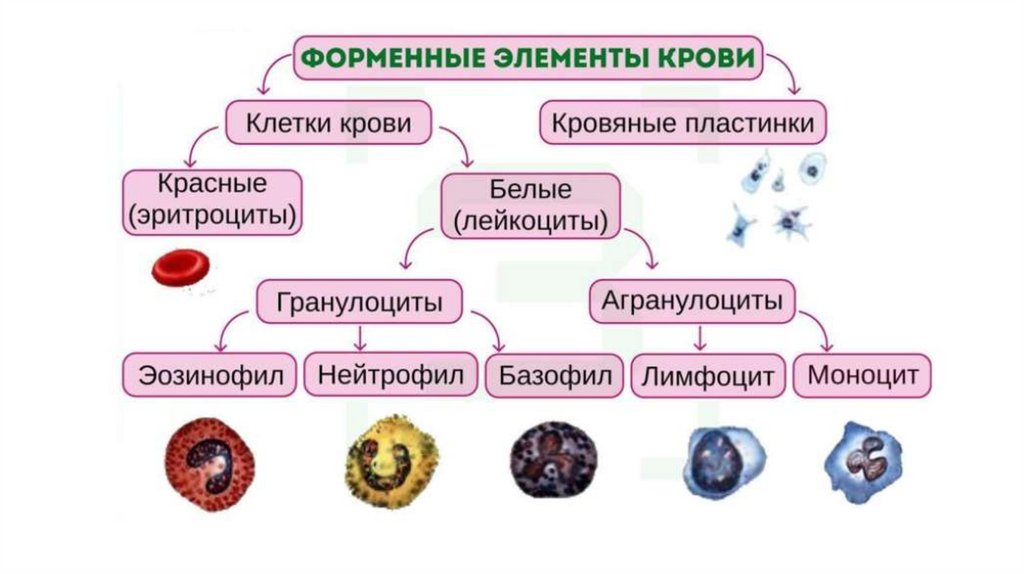
Форменные элементы крови:• Эритроциты (перенос кислорода и углекислого газа)
• Лейкоциты (защита от болезнетворных микробов)
• Тромбоциты (участвуют в свертывании крови)
5.
6.
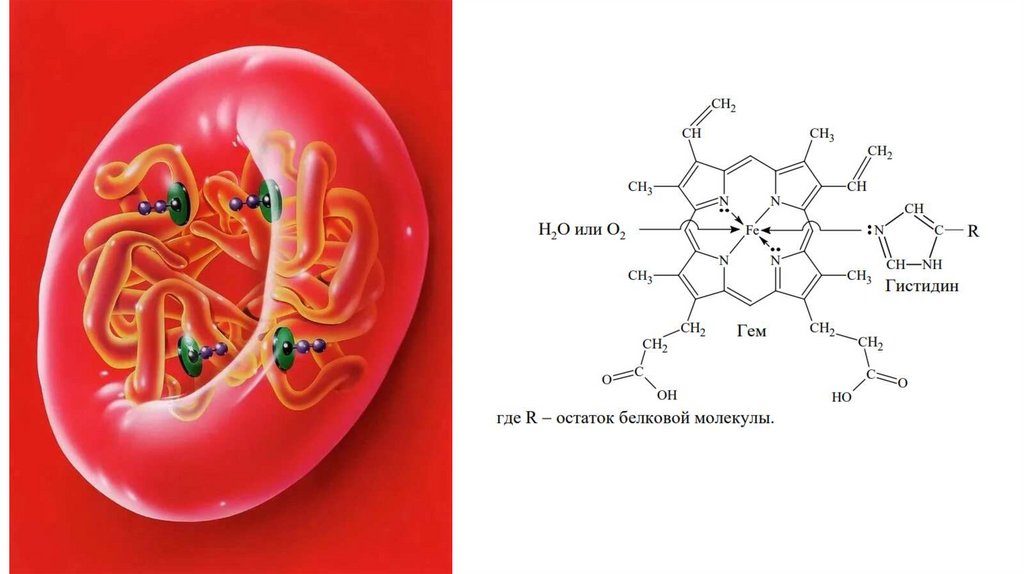
ГемоглобинМолекула гемоглобина состоит из белка глобина и небелковой
группы гема. Гемоглобин - тетрамерный белок состоит из двух αсубъединиц и двух β-субъединиц, каждая из которых содержит
небелковую часть - гем.
7.
8.
Кооперативный эффектГемоглобин осуществляет транспорт кислорода из легких к тканям.
При присоединении кислорода к одной из субъединиц
гемоглобина происходит изменение ее третичной структуры, что
вызывает целый ряд структурных перестроек в соседних
субъединицах. В результате присоединение последующих молекул
кислорода к остальным субъединицам происходит с каждым разом
все более эффективно. В тканях наблюдается обратная
закономерность, которая способствует равномерному
распределению кислорода. Совместное влияние протомеров
олигомерного белка на его свойства называется кооперативным
эффектом.
9.
Эффект БораВ тех тканях и органах, где происходит активное потребление кислорода, происходят
интенсивные окислительные процессы и выделяется значительное количество углекислого
газа. Под действием фермента карбоангидразы углекислый газ взаимодействует с водой с
образованием нестойкой угольной кислоты.
Угольная кислота легко диссоциирует на протоны и бикарбонат ионы. Таким образом, при
активном потреблении кислорода происходит локальное закисление среды. Присоединение
протонов к бкоковой части молекулы гемоглобина снижает его сродство к О2 и усиливает
поступление О2 в ткани, нуждающиеся в нём. Увеличение освобождения О2 гемоглобином
при повышении концентрации Н+ называют эффектом Бора.
10.
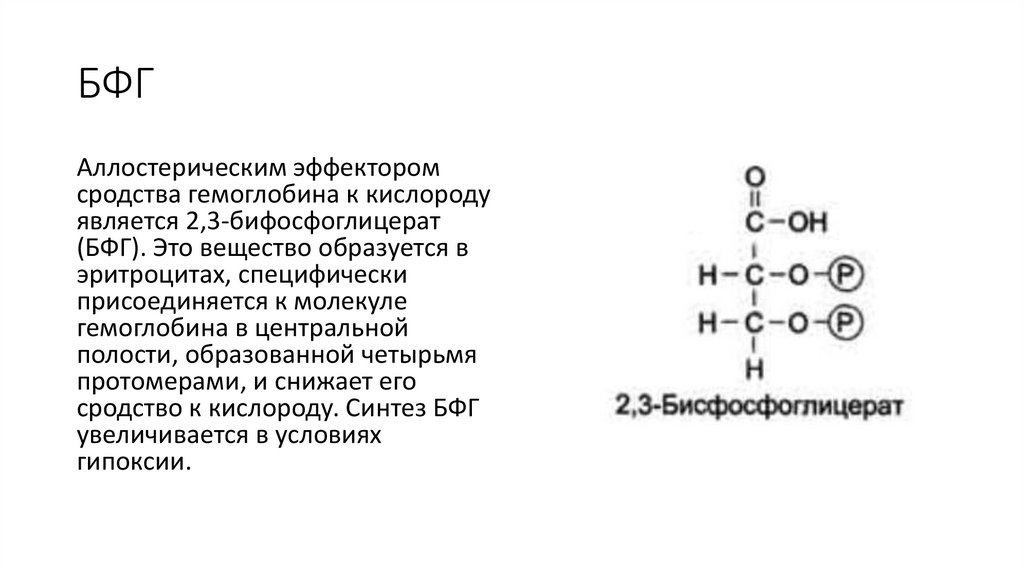
БФГАллостерическим эффектором
сродства гемоглобина к кислороду
является 2,3-бифосфоглицерат
(БФГ). Это вещество образуется в
эритроцитах, специфически
присоединяется к молекуле
гемоглобина в центральной
полости, образованной четырьмя
протомерами, и снижает его
сродство к кислороду. Синтез БФГ
увеличивается в условиях
гипоксии.
11.
Формы гемоглобинаРазличают две основных формы гемоглобина взрослого человека
HbA (95 – 98%) и HbА2 (1.5 – 3%), различающиеся по строению
белковой части.
В период внутриутробного развития синтезируются фетальный
(HbF) и эмбриональный гемоглобины(HbE), обладающие более
высоким сродством к кислороду по сравнению с гемоглобинами
взрослого человека.
12.
ГемоглобинопатииГемоглобинопатии – это наследственные заболения, возникающие
вследствие нарушения структуры гемоглобина.
Наиболее известной гемоглобинопатией является серповидноклеточная анемия, при которой в результате точечной мутации
синтезируется HbS. Этот гемоглобин обладает пониженным
сродством к кислороду и, его молекулы в дезокси-форме образуют
агрегаты, не приспособленные к транспорту кислорода.
13.
14.
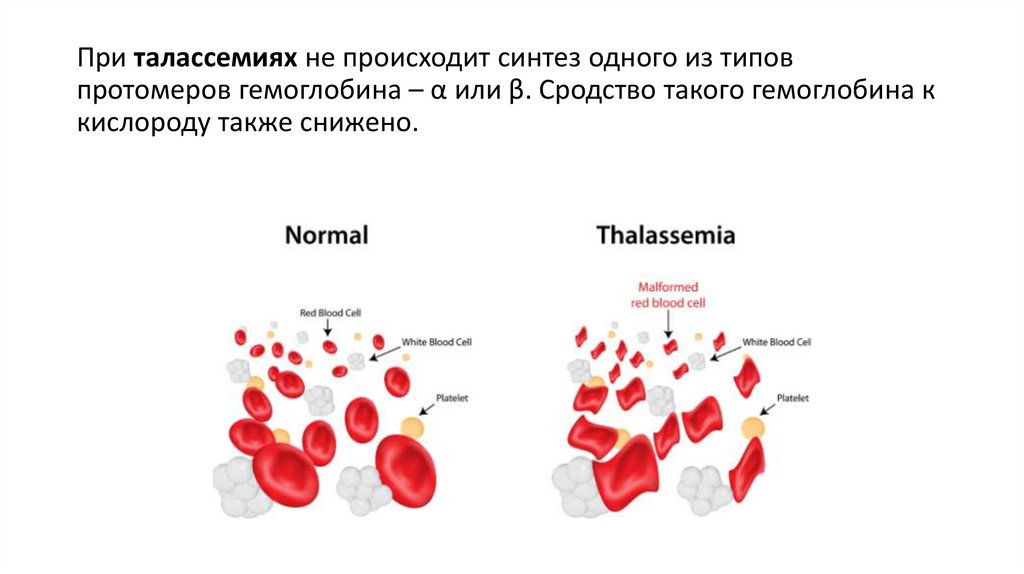
При талассемиях не происходит синтез одного из типовпротомеров гемоглобина – α или β. Сродство такого гемоглобина к
кислороду также снижено.
15.
Белки кровиБелки плазмы крови можно разделить, используя различные
методы, на три основные группы: альбумины, глобулины (α1, α2,
β, γ) и фибриноген. Большинство белков, постоянно
присутствующих и функционирующих в плазме крови,
синтезируется в печени.
16.
17.
АльбуминыНа долю альбуминов приходится более половины всех белков
плазмы крови. В структуре молекулы альбумина выделяют три
домена. Каждый домен способен связывать гидрофобные
вещества и ионы металлов. В соединении с альбумином
транспортируются свободные жирные кислоты, билирубин,
некоторые гормоны, лекарства, ионы кальция, ртути, кадмия и др.
Связывая в плазме крови положительно заряженные ионы,
главным образом Na+, альбумин обеспечивает значительную часть
осмотического давления крови.
18.
19.
ГлобулиныВ отличие от альбуминов глобулины нерастворимы в воде, а
растворимы в слабых солевых растворах. В составе α- и β глобулиновых фракций определяются липо- и гликопротеины, а
также белки, связанные с ионами металлов. Они отличаются не
только по строению, но и по функции.
α- и β -глобулины осуществляют перенос металлов и липидов в
виде липопротеинов, γ-глобулины - это антитела
(иммуноглобулины), выполняющие защитную функцию.
20.
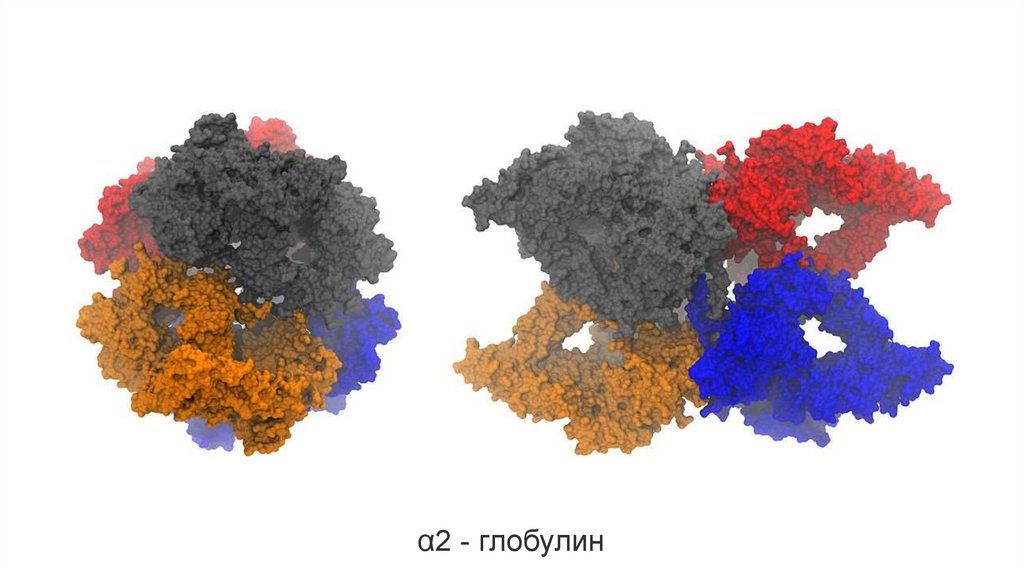
α2 - глобулин21.
22.
ФибриногенФибриноген - белок, участвующий в процессе свертывания крови.
Под действием тромбина он превращается в нерастворимый белок
фибрин.
При отсутствии фибриногена наблюдаются кровотечения при
малейших травмах. При повышении количества фибриногена,
наоборот, повышается свертываемость крови, и образуются
тромбы, которые могут отрываться и привести к закупорке сосуда,
что приводит к смерти.
23.
Снижение уровня белка в плазме крови называетсягипопротеинемией. Чаще всего это связано с уменьшением
количества альбумина. Причиной гипоальбуминемии могут быть
заболевания печени, почек, сердечно-сосудистой системы, а также
длительное голодание.
При многих заболеваниях общее количество белка остается в
пределах нормы (65-85 г/л), но развивается диспротеинемия, то
есть меняется процентное соотношение отдельных белковых
фракций. Так, например, при остром воспалении происходит
повышение количества α2-глобулинов за счет повышения Среактивного белка, уменьшение фракций α- и β-глобулинов
отмечается при патологии печени, при хроническом воспалении
увеличивается количество γ-глобулинов
24.
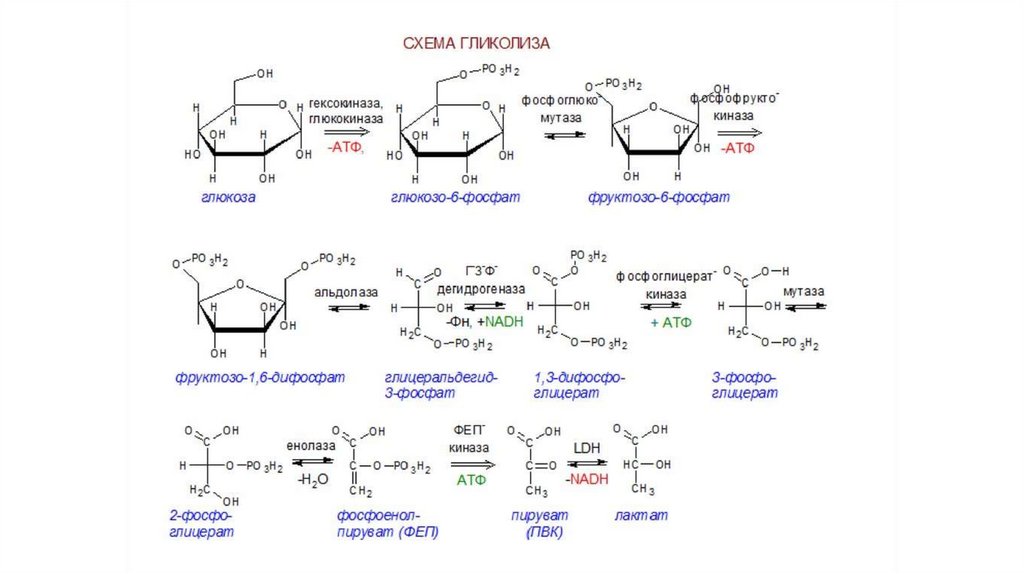
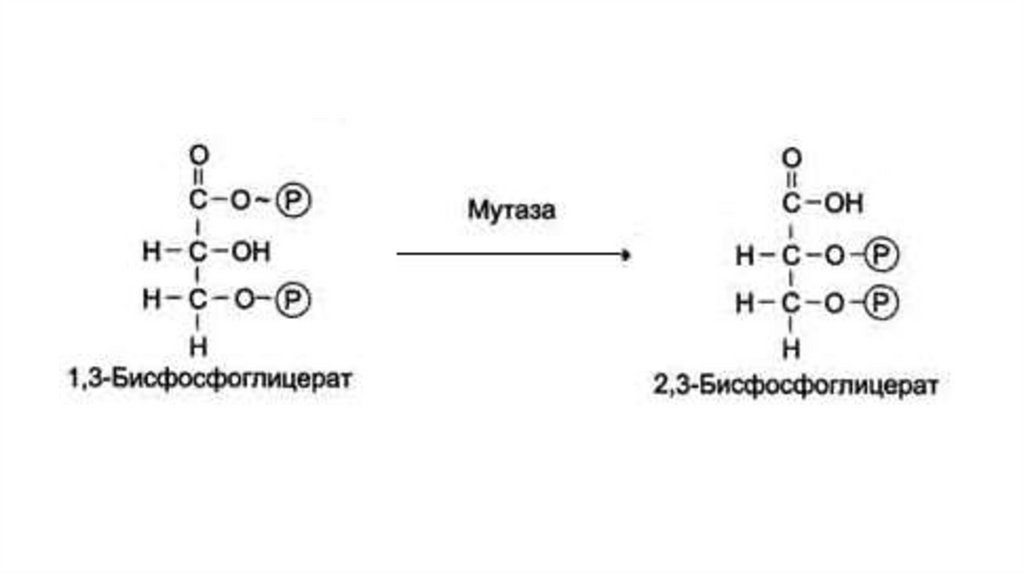
Особенности метаболических процессов вэритроцитах человека
В зрелых эритроцитах протекает ограниченное количество
обменных процессов. Из-за отсутствия митохондрий гликолиз
служит единственным источником энергии для эритроцитов.
Глюкоза распадается в цитоплазме до двух молекул молочной
кислоты, которая удаляется из клетки в плазму крови.
Уникальной особенностью гликолиза в эритроцитах является
превращение части молекул 1,3-бисфосфоглицерата в 2,3бисфосфоглицерат, который выступает в качестве аллостерического
регулятора гемоглобина.
25.
26.
27.
Присоединение 2,3-бисфосфоглицерата к молекуле гемоглобинаснижает его сродство к кислороду. Компенсаторное увеличение
синтеза 2,3-бисфосфоглицерата происходит при гипоксии.
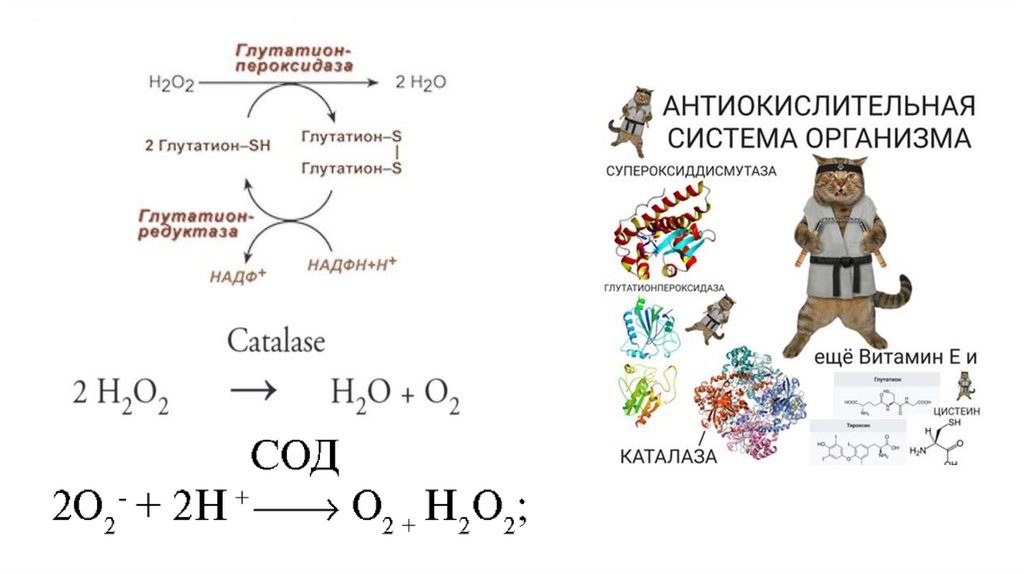
10% глюкозы в эритроцитах окисляется в реакциях
пентозофосфатного пути.
Дегидрогеназные реакции пентозофосфатного пути поставляют
восстановительные эквиваленты (НАДФН) для антиоксидантной
защиты с участием трипептида глутатиона.
В эритроцитах активны различные ферменты антиоксидантной
защиты. В обезвреживании супероксиданион-радикала участвует
супероксиддисмутаза, распад пероксида водорода
осуществляется под действием каталазы и глутатионпероксидазы.
28.
29.
Перенося кислород, эритроциты его сами не потребляют. Однако,под действием кислорода происходит окисление небольшого
количества Fe2+ гемоглобина до Fe3+. В этом случае гемоглобин
превращается вметгемоглобин и не способен связывать О2.
Обратное превращение метгемоглобина в гемоглобин
обеспечивает фермент метгемоглобинредуктаза, известная под
названием цитохром b5-редуктаза, использующая в реакции
восстановления НАДН и НАДФН.
Карбоангидраза эритроцитов в тканях катализирует образование
угольной кислоты из Н2О и СО2. Ион НСО3 - является основной
формой транспорта углекислого газа к легким, а Н+ снижает
сродство гемоглобина к кислороду, тем самым спопобствуя
снабжению тканей О2. В легких происходит обратная реакция, и
СО2 попадает в выдыхаемый воздух.
30.
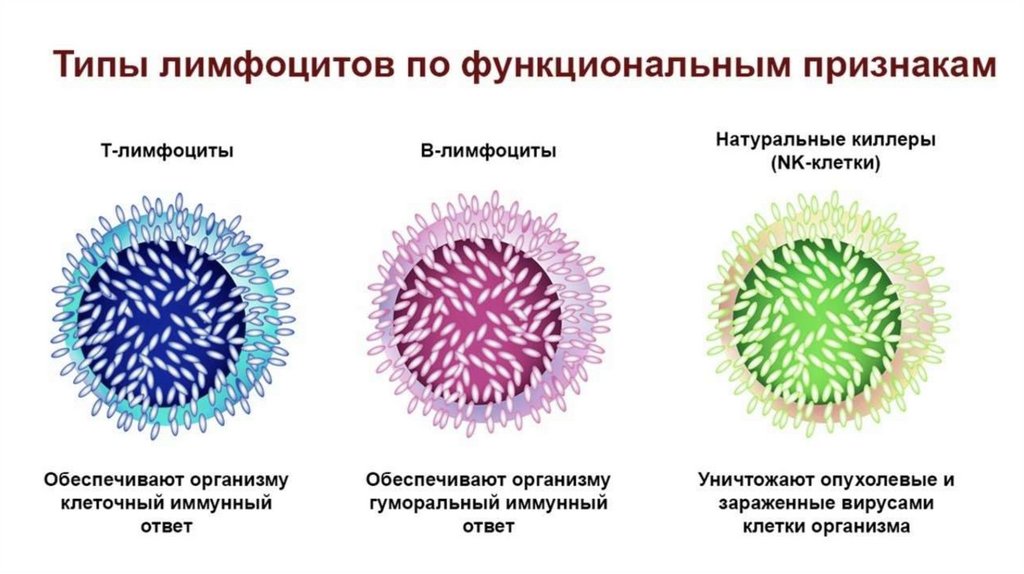
Особенности метаболических процессов влейкоцитах человека
Лейкоциты отличаются друг от друга как по строению, так и по
функциональному предназначению. Они представлены
полиморфноядерными нейтрофилами (50-70%), лимфоцитами (25-40%),
а также моноцитами, эозинофилами и базофилами.
Полиморфноядерные нейтрофилы и моноциты участвуют в
уничтожении микроорганизмов, а также собственных поврежденных
макромолекул путем фагоцитоза. Для окисления частиц, захваченных
фагоцитозом, в фагоцитах образуются активные формы кислорода
(АФК).
Если процесс фагоцитоза идет активно, то происходит так называемый
«респираторный» или дыхательный взрыв. Для него характерно резкое
увеличение потребления кислорода и глюкозы фагоцитирующей
клеткой.
31.
Активируется пентозофосфатный путь обмена глюкозы, и в клеткевозрастает количество молекул НАДФН.
Фермент мембраны фагосом – НАДФН-оксидаза восстанавливает
молекулу кислорода с образованием супероксид-анионного
радикала, который при участии супероксиддисмутазы
превращается в пероксид водорода.
При участии пероксида водорода под действием
миелопероксидазы иодиды и хлориды окисляются и образуются
сильные окислители – гипохлорит и гипойодид. После окисления
АФК продуктов фагоцитоза происходит расщепление содержимого
фаголизосомы лизосомальными ферментами. Эти гидролазы
активнЫ исключительно в кислой среде, которая поддерживается
внутри лизосом за счет работы Н+-АТФ-азы.
32.
33.
34.
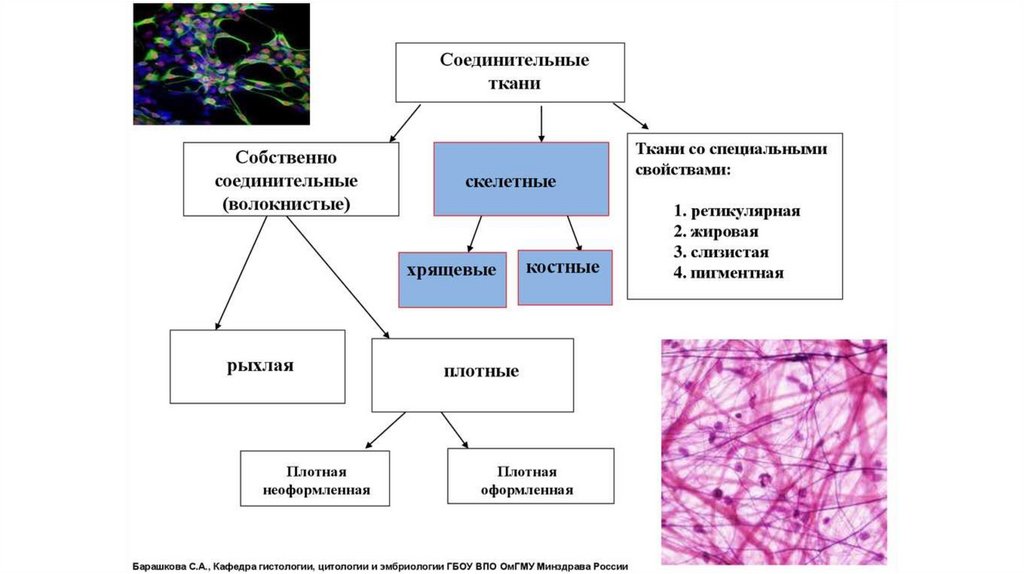
Биохимия межклеточного матриксасоединительной ткани
35.
Гистология соединительной ткани36.
37.
Соединительная ткань — это внеклеточный матрикс вместе склетками различного типа (фибробласты, хондробласты,
остеобласты, тучные клетки, макрофаги) и волокнистыми
структурами.
Межклеточный матрикс (ВКМ — внеклеточный матрикс)
представлен белками — коллагеном и эластином,
гликопротеидами и протеогликанами, гликозаминогликанами (ГАГ),
а также неколлагеновыми структурными белками —
фибронектином, ламинином и др.
38.
Коллаген39.
Коллаген – основной фибриллярный белок межклеточногоматрикса соединительной ткани.
Общим для всех коллагенов является наличие участков
последовательностью гли-про-х, где в качестве х присутствует
остаток какой-либо аминокислоты (ала, лиз и др.), а часть остатков
пролина и лизина гидроксилированы.
Пространственная структура коллагена представлена тремя
полипептидными цепями, закрученными вокруг общей оси. Такая
структура называется тропоколлаген. Формируя фибриллы,
молекулы тропоколлагена (тримеры) располагаются ступенчато,
смещаясь относительно друг друга на одну четверть длины, что
придает фибриллам характерную исчерченность
40.
41.
Типы коллагенаВсе типы коллагенов в зависимости от структуры делятся на следующие
группы:
1) фибриллообразующие;
2) ассоциированные с фибриллами коллагена;
3) сетевидные;
4) микрофибриллярные;
5) заякоренные фибриллы и другие.
Тип коллагена обозначается римскими цифрами. Более 90 % всего
коллагена высших организмов приходится на коллагены I, II, III и IV
типов.
42.
43.
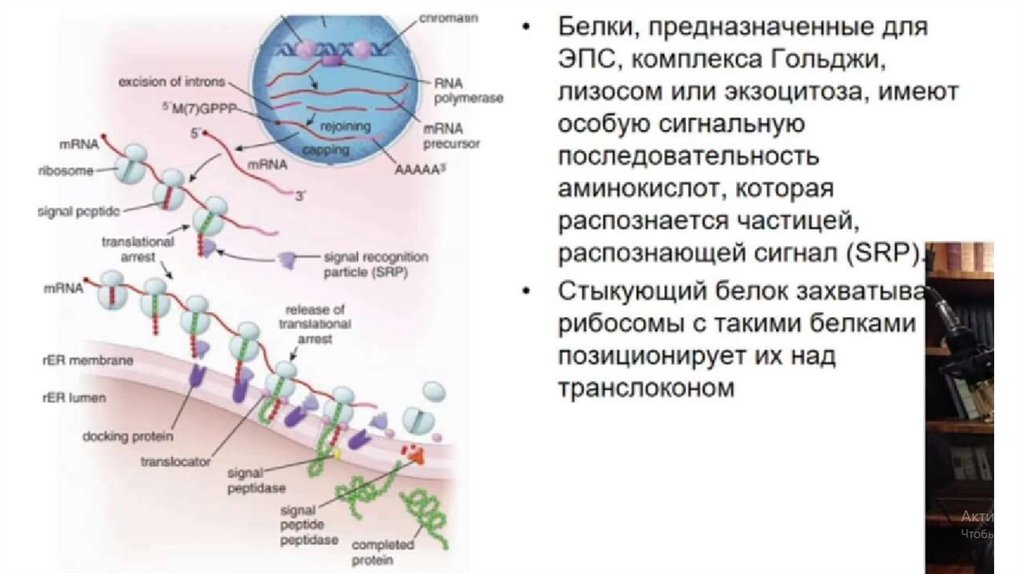
Синтез коллагенаНачальные стадии синтеза коллагена протекают в клетке,
заканчивается процесс в межклеточном матриксе.
Внутриклеточный этап включает синтез на рибосомах
преколлагеновых про-α-цепей, перемещение их в ЭПР, удаление
сигнального пептида, гидроксилирование остатков пролина и
лизина, гликозилирование и объединение трех про-α-цепей в
трехспиральную молекулу проколлагена.
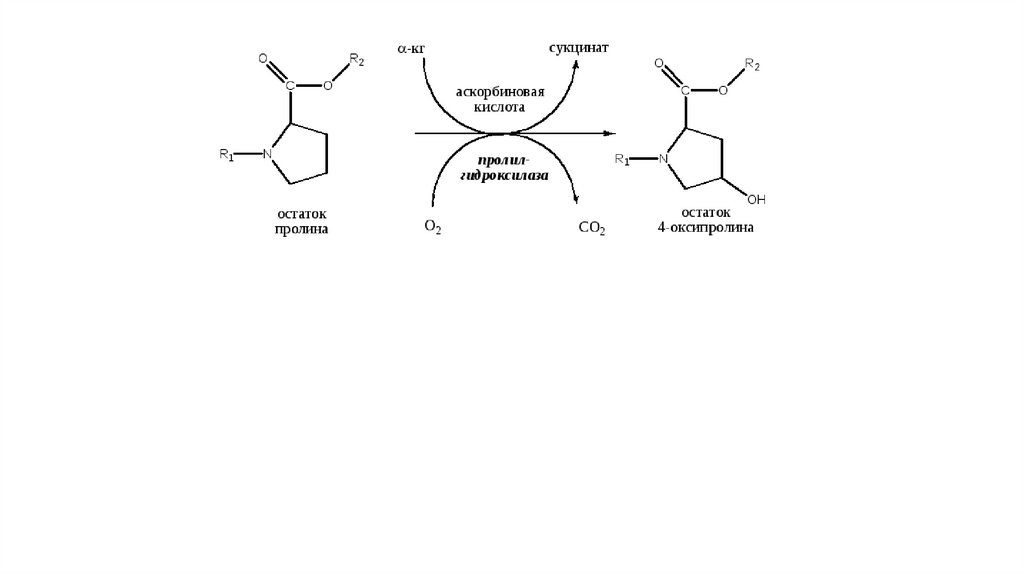
В гидроксилировании принимают участие ферменты пролил- и
лизил- гидроксилазы, кофакторами которых являются
аскорбиновая кислота и ионы Fe2+. Образовавшийся проколлаген
заключается в секреторные везикулы и выделяется в
межклеточный матрикс.
44.
45.
46.
47.
Внеклеточный этап начинается с отщепления концевых пептидовпептидазами от молекулы проколлагена. В результате образуются
молекулы тропоколлагена, которые готовы к самосборке
коллагеновых микрофибрилл.
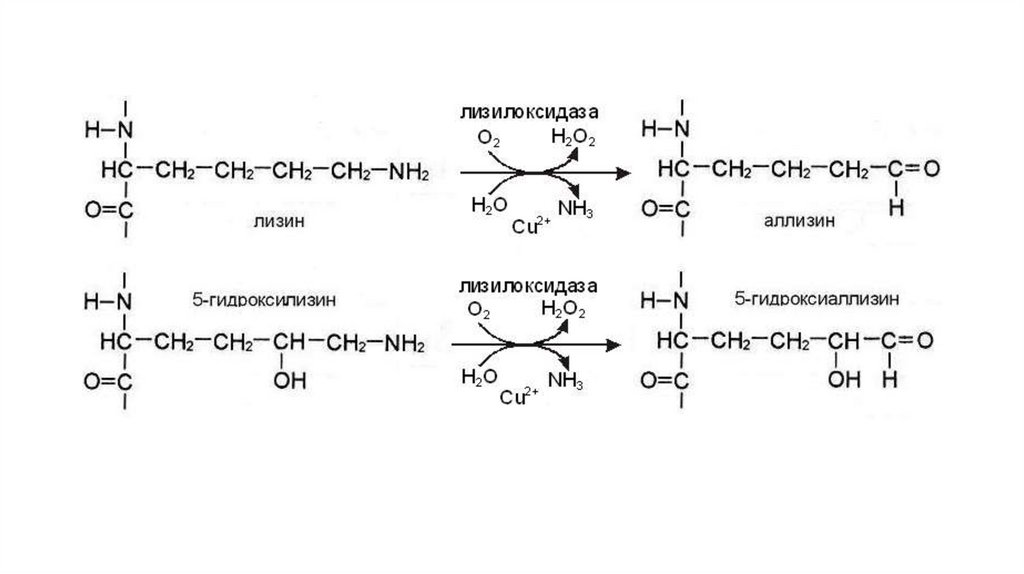
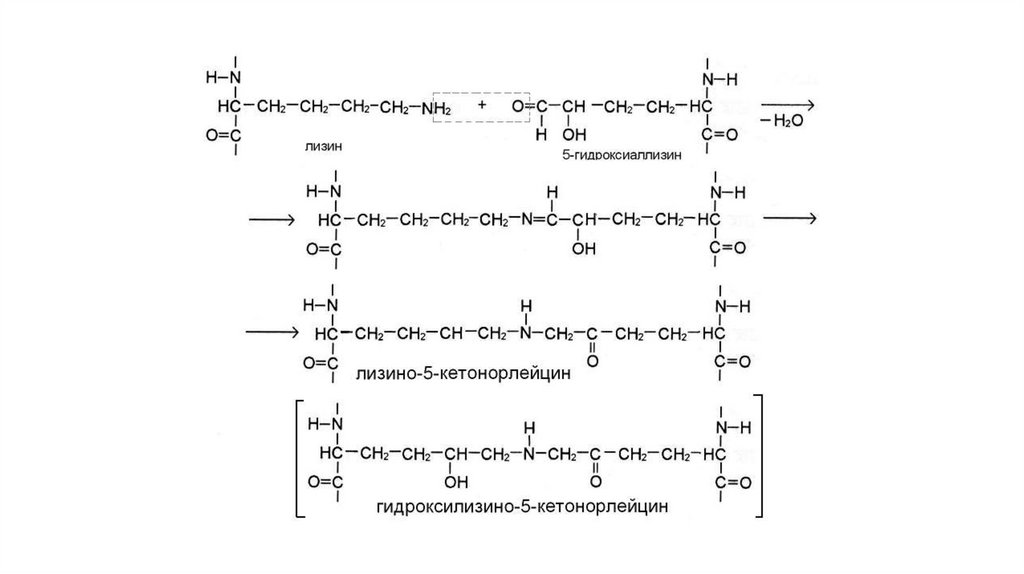
По ходу формирования микрофибрилл часть остатков лизина и
гидроксилизина подвергается окислительному
дезаминированию, что приводит к появлению альдегидных
аналогов – аллизина и 5- гидроксиаллизина. Эти остатки участвуют
в образовании межцепочечных ковалентных связей, за счет
которых между молекулами тропоколлагена происходит
образование сшивок. Микрофибрилла собирается в коллагеновую
фибриллу, коллагеновая фибрилла агрегируется в коллагеновое
волокно
48.
49.
50.
Гидролиз коллагенаГидролизуют молекулы коллагена преимущественно матриксные
металлопротеиназы (ММП) -1, -8, -13 (их ещё называют
коллагеназами), а также ММП-2 и ММП-9 (желатиназы).
Коллагеназы расщепляют пептидную связь в тройной
суперспирали, образованную остатками гли-лей или гли-илей в Сконцевой области нативного и денатурированного коллагена, а
желатиназы гидролизуют обычно отдельные α-цепи
Маркером распада коллагена является гидроксипролин в моче
51.
Эластин52.
Особенности строения и функции эластинаЭластин – фибриллярный белок соединительной ткани, который в
больших количествах присутствует в межклеточном веществе кожи,
легких, связок, стенок кровеносных сосудов. Именно эластин
обеспечивает резиноподобные свойства этих тканей.
Эластин - гликопротеин, содержащий около 27% глицина, 19%
аланина, 10% валина, 4,7% лейцина (нужно изобразить
полипептид). Наличие большого количества гидрофобных
радикалов препятствует созданию стабильной глобулы, в
результате полипептидные цепи эластина не формируют
регулярные вторичную и третичную структуры.
53.
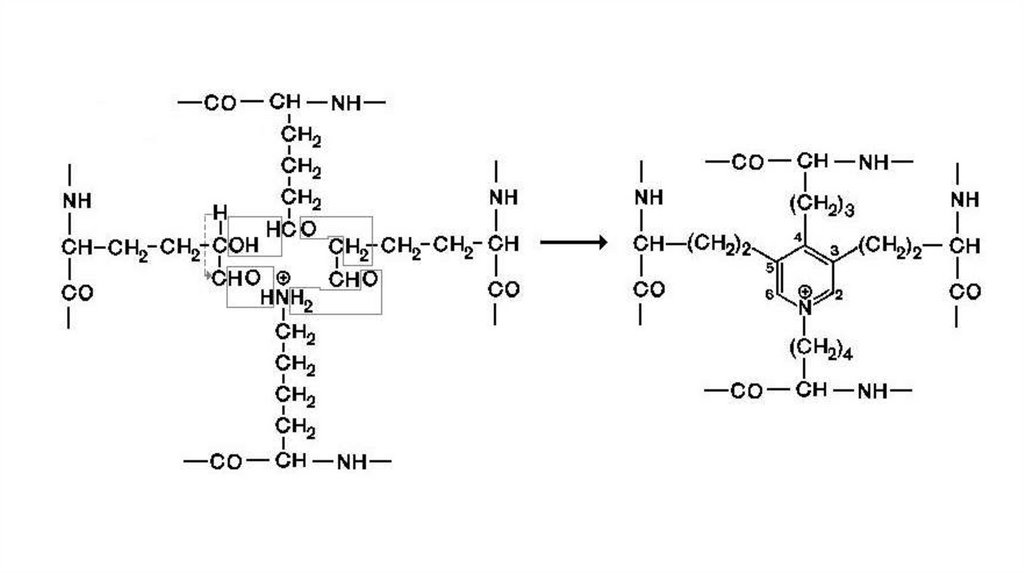
Нативные волокна эластина построены из относительнонебольших, почти сферических молекул, соединенных в
волокнистые тяжи с помощью жёстких поперечных сшивок –
десмозина и изодесмозина, а также лизиннорлейцина. В
образовании этих поперечных сшивок участвуют 4 остатка лизина,
3 из которых предварительно окисляются до соответствующих
альдегидов при участии лизилоксидазы.
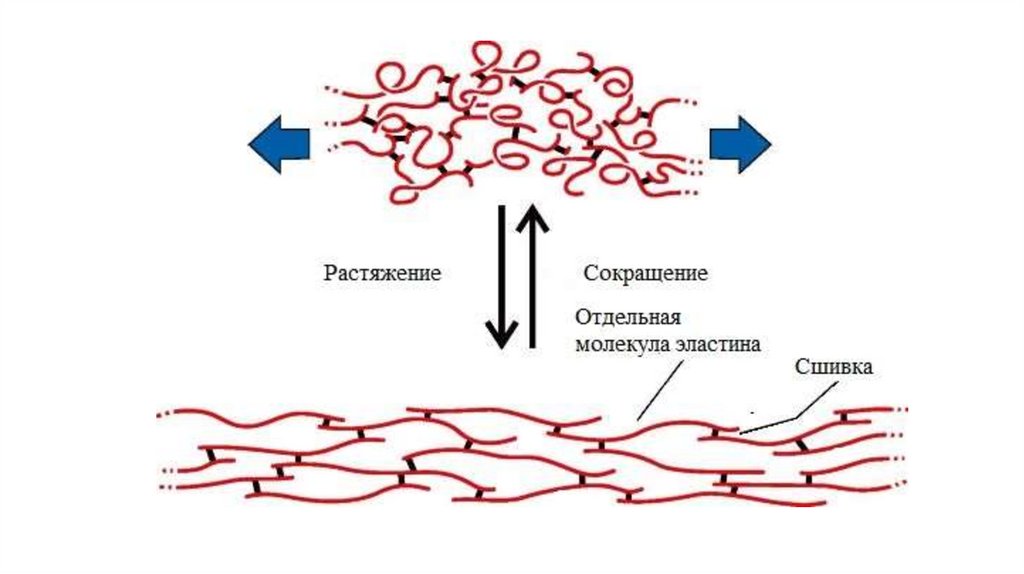
Способность эластина растягиваться и сжиматься объясняется тем,
что при нагрузке гидрофобные взаимодействия, поддерживающие
пространственную структуру молекулы, легко разрушаются, а затем
восстанавливаются. Ковалентные сшивки при этом удерживают
структуру от разрыва.
54.
55.
56.
Гликозаминогликаны и протеогликаны57.
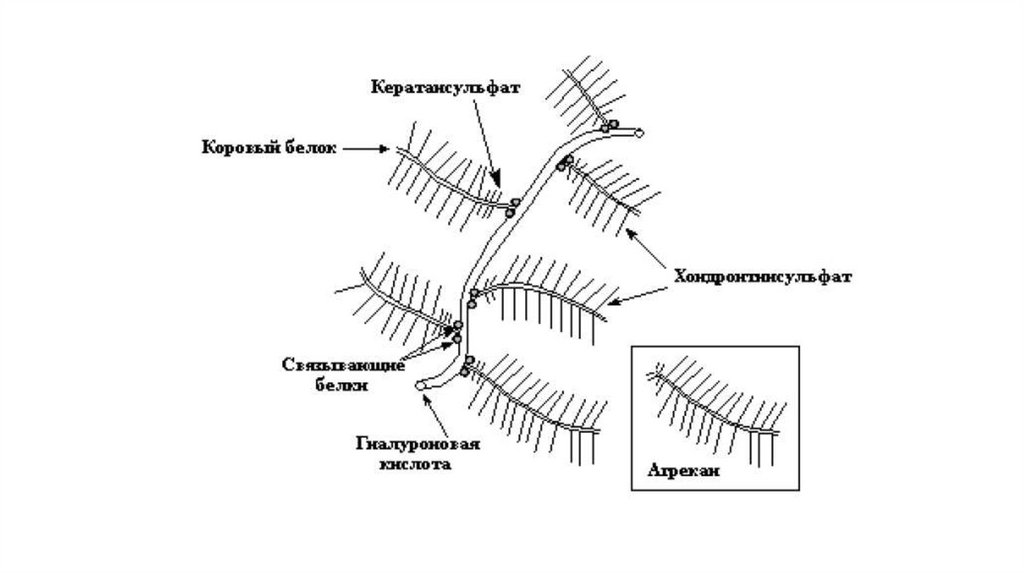
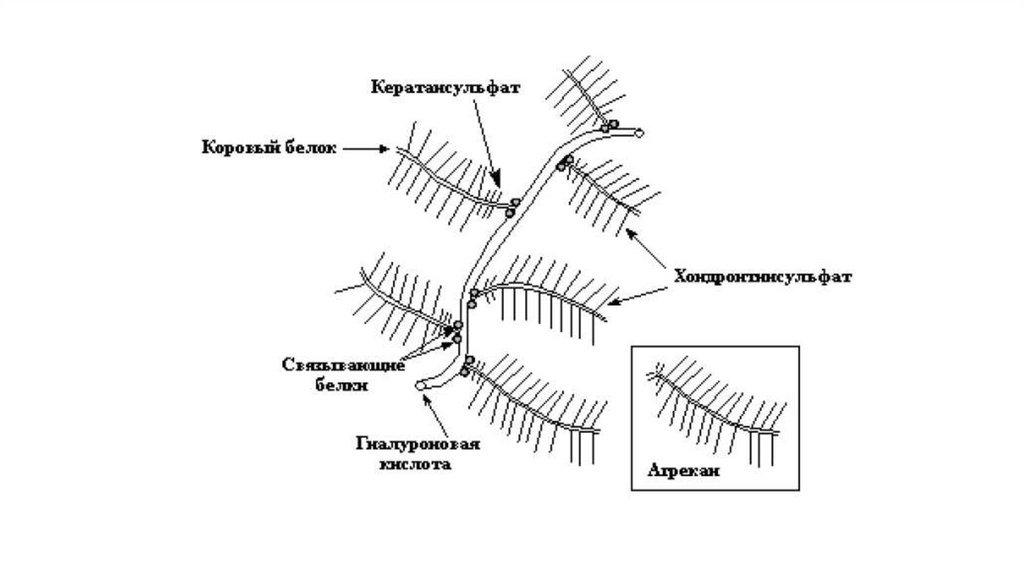
Протеогликаны – это семейство сложных макромолекул,состоящих из белкового компонента (кора) и ковалентно
присоединённых к нему через N- и О-гликозидные связи
углеводных цепей – сульфатированных гликозаминогликанов.
Протеогликаны являются структурными белками; выполняют роль
рецепторов при сборке межклеточного матрикса; облегчают
адгезию клеток; регулируют процессы роста и дифференцировки
клеток.
58.
59.
Гликозаминогликаны - углеводная часть протеогликанов. Онисостоят из повторяющихся дисахаридных единиц, включающих,
как правило, уроновую кислоту и гексозамин. Наличие в
гликозаминогликанах сульфатных и карбоксильных групп придает
им большой отрицательный заряд, что позволяет им связывать
воду, катионы кальция, натрия, калия.
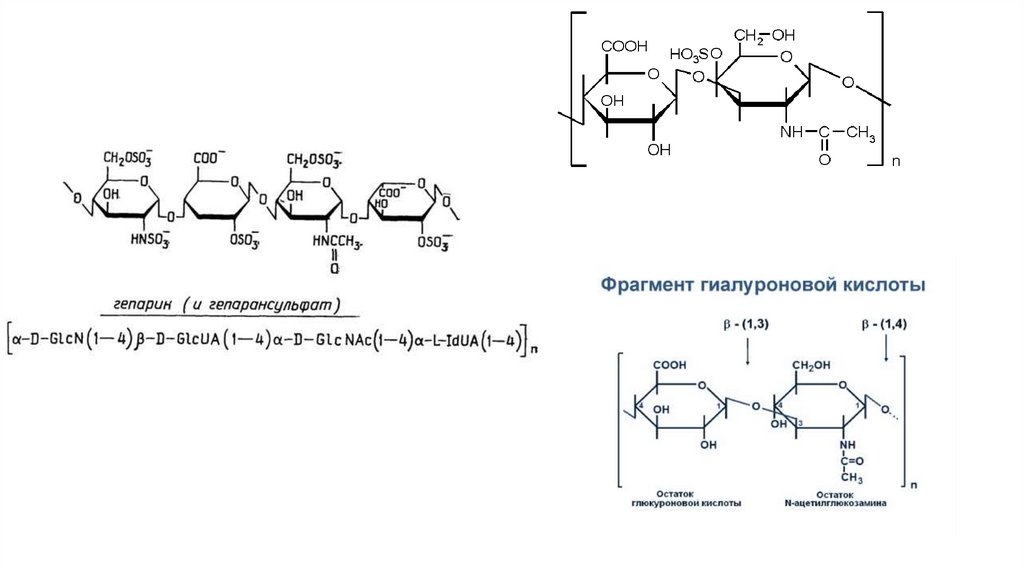
К гликозаминогликанам относят гиалуроновую кислоту,
гепарансульфат, хондроитинсульфаты, (в зависимости от
положения сульфатной группы различают хондроитин-4-сульфат и
хондроитин-6-сульфат), дерматансульфат, кератансульфаты.
60.
61.
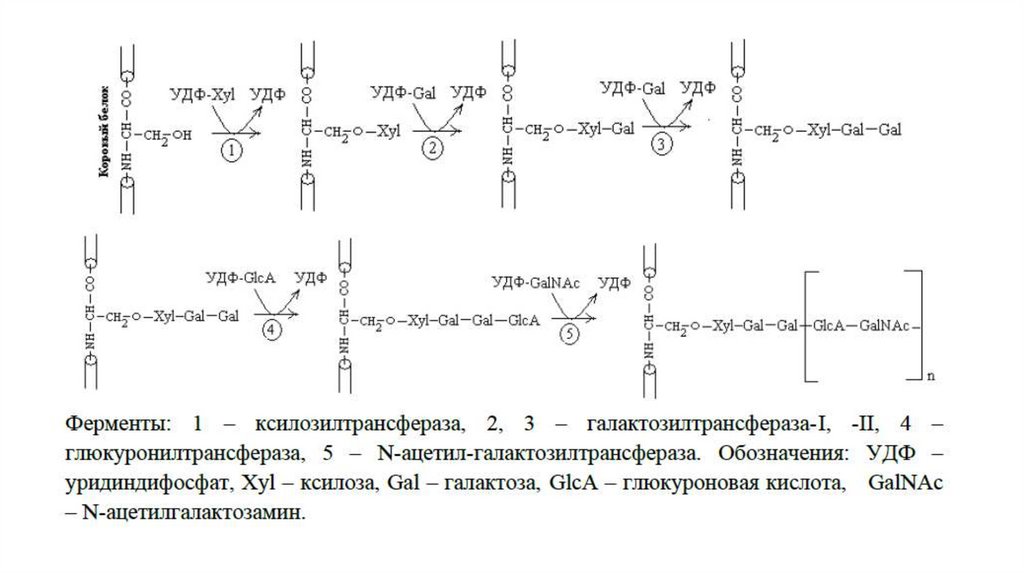
Синтез протеогликанаСинтез протеогликана начинается с биосинтеза корового белка на
полирибосомах. Синтезированный белок транспортируется в
аппарат Гольджи, где происходит его гликозилирование. Процесс
гликозилирования начинается с присоединения к серину через О–
гликозидную связь «связующего трисахарида» ксилоза-галактозагалактоза. Углеводы присоединяются с помощью соответствующих
гликозилтрансфераз, а их источником являются УДФ-производные.
Окончательной реакцией синтеза цепи хондроитинсульфата
является сульфатирование. Донором сульфатной группы выступает
3'-фосфоаденозин-5'-фосфосульфат (ФАФС).
62.
63.
64.
Роль гиалуроновой кислоты в организациимежклеточного матрикса.
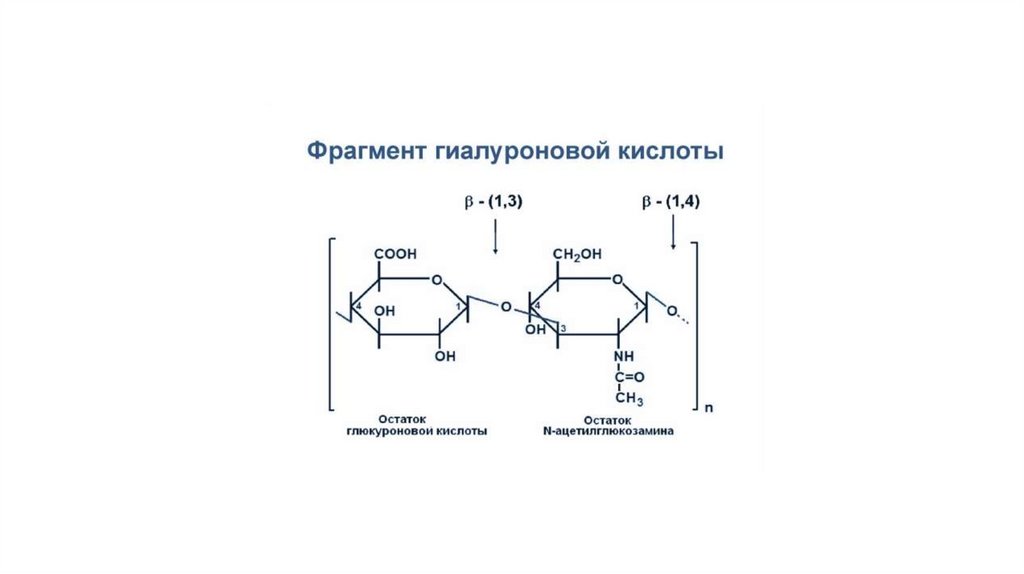
Гиалуроновая кислота – это несульфатированный глюкозаминогликан. В
свободном виде она присутствует в стекловидном теле глаза, пупочном
канатике, суставной жидкости, а в хряще входит в состав
протеогликановых агрегатов.
Гиалуроновая кислота является связывающей молекулой. К ней
присоединяются до сотни отрицательно заряженных протеогликанов.
В суставной жидкости гиалуроновая кислота играет роль смазочного
вещества, уменьшая трение между суставными поверхностями. В
процессе развития эмбриона, заполняя межклеточные пространства,
она облегчает перемещение клеток. Гиалуроновая кислота
синтезируется в больших количествах при заживлении ран.
65.
66.
Деградация протеогликановВ деградации протеогликанов участвуют протеиназы, гликозидазы
и сульфатазы. Распад протеогликанов начинается в межклеточном
матриксе с гидролиза корового белка матриксными
металлопротеиназами. Из внеклеточного пространства путем
эндоцитоза гликозаминогликаны поступают в клетку, где
эндоцитозные пузырьки сливаются с лизосомами. Лизосомальные
гликозидазы гидролизуют цепи гликозаминогликанов и
олигосахаридов до мономеров.
67.
Адгезивные белки межклеточногоматрикса
68.
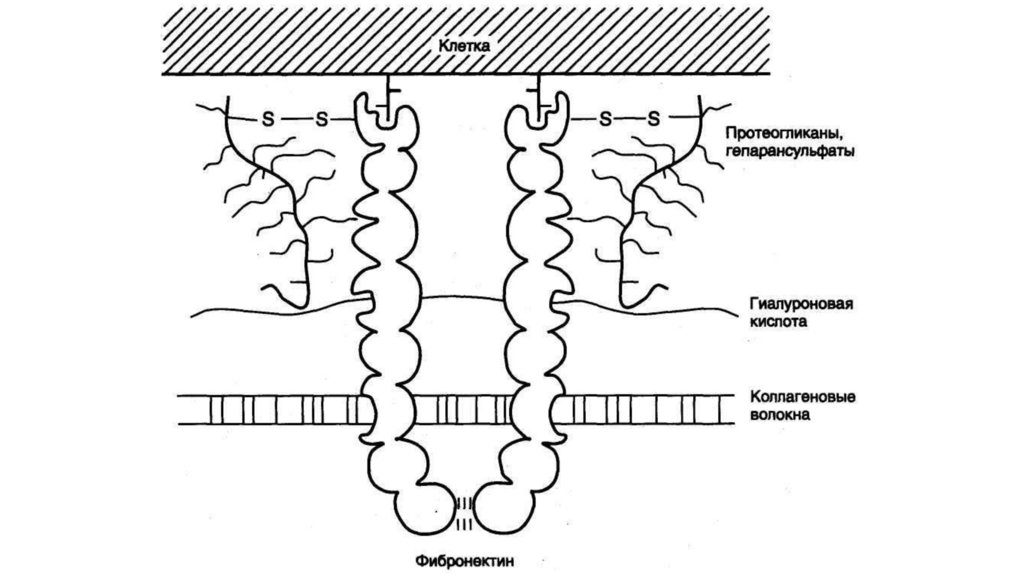
Белки адгезии (от лат. adhaesio — прилипание) обеспечиваютсклеивание клеток и компонентов межклеточного матрикса. В
соединительной ткани присутствуют следующие адгезивные белки:
фибронектин, ламинин, интегрины, нидоген, витронектин и др.
69.
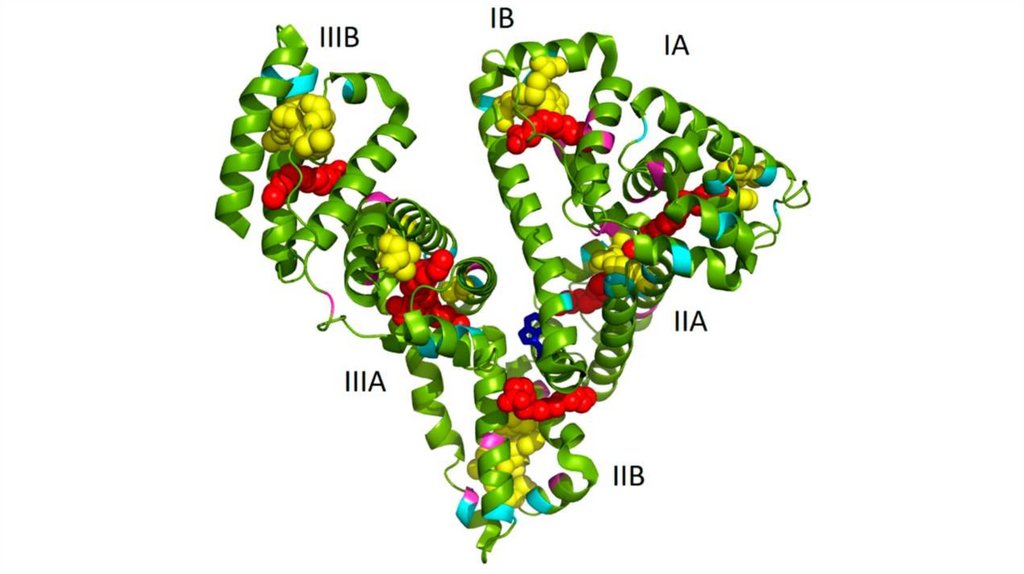
ФибронектинФибронектин является основным адгезивным гликопротеином
соединительной ткани. Его молекула состоит из 2-х сходных
субъединиц, соединённых двумя дисульфидными связями в Сконцевой области. Каждая субъединица представлена доменами,
которые являются центрами узнавания различных макромолекул
межклеточного матрикса.
Фибринонектин содержит последовательность Арг-Гли-Асп (RGD)
(нужно нарисовать) c помощью которой он может присоединятся к
клеточным рецепторам и передавать информацию как внутрь, так
и наружу клеток.
70.
71.
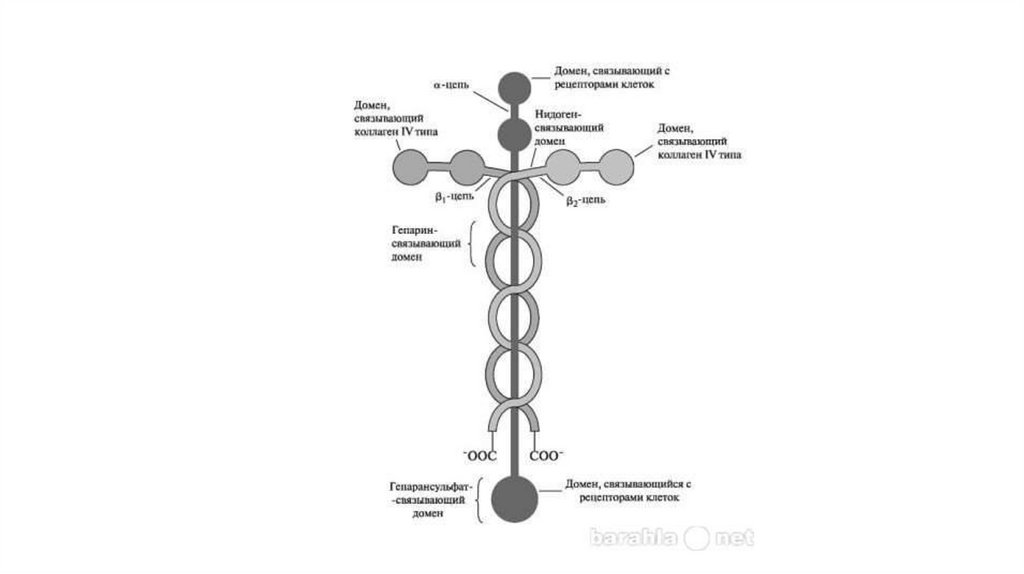
ЛамининыЛаминины также относятся к семейству адгезивных
гликопротеинов. Молекула ламинина представляет собой большой
гибкий комплекс, состоящий из длинных α, β1, β2 полипептидных
цепей, ассоциированных в форме асимметричного креста и
удерживаемых вместе при помощи дисульфидных связей.
Каждая цепь содержит несколько функциональных доменов,
способных связываться с коллагеном IV типа, гепарансульфатом,
нидогеном и рецепторами на клеточной поверхности. Ламинины
склеивают эпителиальные клетки с базальной мембраной.
Связывается с клетками так же RGD рецептором
72.
73.
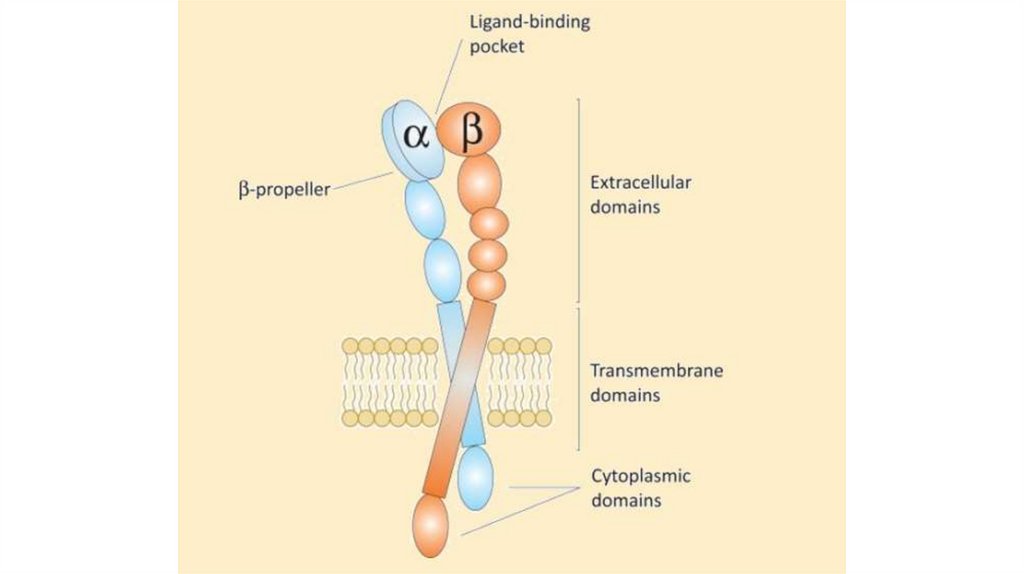
ИнтегриныИнтегрины – это группа белковых рецепторов на плазматической
мембране многих эукариотических клеток, которые участвуют в
адгезии (т. е. прилипании) клеток друг к другу и к поверхностям.
Все интегрины состоят из двух полипептидных цепей – α и β,
соединенных нековалентными связями. Интегрины имеют
большую внеклеточную часть, обращенную наружу,
трансмембранную часть, пронизывающую клеточную мембрану, и
цитоплазматические «хвостики», обращенные в цитозоль.
Интегрины могут взаимодействовать с фибронектином и
витронектином.
Белки межклеточного матрикса взаимодействуют с интегринами с
помощью RGD последовательности













































 biology
biology