Similar presentations:
Азотная кислота
1.
- Это вещество было описано арабским химиком в VIIIвеке Джабиром ибн Хайяном (Гебер) в его труде
«Ямщик мудрости», а с ХV века это вещество
добывалось для производственных целей.
- Благодаря этому веществу русский учёный В.Ф.
Петрушевский в 1866 году впервые получил динамит.
- Это вещество – прародитель большинства взрывчатых
веществ (например, тротила, или тола).
- Это вещество является компонентом ракетного
топлива, его использовали для двигателя первого в
мире советского реактивного самолёта БИ – 1.
- Это вещество в смеси с соляной кислотой растворяет
платину и золото, признанное «царём» металлов. Сама
смесь, состоящая из 1-ого объёма этого вещества и 3-ёх
объёмов соляной кислоты, называется «царской
водкой».
2. НЕМНОГО ИСТОРИИ
Монах-алхимик Бонавентура в 1270 году впоисках универсального растворителя
«алкагеста» решил нагреть смесь железного
купороса с селитрой. Сосуд, в котором была
смесь, вскоре наполнился красно-бурым
«дымом». Монах в изумлении застыл, затем
убрал огонь и увидел, как в колбу-приемник
стала капать желтоватая жидкость. Она
действовала на все металлы, даже на серебро и
ртуть. Алхимики думали, что сидящий в
жидкости рыжий дым является демоном,
управляющим одной из стихий природы –
водой. Поэтому желтоватую жидкость
называли «крепкой водой» или «крепкой
водкой». Это название сохранилось до времен
М. В. Ломоносова.
3.
4.
HNO3 – азотная кислотаФизические свойства
1. Молярная масса 63,016 г/моль
2. Бесцветная жидкость с резким запахом, «дымит» на
воздухе, Т кип. = 86
3. Хорошо растворима в воде (сильная одноосновная
кислота)
4. Молекула имеет
плоскую структуру
5.Валентность (N)=IV
6. Степень окисления (N)=+5
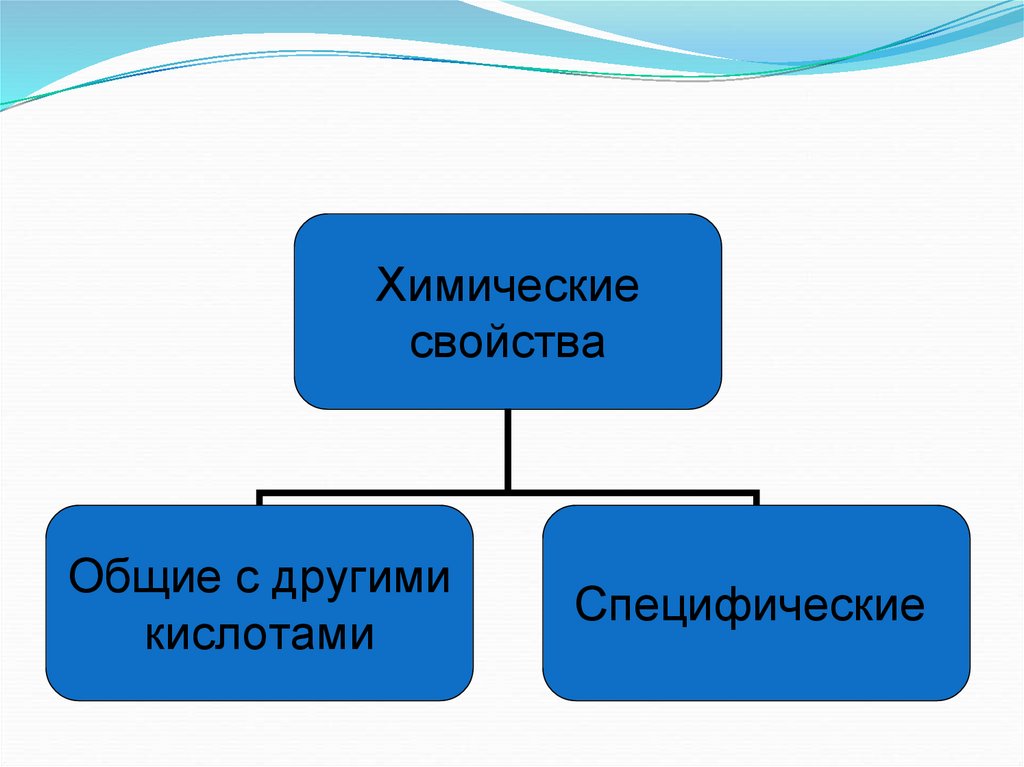
5. HNO3 – азотная кислота
Химическиесвойства
Общие с другими
кислотами
Специфические
6.
Общие с другими кислотами1) Изменяет цвет индикаторов (диссоциация)
HNO3
2) Взаимодействие с основными и
амфотерными оксидами
CuO + HNO3
3) Взаимодействие с основаниями и аммиаком
KOH + HNO3
NH3 + HNO3
4) Взаимодействие с солями
Na2CO3+ HNO3
7. Общие с другими кислотами
Специфические свойства азотнойкислоты
1. Разлагается при нагревании
4HNO3 = 4NO2 + O2+ 2H2O
2. взаимодействует с металлами
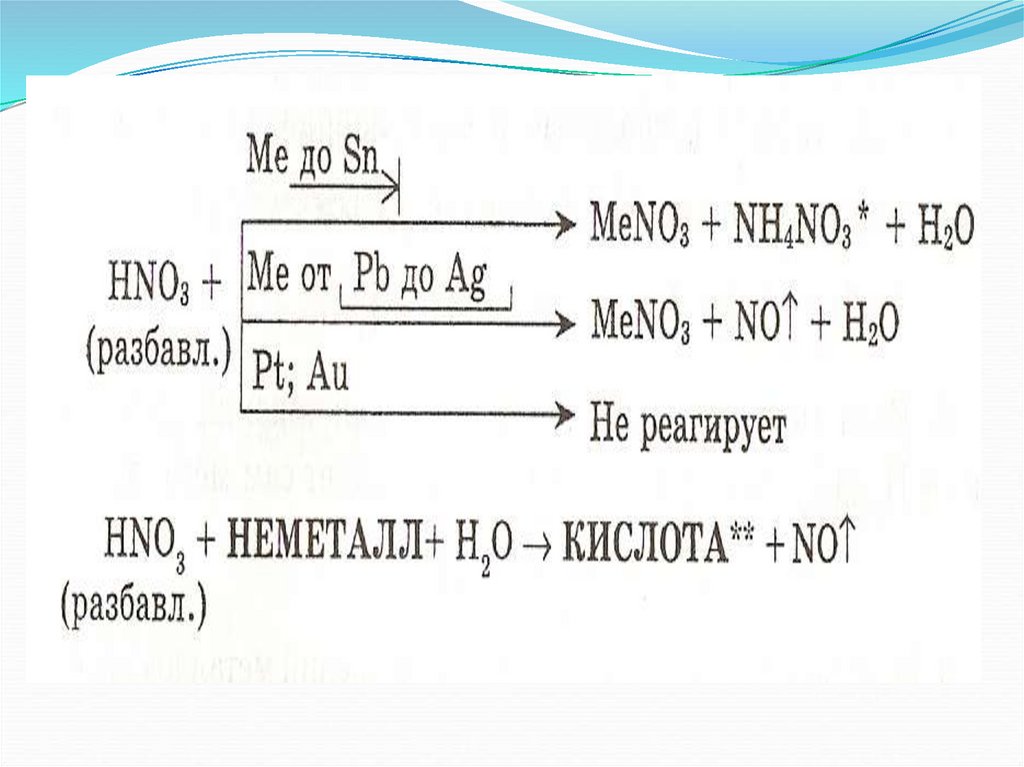
ЗАПОМНИ!
При взаимодействии азотной кислоты
любой концентрации с металлами водород
никогда не выделяется. Продукты зависят от
металла и концентрации кислоты.
8. Специфические свойства азотной кислоты
Разбавленная9. Разбавленная
Концентрированная10. Концентрированная
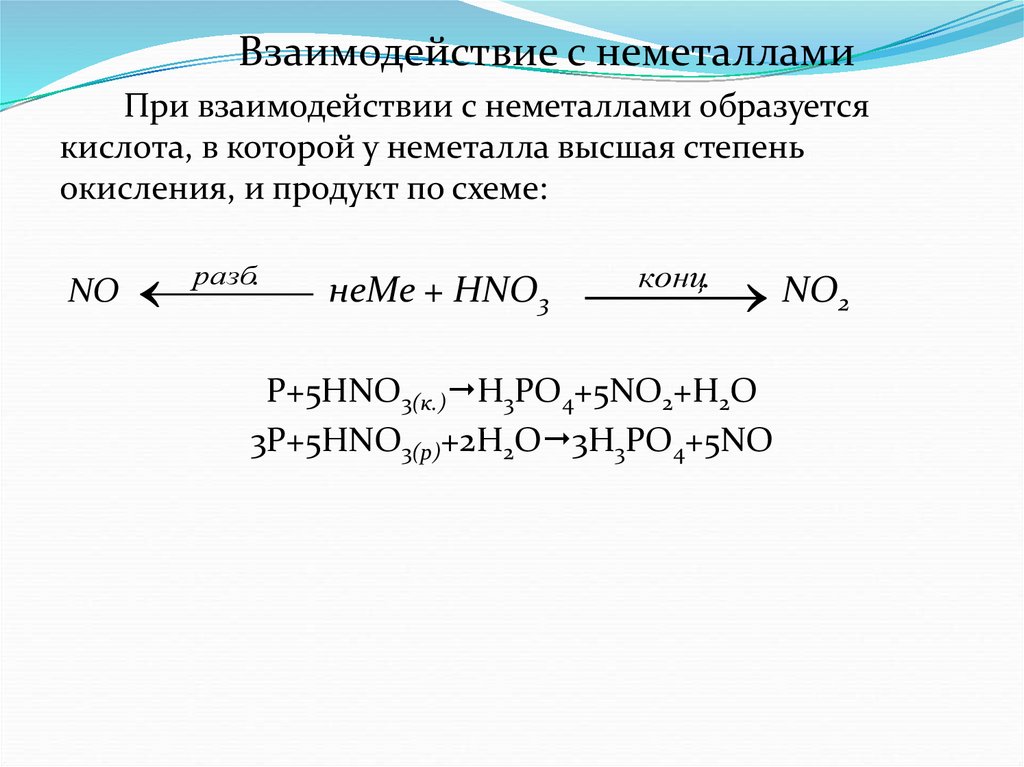
Взаимодействие с неметалламиПри взаимодействии с неметаллами образуется
кислота, в которой у неметалла высшая степень
окисления, и продукт по схеме:
разб.
NO
неMe + HNO3
NO2
конц.
P+5HNO3(к.) H3PO4+5NO2+H2O
3P+5HNO3(р)+2H2O 3H3PO4+5NO
11.
Действие на органическиевещества
Белки при взаимодействии с конц.азотной
кислотой разрушаются и приобретают жёлтую
окраску .
Под действием азотной кислоты воспламеняются
бумага, масло, древесина, уголь.
12. Действие на органические вещества
Смесь концентрированных азотной исоляной кислот (соотношение по объему 1 :3)
называется царской водкой; она растворяет
даже благородные металлы.
Смесь HNO3 концентрации 100% и H2SO4
концентрации 96% при их соотношении по
объему 9:1 называют меланжем.
13. Смесь концентрированных азотной и соляной кислот (соотношение по объему 1 :3) называется царской водкой; она растворяет даже
ПрименениеМинеральные
удобрения
Взрывчатые
вещества
Лекарства
HNO3
Ракетное
топливо
Пластмассы
14
14.
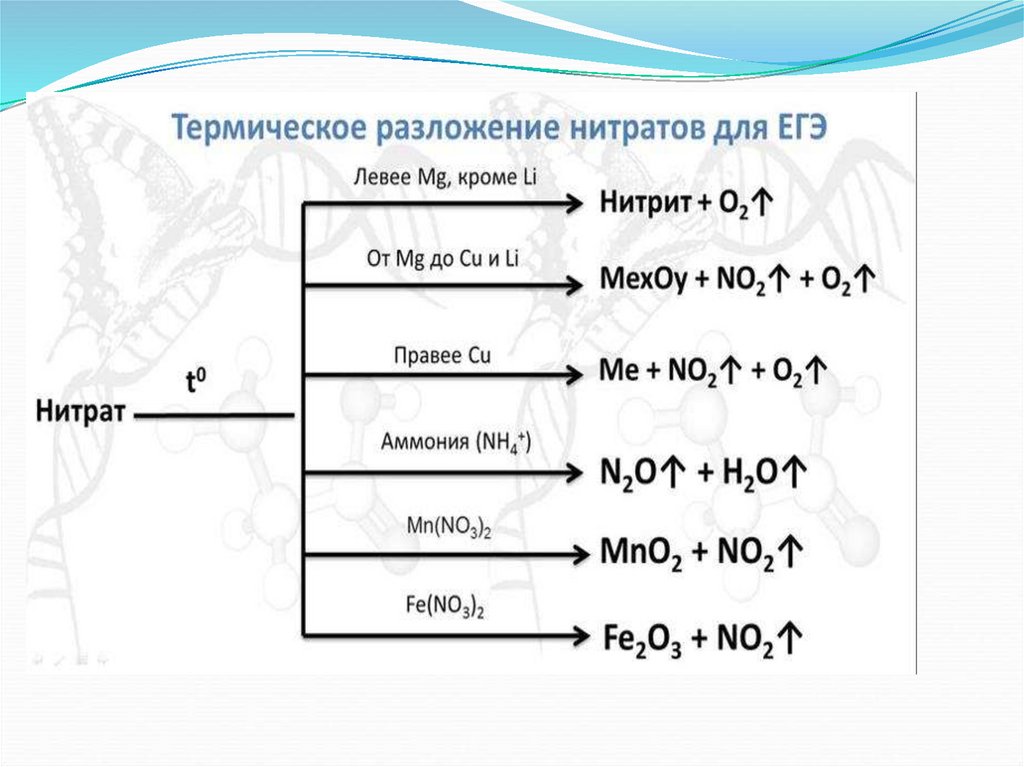
15. Соли азотной кислоты
Номенклатура солейНитраты : Ba(NO₃)₂ , AgNO₃ , Zn(NO₃)₂ , NaNO₃
Селитры : NaNO₃ , KNO₃ , Ca(NO₃)₂ , NH₄NO₃
16. Номенклатура солей
Химические свойства , общие с другими солямиЭлектролиты
Реакции
с кислотами Ba(NO₃)₂ + H₂SO₄
со щелочами Fe(NO₃)₃ + NaOH
с солями AgNO₃ + BaCl₂
с металлами Cu(NO₃)₂ + Fe
17. Химические свойства , общие с другими солями
18.
Домашнее задание§ 27,28 стр 95 № 2,5,7 (расставить
коэффициенты методом электронного
баланса), тест














 chemistry
chemistry








