Similar presentations:
Основы молекулярно-кинетической теории
1. Тема: Основы молекулярно – кинетической теории
Учитель:Абдуллаева Алла Витальевна
г. Калининград
ММЦ 74212
2. Цель урока: Рассмотреть, изучить основы молекулярно – кинетической теории строения вещества.
Сформулировать основные положения МКТ,раскрыть их сущность и их опытное
обоснование.
Сформировать понятия количество
вещества,моль,молярная масса,число
Авогадро.
Развивать коммуникативность, логическое
мышление,умение делать выводы.
ММЦ 74212
3. Эпиграф:
О, физика – наука из наук!Все впереди!
Как мало за плечами!
Пусть химия нам будет вместо
рук.
Пусть станет математика очами.
Не разлучайте этих трех сестер
Познания всего в подлунном
мире,
Тогда лишь будет ум и глаз остер
И знанье человеческое шире.
(отрывок из поэмы М. Алигер
“Ленинские горы”)
4.
Слово синквейн происходит от французского " пять".Это стихотворение из пяти строк, которое строится
по правилам.
1. В первой строчке тема называется одним словом (обычно
существительным).
2. Вторая строчка - это описание темы в двух словах (двумя
прилагательными).
3. Третья строчка - это описание действия в рамках этой темы тремя
словами.
4. Четвертая строка - это фраза из четырех слов, показывающая
отношение к теме.
5. Последняя строка - это синоним из одного слова, который повторяет
суть темы.
Как это делать:
Название (обычно существительное)___________________________
Описание (обычно прилагательное)____________________________
Действия___________________________________________________
Чувство (фраза)_____________________________________________
Повторение сути____________________________________________
5. Если следовать правилам, может получиться, например, такой синквейн:
Например:•Учитель.
Душевный, открытый.
Любящий, ищущий, думающий.
Много идей - мало времени.
Призвание.
•Или
•Учитель.
Суетливый, крикливый.
Объясняет, объясняет и ждет.
Когда окончится эта пытка?
Бедолага!
6. Молекула
1. В первой строчке тема называется одним словом (обычносуществительным).
2. Вторая строчка - это описание темы в двух словах (двумя
прилагательными).
3. Третья строчка - это описание действия в рамках этой темы
тремя словами.
4. Четвертая строка - это фраза из четырех слов, показывающая
отношение к теме.
5. Последняя строка - это синоним из одного слова, который
повторяет суть темы.
Как это делать:
Название (обычно существительное)___________________________
Описание (обычно прилагательное)____________________________
Действия___________________________________________________
Чувство (фраза)_____________________________________________
Повторение сути____________________________________________
7.
Определение молекулярнокинетической теорииТеория, объясняющая тепловые свойства
макроскопических тел на основе представления об их
атомно-молекулярном строении, называется
молекулярно-кинетической теорией (МКТ)или просто
молекулярной физикой
8. Агрегатные состояния вещества
Твердые;Жидкие;
Газообразные;
Плазма;
Атомарное вещество.
9. Газы
Размеры между молекулами гораздо
больше размеров самих молекул.
Силы притяжения слабые, поэтому
газы могут неограниченно
расширяться.
Не сохраняют ни форму ни объем.
10. Жидкости
Молекулы находятсянепосредственно друг возле друга.
Обладают плохой сжимаемостью.
Жидкости текучи, т.е. не
сохраняют своей формы.
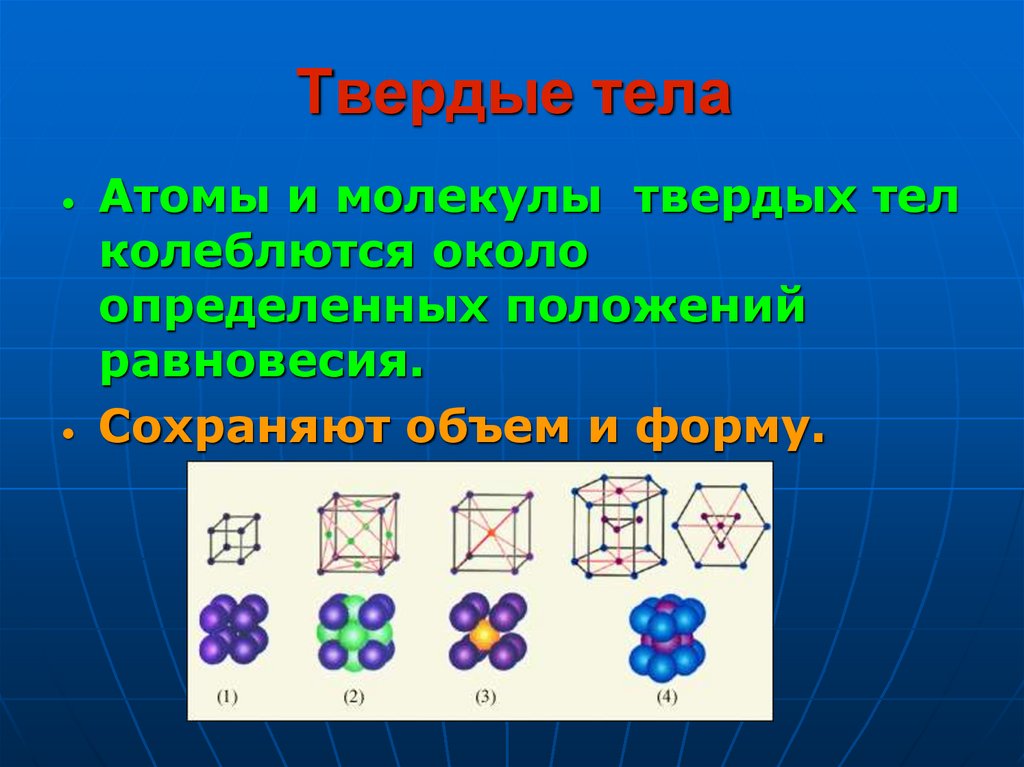
11. Твердые тела
Атомы и молекулы твердых телколеблются около
определенных положений
равновесия.
• Сохраняют объем и форму.
12. Доказательства первого положения МКТ
1.2.
Электронный
микроскоп
Ионный проектор
13.
Доказательства второгоположения МКТ
Диффузия –
самопроизвольное
перемешивание
соприкасающихся веществ.
Броуновское движение тепловое движение
взвешенных в жидкости или
газе частиц
Роберт Броун
14.
Доказательства третьегоположения МКТ
Опыт со свинцовыми цилиндрами и др.
Три агрегатных состояния вещества:
твердое, жидкое, газ. Состояние
вещества определяется соотношением
между потенциальной и кинетической
энергиями молекул тела.
15.
Оценим размер молекул.Какие измерения необходимо произвести, чтобы вычислить размеры
молекулы?
1. Измерить объем капли.
V = 1 мм3 = 0,001 см3
2. Измерить площадь пленки.
Как вычислить размер молекул?
S = 0,6 м2 = 6000 см2
0,001 см 3
7
1
,
7
10
см
2
6000 см
Подсчитаем приблизительное число молекул в капле воды массой 1 г и,
следовательно, объемом 1 см3.
V
d
S
d H 2O 3 10 8 см VH 2O (3 10 8 ) 3 cм – при плотной упаковке молекул
1 см3
22
N
3
,
7
10
(3 10 8 ) 3 см3
16. Относительная молекулярная масса
m0
Mr
1
m
0C
12
17.
Показывает числоструктурных частиц в 1
моль вещества
Число
Авогадро
Обозначается NА
Измеряется в моль
-1
Имеет числовое 23
значение 6,02 · 10
18.
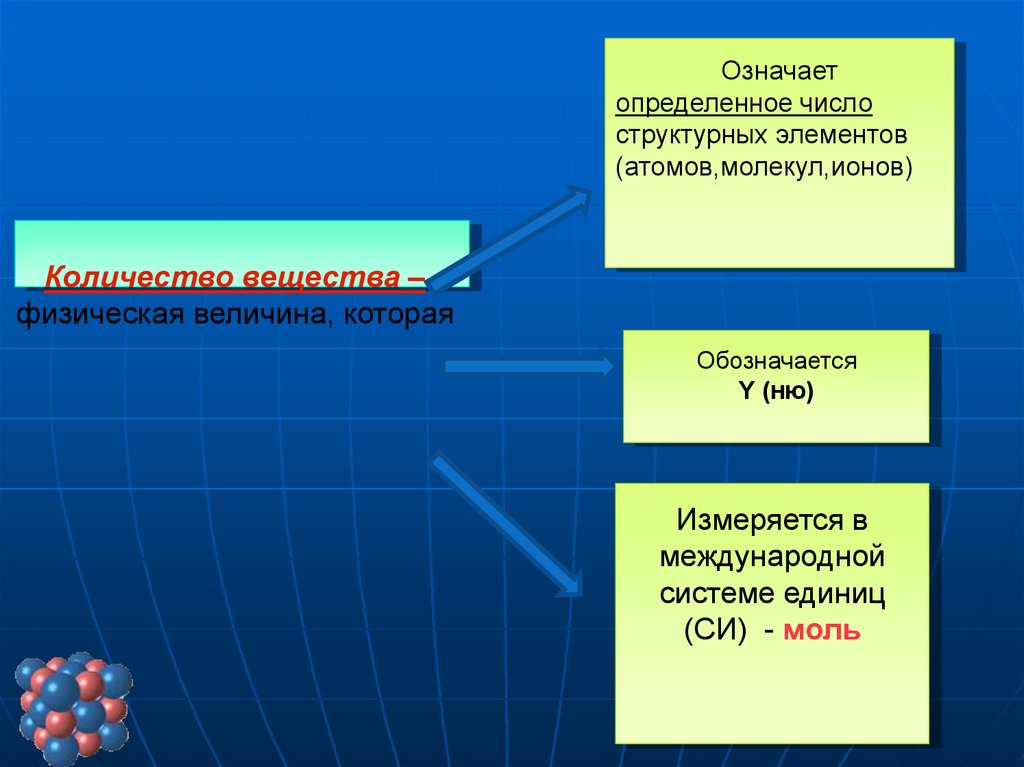
Означаетопределенное число
структурных элементов
(атомов,молекул,ионов)
Количество вещества –
физическая величина, которая
Обозначается
Υ (ню)
Измеряется в
международной
системе единиц
(СИ) - моль
19.
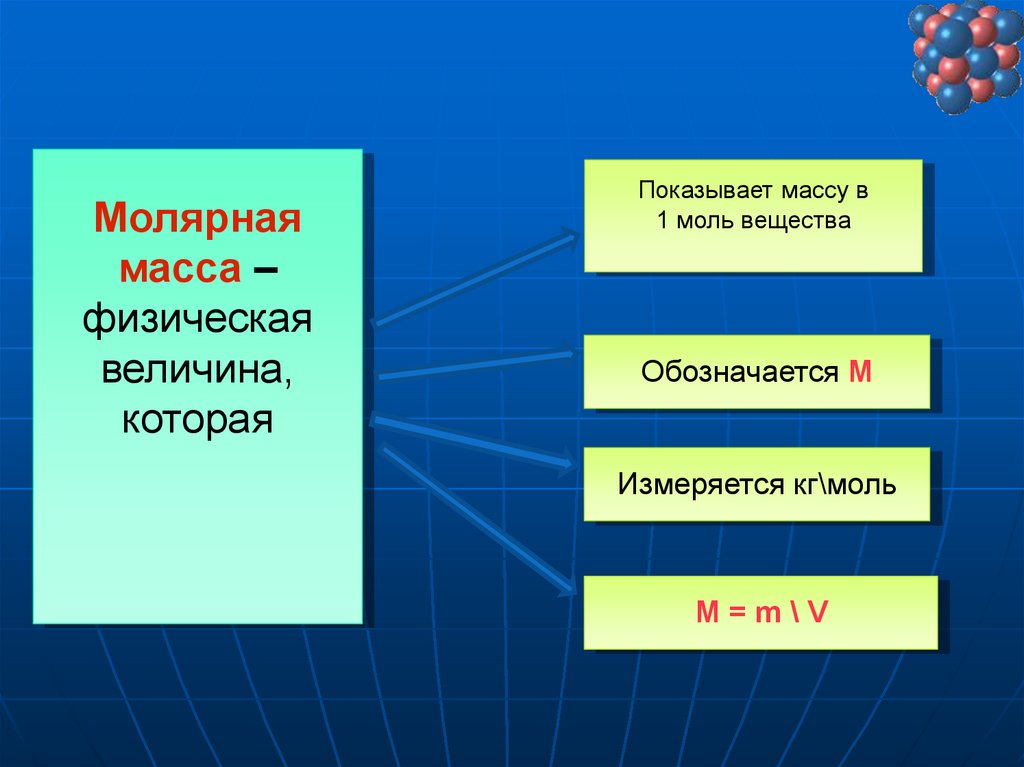
Молярнаямасса –
физическая
величина,
которая
Показывает массу в
1 моль вещества
Обозначается М
Измеряется кг\моль
М=m\V
20. Задание:
Используя учебник, найти формулы иопределения данных понятий.
Количество вещества
•Относительная молекулярная масса
•Молярная масса
•Постоянная Авогадро
Записать их в тетрадь
•Записать каждую величину,
обозначение, единицы измерения
21. Количество вещества
• Количествовещества:
N
NA
• Молярная масса:
или
M m0NA
3
M 10 M
r
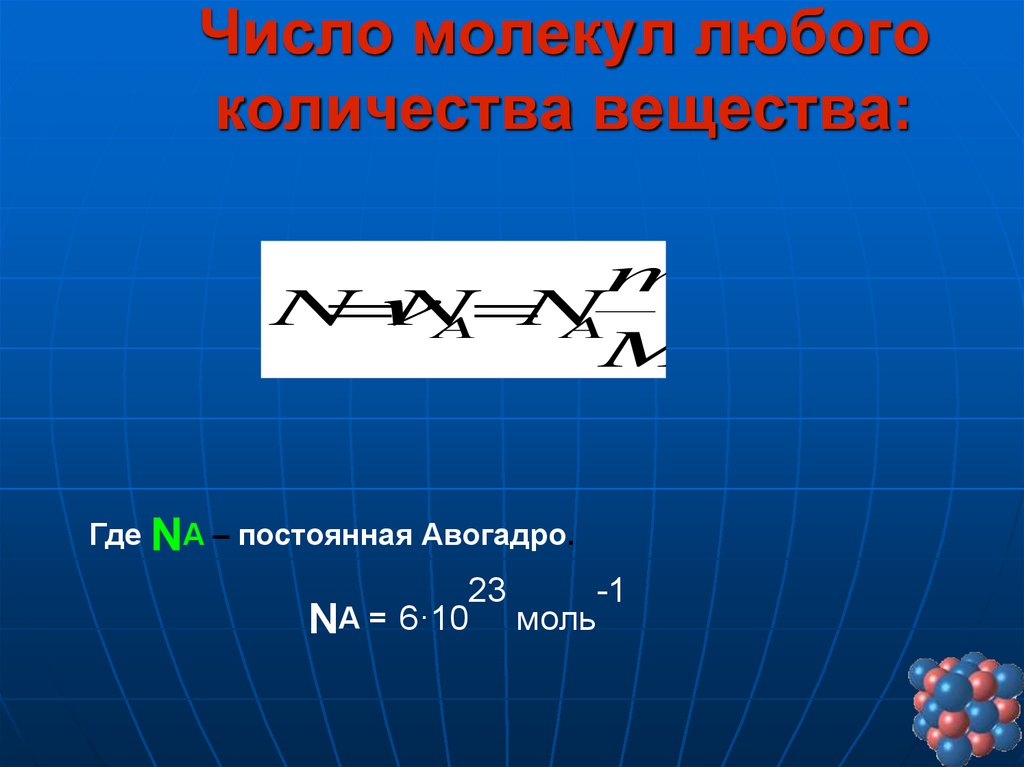
22. Число молекул любого количества вещества:
mN
N
N
A
A
M
Где NA – постоянная Авогадро.
23
-1
NА = 6·10 моль
23. Задача №1
На левой чашке рычажныхвесов лежит порошок
железа массой 11,2 грамма,
на правой – такой же
порошок количеством
вещества 0,2 моль.
Определите положение
весов.
А. Перетягивает левая чашка
Б. Перетягивает правая
чашка
В. Весы в состоянии
равновесия
24.
Таблица расчетовНазван
ие
вещест
ва
Масса
вещест
ва
Молек
ул
масса
Моляр
ная
масса
Объе
м
веще
ства
Плотнос
ть
веществ
а
Вычис
ления
Вывод
25.
Карта исследования № 1 по темеОборудование: весы с разновесами.
Вещества: сахар – рафинад.
Порядок выполнения работы:
Вспомните правила взвешивания
В таблице расчетов запишите молекулярную формулу
сахара, если известно, что в состав молекулы входят
двенадцать атомов углерода, двадцать два атома водорода,
одиннадцать атомов кислорода.
Подсчитайте ее молекулярную массу и результат запишите
в таблицу.
На весах взвесьте кусочек рафинада, сделайте расчеты в
таблице и определите, сколько моль сахара вы выпиваете с
чаем.
26.
Карта исследования № 2 потеме:
Оборудование: мензурка, мерная ложка.
Вещества: вода.
1. Вспомните правила определения объема
жидкости.
2. В мерный цилиндр отмерьте 15 столовых
ложек воды. Определите, какое количество
моль воды содержится в этом объеме.
3. Подсчитайте количество молекул воды.
27. Рефлексия
Цель- осознать смысл изученного науроке, выполненных заданий.
Ответьте на вопросы:
1.Усвоил ли ты материал урока или нет?
2.Над чем ещё надо поработать?
3.Как ты собираешься решать эту проблему?
(Разберусь сам, спрошу у знающего ученика,
спрошу у учителя)
4.Доволен ли ты своей работой?
5.Подбери три прилагательных, чтобы
охарактеризовать урок.
28. Домашнее задание
§ 58- 62, вопросыУпражнение 11(1,4,5,7)
29. ДО СВИДАНИЯ!
Спасибо заурок!

























 physics
physics








