Similar presentations:
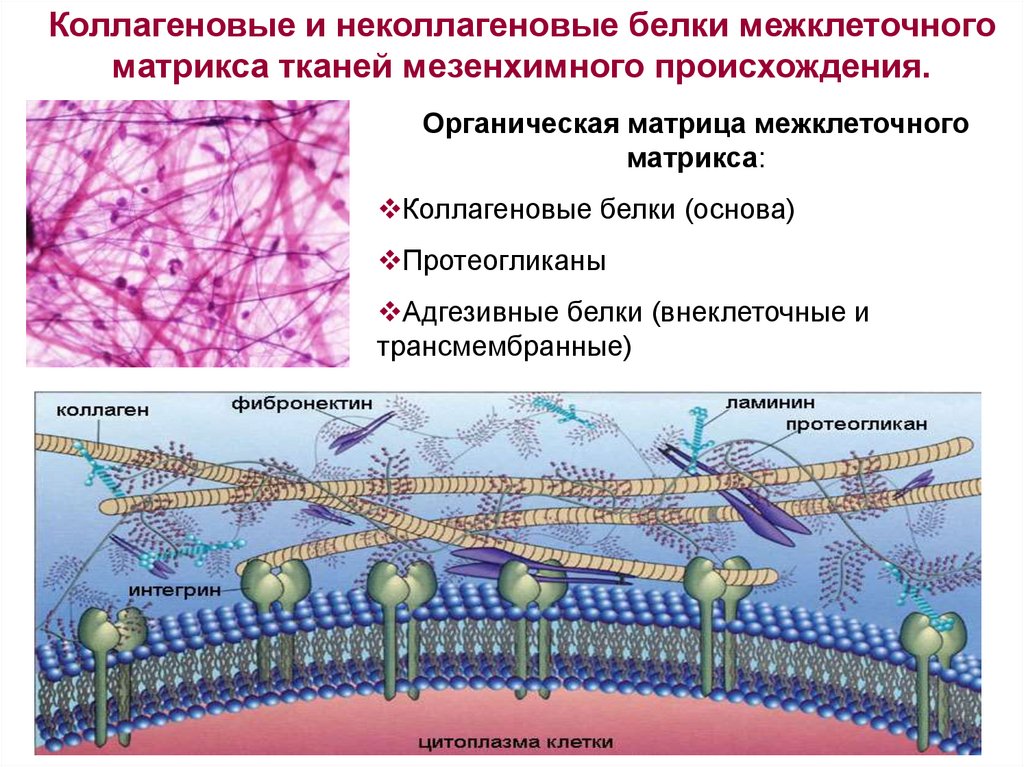
Коллагеновые и неколлагеновые белки межклеточного матрикса тканей мезенхимного происхождения
1.
Коллагеновые и неколлагеновые белки межклеточногоматрикса тканей мезенхимного происхождения.
Органическая матрица межклеточного
матрикса:
Коллагеновые белки (основа)
Протеогликаны
Адгезивные белки (внеклеточные и
трансмембранные)
2.
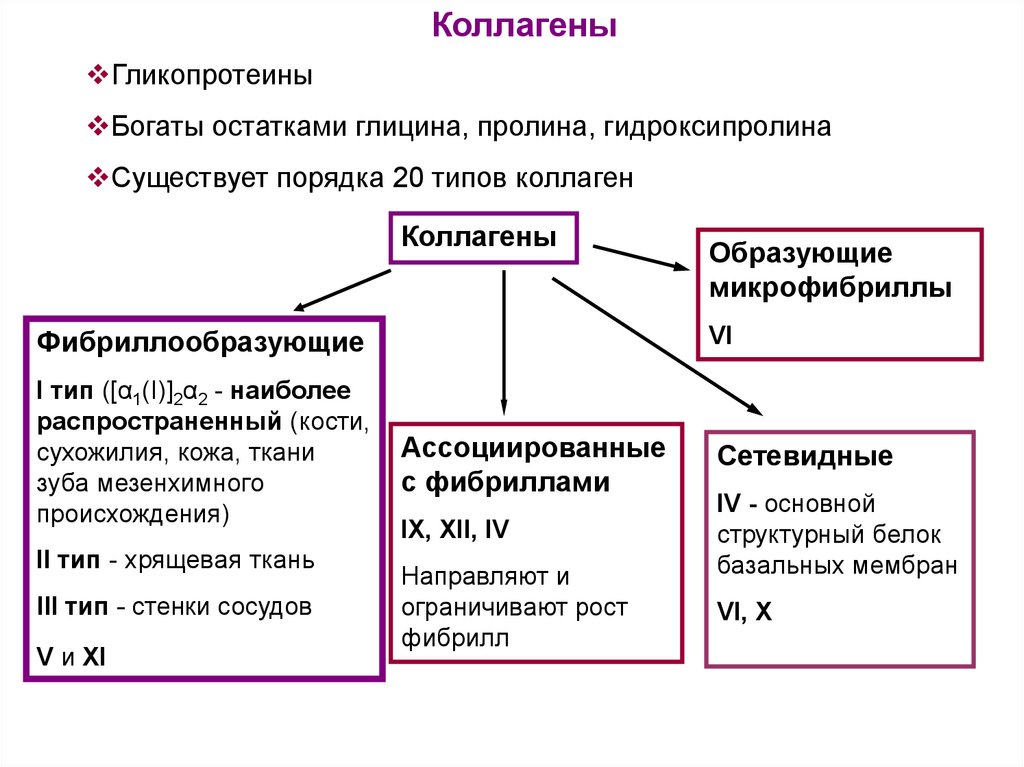
КоллагеныГликопротеины
Богаты остатками глицина, пролина, гидроксипролина
Существует порядка 20 типов коллаген
Коллагены
VI
Фибриллообразующие
I тип ([α1(I)]2α2 - наиболее
распространенный (кости,
сухожилия, кожа, ткани
зуба мезенхимного
происхождения)
II тип - хрящевая ткань
III тип - стенки сосудов
V и XI
Образующие
микрофибриллы
Ассоциированные
с фибриллами
IX, XII, IV
Направляют и
ограничивают рост
фибрилл
Сетевидные
IV - основной
структурный белок
базальных мембран
VI, X
3.
В первичнойструктуре
повторяется
последовательность:
гли-х-у, в которой хчаще всего пролин
или гидроксипролин
Тропоколлаген
структурная
единица коллагена
состоит из трех αцепей, каждая по
1000
аминокислотных
остатков
4.
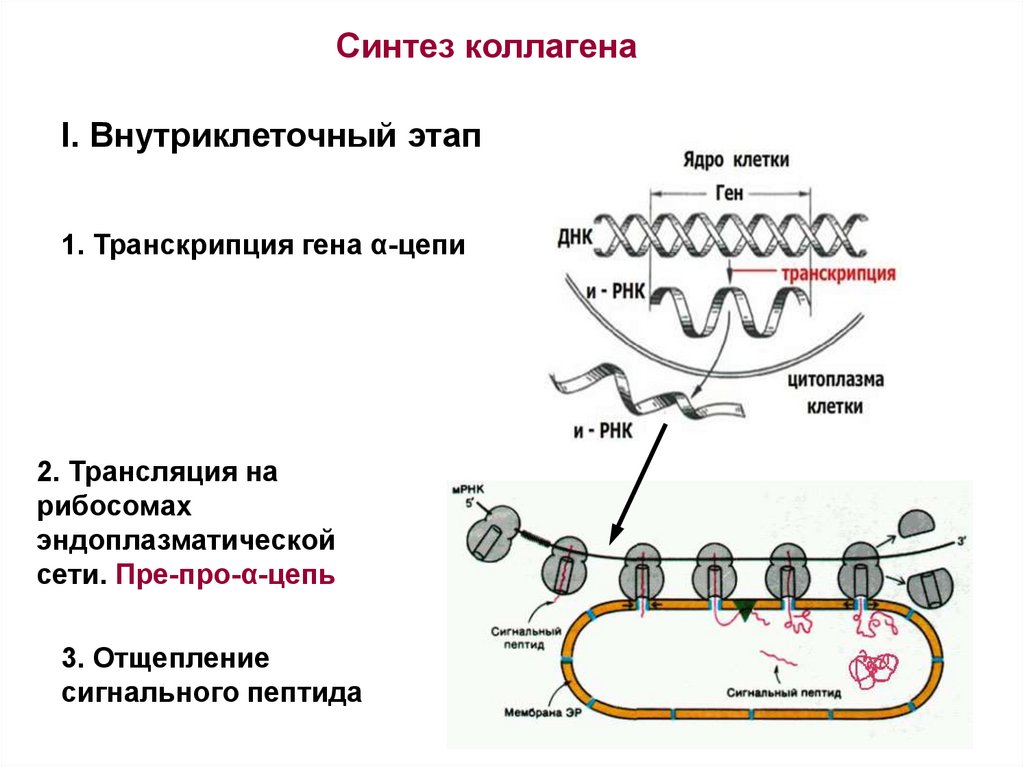
Синтез коллагенаI. Внутриклеточный этап
1. Транскрипция гена α-цепи
2. Трансляция на
рибосомах
эндоплазматической
сети. Пре-про-α-цепь
3. Отщепление
сигнального пептида
5.
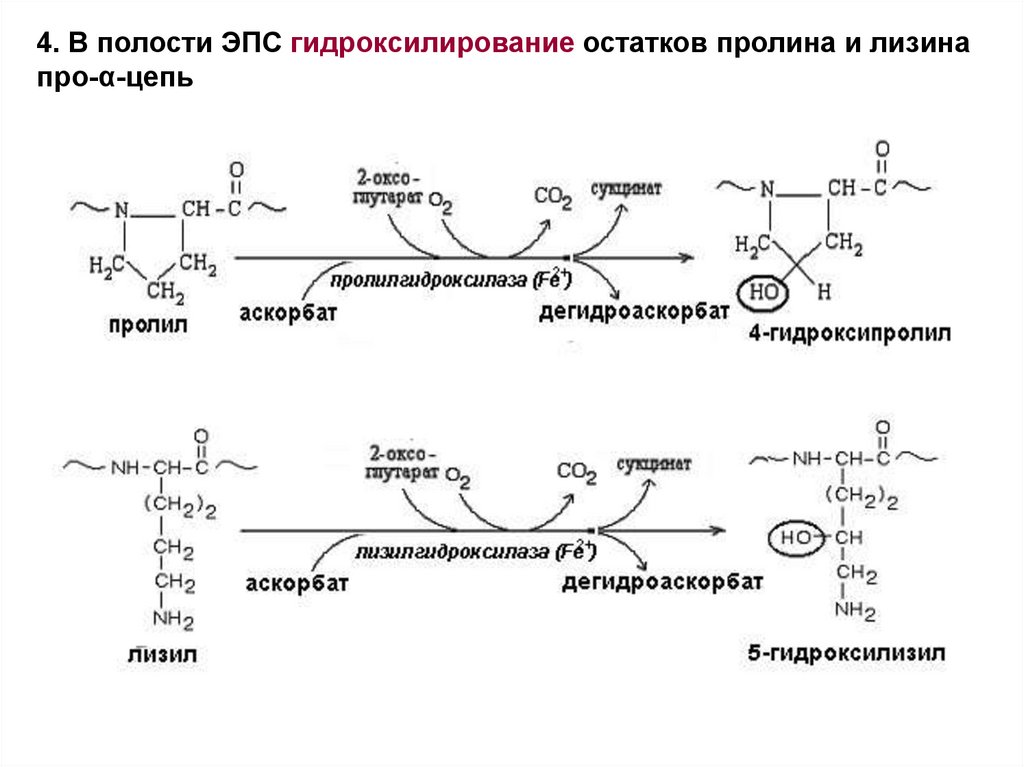
4. В полости ЭПС гидроксилирование остатков пролина и лизинапро-α-цепь
6.
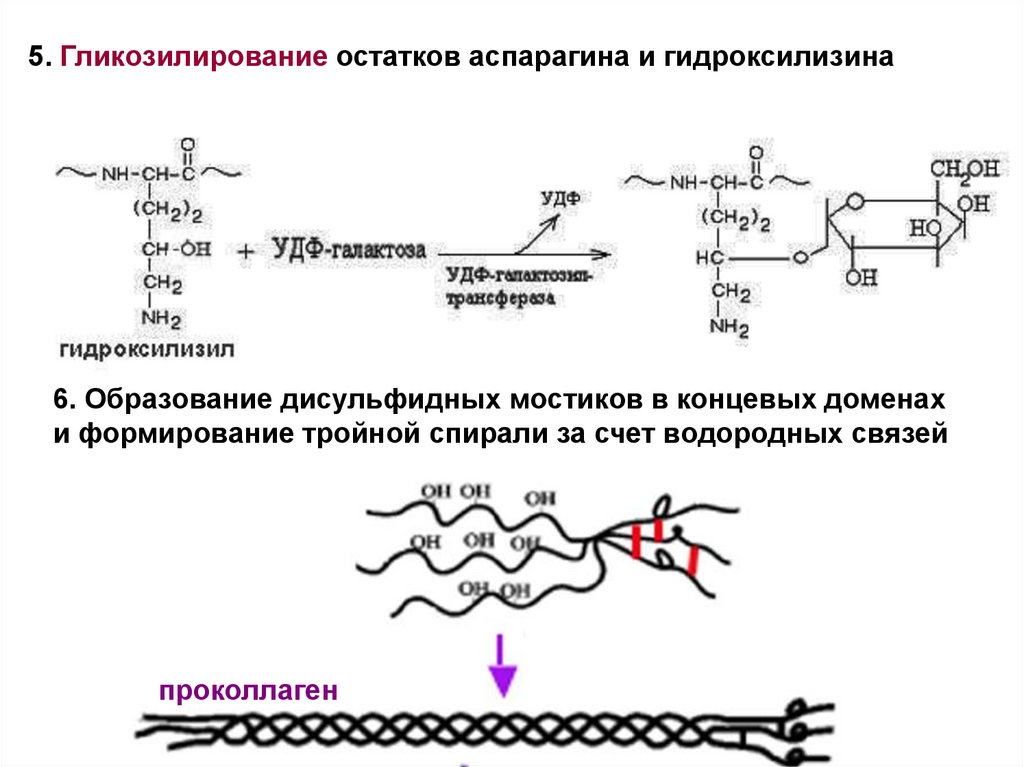
5. Гликозилирование остатков аспарагина и гидроксилизина6. Образование дисульфидных мостиков в концевых доменах
и формирование тройной спирали за счет водородных связей
проколлаген
7.
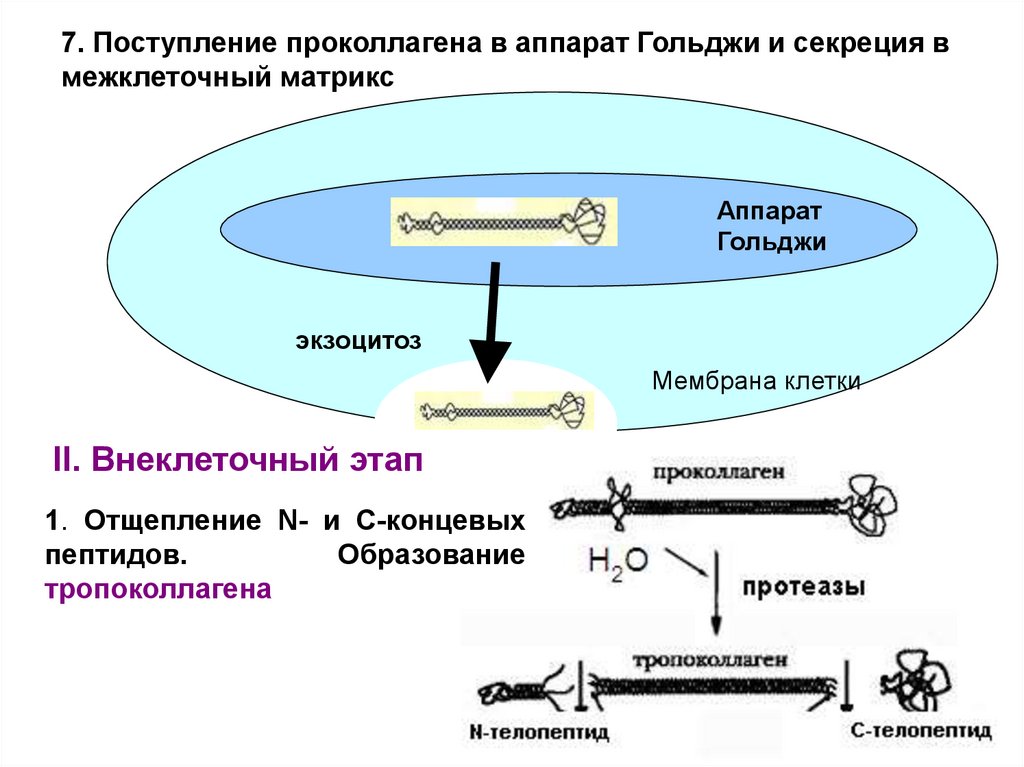
7. Поступление проколлагена в аппарат Гольджи и секреция вмежклеточный матрикс
Аппарат
Гольджи
экзоцитоз
Мембрана клетки
II. Внеклеточный этап
1. Отщепление N- и C-концевых
пептидов.
Образование
тропоколлагена
8.
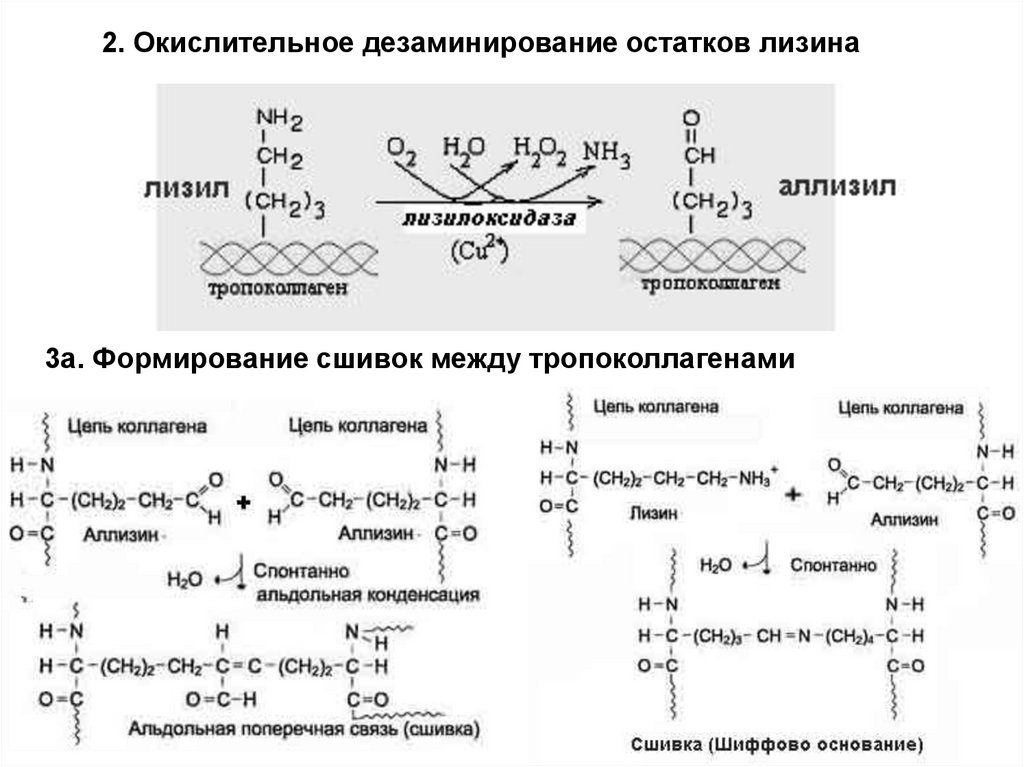
2. Окислительное дезаминирование остатков лизина3а. Формирование сшивок между тропоколлагенами
9.
3б. Самосборка микрофибриллы4. Самосборка
коллагенового волокна
10.
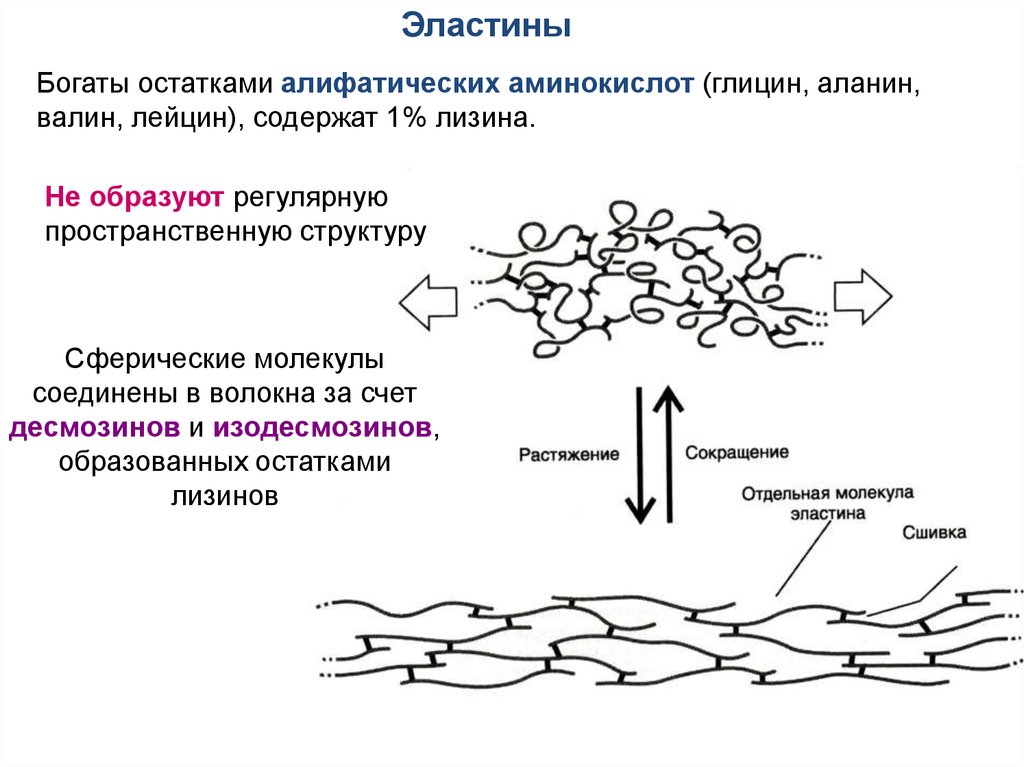
ЭластиныБогаты остатками алифатических аминокислот (глицин, аланин,
валин, лейцин), содержат 1% лизина.
Не образуют регулярную
пространственную структуру
Сферические молекулы
соединены в волокна за счет
десмозинов и изодесмозинов,
образованных остатками
лизинов
11.
Протеогликанысложные белки;
белковая часть - коровый
белок
небелковая часть гликозаминогликаны;
гликозаминогликаны связаны с
белковой частью N- и Огликозидными связями через
связывающий трисахарид
(ксилоза-галактоза-галактоза)
в большинстве случаев
гликозаминогликаны
сульфатированы
12.
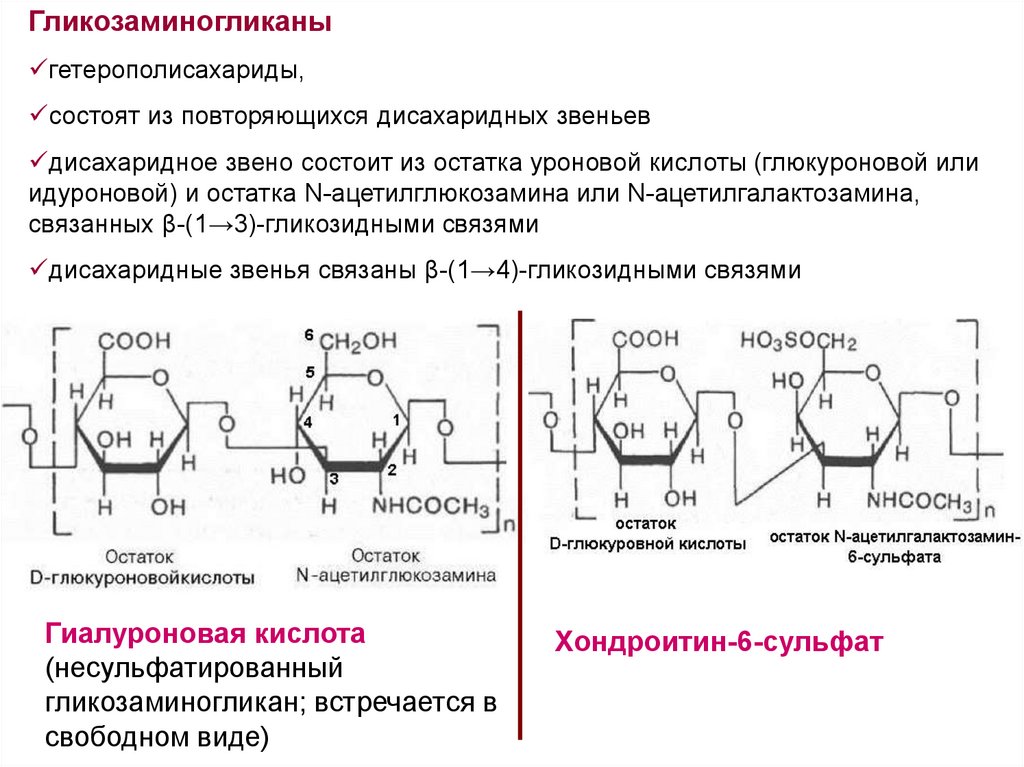
Гликозаминогликаныгетерополисахариды,
состоят из повторяющихся дисахаридных звеньев
дисахаридное звено состоит из остатка уроновой кислоты (глюкуроновой или
идуроновой) и остатка N-ацетилглюкозамина или N-ацетилгалактозамина,
связанных β-(1→3)-гликозидными связями
дисахаридные звенья связаны β-(1→4)-гликозидными связями
Гиалуроновая кислота
(несульфатированный
гликозаминогликан; встречается в
свободном виде)
Хондроитин-6-сульфат
13.
ПротеогликаныБольшие (более 100 цепей
гликозаминогликанов)
•агрекан
•версикан
•нейрокан
•бревикан
Функции протеогликанов
Малые (небольшой коровый
белок, 1-2 цепи
гликозаминогликанов)
•фибромодулин
•люмикан
•декорин
•бигликан
•остеоадерин
Связывают воду, обеспечивая упругость тканей
Структурный каркас межклеточного матрикса
Обеспечивают взаимосвязь между компонентами межклеточного
матрикса
Регулируют процессы роста клеток
Защищают белки клеточного матрикса от протеолиза
14.
15.
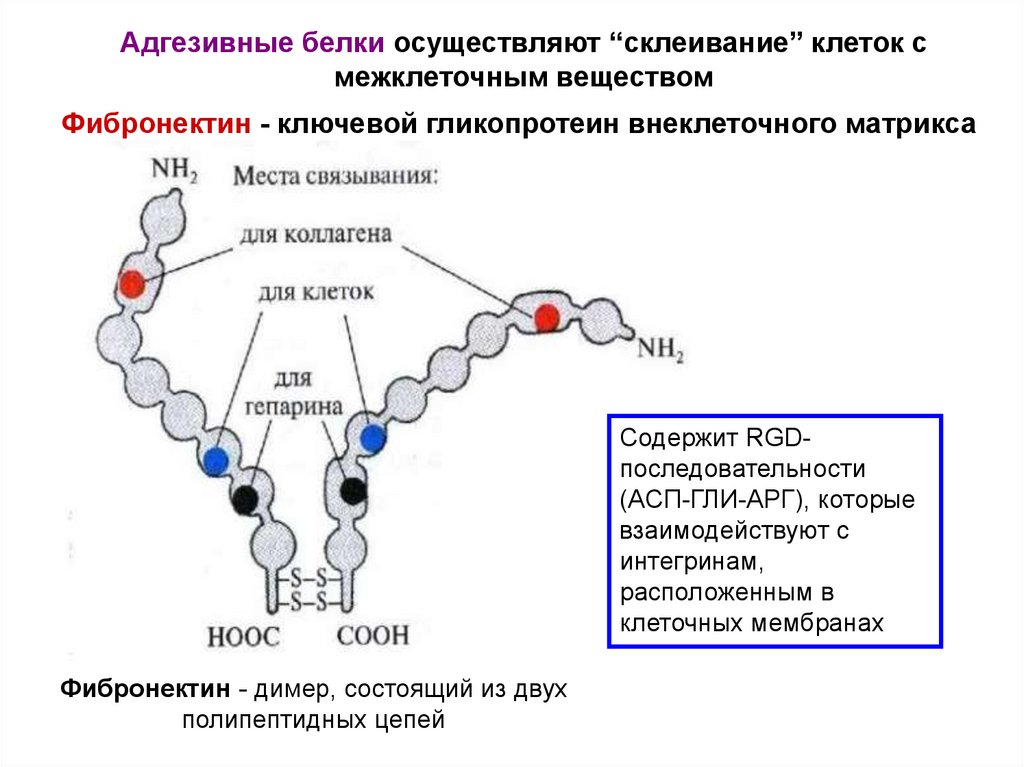
Адгезивные белки осуществляют “склеивание” клеток смежклеточным веществом
Фибронектин - ключевой гликопротеин внеклеточного матрикса
Содержит RGDпоследовательности
(АСП-ГЛИ-АРГ), которые
взаимодействуют с
интегринам,
расположенным в
клеточных мембранах
Фибронектин - димер, состоящий из двух
полипептидных цепей
16.
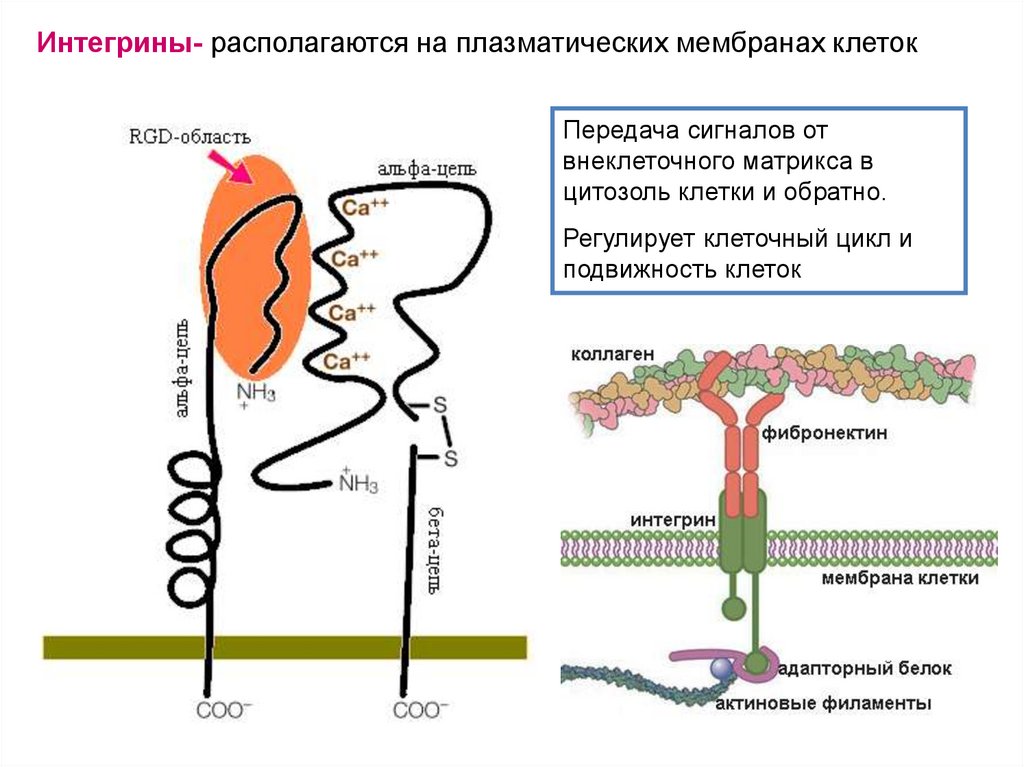
Интегрины- располагаются на плазматических мембранах клетокПередача сигналов от
внеклеточного матрикса в
цитозоль клетки и обратно.
Регулирует клеточный цикл и
подвижность клеток
17.
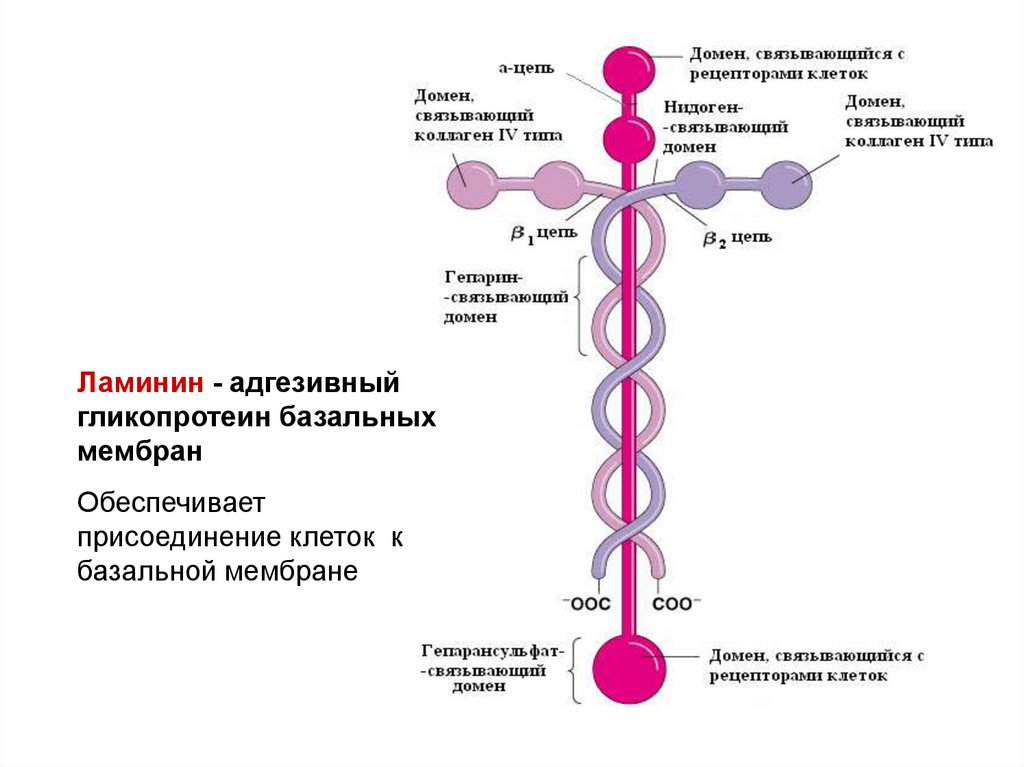
Ламинин - адгезивныйгликопротеин базальных
мембран
Обеспечивает
присоединение клеток к
базальной мембране





 biology
biology








