Similar presentations:
Химические элементы живых систем
1.
Факультет естественных наукКафедра общей биологии и биоэкологии
Курс: «Биология»
Практическая работа №2
«Химия жизни»
2.
Практическая работа №2Химия жизни
План работы:
1. Химические элементы живых систем;
2. Вода;
3. Углеводы;
4. Липиды;
5. Белки;
6. Нуклеиновые кислоты.
3.
4.
5.
УглеводыУглеводы представляют собой соединения с общей
формулой , то есть условно состоящие из углерода
и воды — отсюда их название. Содержание
углеводов в живых клетках различно. В животных
клетках содержание углеводов колеблется от 1 до 5
%. В растениях содержание углеводов заметно
выше — до 70 % в некоторых запасающих органах,
например в клубнях картофеля. Кроме высокого
содержания углеводов для растений характерно и
большее их разнообразие.
6.
УглеводыМоносахариды (от греч. monos — “одиночный” и sacchar — “сахар”) обычно
имеют молекулярную формулу, в которую входит несколько
групп СН2О. Наиболее распространенным моносахаридом является глюкоза
(С6Н12О6), которая занимает центральное место в химии жизни.
7.
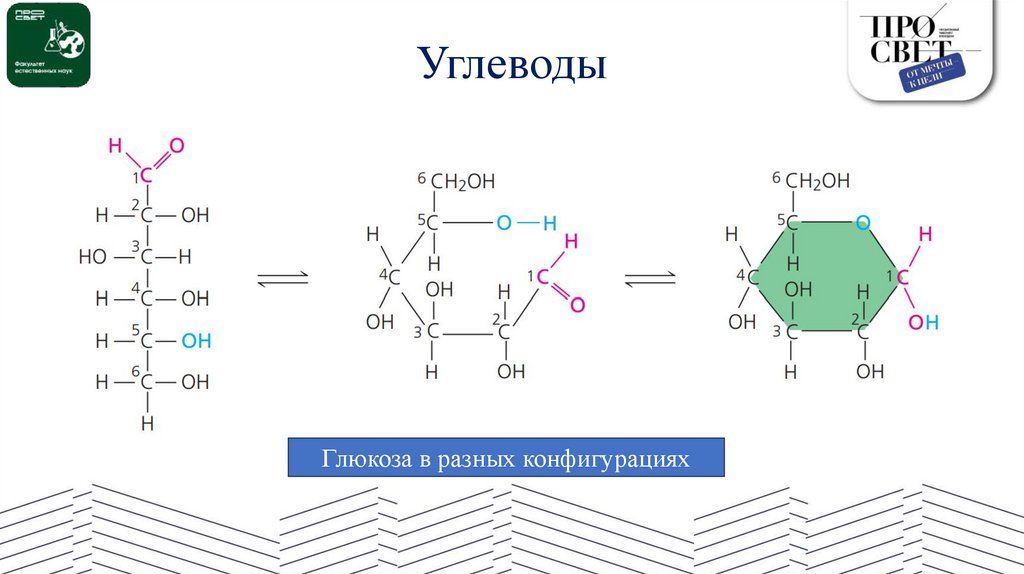
УглеводыГлюкоза в разных конфигурациях
8.
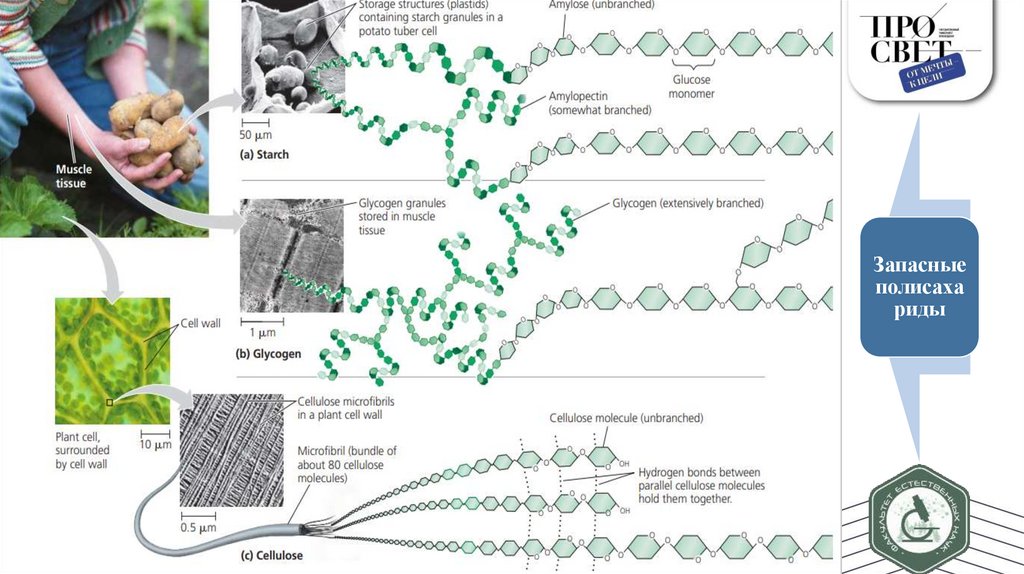
Запасныеполисаха
риды
9.
Функции углеводовПервичная
Углеводы являются первичными продуктами фотосинтеза, на основе их углеродного
скелета образуются практически все другие вещества в клетках автотрофов. Гетеротрофы
потребляют эти вещества в качестве пищи.
Энергетическая
функция
углеводы являются наиболее удобным источником энергии. Основные пути получения
энергии у всех живых организмов рассчитаны на использование глюкозы и фруктозы.
Структурная функция
полисахариды, например целлюлоза и хитин, входят в состав клеточных стенок, хитинового
панциря членистоногих. Также полисахариды являются неотъемлемыми компонентами
соединительной ткани животных (хрящи, сухожилия и др.).
Запасающая
(резервная) функция
Важнейшие резервные углеводы — крахмал (у растений) и гликоген (у животных и грибов).
Транспортная
функция
в форме углеводов осуществляется основной транспорт веществ в многоклеточных
организмах, например в крови животных (глюкоза) или в флоэме высших растений (сахароза).
Межклеточное
взаимодействие
Остатки олигосахаридов, находящиеся на поверхности клеток в составе гликопротеинов и
гликолипидов, играют важную роль в межклеточном взаимодействии и адгезии —
организации клеток в ткани.
10.
11.
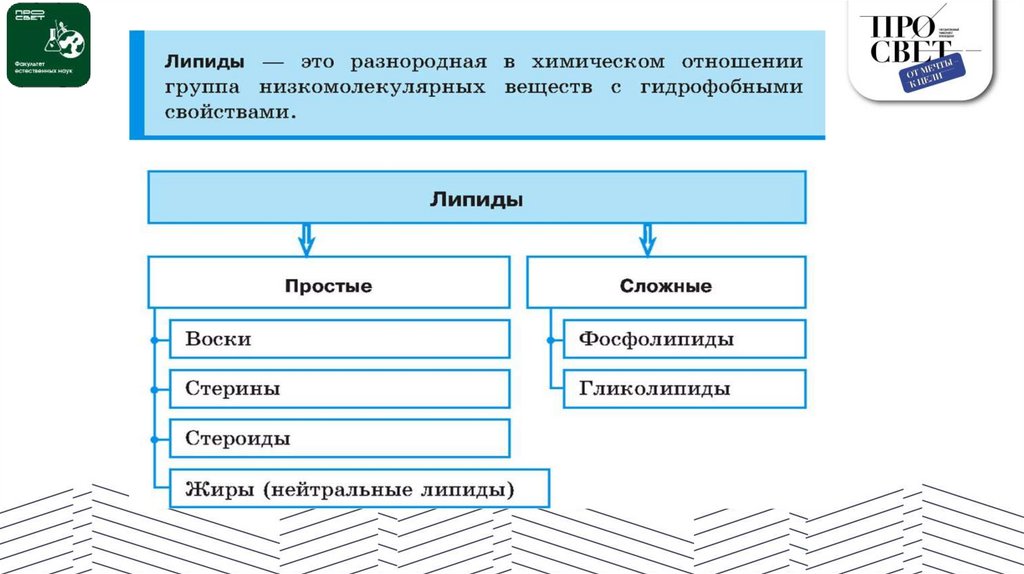
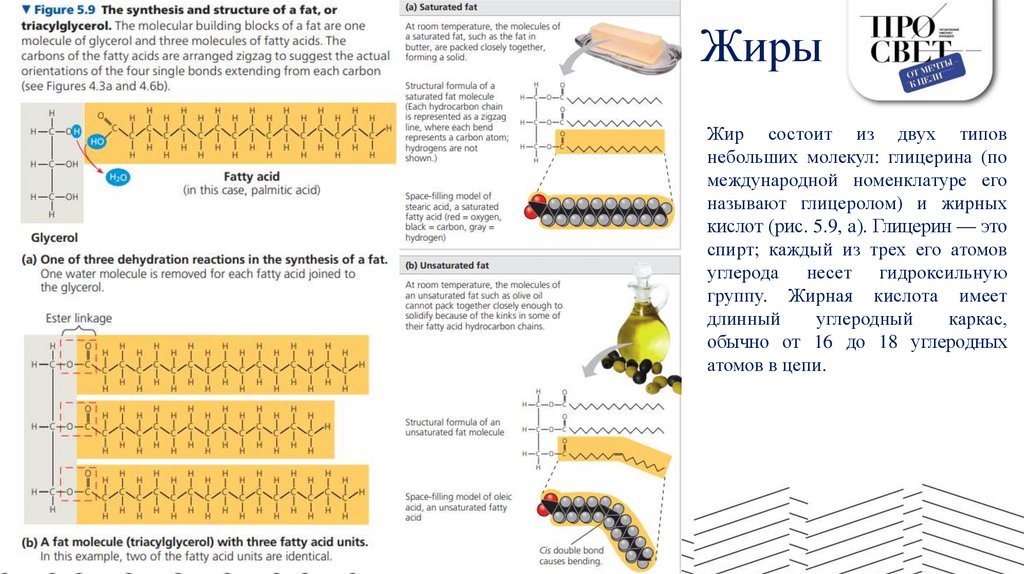
ЖирыЖир состоит из двух типов
небольших молекул: глицерина (по
международной номенклатуре его
называют глицеролом) и жирных
кислот (рис. 5.9, а). Глицерин — это
спирт; каждый из трех его атомов
углерода несет гидроксильную
группу. Жирная кислота имеет
длинный
углеродный
каркас,
обычно от 16 до 18 углеродных
атомов в цепи.
12.
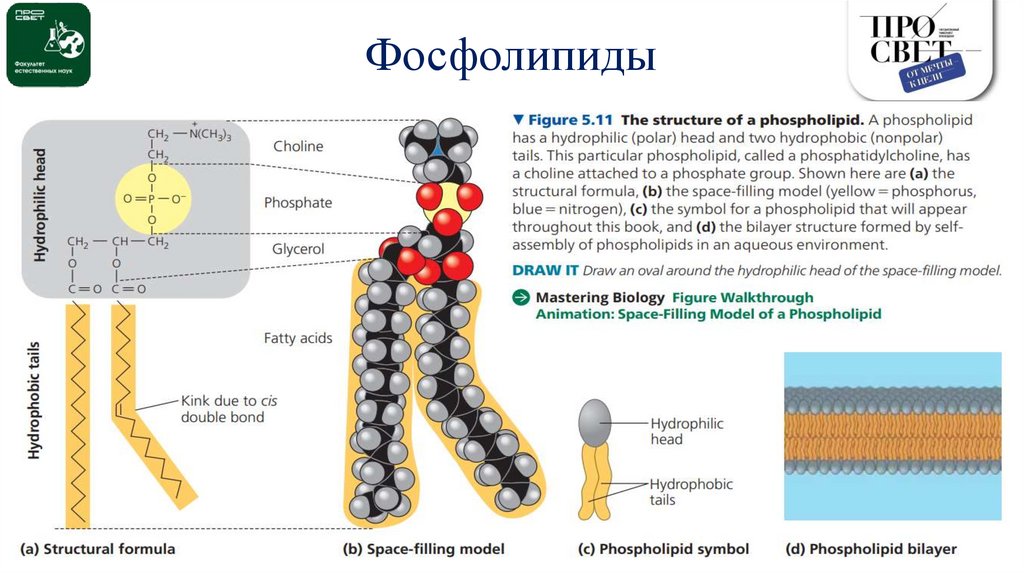
Фосфолипиды13.
СтероидыСтероиды — это липиды, углеродный
каркас которых состоит из четырех
конденсированных колец. Стероиды
отличаются друг от друга конкретными
химическими
группами,
которые
присоединены
к
группе
колец.
Холестерин, один из стероидов,
является ключевой молекулой в жизни
животных (рис. 5.12).
Холестерин
—
распространенный
компонент мембран животных клеток, а
также вещество-предшественник, из
которого
синтезируются
другие
стероиды, например половые гормоны
позвоночных.
14.
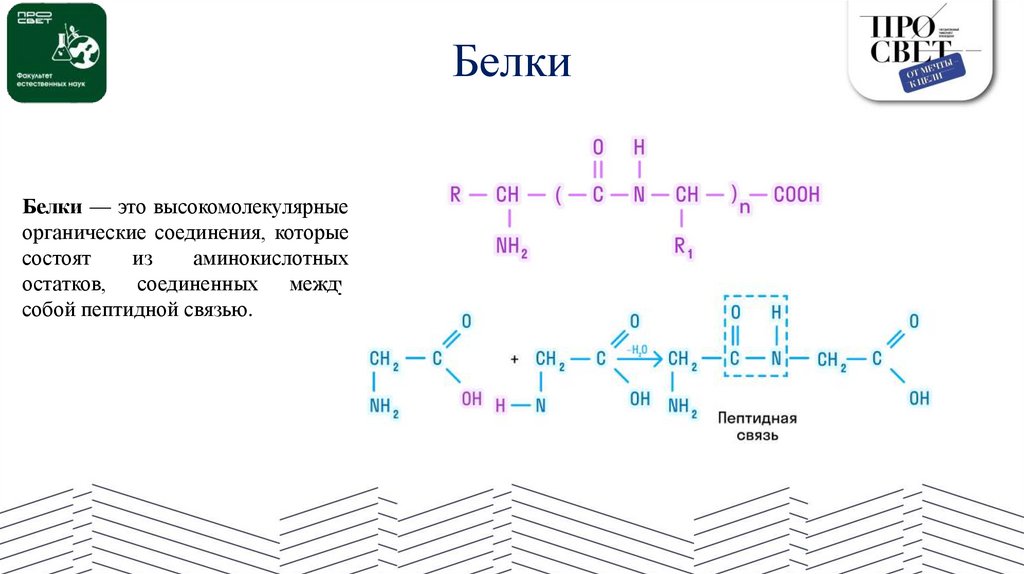
БелкиБелки — это высокомолекулярные
органические соединения, которые
состоят
из
аминокислотных
остатков, соединенных между
собой пептидной связью.
15.
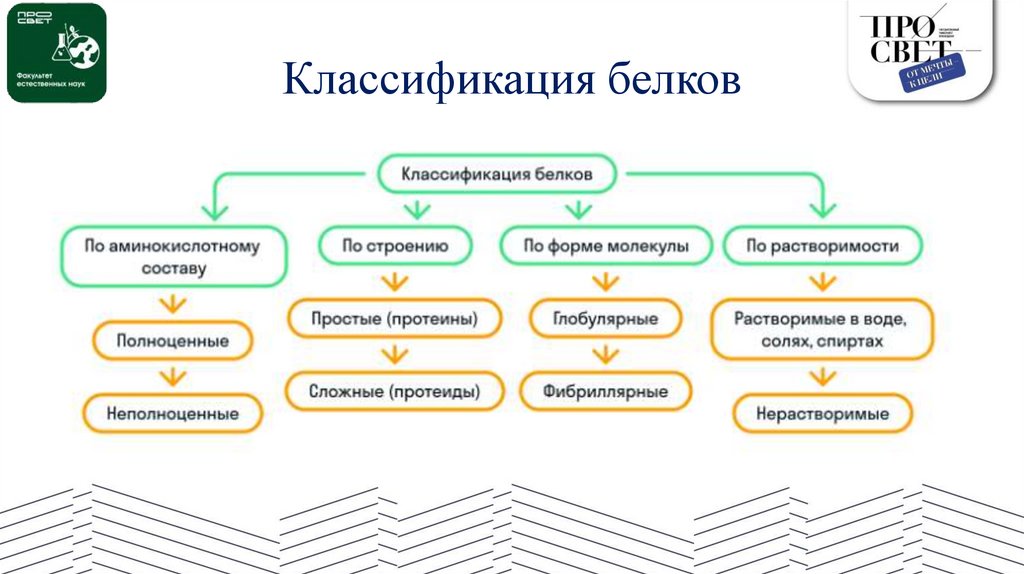
Классификация белков16.
По аминокислотному составуКак мы уже знаем, существуют незаменимые аминокислоты. Так вот, исходя
из их наличия, белки бывают либо полноценные, либо неполноценные:
• к полноценным относятся белки животного происхождения, также
полноценные белки содержат некоторые растения: картофель, бобовые и
другие;
• к неполноценным относятся желатин и белки преимущественно
растительного происхождения.
17.
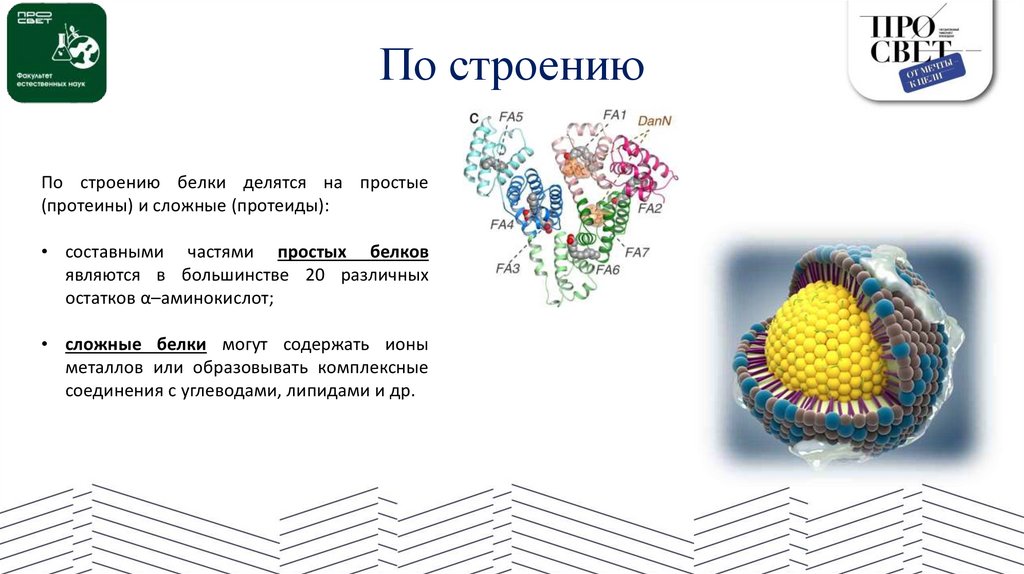
По строениюПо строению белки делятся на простые
(протеины) и сложные (протеиды):
• составными частями простых белков
являются в большинстве 20 различных
остатков α–аминокислот;
• сложные белки могут содержать ионы
металлов или образовывать комплексные
соединения с углеводами, липидами и др.
18.
По форме молекулыПо форме молекулы белки подразделяются на
глобулярные и фибриллярные:
• форма молекулы глобулярных белков — глобула
(сфера или эллипс). Например, альбумин (яичный
белок), казеин (молочный белок). Такие белки
растворимы в воде;
• форма молекулы фибриллярных белков —
фибрилла (нити или волокна). Например, кератин
(волосы, ногти, перья), коллаген (мускулы,
сухожилия). Эти белки в воде не растворяются.
19.
По растворимостиРастворимость белков зависит от их структуры, величины рН, солевого состава
раствора, температуры и определяется природой тех групп, которые находятся на
поверхности белковой молекулы.
Так, существуют белки (глобулины), которые растворяются только в растворах
солей и не растворяются в чистой воде, а противоположные им альбумины хорошо
растворимы в чистой воде.
К нерастворимым белкам относятся кератин (волосы, ногти, перья), коллаген
(сухожилия), фиброин (шелк, паутина).
20.
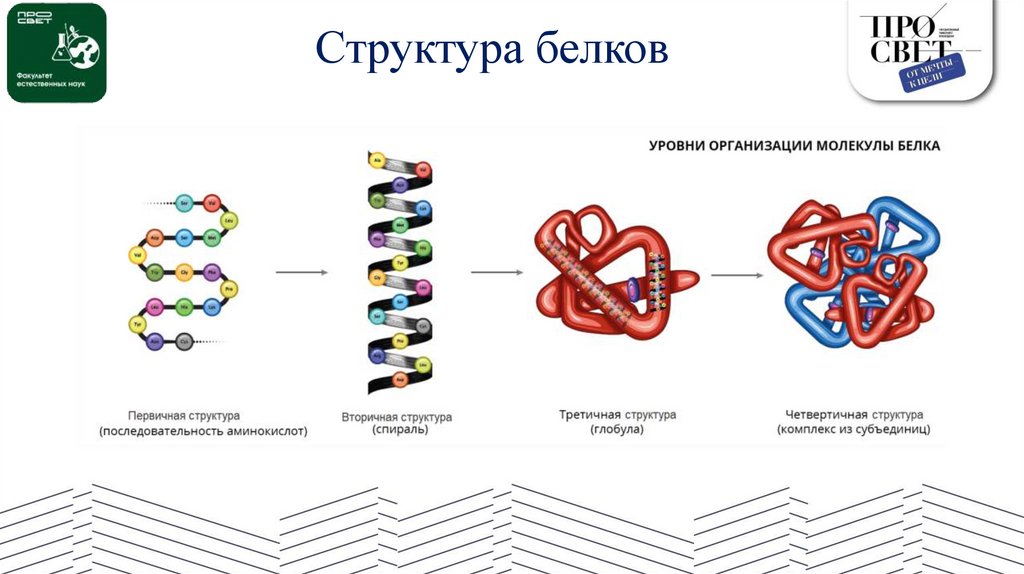
Структура белков21.
Белки1. Первичная структура белка — это простейший вид белковой структуры. Представляет собой последовательность
аминокислот в полипептидной цепи. Последовательность аминокислот в белке определяется ДНК, а именно геном,
кодирующим этот белок. Изменение всего лишь одной аминокислоты влечет за собой последствия: например, если вместо
глутаминовой кислоты в молекуле гемоглобина находится валин, то у человека образуется серповидноклеточная анемия.
При замене глутаминовой кислоты на валин клетки гемоглобина вытягиваются и принимают форму месяца или серпа.
2. Вторичная структура — пространственная структура, которая образуется в результате взаимодействия функциональных
групп пептидного остова (полипептидная цепь без атомов R-групп). Самые распространенные формы вторичной структуры
— это α-спираль и β-лист. Обе структуры удерживают форму благодаря водородным связям между кислородом
карбонильной группы одной аминокислоты и водородом аминогруппы другой аминокислоты.
3. Третичная структура — это пространственное строение всей молекулы белка, состоящей из единственной цепи. Эта
структура обусловлена взаимодействиями между R-группами аминокислот, которые входят в состав белка. Среди
взаимодействий между R-группами, формирующими третичную структуру, встречаются водородные, ионные и дипольдипольные связи, а также дисперсионные силы.
4. Четвертичная структура — взаимное расположение нескольких полипептидных цепей в составе единого белкового
комплекса.
22.
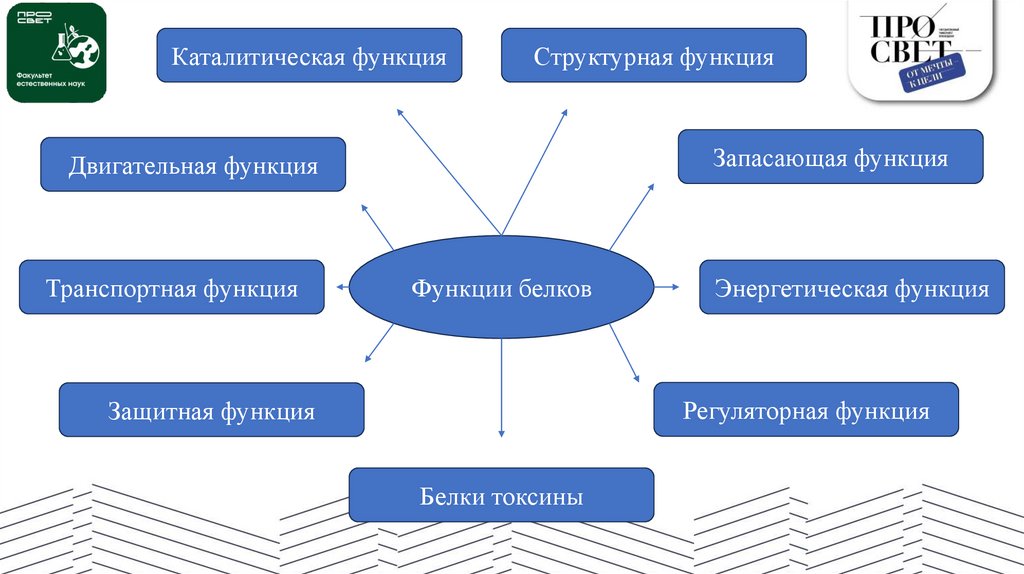
Каталитическая функцияСтруктурная функция
Запасающая функция
Двигательная функция
Транспортная функция
Функции белков
Энергетическая функция
Регуляторная функция
Защитная функция
Белки токсины
23.
Каталитическая функция белковОдна из важнейших функций белков — каталитическая. При той температуре и кислотности среды, которая характерна для
живой клетки, скорость большинства химических реакций мала. Тем не менее реакции в клетке протекают с очень большой
скоростью. Увеличение скорости химических реакций достигается за счет функционирования биологических катализаторов
— ферментов.
Ферменты — самый крупный и специализированный класс белков. Именно ферменты обеспечивают протекание в клетке
многочисленных химических реакций, совокупность которых составляет обмен веществ или метаболизм. В настоящее время
известны десятки тысяч различных ферментов.
По сравнению с химическими катализаторами ферменты имеют ряд особенностей:
•Их каталитическая эффективность необычайно высока: ферменты способны ускорять химические реакции в раз, это
значительно выше, чем эффективность химических катализаторов.
•Ферменты очень специфичны: обычно фермент катализирует лишь одну реакцию (то есть превращение одного вещества,
называемого субстратом) или нескольких реакций одного типа.
•Кроме того, активность ферментов в большинстве случаев регулируется различными химическими соединениями,
имеющимися в клетке.
•Важным свойством некоторых ферментов является способность сопрягать две химические реакции и таким образом
осуществлять энергетически невыгодные процессы синтеза сложных веществ за счет энергии, выделяющейся, например, при
гидролизе АТФ и других высокоэнергетических соединений.
24.
Структурная функция белковВторая важная функция белков — это структурная функция.
Из структурных белков формируются элементы цитоскелета.
К структурным белкам относится, например, фибриллярный белок -кератин, который образует
промежуточные филаменты эпителиальных клеток, входит в состав волос, когтей, рогов и копыт
млекопитающих, а также фибриллярный белок коллаген, основной структурный белок соединительной и
костной ткани.
Химическая структура этих белков, которые выдерживают очень большую нагрузку, идеально
приспособлена к выполнению механической функции.
25.
Двигательная функция белковДругие типы белков обеспечивают двигательную функцию.
По цитоскелетным нитям – микротрубочкам и микрофиламентам – способны
АТФ- или ГТФ-зависимо перемещаться моторные белки.
Так, по микротрубочкам «ходят» динеины и кинезины, а по актиновым нитям –
миозин.
Актин и миозин входят не только в сократимые волокна мышечных клеток –
миофибриллы, но и участвуют в изменении формы других типов клеток.
26.
Транспортная функция белковНекоторые белки выполняют транспортную функцию.
а) Прежде всего, это белки мембран, осуществляющие активный перенос веществ из окружающей среды
в клетку и обратно. К транспортным белкам относятся также некоторые белки, встроенные в
биологические мембраны и формирующие в них поры (каналы).
б) Это также белки крови, которые связывают и переносят различные вещества. Наиболее известным из
транспортных белков является гемоглобин, который осуществляет перенос кислорода из легких в ткани.
Помимо кислорода с кровью переносятся и другие вещества: сывороточные липопротеиды переносят с
током крови липиды, а сывороточный альбумин — свободные жирные кислоты. Ионы железа
переносятся белком трансферрином, а ионы меди — белком церулоплазмином.
27.
Защитная функция белковБелки способны также осуществлять защитную функцию, при попадании в
организм животных или человека вирусов, бактерий, чужеродных белков или
других полимеров в организме происходит синтез белков, которые называют
антителами, или иммуноглобулинами, антитела связываются с чужеродными
полимерами, которые называют антигенами.
28.
Белки токсины• Многие живые существа (растения, грибы, бактерии, беспозвоночные, рыбы,
амфибии, змеи) для обеспечения защиты и нападения выделяют также белки и
пептиды, называемые токсинами.
• Эти белки подавляют жизненно важные процессы в клетках других
организмов, могут разрушать определенные клеточные полимеры, что
приводит к гибели организма.
29.
Регуляторная функция белковЕще одной важной функцией белков является регуляторная.
а) Прежде всего, эту функцию выполняют белки — активаторы и репрессоры генов.
б) Кроме того, специализированные белки регулируют активность ферментов.
в) В специализированных клетках животных осуществляется синтез биологически активных веществ, поступающих непосредственно в кровь, — гормонов. Гормоны способны в
очень малых концентрациях обеспечивать регуляцию метаболизма. Часть гормонов (но не все) являются пептидами или белками. Наиболее известным из белковых гормонов
является инсулин — гормон, вырабатываемый в поджелудочной железе и регулирующий уровень глюкозы в клетках организма. При недостатке инсулина в организме возникает
заболевание, известное как сахарный диабет.
К белковым гормонам относятся и гормоны, продуцируемые передней долей гипофиза: гормон роста соматотропин, пролактин. Задняя доля гипофиза выделяет пептидные
гормоны окситоцин и вазопрессин, каждый из которых состоит из восьми аминокислот и регулирует сокращение мускулатуры матки и сосудов соответственно.
г) Многие клетки в организме выделяют белки и пептиды, являющиеся биологически активными соединениями, которые влияют на функции соседних клеток. К ним, в частности,
относятся многочисленные факторы роста, которые регулируют рост и развитие клеток определенных тканей, например фактор роста нервной ткани, фактор роста фибробластов.
д) Большая часть биологически активных соединений, оказывающих биологических эффект в очень низких концентрациях, в том числе гормоны и факторы роста, связываются со
специфическими рецепторами, которые являются белками, часто гликопротеинами.
У каждого рецептора есть свой лиганд — вещество, с которым он связывается с крайне высокой специфичностью. Связывание биологически активного вещества (например,
гормона или фактора роста) с соответствующим рецептором приводит к изменению конформации (пространственной структуры) рецептора, что является сигналом,
инициирующим внутриклеточный каскад передачи сигнала. Результат работы каскада — изменение активности ферментов или генов.
Таким образом, биологически активные вещества белковой природы и их рецепторы обеспечивают регуляторную функцию белков.
30.
Энергетическая функция белков• Кроме того, белки пищи для животных выполняют энергетическую
функцию и функцию источника незаменимых аминокислот.
• При голодании собственные белки используются в качестве энергетического
субстрата в последнюю очередь — когда израсходованы запасы гликогена и
жира.
• Это может приводить к падению мышечной массы, заболеваниям кожи,
возникновению язв и др.
31.
Запасающая функция белковВ ряде случаев белки выполняют запасающую функцию. Чаще всего это
происходит в структурах, связанных с размножением.
Такие белки откладываются в семенах многих растений (алейроновые зерна), в
яйцах животных (овальбумин).
Таким образом, белки выполняют все основные функции в живом организме,
кроме функций хранения и передачи наследственной информации.
32.
Нуклеиновые кислотыНуклеиновые кислоты
—
биологические
полимеры,
мономерами
которым
служат нуклеотиды.
Связи между нуклеотидами
легко
подвергаются
гидролизу
(распаду
при
реакции с водой). Каждый
нуклеотид состоит из остатков
углевода, фосфорной кислоты
и азотистого основания.
33.
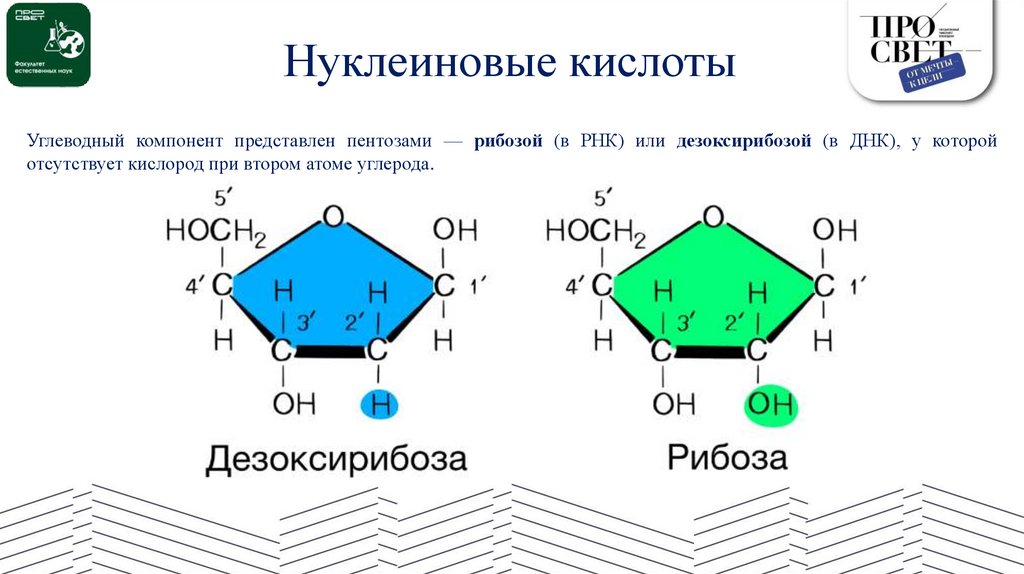
Нуклеиновые кислотыУглеводный компонент представлен пентозами — рибозой (в РНК) или дезоксирибозой (в ДНК), у которой
отсутствует кислород при втором атоме углерода.
34.
Нуклеиновые кислотыОстаток фосфорной кислоты образует сложноэфирную связь с гидроксилом при 5-м атоме углерода в сахаре.
Соединение нуклеотидов в полимер происходит путем образования фосфатом одного нуклеотида второй
эфирной связи с гидроксилом при 3-м углероде соседнего нуклеотида. Такая связь получила название
фосфодиэфирной.
Таким образом, нуклеиновые кислоты представляют собой цепь из чередующихся остатков пентозы и
фосфорной кислоты.
Кроме того, от первого атома углерода каждой пентозы отходит в бок азотистое основание. В этом нуклеиновые
кислоты сходны с белками, в которых полимерная цепь образована пептидными группировками с отходящими
от них боковыми радикалами аминокислот. Так же, как и у белков, в нуклеиновых кислотах два конца цепи
неодинаковы. С одной стороны имеется не занятое связью пятое положение рибозы, этот конец называют 5’концом. С противоположной стороны не занят связью третий гидроксил сахара, этот конец обозначают как 3’конец. 5’-конец считается началом цепи, а 3’-конец — ее окончанием.
35.
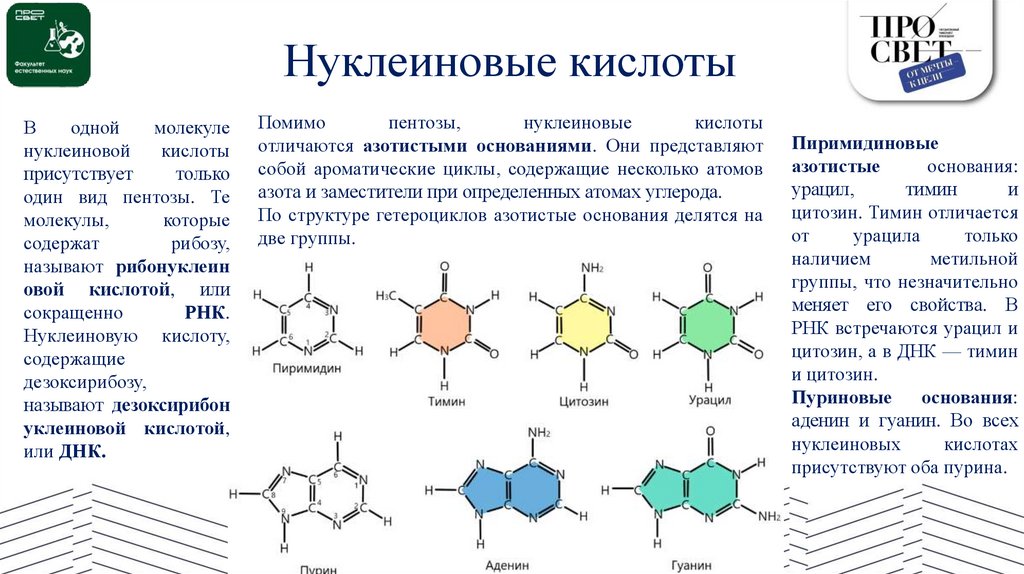
Нуклеиновые кислотыВ
одной
молекуле
нуклеиновой
кислоты
присутствует
только
один вид пентозы. Те
молекулы,
которые
содержат
рибозу,
называют рибонуклеин
овой кислотой, или
сокращенно
РНК.
Нуклеиновую кислоту,
содержащие
дезоксирибозу,
называют дезоксирибон
уклеиновой кислотой,
или ДНК.
Помимо
пентозы,
нуклеиновые
кислоты
отличаются азотистыми основаниями. Они представляют
собой ароматические циклы, содержащие несколько атомов
азота и заместители при определенных атомах углерода.
По структуре гетероциклов азотистые основания делятся на
две группы.
Пиримидиновые
азотистые
основания:
урацил,
тимин
и
цитозин. Тимин отличается
от
урацила
только
наличием
метильной
группы, что незначительно
меняет его свойства. В
РНК встречаются урацил и
цитозин, а в ДНК — тимин
и цитозин.
Пуриновые
основания:
аденин и гуанин. Во всех
нуклеиновых
кислотах
присутствуют оба пурина.
36.
Нуклеиновые кислотыПринцип комплементарности
При анализе содержания азотистых оснований в ДНК из
различных организмов Эрвин Чаргафф обнаружил
определенные закономерности, позднее
названные правилами Чаргаффа.
• Молярное содержание аденина всегда равно молярному содержанию тимина, а молярное
содержание гуанина — молярному содержанию цитозина.
• Количество пуринов равнялось количеству пиримидинов, а отношение А+Т/Г+Ц было различным
у разных видов живых организмов.
37.
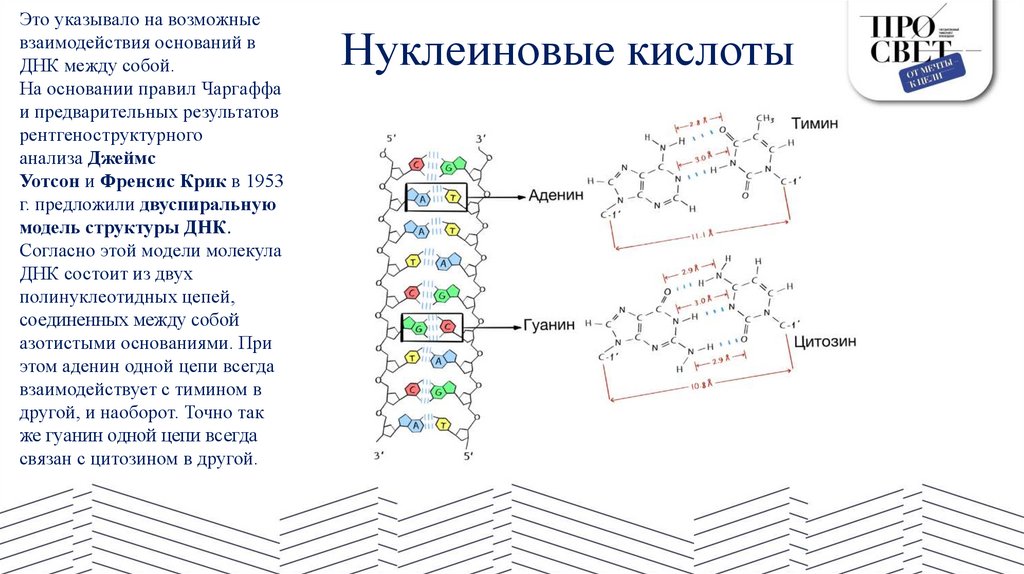
Это указывало на возможныевзаимодействия оснований в
ДНК между собой.
На основании правил Чаргаффа
и предварительных результатов
рентгеноструктурного
анализа Джеймс
Уотсон и Френсис Крик в 1953
г. предложили двуспиральную
модель структуры ДНК.
Согласно этой модели молекула
ДНК состоит из двух
полинуклеотидных цепей,
соединенных между собой
азотистыми основаниями. При
этом аденин одной цепи всегда
взаимодействует с тимином в
другой, и наоборот. Точно так
же гуанин одной цепи всегда
связан с цитозином в другой.
Нуклеиновые кислоты
38.
Нуклеиновые кислотыТакие пары оснований удерживаются за счет образования между основаниями водородных связей:
•пара А–Т образует 2 водородные связи;
•пара Г–Ц образует 3 водородные связи.
Главной особенностью пар А–Т и Г–Ц является их одинаковая геометрия. Это позволяет построить
двуспиральную молекулу с постоянным расстоянием между цепями, построенными остатками сахара и
фосфорной кислоты. Образование любых других пар приводит к нарушению правильной структуры.
Такое взаимодействие оснований, при котором они дополняют друг друга до определенной структуры,
одинаковой для всех пар, получило название принципа комплементарности.
Пары аденин и тимин, гуанин и цитозин называются комплементарными парами, а две цепочки
нуклеиновых кислот, в которых все основания образуют комплементарные пары — комплементарными
цепочками. Таким образом, каждая молекула ДНК состоит из двух комплементарных цепочек
полинуклеотидов.
39.
Нуклеиновые кислоты• Важной особенностью структуры двойной спирали ДНК является то, что комплементарные цепи направлены в
противоположные стороны, т. е. 5’-конец одной цепи связан комплементарными основаниями с 3’-концом
другой цепи, и наоборот.
• Основания плотно слипаются своими плоскостями, что делает связь между цепочками еще более прочной.
• Такое слипание получило название стэкинг-взаимодействия.
• В результате в центре молекулы ДНК находится как бы стержень, построенный из азотистых оснований, а по
краям он обвит двумя нитями, состоящими из чередующихся остатков дезоксирибозы и фосфорной кислоты.
40.
Сравнение ДНК и РНКНуклеиновая кислота
Строение
Функции
Особенности
ДНК
азотистое основание:
аденин (А)
тимин (Т)
гуанин (Г)
цитозин (Ц)
углевод: дезоксирибоза
остаток фосфорной
кислоты
хранение и передача
наследственной
информации
двойная спираль (по
принципу
комплементарности);
способность к репликации
(самоудвоению)
РНК
азотистое основание:
аденин (А)
урацил (У)
гуанин (Г)
цитозин (Ц)
углевод:
рибоза
остаток фосфорной
кислоты
биосинтез белка
одинарная цепочка
нуклеотидов
41.
Курс подготовил:Ассистент кафедры
общей биологии и
биоэкологии
Темников Андрей
Андреевич



























 biology
biology








