Similar presentations:
Коллоидная химия. Растворы ВМС
1.
Коллоидная химияИТХТ им. М.В. Ломоносова
кафедра НС и ПЯ
группы ХХБО-01-03-2022,
ХТБО-01-22
ЛЕКЦИЯ 15
Шубенкова Екатерина Гаррьевна
2.
Коллоидная химияЛЕКЦИЯ 15
Растворы ВМС
Шубенкова Е.Г.
2024
3.
План лекции1. Размеры и форма макромолекул в растворе. Свойства
Гауссова клубка.
2. Механизмы гибкости полимерной цепи: поворотноизомерный и персистентный.
3. Термодинамическое сродство полимера к
растворителю количественные критерии его
характеризующие.
4. Термодинамика набухания и растворения полимеров.
5. Межмолекулярные и внутримолекулярные
взаимодействия в растворах полимеров. Температура
Флори.
6. Фазовые диаграммы полимерных растворов.
7. Структурный и термодинамический критерии деления
растворовна разбавленные и концентрированные.
4.
Растворы ВМСмономолекулярные
лиофильные
системы,
термодинамически устойчивые и обратимые.
На начальном этапе развития коллоидной химии
растворы полимеров были отнесены к коллоидным системам
по причине:
1) тепловое движение частиц растворенного вещества, схожее
с броуновским движением мицелл в золях;
2)
низкие
скорости
диффузии
и
низкие
величины
осмотического
давления
по
сравнению
с
истинными
растворами;
3) способность частиц дисперсной фазы к коагуляции при
добавлении электролитов, изменении температуры и т.д...;
4) частицы дисперсной фазы не проходят через поры
полупроницаемых мембран;
5) близка и степень дисперсности вещества в коллоидах и
растворах ВМС.
5.
Растворы ВМСВ отличии от гидрофобных коллоидов:
1) гораздо более устойчивы;
2) образуются самопроизвольно, не требуя обязательного
присутствия стабилизаторов;
3) для осаждения полимера из раствора электролит
требуется в сотни раз больших количествах;
4) после осаждения полимера из раствора с помощью
электролита осадок легко растворяется в чистом
растворителе.
Растворы ВМС - лиофильные золи?
6.
Растворы ВМСРастворы ВМС – гомогенные системы,
которые большинство современных авторов
относят к истинным растворам.
Причина высокой устойчивости которых в
отсутствии
поверхности
раздела
между
веществами дисперсной фазы и дисперсионной
среды.
7.
Макромолекула- совокупность атомов или атомных групп, различных или
одинаковых по составу и строению, соединенных химическими
связями в линейную или разветвленную структуру достаточно
высокой молярной массы порядка 104– 106 г/моль.
Наименьшая, многократно повторяющаяся группировка
атомов в цепи называется элементарным звеном (или
структурной единицей) полимера.
Число элементарных звеньев макромолекулы – степень
полимеризации (n), которая зависит от ряда факторов
(условий получения, строения элементарного звена и др.).
Mr (полимера) = nMr (элементарного
звена)
8.
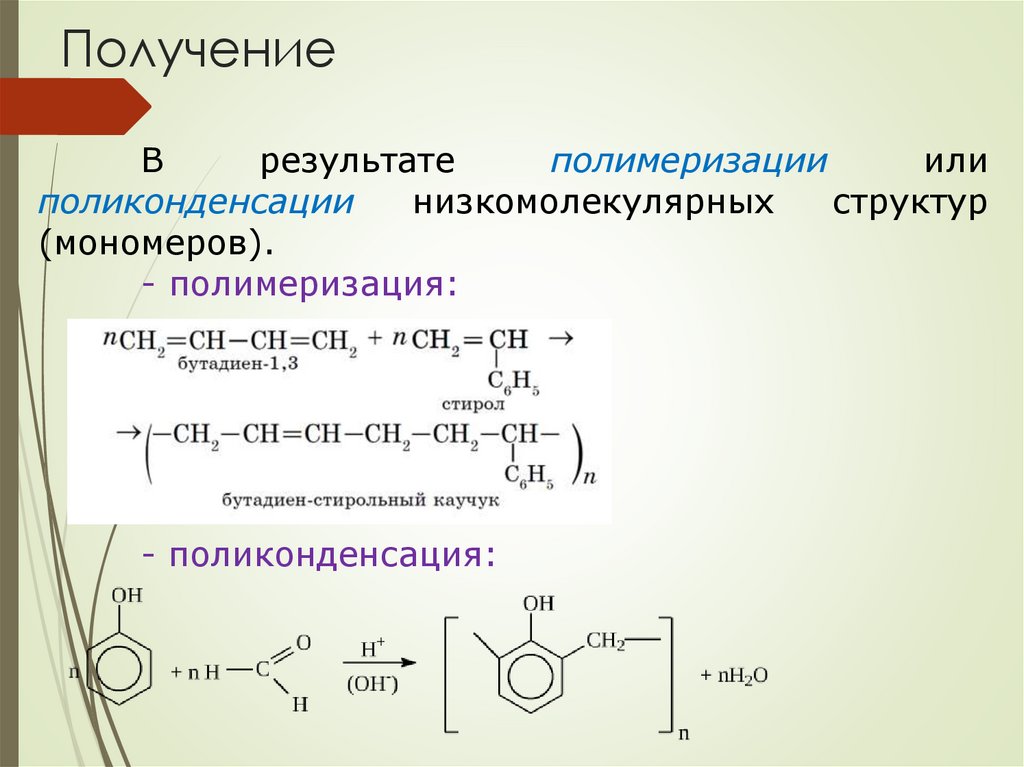
ПолучениеВ
результате
полимеризации
или
поликонденсации
низкомолекулярных
структур
(мономеров).
- полимеризация:
- поликонденсация:
9.
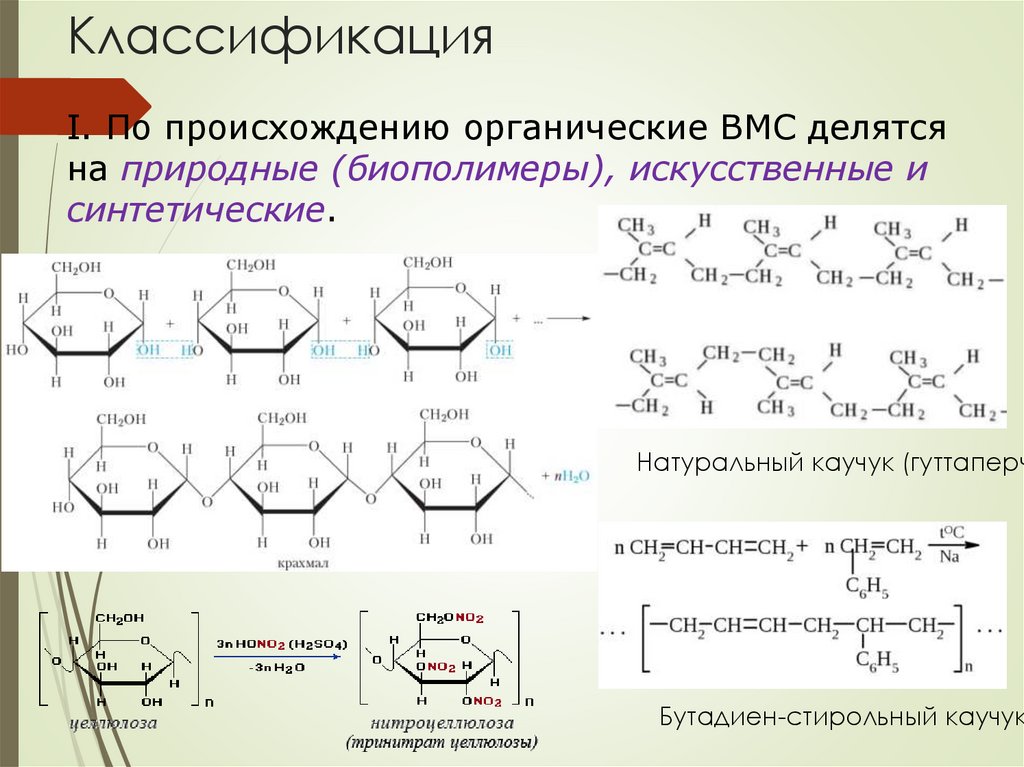
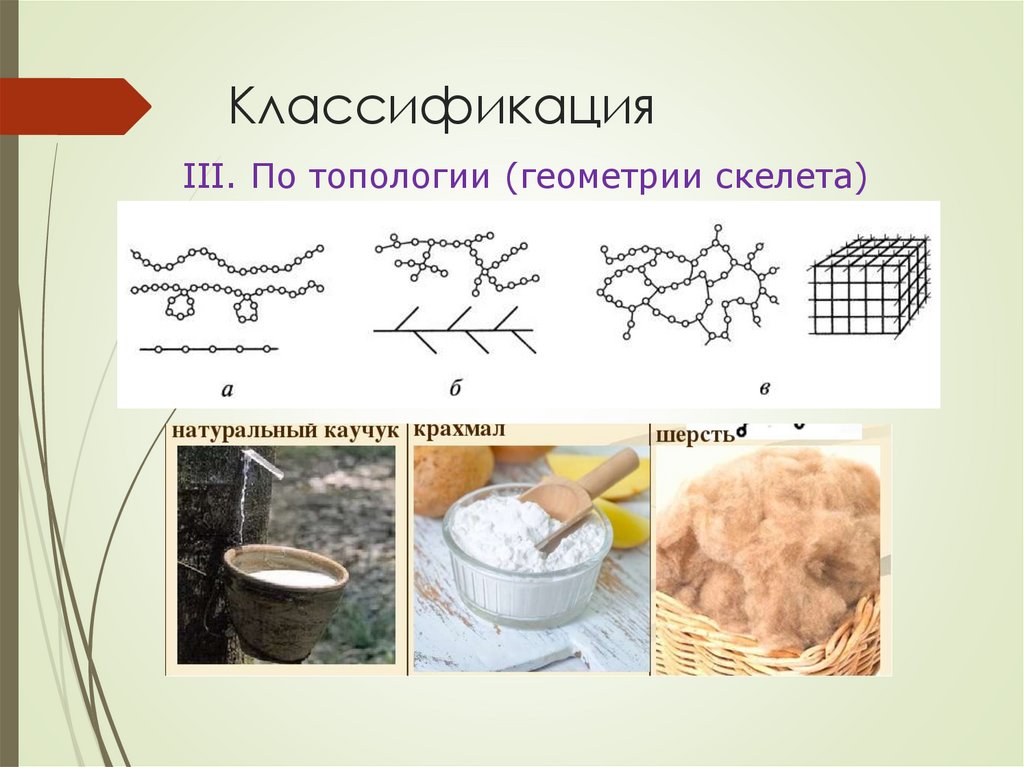
КлассификацияI. По происхождению органические ВМС делятся
на природные (биополимеры), искусственные и
синтетические.
Натуральный каучук (гуттаперч
Бутадиен-стирольный каучук
10.
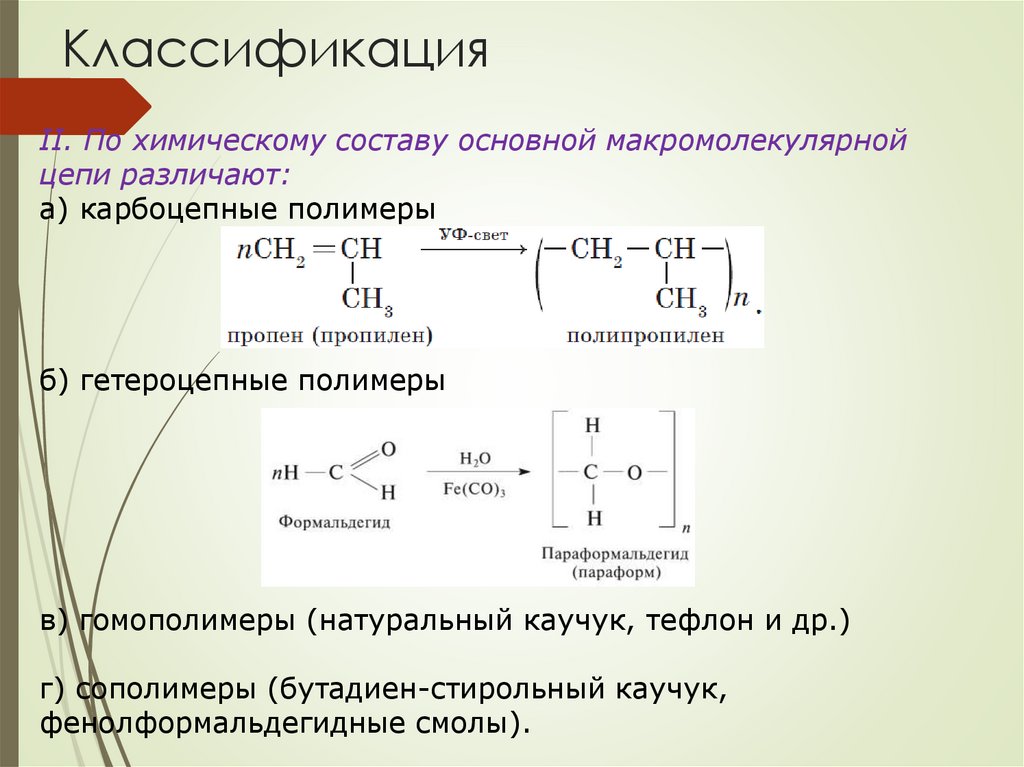
КлассификацияII. По химическому составу основной макромолекулярной
цепи различают:
а) карбоцепные полимеры
б) гетероцепные полимеры
в) гомополимеры (натуральный каучук, тефлон и др.)
г) сополимеры (бутадиен-стирольный каучук,
фенолформальдегидные смолы).
11.
КлассификацияIII. По топологии (геометрии скелета)
12.
Гибкость цепи. Механизмыгибкости
13.
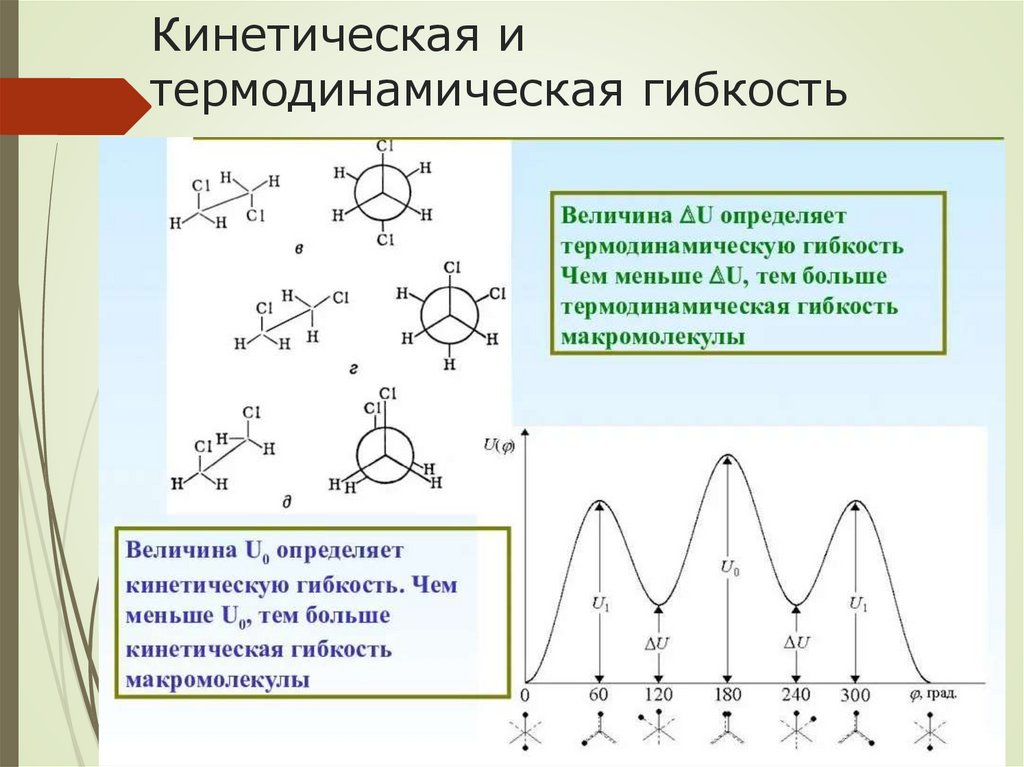
Кинетическая итермодинамическая гибкость
14.
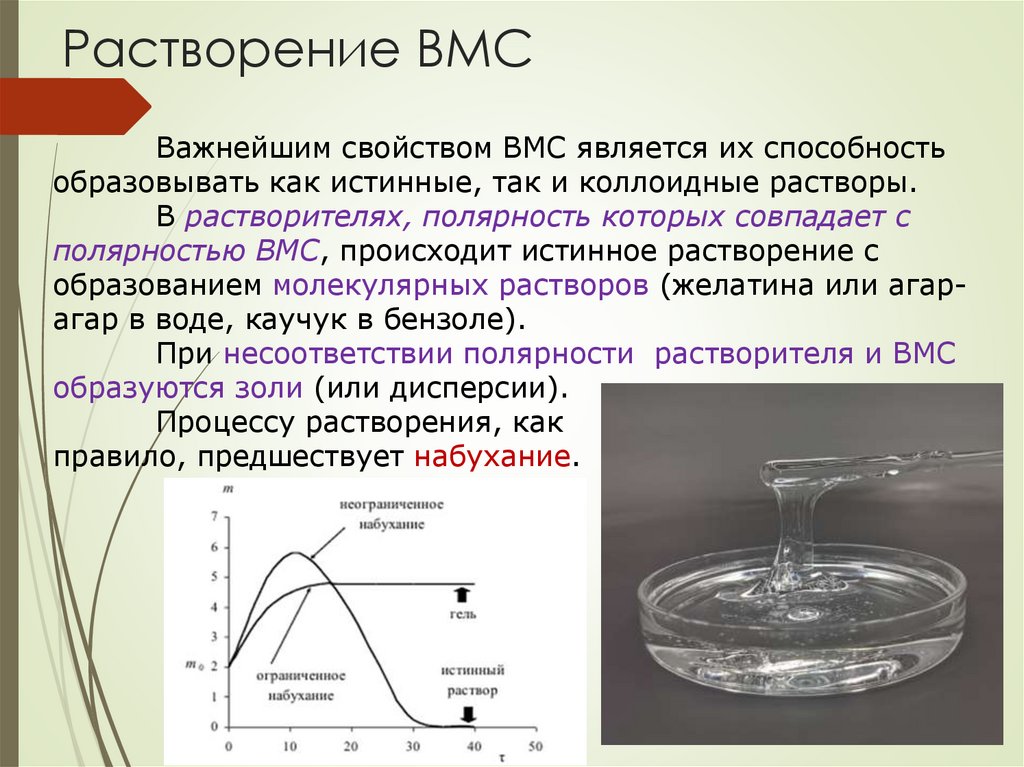
Растворение ВМСВажнейшим свойством ВМС является их способность
образовывать как истинные, так и коллоидные растворы.
В растворителях, полярность которых совпадает с
полярностью ВМС, происходит истинное растворение с
образованием молекулярных растворов (желатина или агарагар в воде, каучук в бензоле).
При несоответствии полярности растворителя и ВМС
образуются золи (или дисперсии).
Процессу растворения, как
правило, предшествует набухание.
15.
Растворение ВМС16.
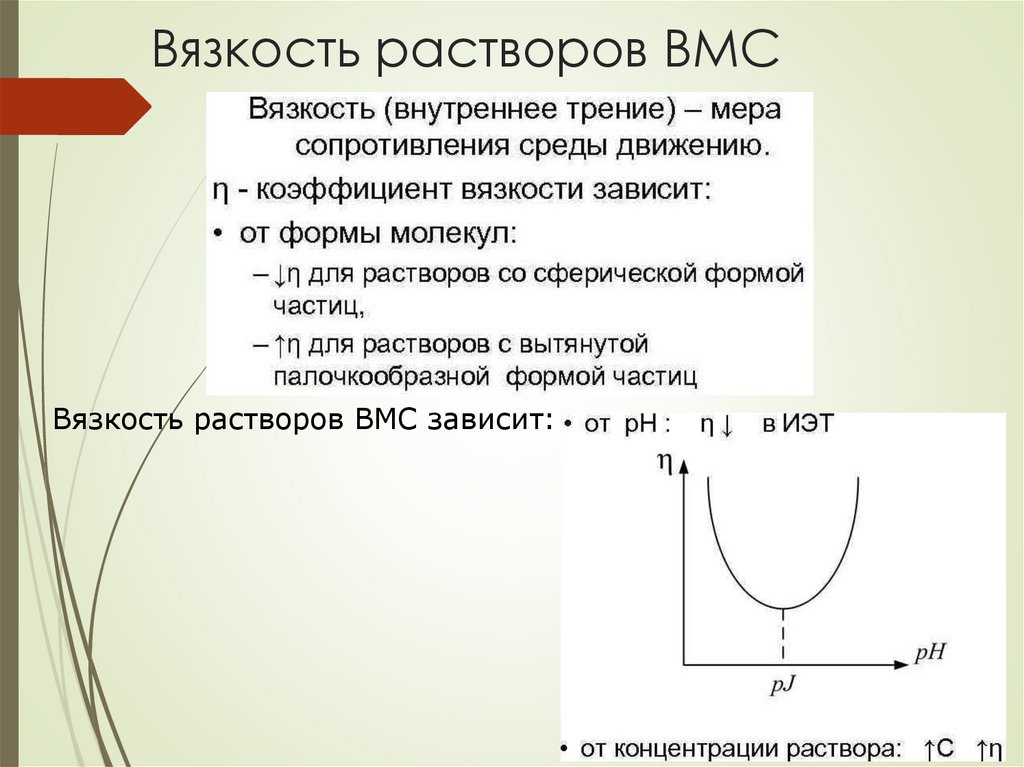
Вязкость растворов ВМСВязкость растворов ВМС зависит:
17.
Идеальные растворы. ТемператураФлори
18.
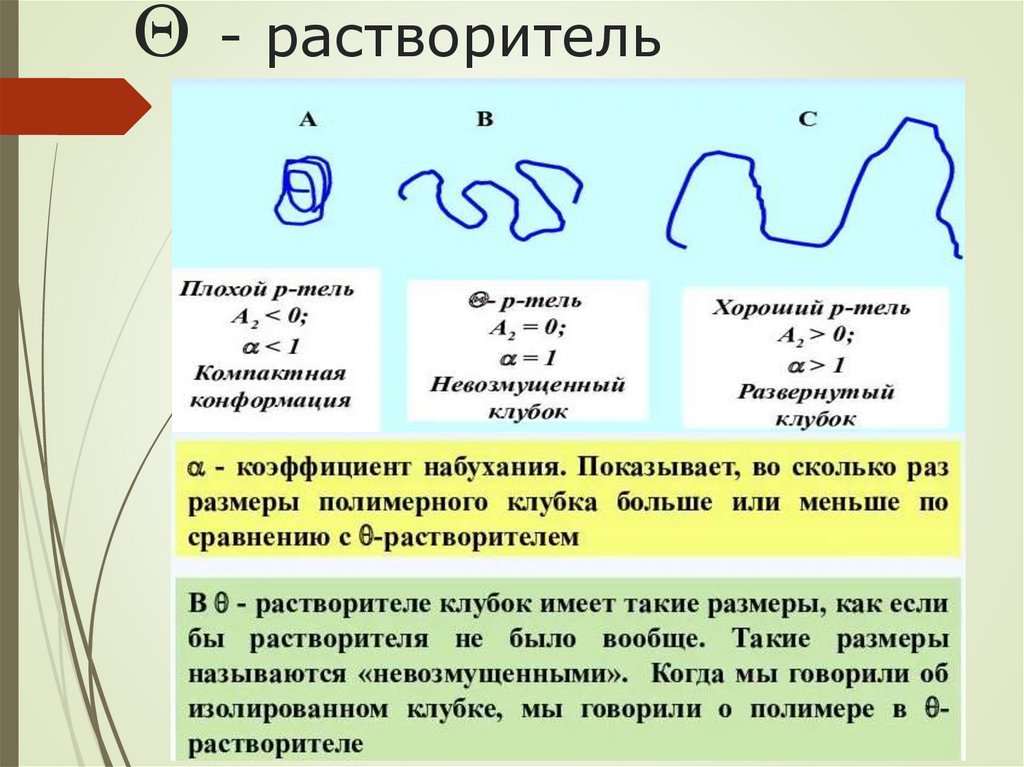
- растворитель19.
Вязкость растворов ВМС20.
Определение молекулярноймассы полимеров
21.
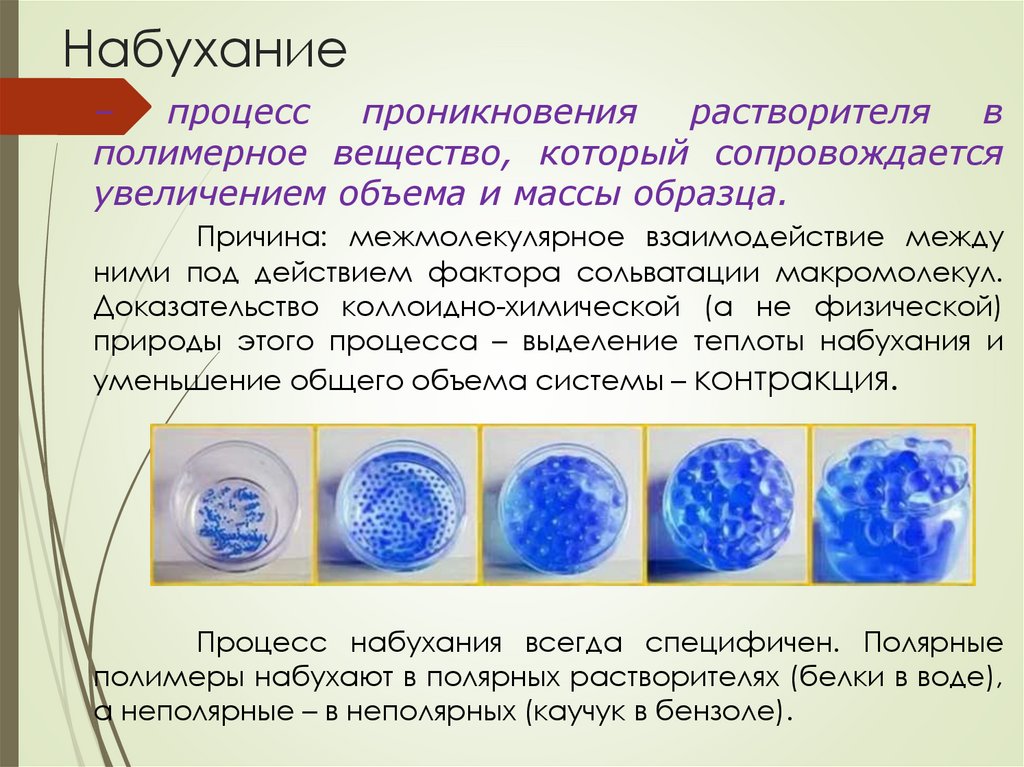
Набухание–
процесс
проникновения
растворителя
в
полимерное вещество, который сопровождается
увеличением объема и массы образца.
Причина: межмолекулярное взаимодействие между
ними под действием фактора сольватации макромолекул.
Доказательство коллоидно-химической (а не физической)
природы этого процесса – выделение теплоты набухания и
уменьшение общего объема системы – контракция.
Процесс набухания всегда специфичен. Полярные
полимеры набухают в полярных растворителях (белки в воде),
а неполярные – в неполярных (каучук в бензоле).
22.
Набухание23.
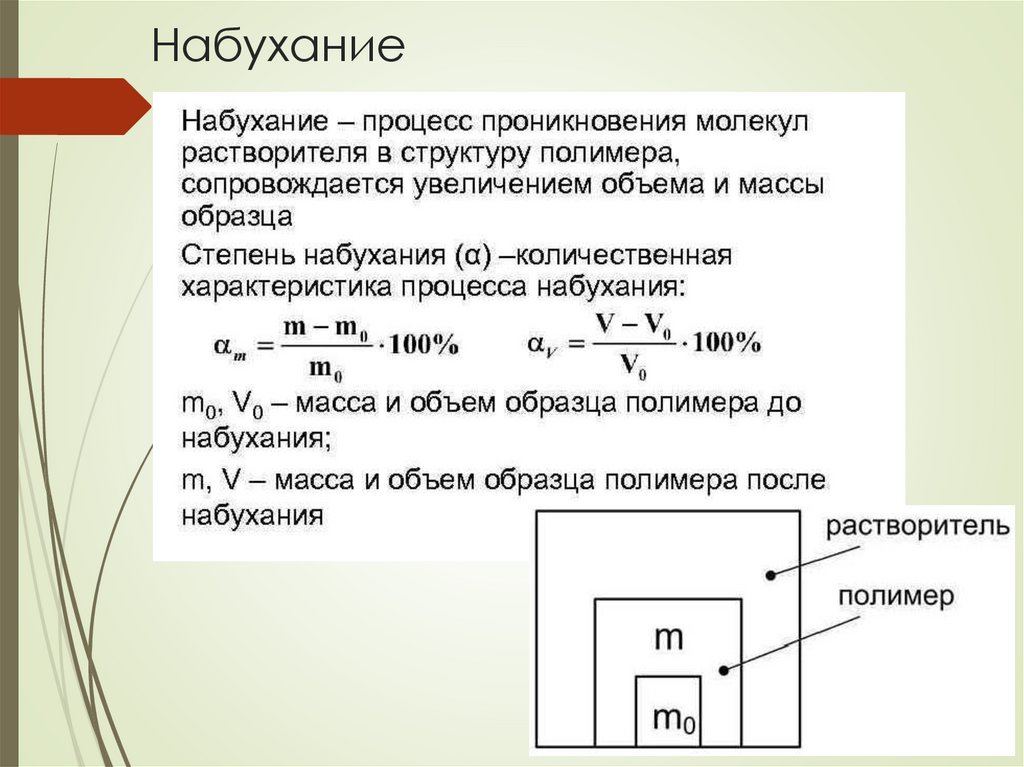
Набухание24.
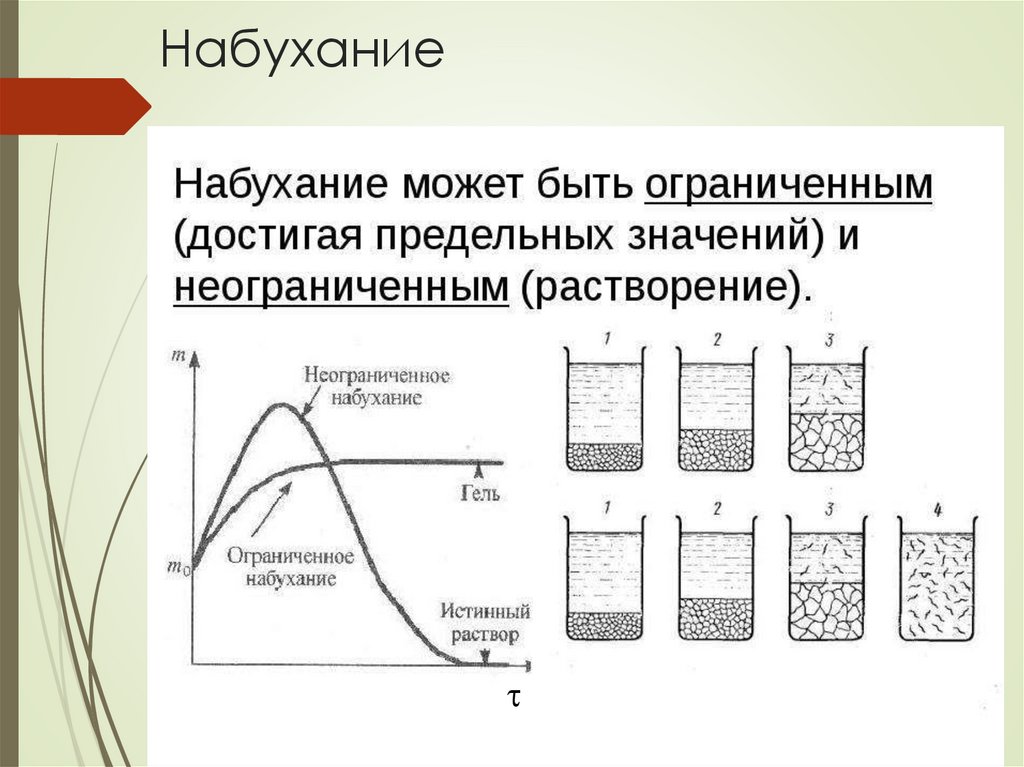
Механизм и термодинамиканабухания






















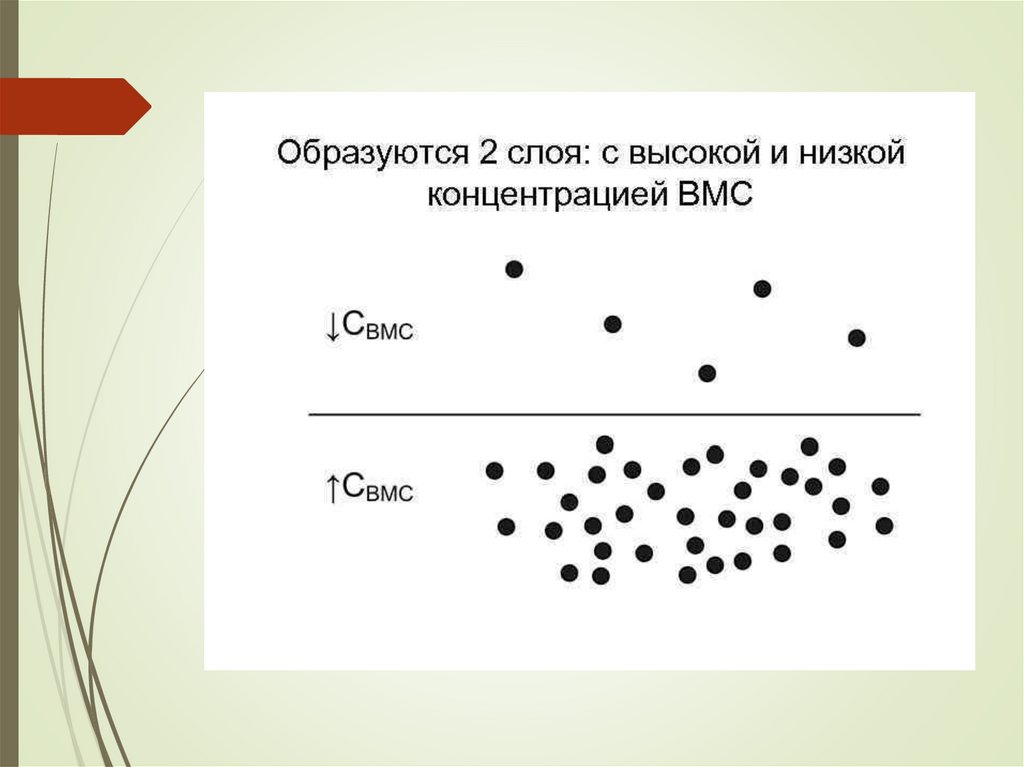

 chemistry
chemistry








