Similar presentations:
Коллоидная химия. Устойчивость и коагуляция дисперсных систем (лекция 12)
1.
Коллоидная химияИТХТ им. М.В. Ломоносова
кафедра НС и ПЯ
группы ХХБО-01,02,03-2022,
ХТБО-01-22
ЛЕКЦИЯ 12
Шубенкова Екатерина Гаррьевна
2.
Коллоидная химияЛЕКЦИЯ 12
Устойчивость и коагуляция дисперсных
систем.
2024
Шубенкова Е.Г.
3.
План лекции:1. Агрегативная и седиментационная устойчивость коллоидных систем.
Факторы устойчивости коллоидных систем. Стабилизаторы, их роль в придании
коллоидной системе временной агрегативной устойчивости.
2. Расклинивающее давление, его компоненты.
3. Устойчивость и коагуляция лиофобных дисперсных систем по теории ДЛФО.
Природа сил притяжения и отталкивания между частицами. Изменение этих
сил с расстоянием Потенциальные кривые, энергетический барьер, ближняя и
дальняя агрегация.
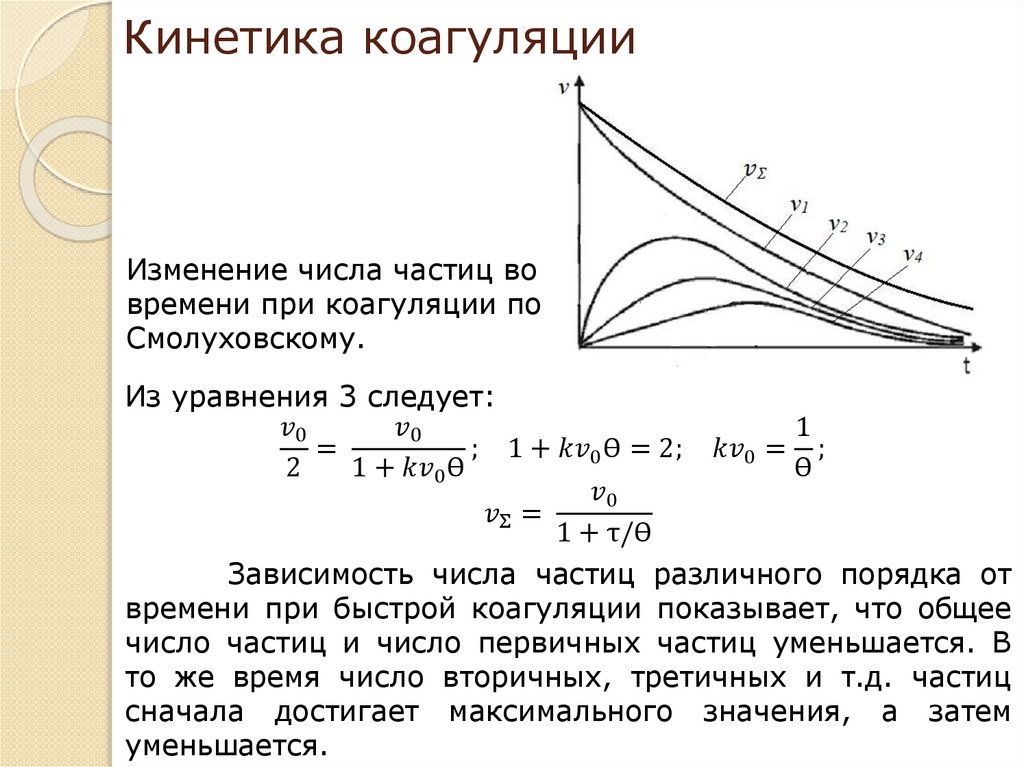
4. Кинетика коагуляции по Смолуховскому. Вывод уравнения для
концентрации частиц через время коагуляции. Константы скорости быстрой и
медленной коагуляции.
5. Зависимость скорости коагуляции от концентрации электролита, быстрая и
медленная коагуляция.
6. Кривые потенциальной энергии для систем с различной степенью
агрегативной устойчивости.
7. Концентрационная и нейтрализационная коагуляция.
8.Пептизация
как
физико-химический
метод получения
коллоидных
систем. Механизмы пептизации. Правило осадков Оствальда.
9.Правила коагуляции электролитами с точки зрения строения ДЭС.
4.
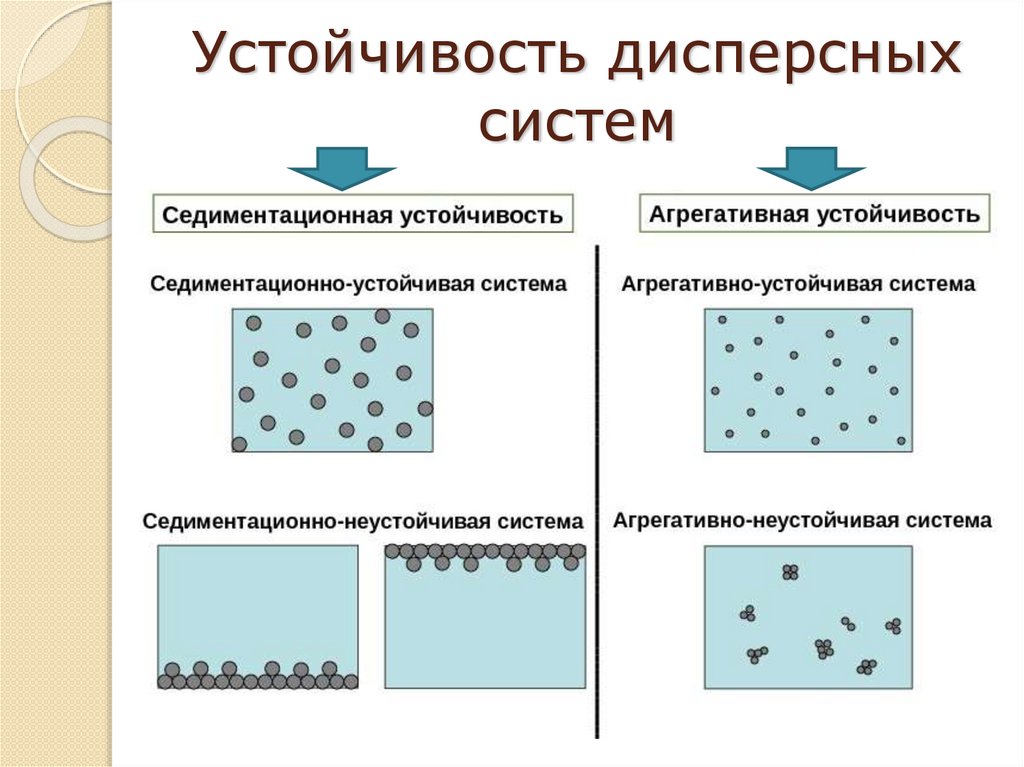
Устойчивость и коагуляциядисперсных систем
Устойчивость
основных
–
параметров
дисперсности
и
неизменность
во
времени
системы:
степени
распределения
частиц
дисперсной
равномерного
дисперсной фазы в дисперсионной среде.
Коагуляция
–
процесс
разрушения
коллоидных
систем за счет слипания частиц, образования более
крупных агрегатов с потерей устойчивости и последующим
разделением фаз.
4
5.
Устойчивость дисперсныхсистем
6.
Седиментационнаяустойчивость
7.
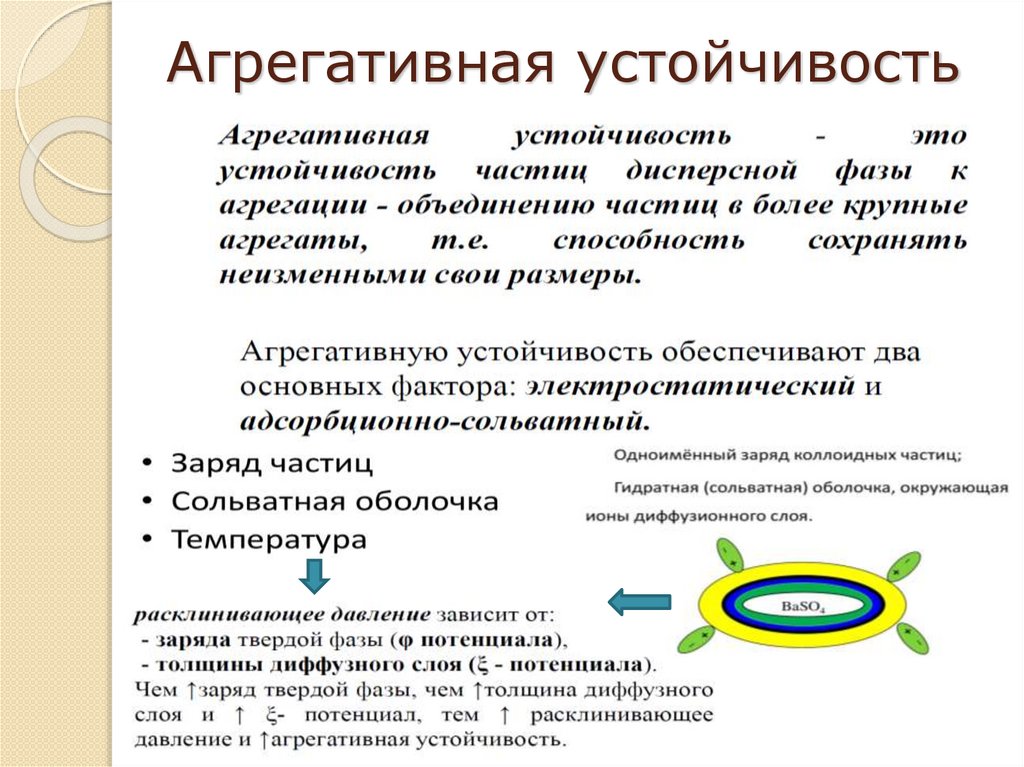
Агрегативная устойчивость8.
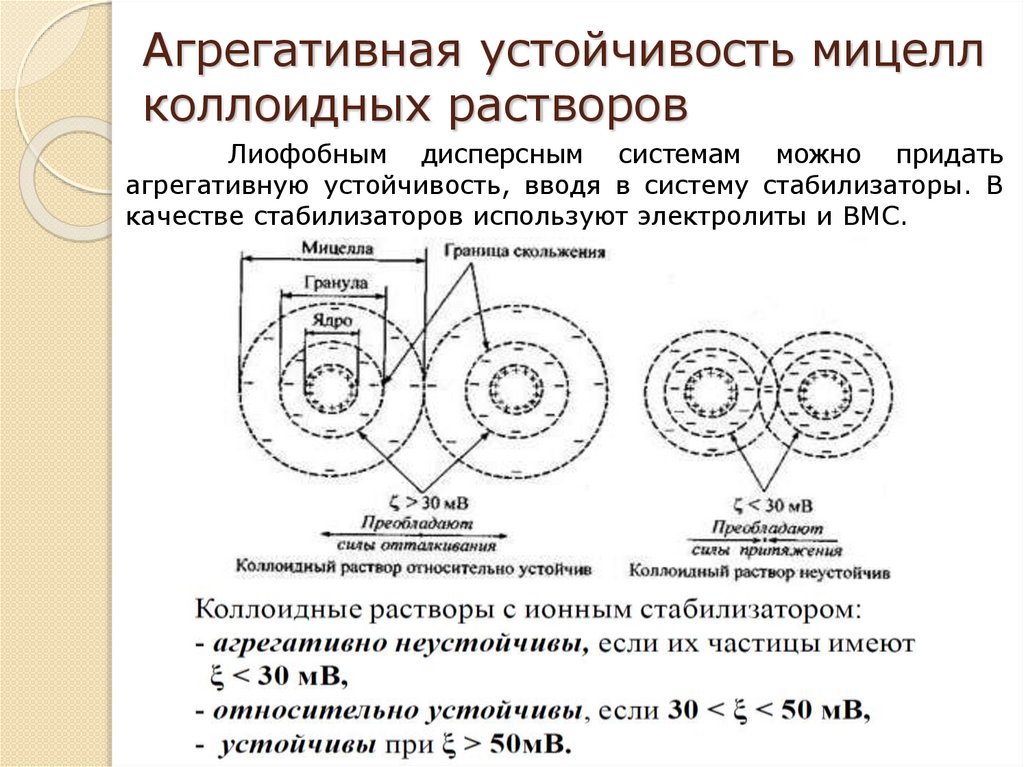
Агрегативная устойчивость мицеллколлоидных растворов
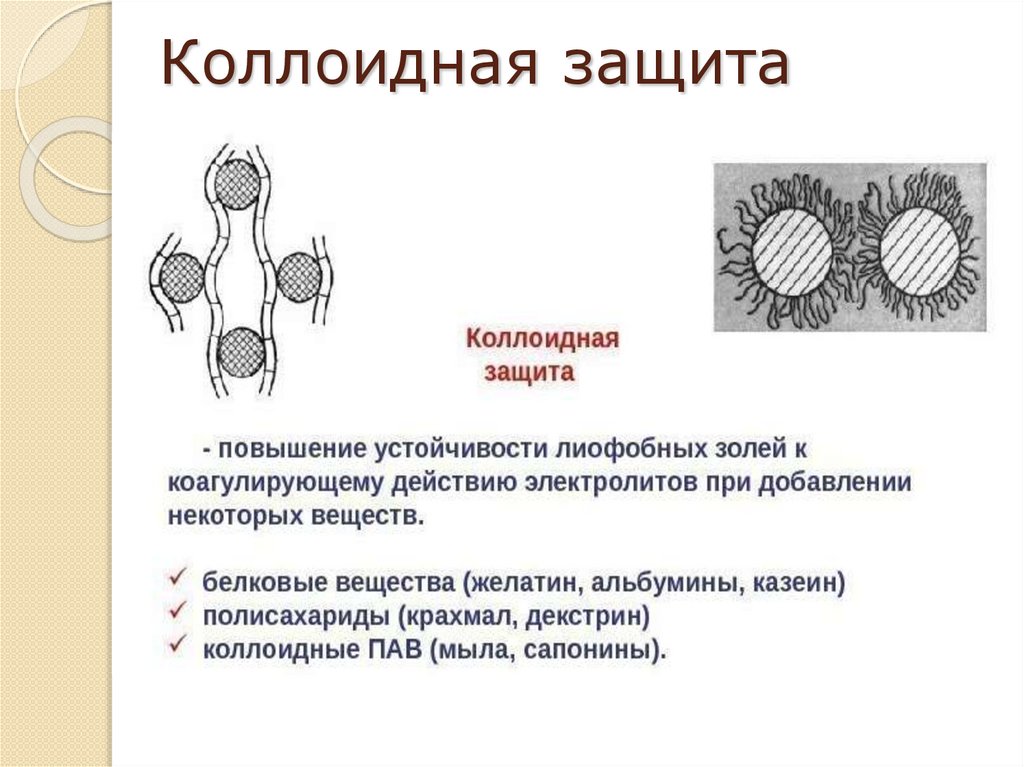
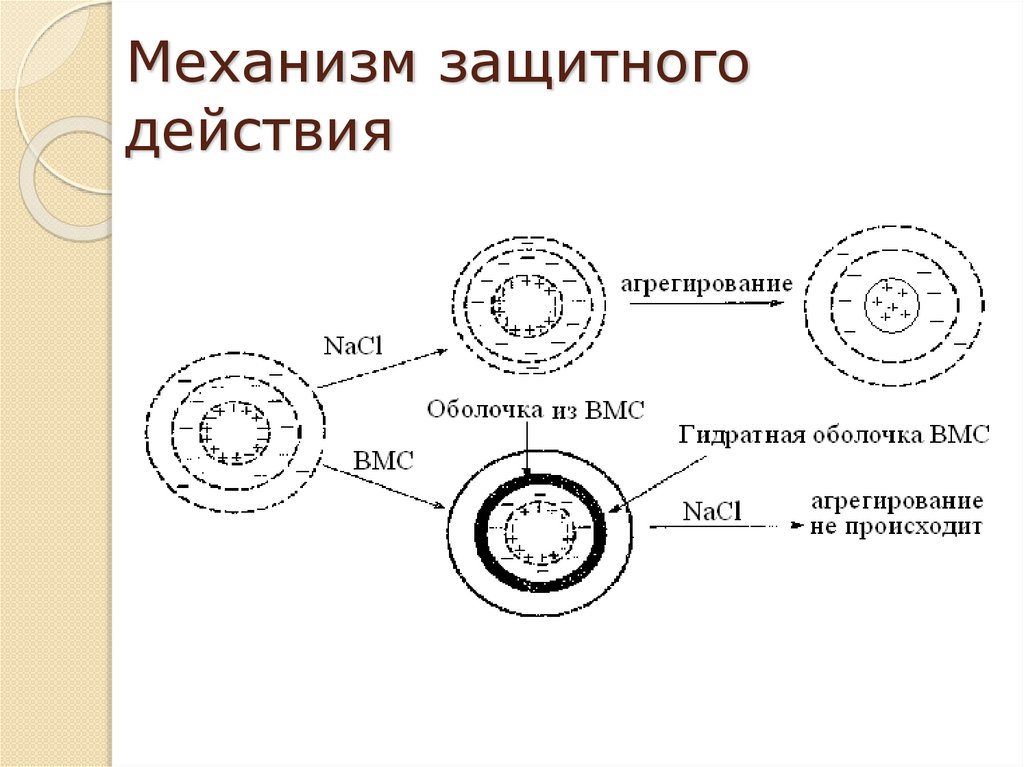
Лиофобным дисперсным системам можно придать
агрегативную устойчивость, вводя в систему стабилизаторы. В
качестве стабилизаторов используют электролиты и ВМС.
9.
Факторы устойчивости дисперсныхсистем
Факторы устойчивости подразделяют на:
-
термодинамические,
эти
факторы
уменьшают
вероятность
эффективных
соударений
между
частицами,
создают
потенциальные
барьеры,
замедляющие
или
даже
исключающие
процесс
коагуляции;
-
кинетические, которые связаны в основном с
гидродинамическими свойствами среды: с замедлением
сближения частиц, вытеснением и разрушением
прослоек среды между ними.
10.
Факторы устойчивости дисперсныхсистем
Термодинамические факторы:
1. Электростатический фактор – заключается в
уменьшении межфазного натяжения вследствие
возникновения ДЭС на поверхности частиц в
соответствии с уравнением Липпмана.
2.
Адсорбционно-сольватный фактор - состоит в
уменьшении межфазного натяжения при
взаимодействии частиц дисперсной фазы со средой в
соответствии с уравнением Дюпре для работы
адгезии или, при адсорбции ПАВ, в соответствии с
адсорбционным уравнением Гиббса.
11.
Факторы устойчивости дисперсныхсистем
3.
Стерический (энтропийный) фактор имеет двоякую
трактовку.
а) Фактор заключается в стремлении частиц дисперсной
фазы к равномерному распределению по объему системы;
б) Если стабилизатор ВМС или ПАВ с длинными гибкими
молекулами, то они адсорбируются на поверхности частиц
своими отдельными звеньями, при этом большая часть
цепи находится в дисперсионной среде и может совершать
микроброуновское движение. Стабилизация
осуществляется за счет отталкивания друг от друга гибких
участков цепных молекул, находящихся в среде.
Стабилизация частиц НПАВ
и высокомолекулярными
соединениями
12.
Факторы устойчивости дисперсныхсистем
Кинетические факторы:
Структурно-механический фактор заключается в том,
что на поверхности частиц имеются пленки, обладающие
упругостью и механической прочностью, разрушение
которых требует определенной энергии и времени. Этот
фактор возникает в том случае, когда в качестве
стабилизаторов используют ВМС.
Гидродинамический
фактор
снижает
скорость
коагуляции благодаря изменению вязкости среды и
плотности дисперсной фазы и дисперсионной среды.
В реальных системах наиболее часто реализуется
смешанный фактор, т.е.
агрегативная устойчивость
обеспечивается несколькими факторами одновременно.
Особенно
высокая
устойчивость
наблюдается
при
совокупности действия термодинамических и кинетических
факторов, когда наряду со снижением межфазного
натяжения проявляются структурно-механические свойства
межчастичных прослоек.
13.
Коагуляция14.
Коагуляция под действием электролитовПорог
коагуляции
(γ,
Скр)
–
наименьшая
концентрация электролита, достаточная для того, чтобы
вызвать коагуляцию золя
V C
( C кр )
Коагулирующая
способность
обратная порогу коагуляции
P
W
(Р)
–
величина,
1
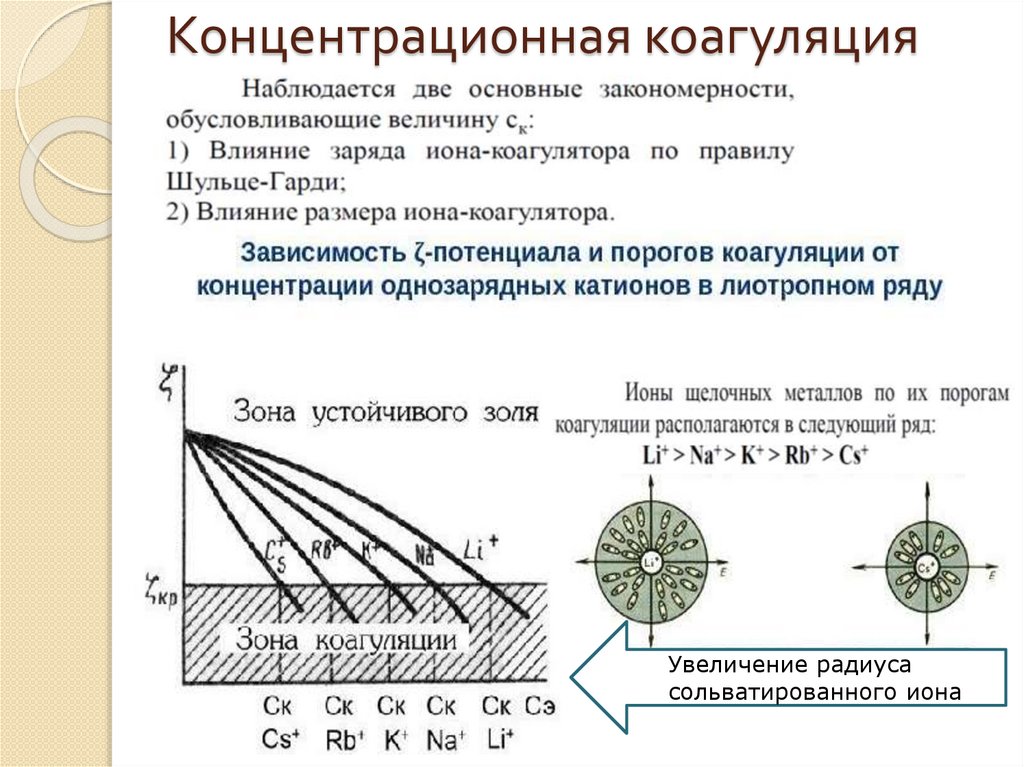
•Влияние заряда иона-коагулятора (правило ШульцеГарди):
коагулирующая
способность
электролита
возрастает с увеличением заряда иона – коагулятора
const
n
z
n=2÷6
Na Ca 2 Al 3 Th4
возрастани е коагулирующей способности
15.
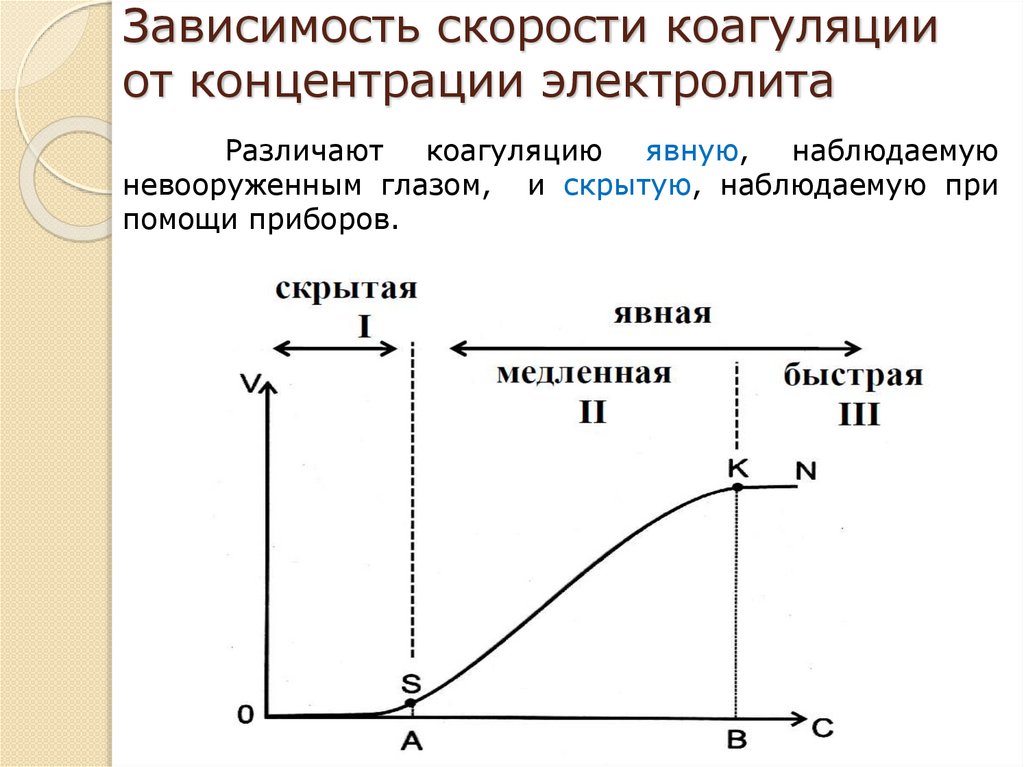
Зависимость скорости коагуляцииот концентрации электролита
Различают коагуляцию явную, наблюдаемую
невооруженным глазом, и скрытую, наблюдаемую при
помощи приборов.
16.
Теории коагуляцииАдсорбционные
Электростатические
17.
Теория Фрейндлиха(адсорбционная)
18.
Теория Мюллера(электростатическая)
19.
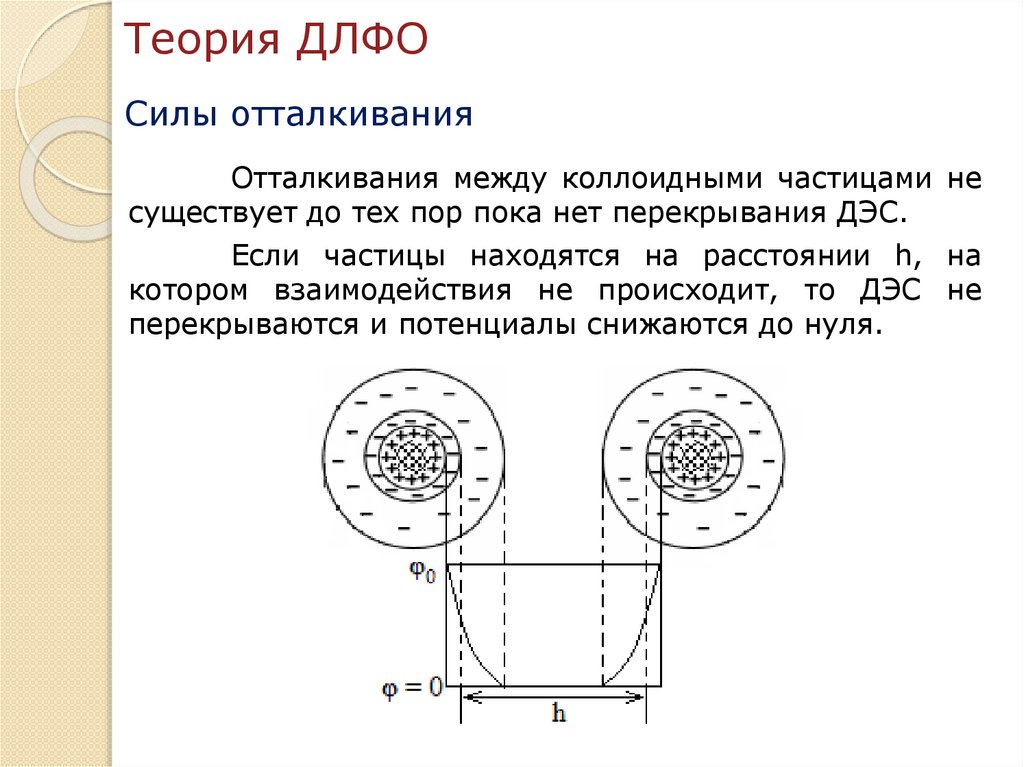
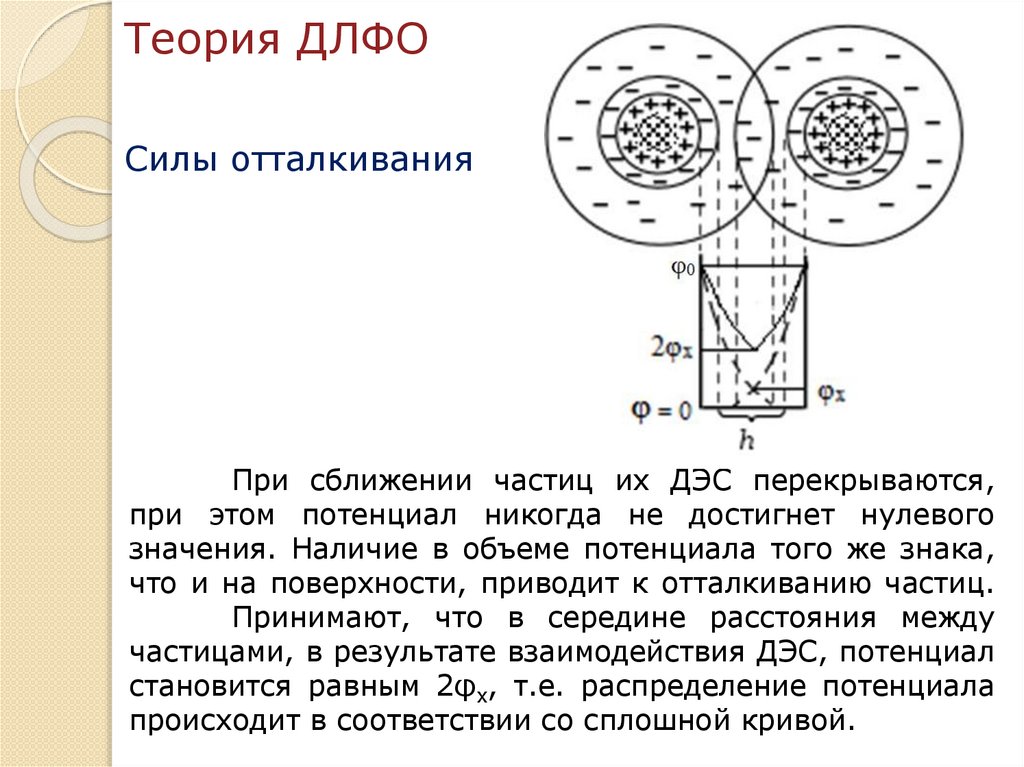
Теория агрегативной устойчивости икоагуляции лиофобных дисперсных
систем (теория ДЛФО).
Теория устойчивости лиофобных дисперсных систем (ДЛФО)
была разработана в 1937-1943 гг. независимо друг от друга
Б.В. Дерягиным и Л.Д. Ландау в СССР и Э. Фервеем и Дж. Т.
Овербеком в Голландии. Теория названа по первым буквам
фамилий авторов.
Борис Владимирович
Дерягин
(1902 – 1994)
Русский физико-химик, создал
учение о поверхностных силах
и их влиянии на
расклинивающее давление и
свойства тонких жидких
пленок.
Лев Давидович
Ландау
(1908 – 1968)
Советский физик-теоретик.
Лауреат Нобелевской премии
по физике 1962 года. (За
новаторские теории
конденсированных сред, в
особенности жидкого гелия).
20.
Теория ДЛФО (Дерягина и Ландау,Фервея и Овербека (1937-1941 г.г.))
21.
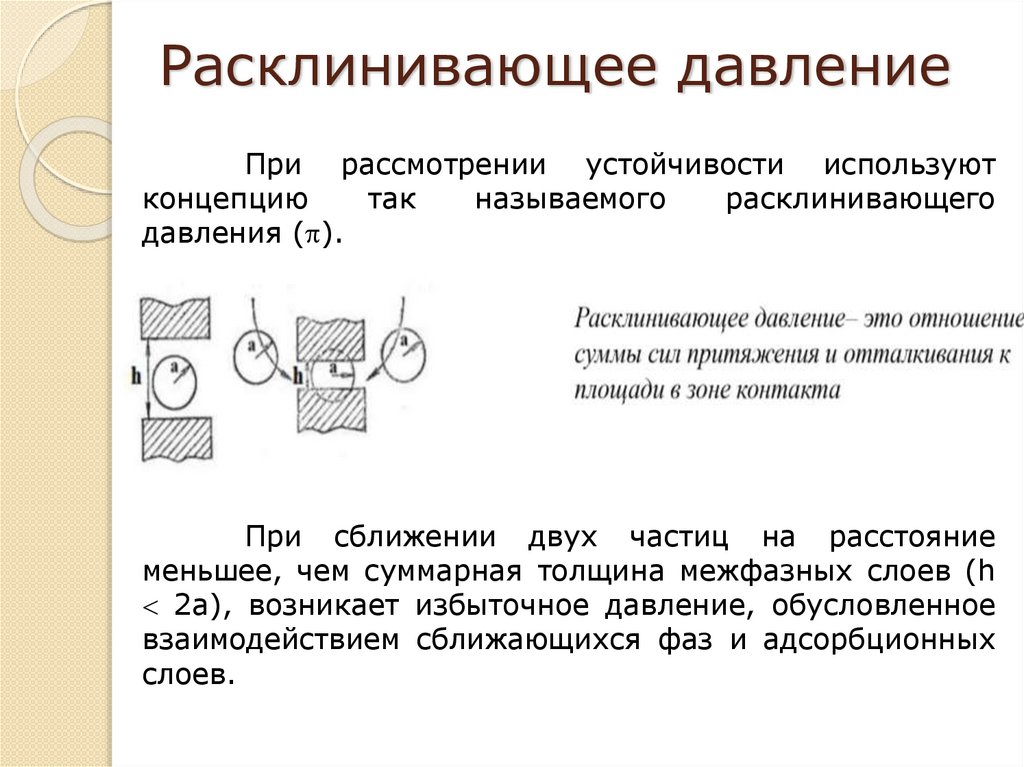
Расклинивающее давлениеПри рассмотрении устойчивости используют
концепцию
так
называемого
расклинивающего
давления ( ).
При сближении двух частиц на расстояние
меньшее, чем суммарная толщина межфазных слоев (h
2a), возникает избыточное давление, обусловленное
взаимодействием сближающихся фаз и адсорбционных
слоев.
22.
Расклинивающее давление23.
Теория ДЛФОСилы притяжения
Силы притяжения между частицами по своей
природе являются силами Ван-дер-Ваальса.
Известно, что силы Ван-дер-Ваальса имеют
тройственную природу: ориентационные, индукционные
и наиболее универсальные дисперсионные.
Ориентационные
между двумя диполями.
взаимодействия
возникают
Индукционные
взаимодействия
–
это
взаимодействия между диполем полярного вещества и
индуцированным им диполем в неполярной молекуле.
Причиной
дисперсионных
взаимодействий
является квантово-механический эффект, связанный с
флуктуациями электрических полей атомов и молекул.
24.
Теория ДЛФОСилы притяжения
Особенностью дисперсионных сил
дальнодействие.
Оно
обусловлено
причинами:
1) Дисперсионные
силы аддитивны, т.к.
флуктуации
электронных плотностей
приводят к возникновению переменного
диполя, способного наводить диполи в
других молекулах.
2) Дисперсионное взаимодействие синхронно
с несколькими молекулами без взаимной
конкуренции,
в
отличие
от
ориентационных и индукционных сил, при
действии
которых
наблюдается
конкуренция между разными диполями.
Если два диполя расположены оптимально
друг к другу, то они не могут быть
расположены оптимально по отношению к
третьему диполю.
является их
следующими
25.
Теория ДЛФОСилы притяжения
3) Для дисперсионных систем характерен эффект
электромагнитного запаздывания, который состоит в том,
что флуктурирующие электромагнитные поля атомов
распространяются со скоростью света в рассматриваемой
среде. При частоте 10¹⁵с-1 за один период свет проходит
расстояние около 100 нм.
Если расстояние между атомами превышает 100
нм, то происходит изменение фазы колебания, прежде
чем электромагнитная волна дойдет от одного атома до
другого.
Электромагнитные волны, исходящие от атомов,
разделенных расстоянием более 100 нм не совпадают по
фазе,
что
приводит
к
медленному
ослаблению
взаимодействия
между
частицами.
Это
явление
называется электромагнитным запаздыванием.
26.
Теория ДЛФОСилы притяжения
В
общем
виде
энергия
следующей формулой:























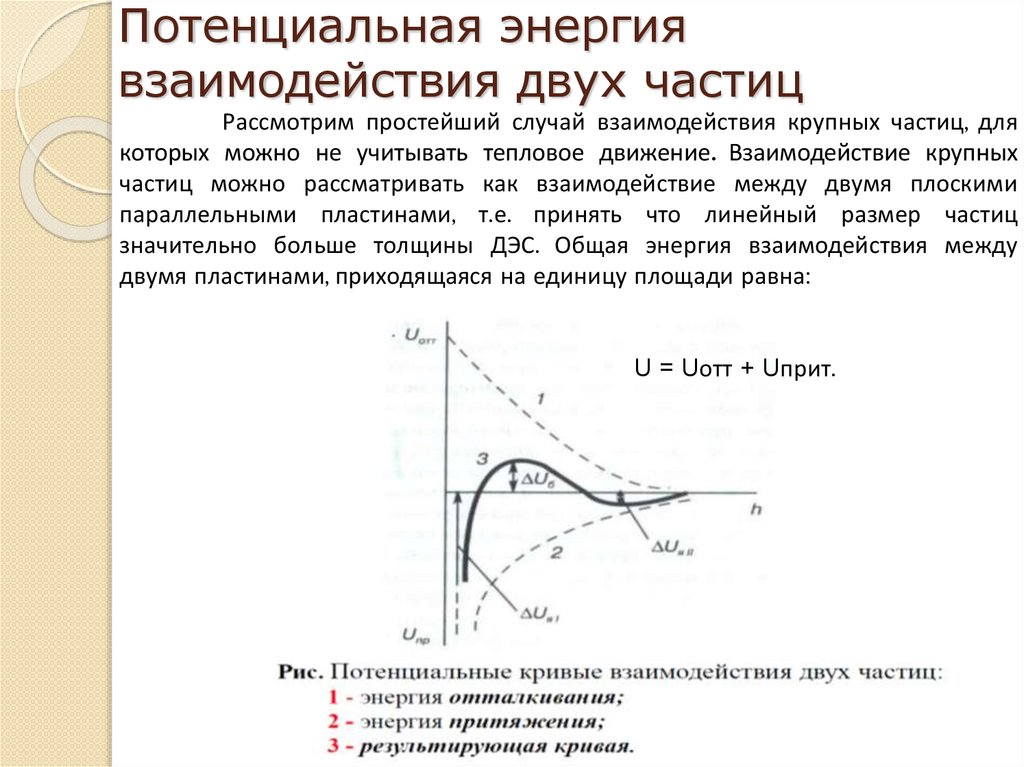


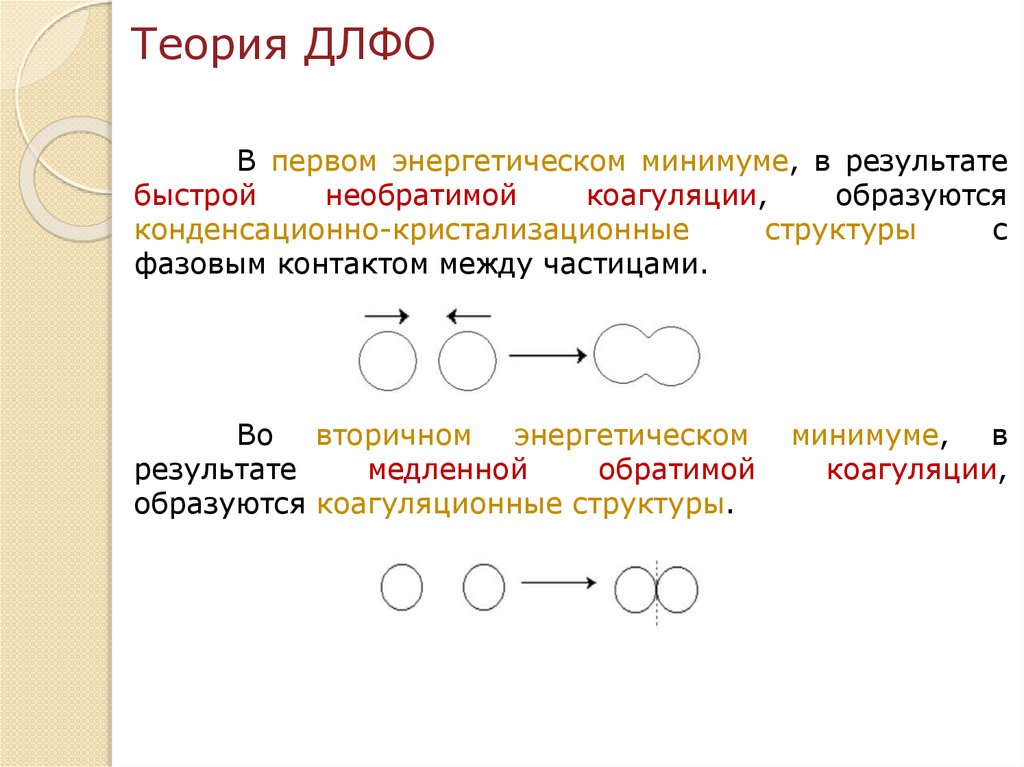
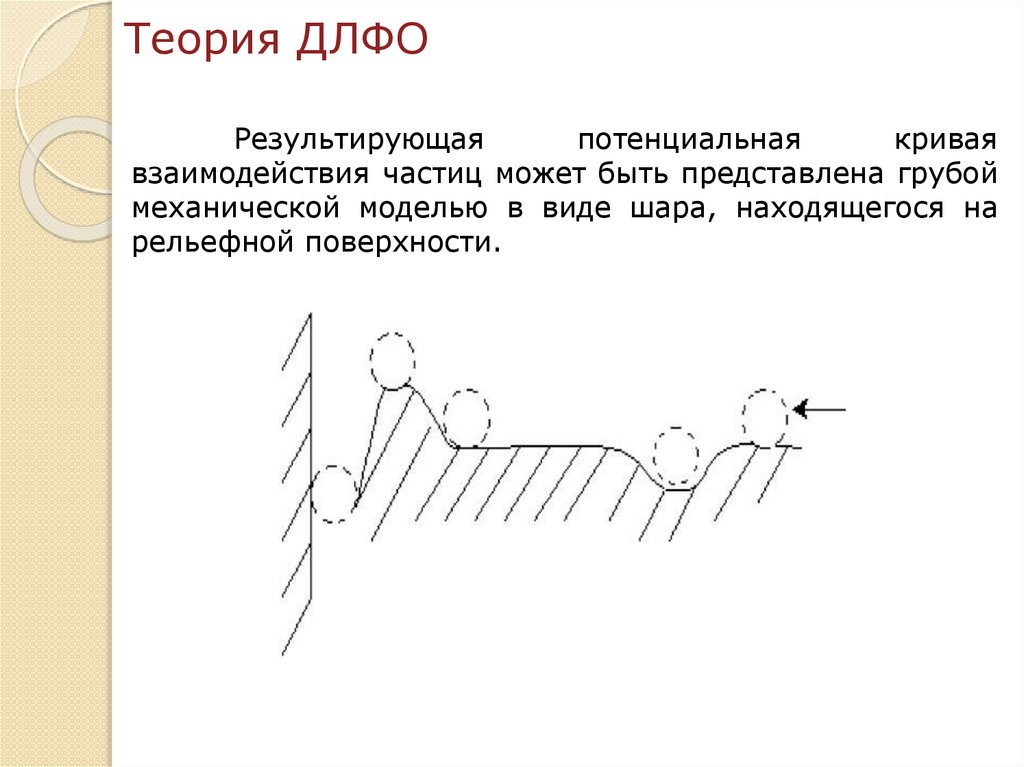
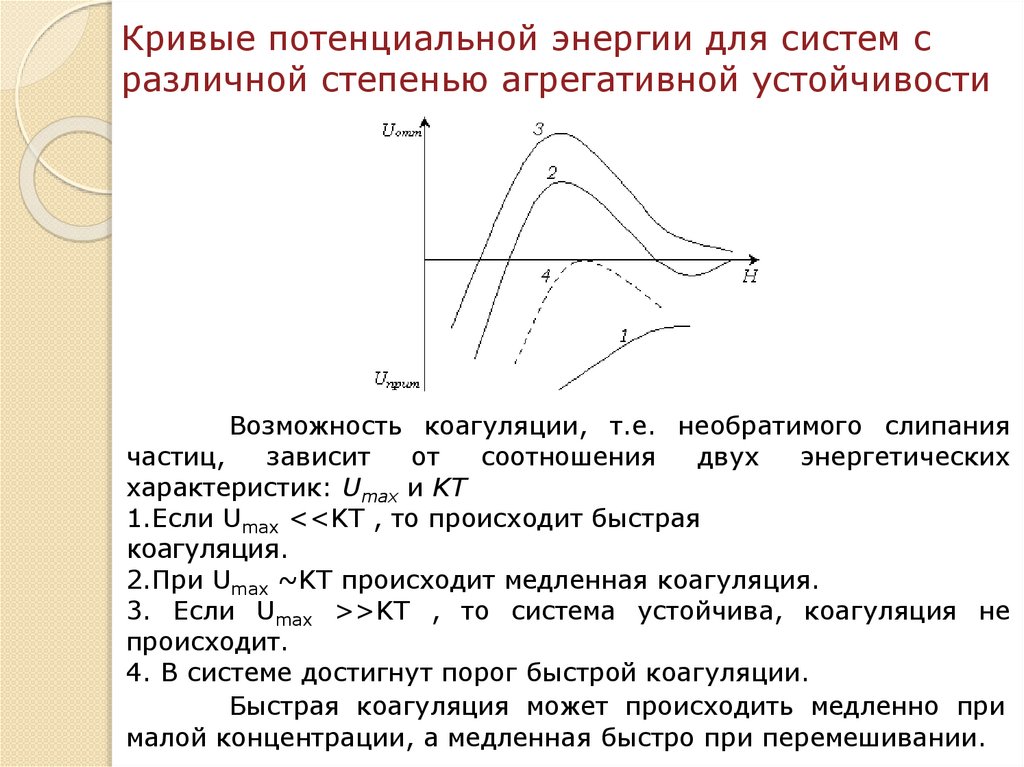















 chemistry
chemistry








