Similar presentations:
Биогенные элементы
1.
ОМСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙУНИВЕРСИТЕТ
Кафедра химии
Биогенные элементы
1. Классификация.
2. Биогеохимические провинции. Эндемические
заболевания.
3. Общая характеристика элементов s-блока.
4. Общая характеристика элементов d-блока.
5. Общая характеристика элементов p-блока.
Лектор: доктор биологических наук, профессор, зав.
кафедрой химии Степанова Ирина Петровна.
2.
БиогеохимияВЕРНАДСКИЙ
Владимир Иванович
(1863-1945)
В экспедиции по поиску радиоактивных
материалов. 1911 г. Закавказье
В начале 20 в. советским академиком Вернадским
на основе геохимии, биологии и биохимии была
создана новая наука – биогеохимия.
3.
БиогеохимияБиогеохимия – наука, изучающая взаимосвязь
элементарного химического состава земной
коры и живых организмов, а также миграцию
химических элементов и их круговорот в
системе «живая материя – земля».
4.
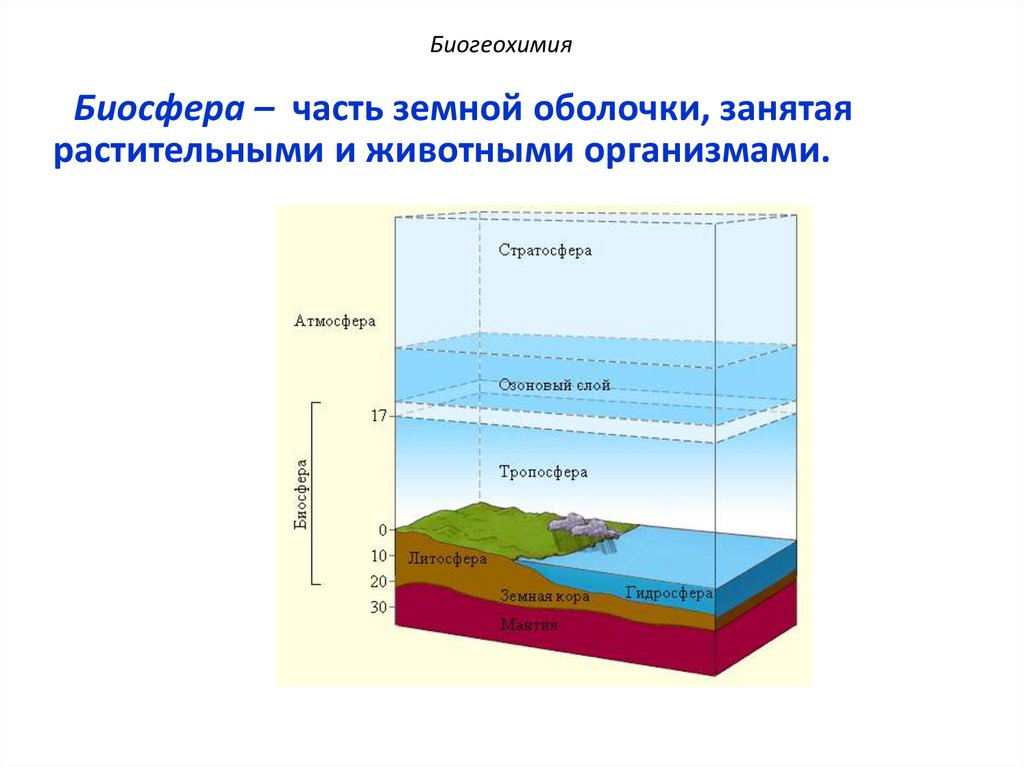
БиогеохимияБиосфера – часть земной оболочки, занятая
растительными и животными организмами.
5.
БиогеохимияВ процессе деятельности живых организмов в
биосфере образуются минералы и различные
природные вещества.
Известно ≈ 90 хим.
элементов в составе
земной коры.
В составе живых организмов
обнаружено около 75 химических
элементов периодической системы.
6.
БиогеохимияРеальные зоны, в которых в результате
жизнедеятельности осуществляется круговорот
элементов, называют экосистемами или, по
определению
академика
В.Н.
Сукачева,
биогеоценозами.
Согласно учению В.И. Вернадского, оболочку
нашей планеты, измененную хозяйственной
деятельностью человека, называют ноосферой.
Главную роль в ноосфере играет техногенная
миграция элементов – техногенез.
7.
Биогенные элементыХимические элементы, находящиеся в
живом организме и обладающие выраженной
физиологической ролью называются биогенными
элементами.
8.
Классификация биогенных элементовНа биологическую роль химических элементов
оказывают влияние следующие факторы:
• заряд ядра атома,
• радиус атома или иона,
• энергия гидратации иона,
• значения координационных чисел атомов,
• растворимость природных соединений данного
элемента в воде.
9.
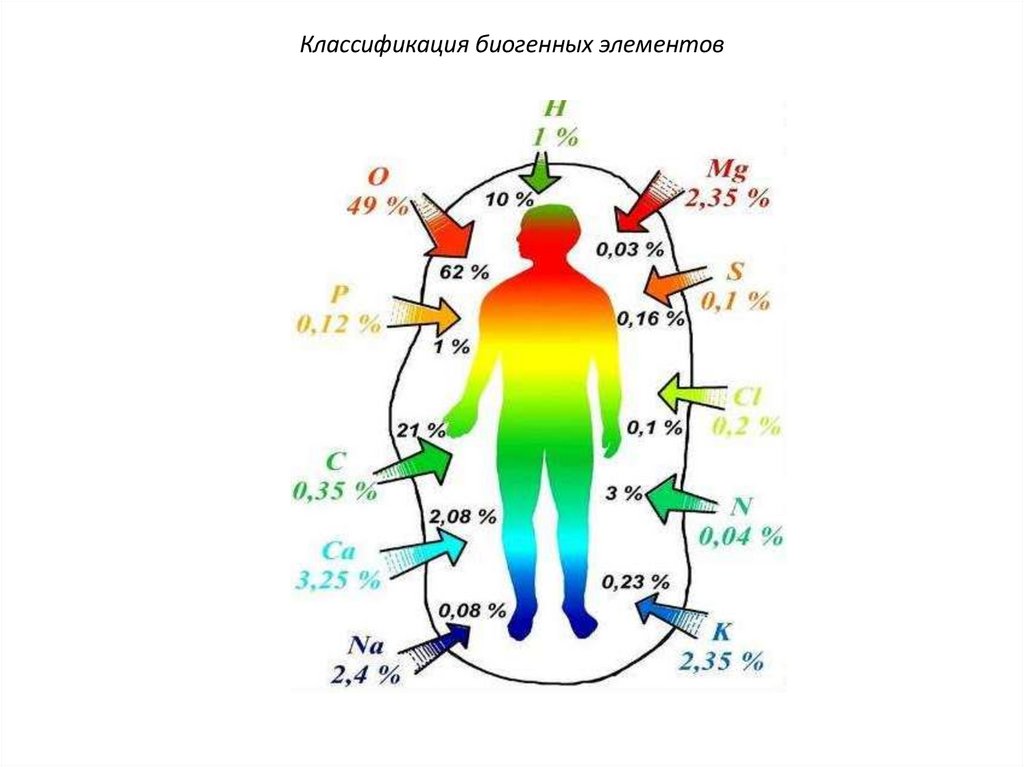
КлассификацияI. В зависимости от массовой доли элемента в
организме (ω%) элементы делятся на
следующие группы:
1) макроэлементы, содержащие ω ≥10-3%
от массы организма
С O H N P S
Cl Ca Na Mg K
10.
Классификация биогенных элементов11.
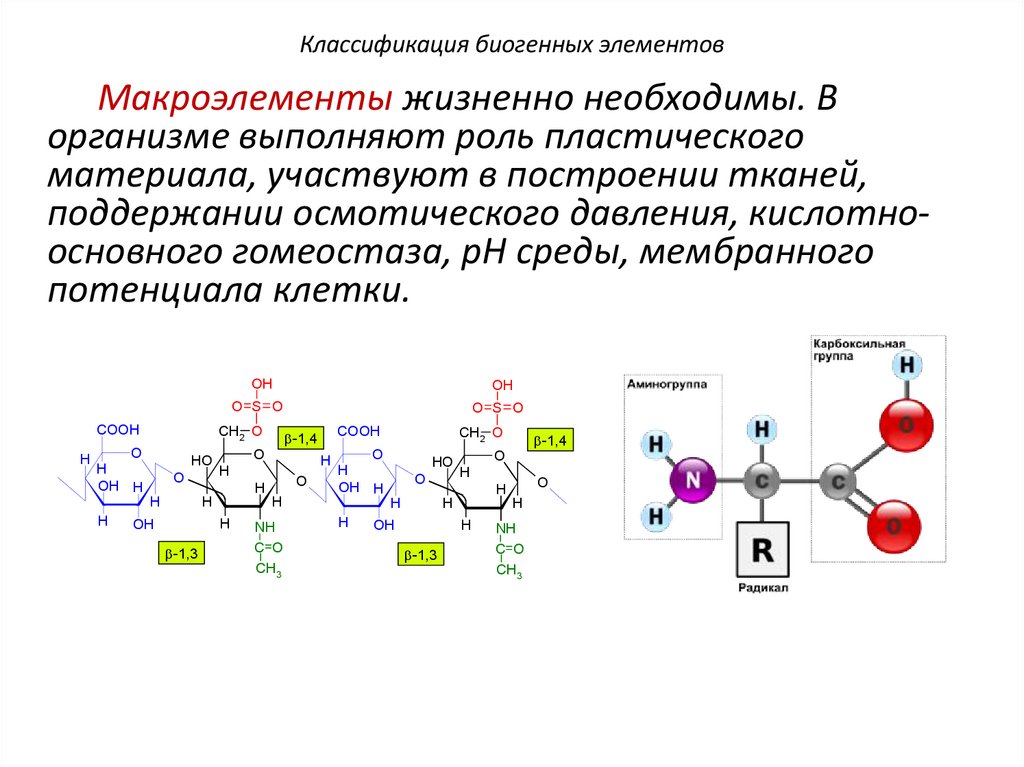
Классификация биогенных элементовМакроэлементы жизненно необходимы. В
организме выполняют роль пластического
материала, участвуют в построении тканей,
поддержании осмотического давления, кислотноосновного гомеостаза, рН среды, мембранного
потенциала клетки.
COOH
H
OH
O S O
O S O
CH2 O
O
HO
H
OH H
O
H
H
OH
O
O
H
H
H
-1,3
H
H
H
OH
-1,4
NH
C O
CH3
COOH
CH2 O
O
O
HO
H
OH H
O
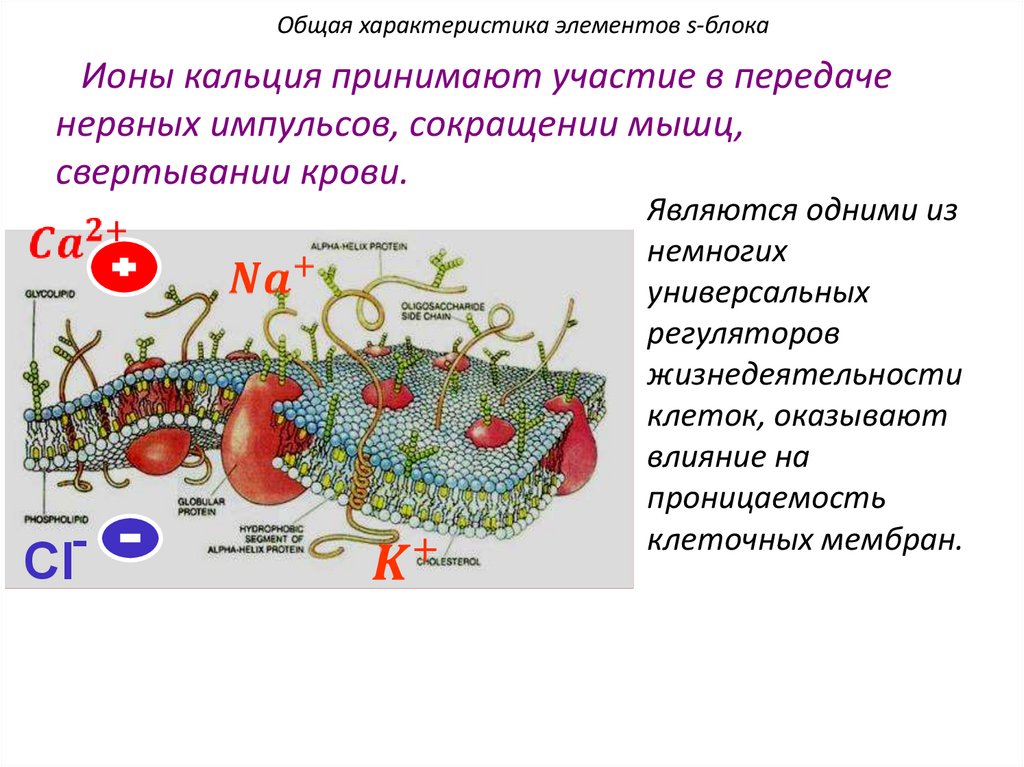
H
H
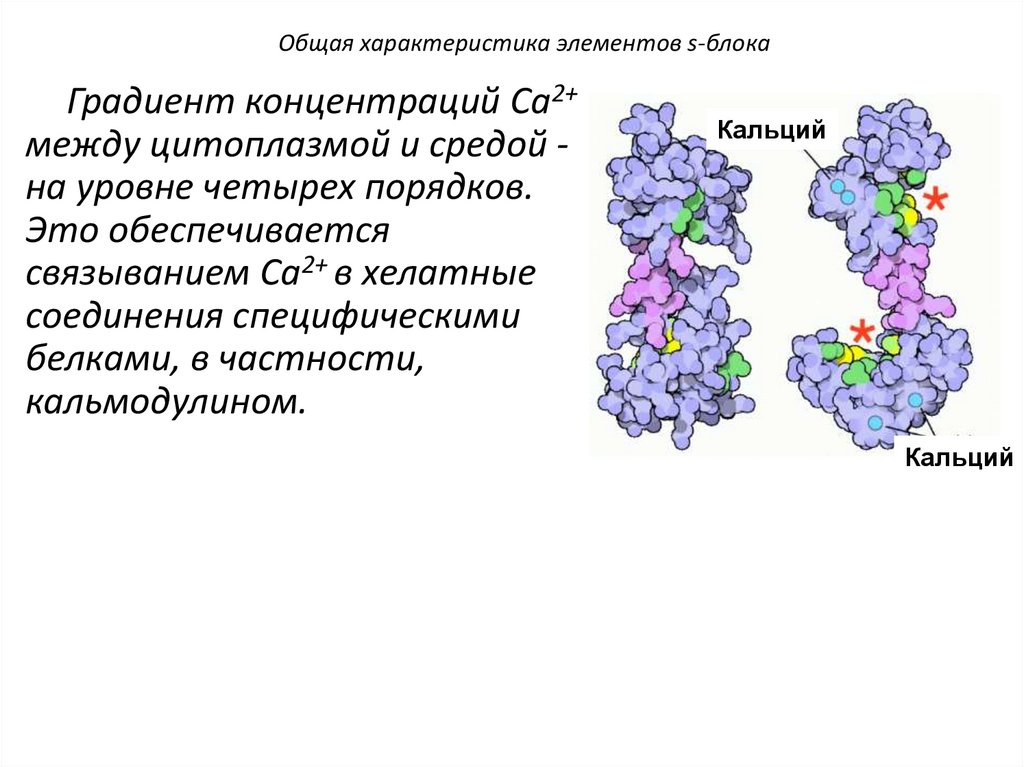
H
H
H
-1,3
O
H
H
OH
-1,4
NH
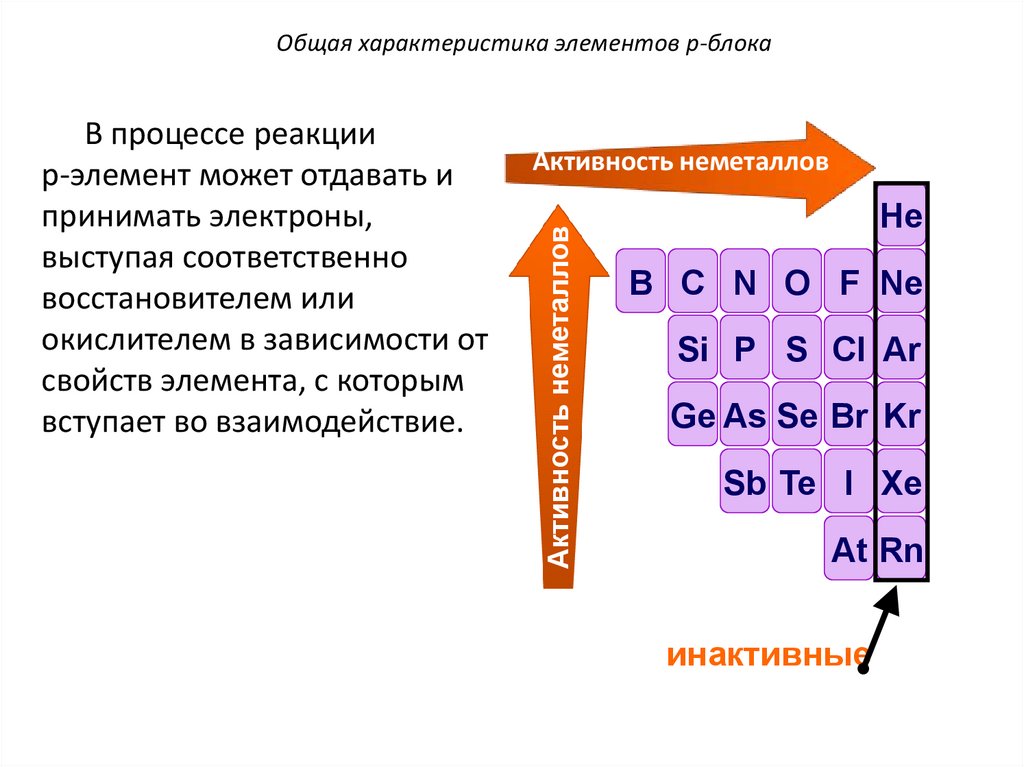
C O
CH3
12.
Классификация биогенных элементов2) микроэлементы: ω от 10-3 до 10-5 %
от массы организма.
Cu Mo Co Cr
Fe F
Br
I
13.
Классификация биогенных элементовМикроэлементы входят в структуру и
активные центры ферментов, находятся в
составе витаминов, гормонов, влияют на обмен
белков, жиров, углеводов.
Глутатионпероксидаза (КФ 1.11. 1.9) –
селензависимый фермент
14.
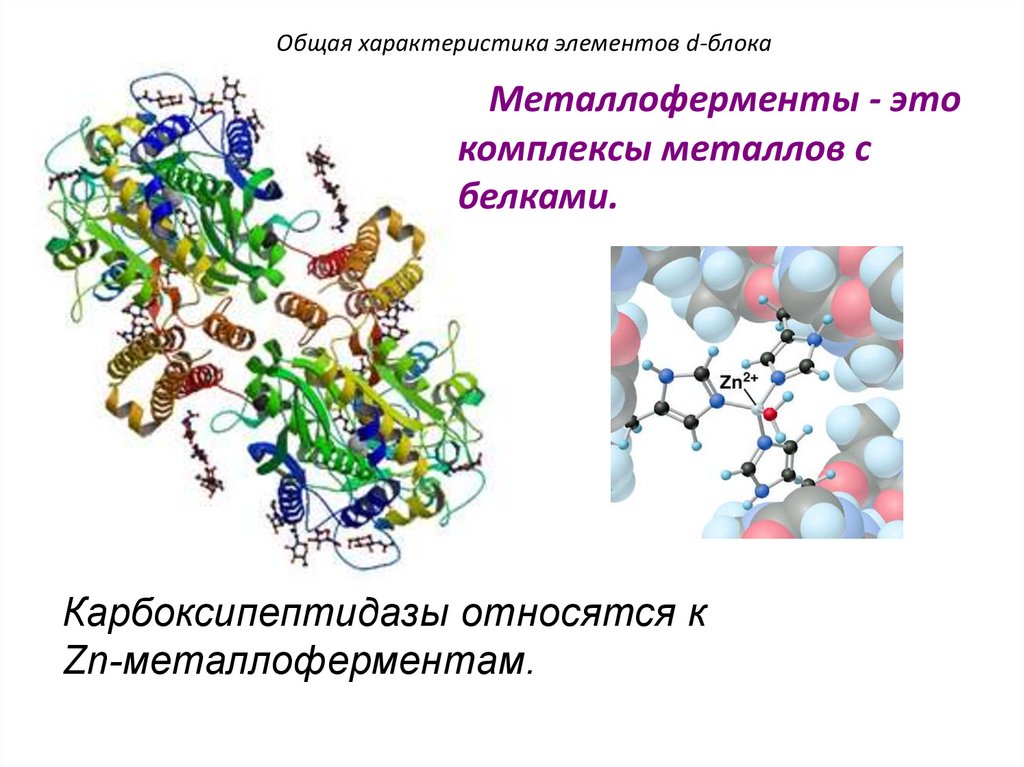
Классификация биогенных элементовДля белкового, углеводного и липидного
обмена веществ необходимы: Fe, Co, Mn, Zn, Мо, V,
В, W; в синтезе белков участвуют: Mg, Мn, Fe, Со,
Си, Ni, Сr; в кроветворении – Со, Ti, Си, Mn, Ni, Zn; в
дыхании – Mg, Fe, Сu, Zn, Mn и Co.
Микроэлементы входят в состав большого числа
биорегуляторов живых систем, в основе которых
лежат биокомплексы -биокластеры.
15.
Классификация биогенных элементов3) Ультрамикроэлементы - ω <10-5 % от массы
тела организма.
Ag
Au
Pt
Hg
Ra
Cs
Биологическая роль ультромикроэлементов
мало изучена.
16.
Классификация биогенных элементовII. В зависимости от значимости химических
элементов в процессе жизнедеятельности (по В.В.
Ковальскому) различают 3 группы:
1)Жизненно
необходимые
(незаменимые,
биогенные, эссенциальные) элементы.
C H O N P S Na K
Ca Mg Mn Cu Co Fe
Zn Mo Cr Cl I Se
17.
Классификация биогенных элементовЭти элементы постоянно содержаться в
животном организме, входят в состав ферментов,
гормонов и витаминов. Их дефицит приводит к
нарушению нормальной жизнедеятельности
организма.
Группа эссенциальных элементов включает в
себя все макроэлементы, часть микро- и
ультамикроэлементов.
18.
Классификация биогенных элементовСреди жизненно необходимых элементов девять
являются катионами металлов - Са2+, Na+, К+, Mg2+,
Мп2+, Zn2+, Fe2+, Си2+, Со2+ и катион водорода - Н+.
Другие являются анионами или содержатся в
анионных группировках: Сl-, I-, РО43-, SO42-, МоО32- и
SeO32- , НСО32-.
19.
Классификация биогенных элементов2)Физиологически активные (условно
эссенциальные) элементы - они постоянно
содержаться в животном организме. Биологическая
роль их выяснена не до конца.
Ga SbSr Br F B Be Li
Si Sn Cs Al Ba Ge As
Rb Ra Bi Cd Cr Ni Ti
20.
Классификация биогенных элементов3)Примесные элементы - они обнаружены в
животном организме, но данные об их количестве
и биологическая роль не выяснены.
Примесные
элементы
также
делят
на
аккумулирующиеся
(Hg,
Pb,
Cd)
и
неаккумулирующиеся (Al, Ag, Go, Ti, F).
Sc
Ta In
La
21.
Классификация биогенных элементовIII. По функциональной роли элементы принято
делить на 3 группы:
1) органогены - в организме их 97,4%.
С H O N P S
22.
Классификация биогенных элементов2) элементы электролитного фона - эти ионы
металлов составляют 99% общего содержания ионов
металлов в организме.
Na K Ca Mg Cl
23.
Классификация биогенных элементов2) микроэлементы
Cu Mo Co Cr
Ba F
Br
I
Mn Mo As Sr
24.
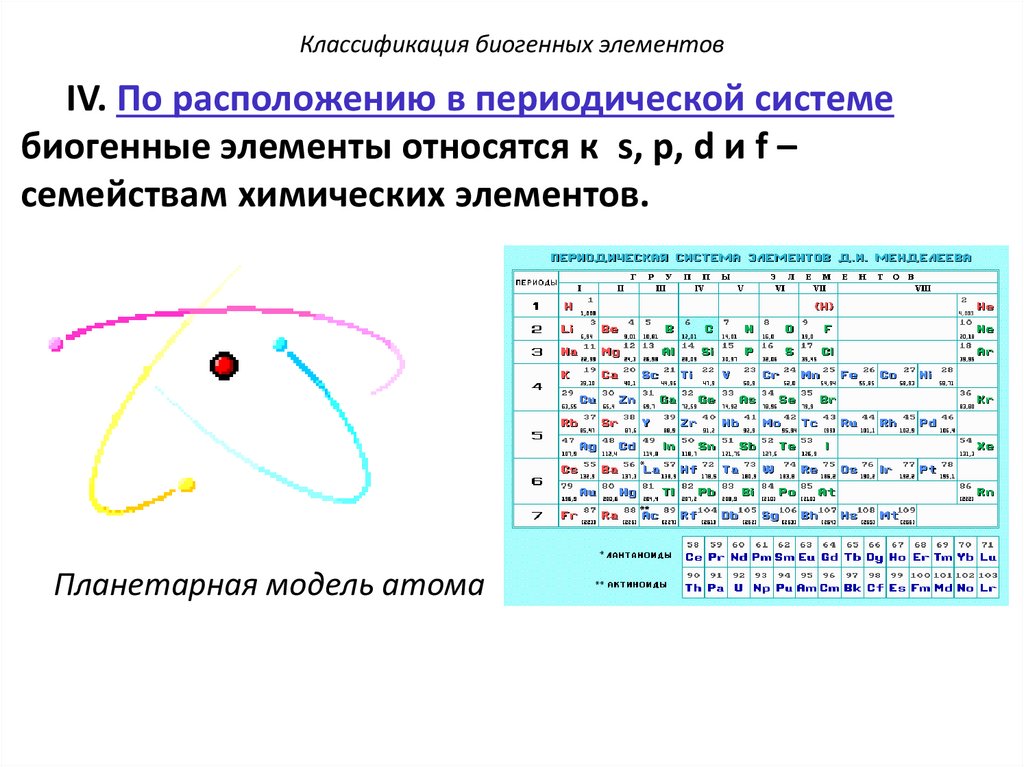
Классификация биогенных элементовIV. По расположению в периодической системе
биогенные элементы относятся к s, p, d и f –
семействам химических элементов.
Планетарная модель атома
25.
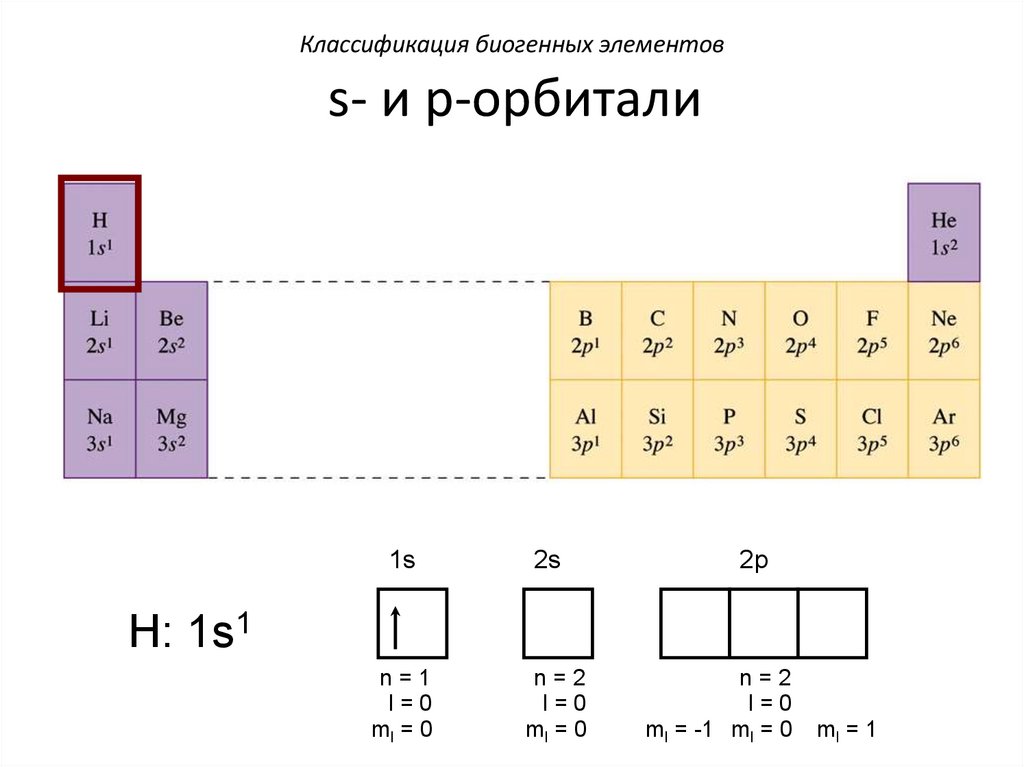
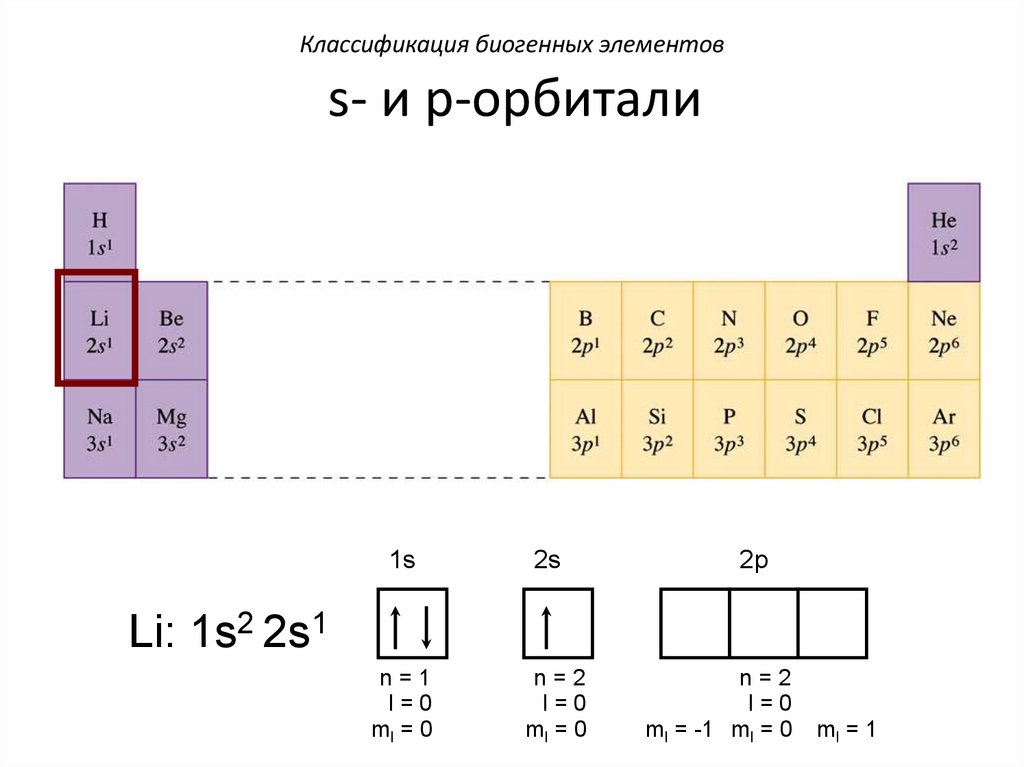
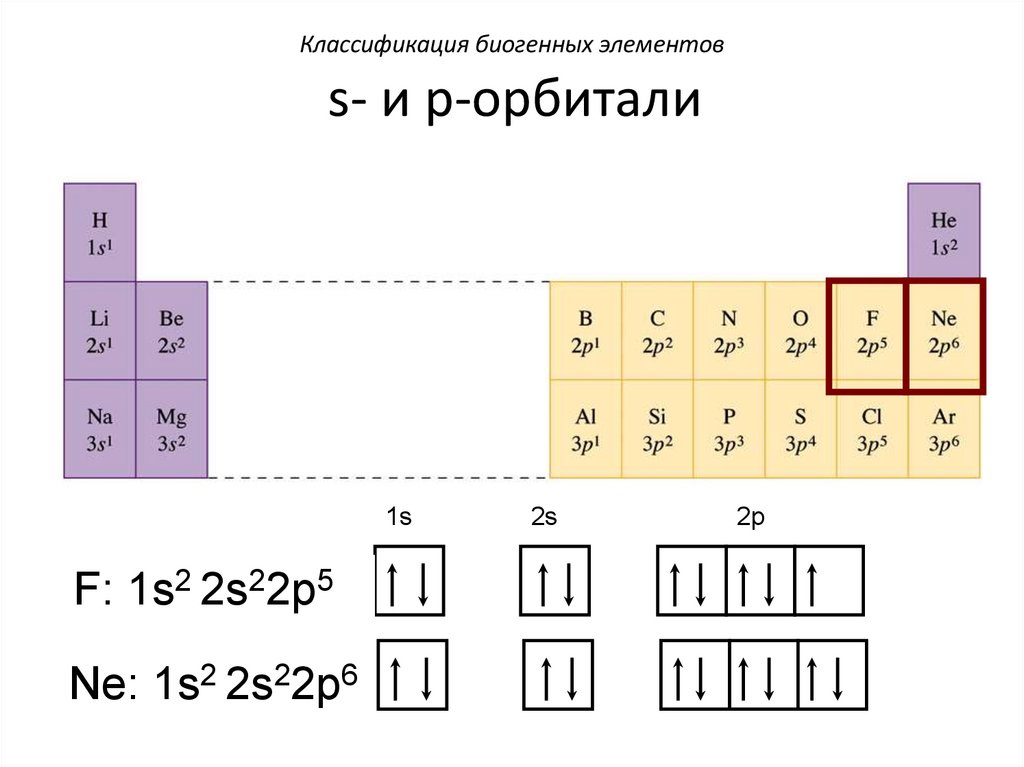
Классификация биогенных элементовs- и p-орбитали
1s
2s
n=1
l=0
ml = 0
n=2
l=0
ml = 0
2p
H: 1s1
n=2
l=0
ml = -1 ml = 0
ml = 1
26.
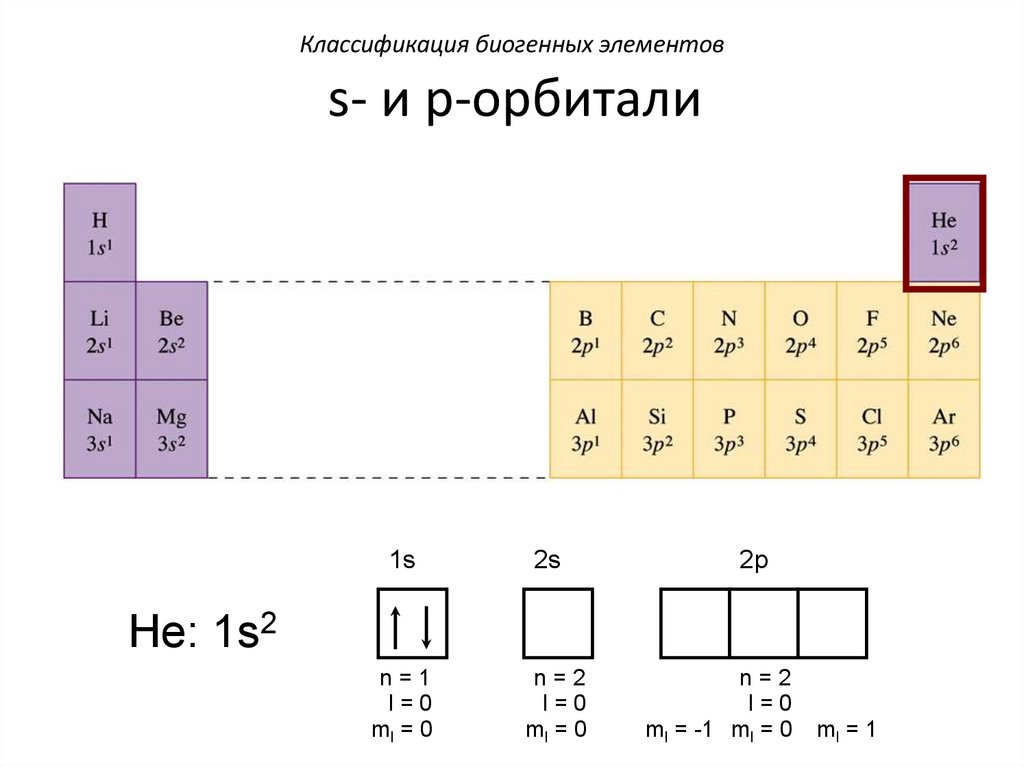
Классификация биогенных элементовs- и p-орбитали
1s
2s
n=1
l=0
ml = 0
n=2
l=0
ml = 0
2p
He: 1s2
n=2
l=0
ml = -1 ml = 0
ml = 1
27.
Классификация биогенных элементовs- и p-орбитали
1s
2s
n=1
l=0
ml = 0
n=2
l=0
ml = 0
2p
Li: 1s2 2s1
n=2
l=0
ml = -1 ml = 0
ml = 1
28.
Классификация биогенных элементовs- и p-орбитали
1s
2s
n=1
l=0
ml = 0
n=2
l=0
ml = 0
2p
Be: 1s2 2s2
n=2
l=0
ml = -1 ml = 0
ml = 1
29.
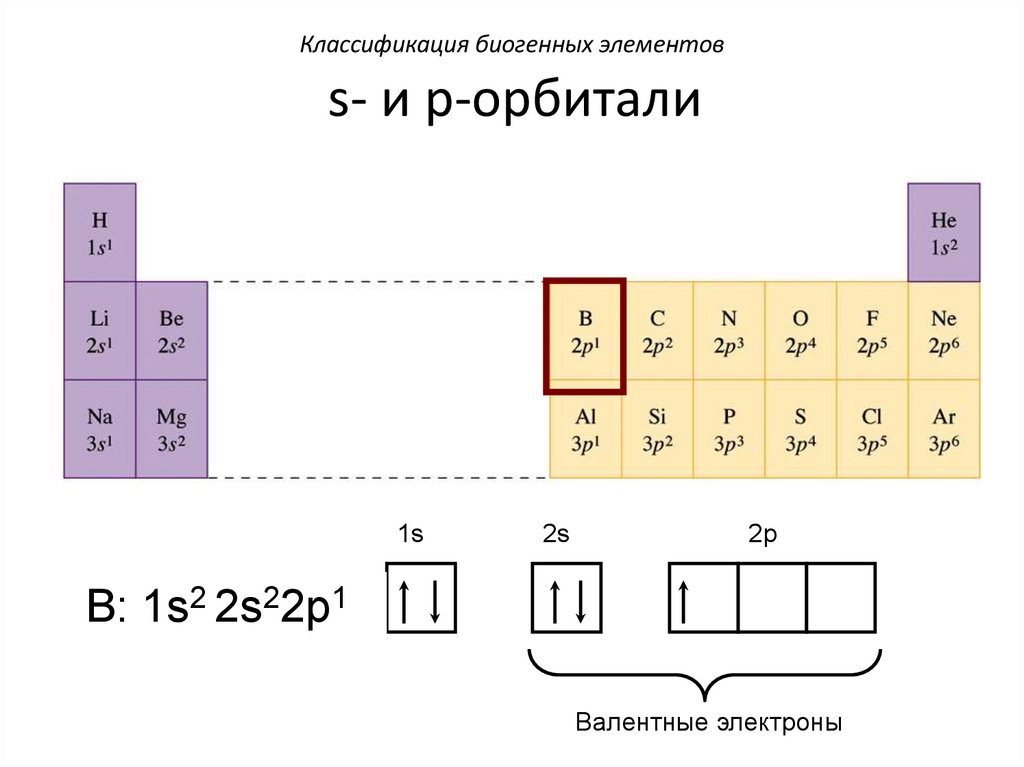
Классификация биогенных элементовs- и p-орбитали
1s
2s
2p
B: 1s2 2s22p1
Валентные электроны
30.
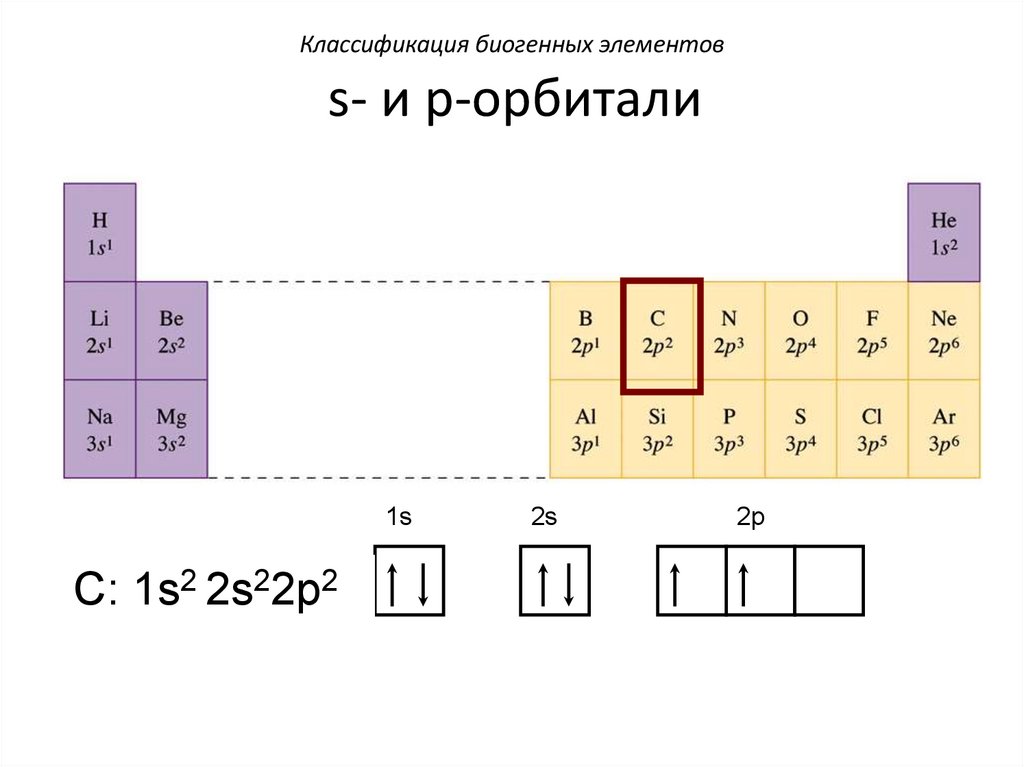
Классификация биогенных элементовs- и p-орбитали
1s
C: 1s2 2s22p2
2s
2p
31.
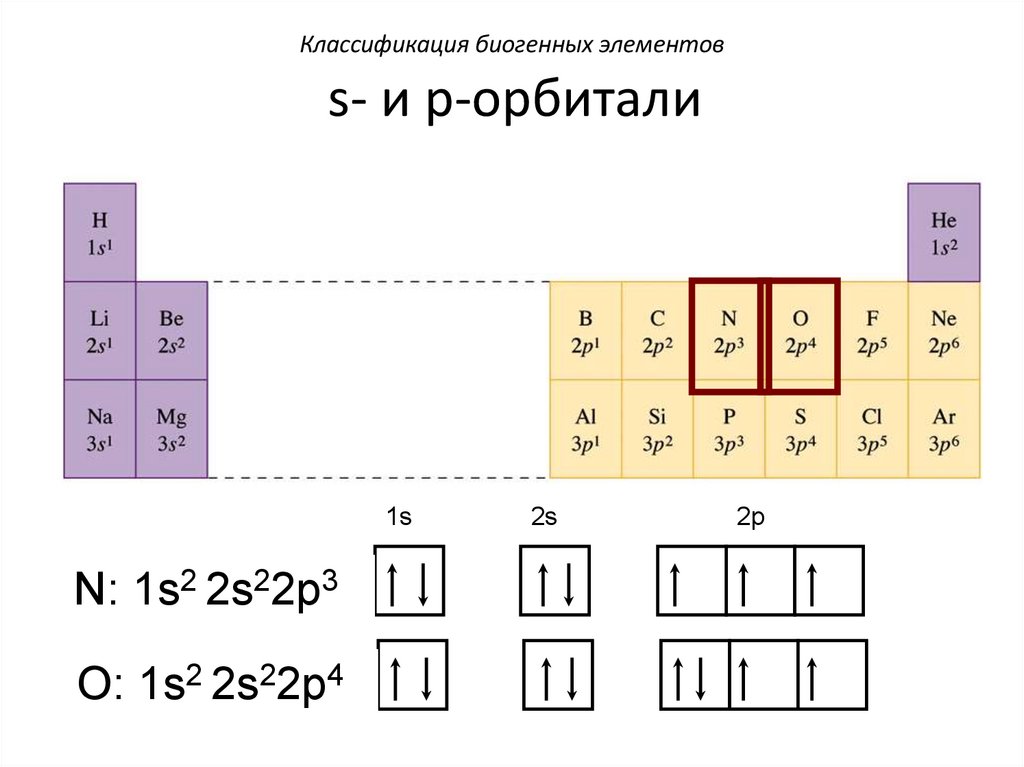
Классификация биогенных элементовs- и p-орбитали
1s
N: 1s2 2s22p3
O: 1s2 2s22p4
2s
2p
32.
Классификация биогенных элементовs- и p-орбитали
1s
F: 1s2 2s22p5
Ne: 1s2 2s22p6
2s
2p
33.
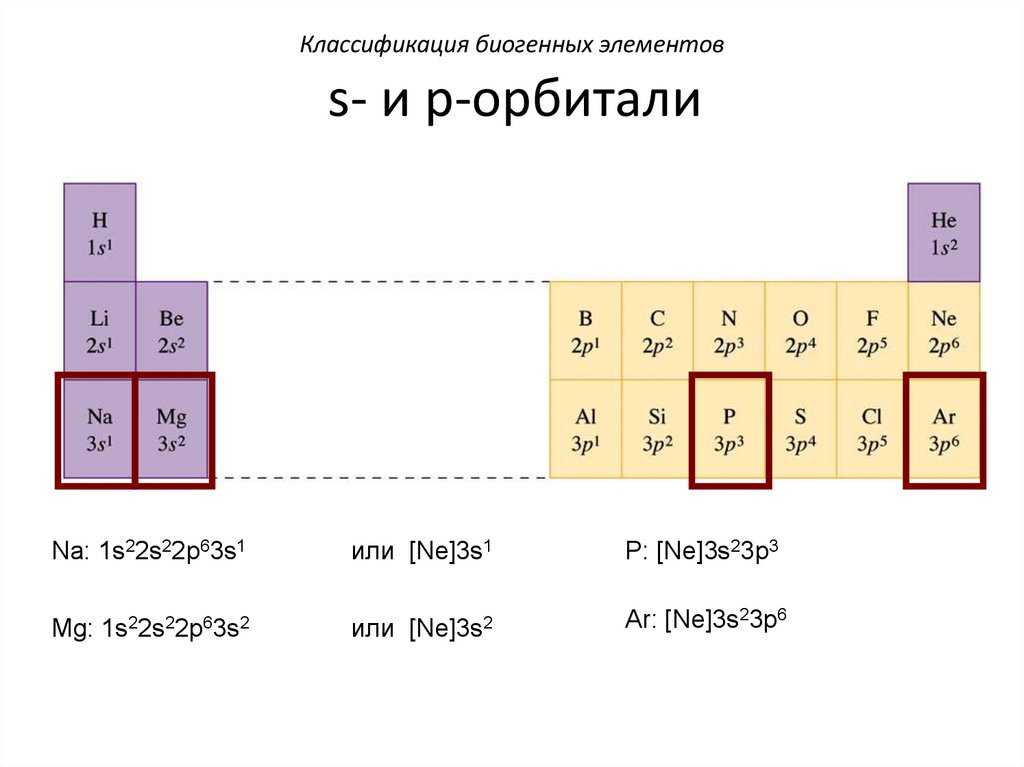
Классификация биогенных элементовs- и p-орбитали
Na: 1s22s22p63s1
или [Ne]3s1
P: [Ne]3s23p3
Mg: 1s22s22p63s2
или [Ne]3s2
Ar: [Ne]3s23p6
34.
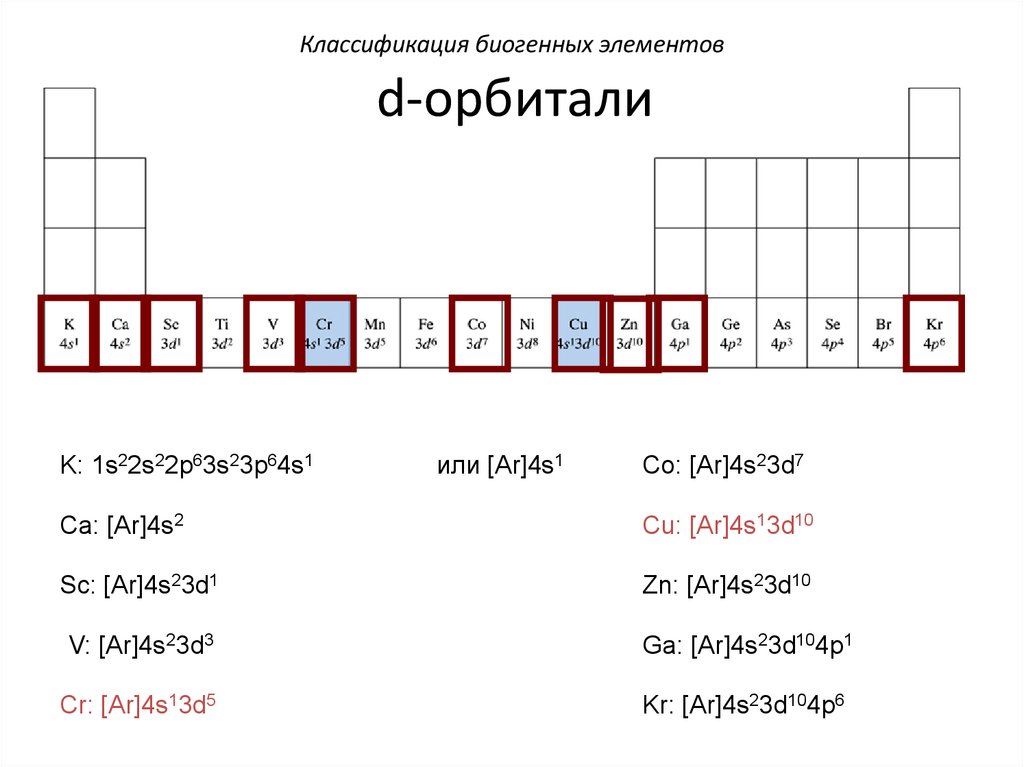
Классификация биогенных элементовd-орбитали
K: 1s22s22p63s23p64s1
или [Ar]4s1
Co: [Ar]4s23d7
Ca: [Ar]4s2
Cu: [Ar]4s13d10
Sc: [Ar]4s23d1
Zn: [Ar]4s23d10
V: [Ar]4s23d3
Ga: [Ar]4s23d104p1
Cr: [Ar]4s13d5
Kr: [Ar]4s23d104p6
35.
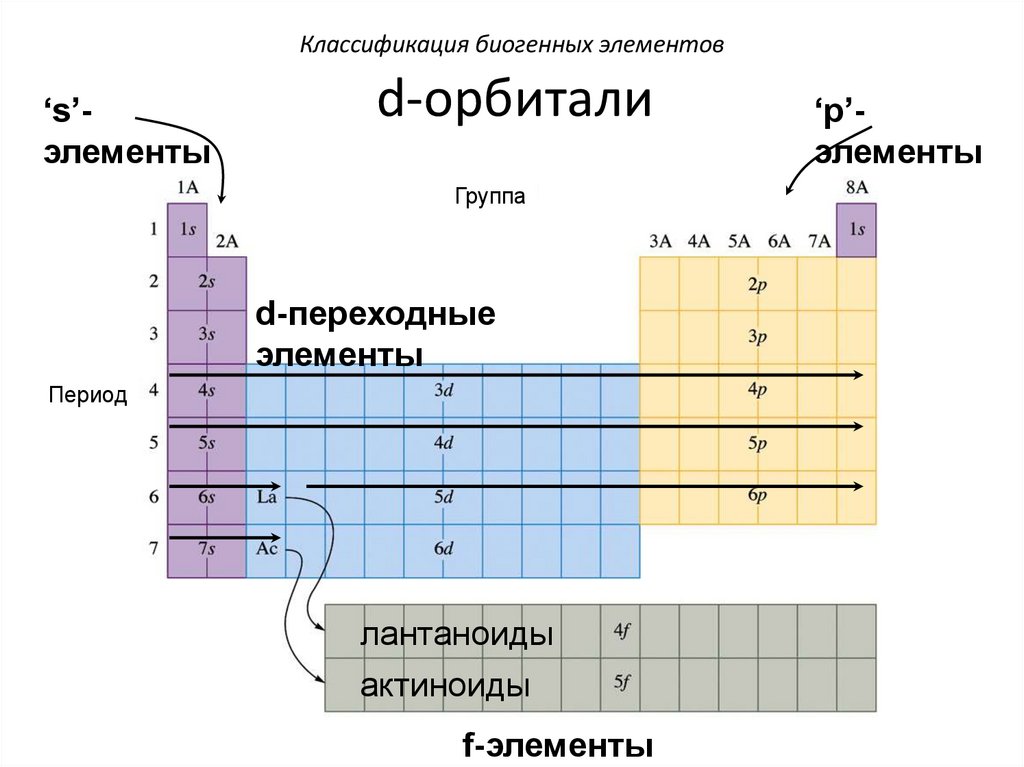
Классификация биогенных элементов‘s’элементы
d-орбитали
Группа
d-переходные
элементы
Период
лантаноиды
aктиноиды
f-элементы
‘p’элементы
36.
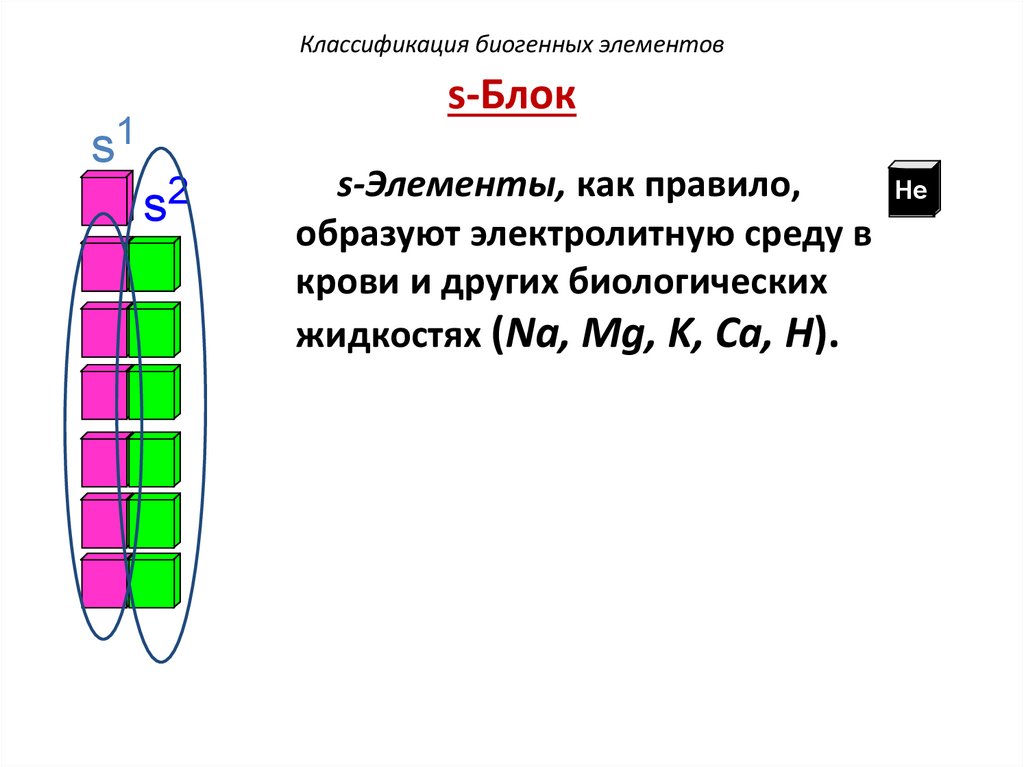
Классификация биогенных элементовs-Блок
s1
2
s
s-Элементы, как правило,
He
образуют электролитную среду в
крови и других биологических
жидкостях (Na, Mg, K, Ca, Н).
37.
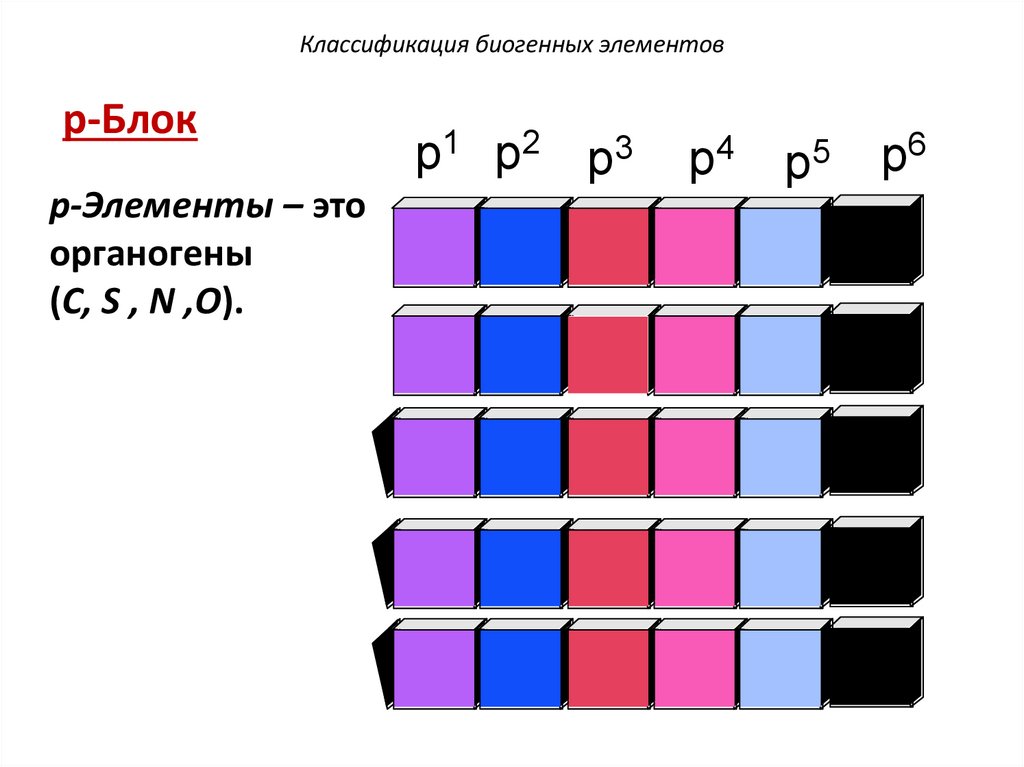
Классификация биогенных элементовp-Блок
р-Элементы – это
органогены
(С, S , N ,О).
p1 p2 p3
p4
p5
p6
38.
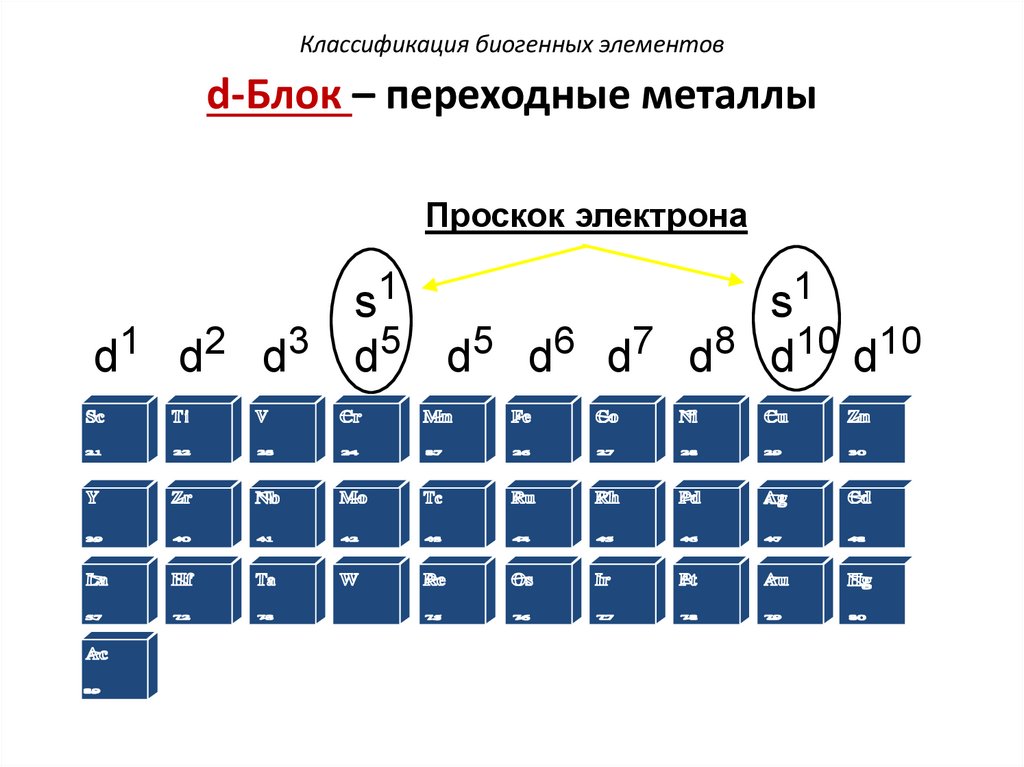
Классификация биогенных элементовd-Блок – переходные металлы
Проскок электрона
s1
s1
d1 d2 d3 d5 d5 d6 d7 d8 d10 d10
39.
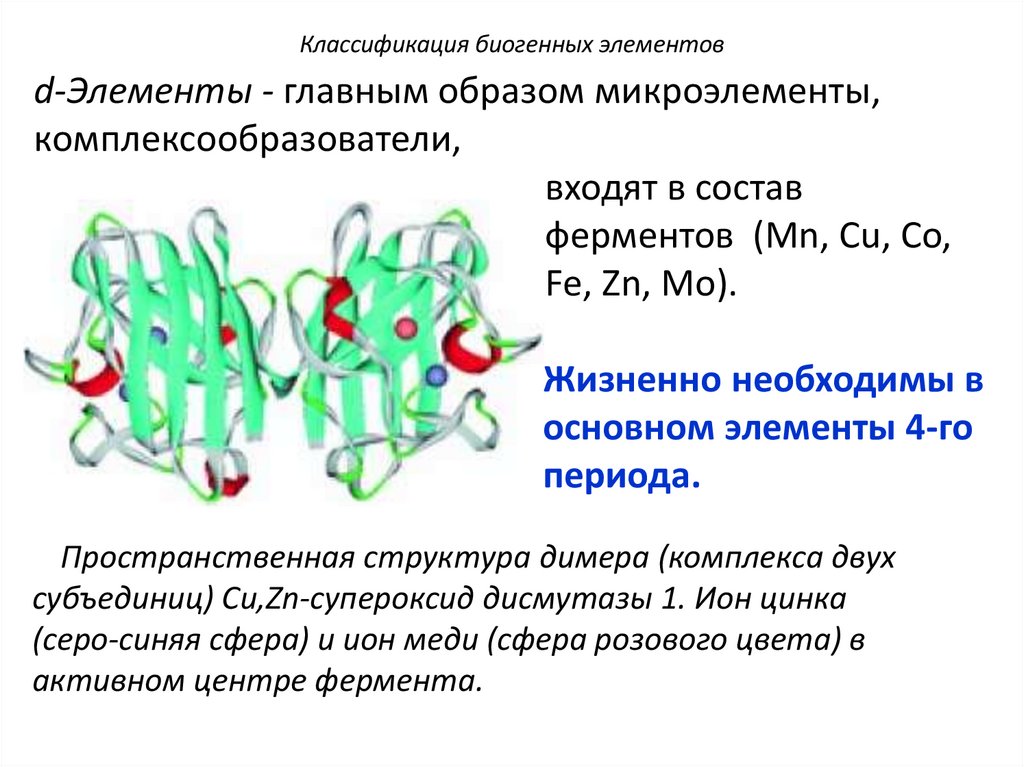
Классификация биогенных элементовd-Элементы - главным образом микроэлементы,
комплексообразователи,
входят в состав
ферментов (Mn, Cu, Co,
Fe, Zn, Mo).
Жизненно необходимы в
основном элементы 4-го
периода.
Пространственная структура димера (комплекса двух
субъединиц) Cu,Zn-супероксид дисмутазы 1. Ион цинка
(серо-синяя сфера) и ион меди (сфера розового цвета) в
активном центре фермента.
40.
Классификация биогенных элементовF-блок
f - элементы в ничтожных количествах
содержатся в организме, где их роль до конца не
выяснена, их соединения высокотоксичны.
f1 f2 f3 f4 f5 f6 f7 f8 f9 f10 f11 f12 f13 f14
41.
Классификация биогенных элементовУстановлена связь между положением химических
элементов в периодической системе и их
биологической ролью.
Элементы I А группы – влияют на деятельность
сердечной мышцы и участвуют в кровообращении.
Элементы II А группы – оказывают влияние на
процессы образования костей, действие гормона
инсулина.
Элементы V А группы – участвуют в процессах
окислительного распада веществ в организме.
Элементы VI А группы – способны к взаимному
замещению в биологических соединениях.
42.
Классификация биогенных элементовСуществует общее правило:
В организме количественное содержание
химического элемента убывает с увеличением его
порядкового номера, при этом возрастает
токсичность соединений элементов.
43.
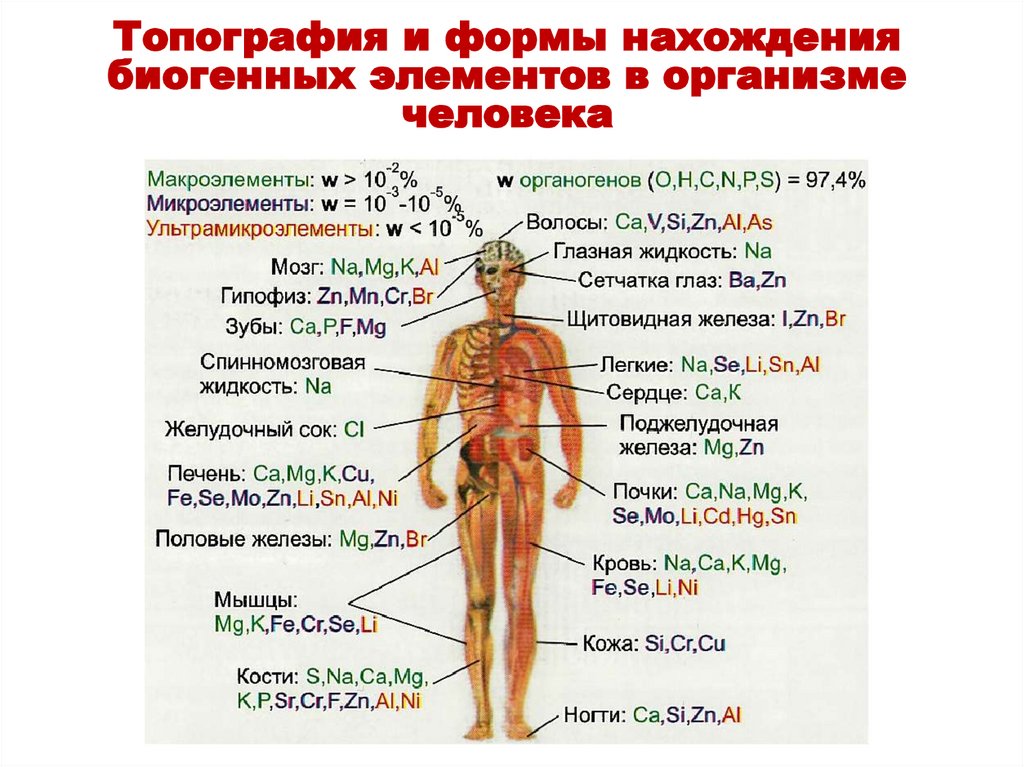
Топография и формы нахождениябиогенных элементов в организме
человека
44.
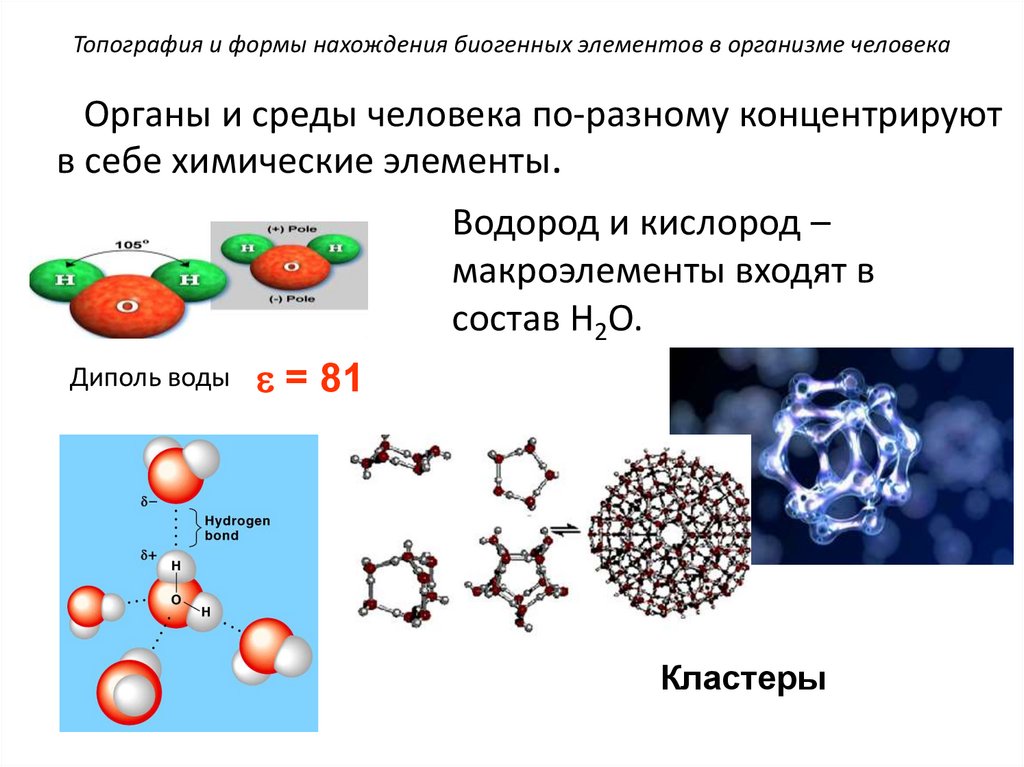
Топография и формы нахождения биогенных элементов в организме человекаОрганы и среды человека по-разному концентрируют
в себе химические элементы.
Водород и кислород –
макроэлементы входят в
состав Н2О.
Диполь воды
= 81
Кластеры
45.
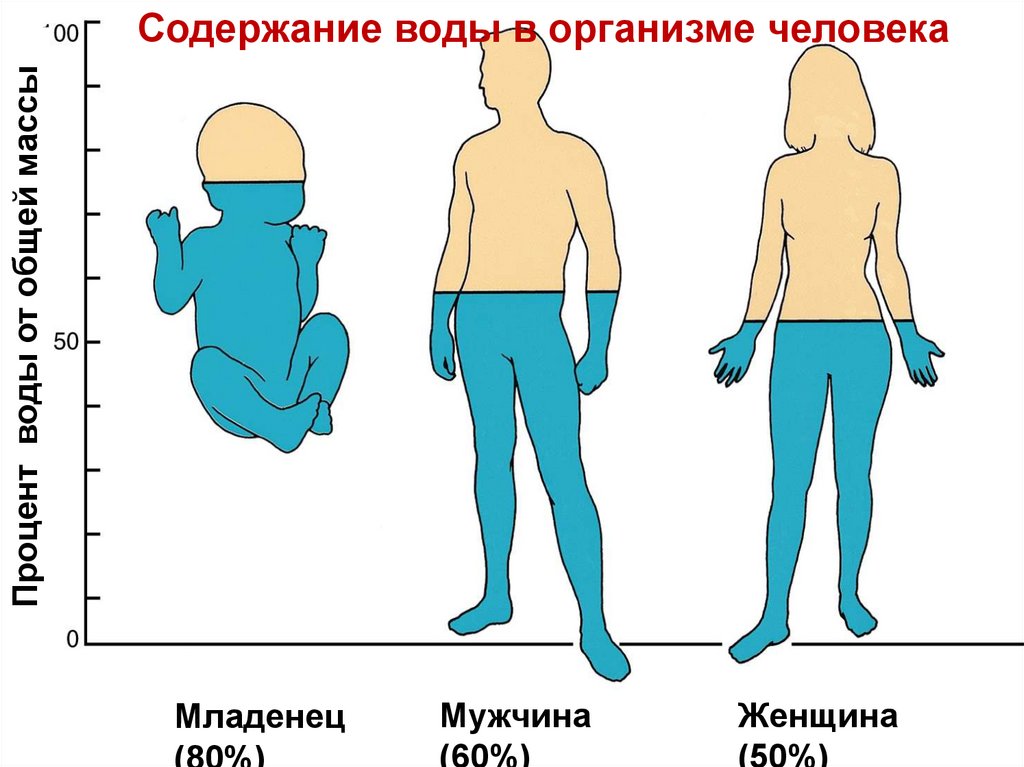
Процент воды от общей массыСодержание воды в организме человека
Младенец
Мужчина
(60%)
Женщина
(50%)
46.
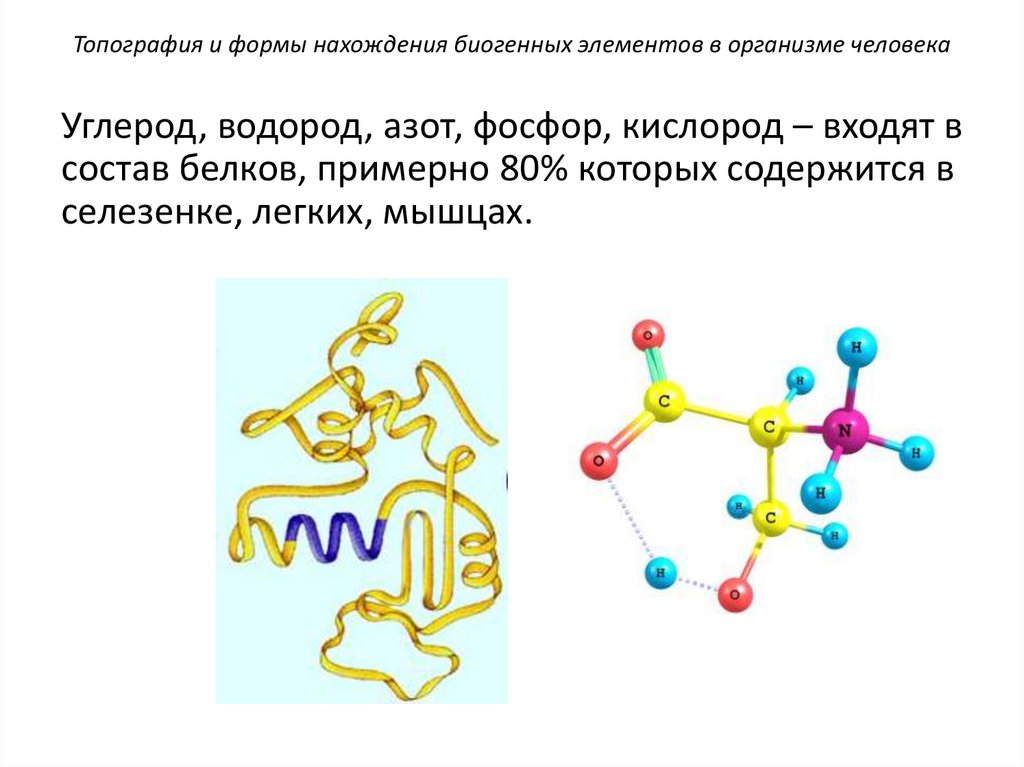
Топография и формы нахождения биогенных элементов в организме человекаУглерод, водород, азот, фосфор, кислород – входят в
состав белков, примерно 80% которых содержится в
селезенке, легких, мышцах.
47.
Топография и формы нахождения биогенных элементов в организме человекаУглерод, водород, кислород – входят в состав
углеводов, липидов, которые концентрируются в
печени, сыворотке крови.
Кальций, магний и фосфор
содержаться в костной ткани,
твердых тканях зубов.
Большинство микроэлементов концентрируются в
печени – функциональном депо микроэлементов.
48.
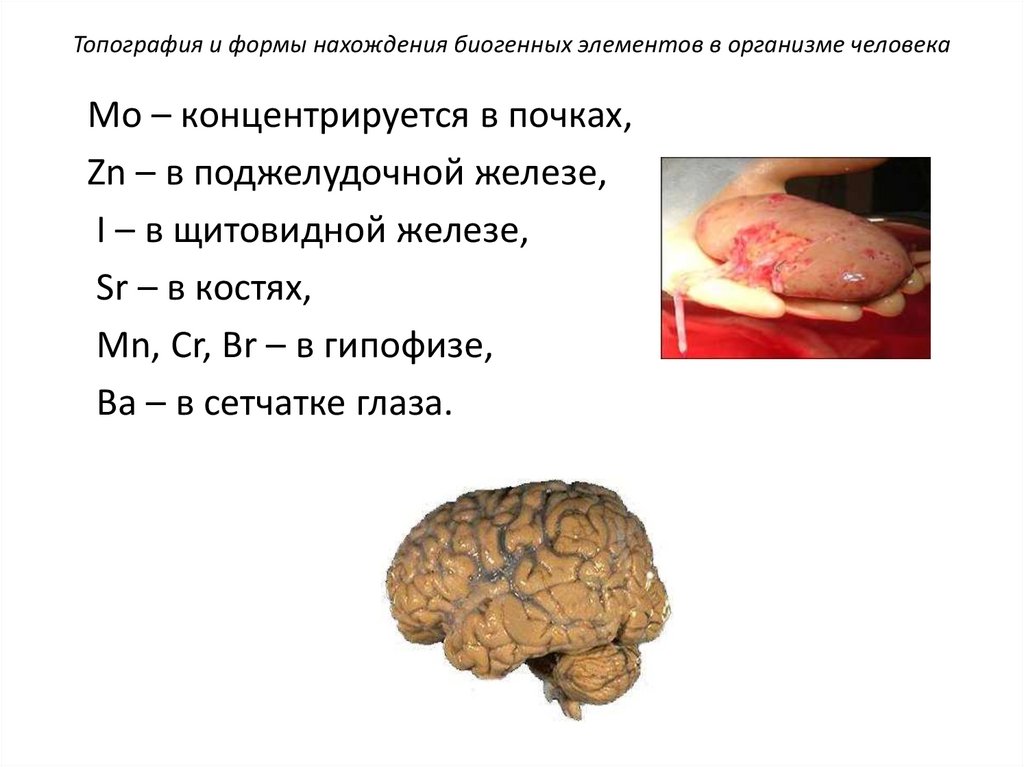
Топография и формы нахождения биогенных элементов в организме человекаМо – концентрируется в почках,
Zn – в поджелудочной железе,
I – в щитовидной железе,
Sr – в костях,
Mn, Cr, Br – в гипофизе,
Ва – в сетчатке глаза.
49.
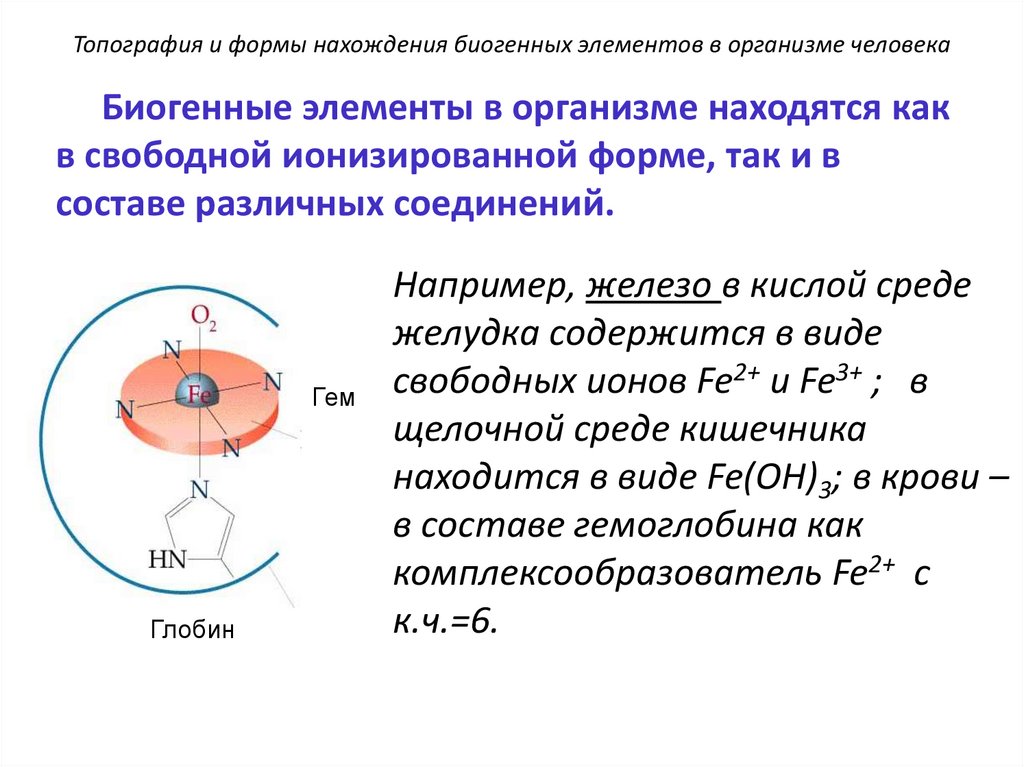
Топография и формы нахождения биогенных элементов в организме человекаБиогенные элементы в организме находятся как
в свободной ионизированной форме, так и в
составе различных соединений.
Гем
Глобин
Например, железо в кислой среде
желудка содержится в виде
свободных ионов Fe2+ и Fe3+ ; в
щелочной среде кишечника
находится в виде Fe(OH)3; в крови –
в составе гемоглобина как
комплексообразователь Fe2+ с
к.ч.=6.
50.
Топография и формы нахождения биогенных элементов в организме человекаS-элементы I А – группы образуют связи с атомом
кислорода. Молекулы воды – находятся в
биологических жидкостях в гидратированной форме
Э+(Н2О)х .
Li и Na способны к взаимозамещению в котором
они являются синергистами – усиливают действие
друг друга.
51.
Топография и формы нахождения биогенных элементов в организме человекаs-Элементы II А группы – входят в состав
комплексов с белками и нуклеиновыми
кислотами, где образуют связи с анионами
карбоновых кислот, карбонатов, фосфатов.
Са, Sr, Ba – способны замещать друг друга, при
этом наблюдаются как случаи синергизма ионов,
так и их антагонизма – ослабления действия друг
друга.
52.
Топография и формы нахождения биогенных элементов в организме человекаp-Элементы IIIА группы входят в состав
биомолекул, связываясь с атомами кислорода.
p-Ээлементы IV-VI А группы образуют связи с
различными элементами в составе биомолекул и
способны связываться друг с другом.
53.
Топография и формы нахождения биогенных элементов в организме человекаp-Элементы VII А группы – бром и хлор – обычно
находятся в организме в виде гидратированных
ионов, а фтор и иод в свободном состоянии.
Иод в организме образует соединения со связью
С – I.
Фтор связывается с металлами (Ca, Mg, Fe).
54.
Топография и формы нахождения биогенных элементов в организме человекаДля d-элементов более характерно горизонтальное
сходство, чем вертикальное.
Ионы двухвалентных марганца, железа, кобальта,
никеля, меди, цинка имеют сходные физико –
химические характеристики : электронную структуру,
близкие радиусы ионов, координационные числа 4 и
6, близкие значения констант устойчивости с
биолигандами.
55.
Биогеохимические провинции.Эндемические заболевания
В организме человека поддерживается баланс
оптимальных концентраций биогенных элементов –
химический гомеостаз.
Нарушение этого баланса вследствие недостатка или
избытка
элемента
приводит
к
различным
заболеваниям.
Оказалось, что особенно чутко организм реагирует
на изменение концентраций микроэлементов.
56.
Биогеохимические провинции. Эндемические заболеванияТак при развитии гипертонической болезни в крови
и эритроцитах более, чем в 2 раза уменьшается
содержание Li+.
При инфаркте миокарда в плазме крови снижается
содержание Zn2+.
Избыток цинка в пище вызывает угнетение
железосодержащих ферментов.
57.
Биогеохимические провинции. Эндемические заболеванияВ 1926 году академик Вернадский предложил
выделить участки земной коры, отличающиеся
накоплением одних элементов и обедненных другими
элементами.
Эти участки были названы – биогеохимическими
провинциями.
Биогеохимические провинции – это территории, в
почве которых содержание химических элементов
отличается от среднего.
58.
Биогеохимические провинции. Эндемические заболеванияТаким образом, одни организмы попадают в
условия избытка какого-либо элемента, а другие –
недостатка.
Это приводит к возникновению эндемических
заболеваний –
характерных для какой-то
определенной местности или региона.
59.
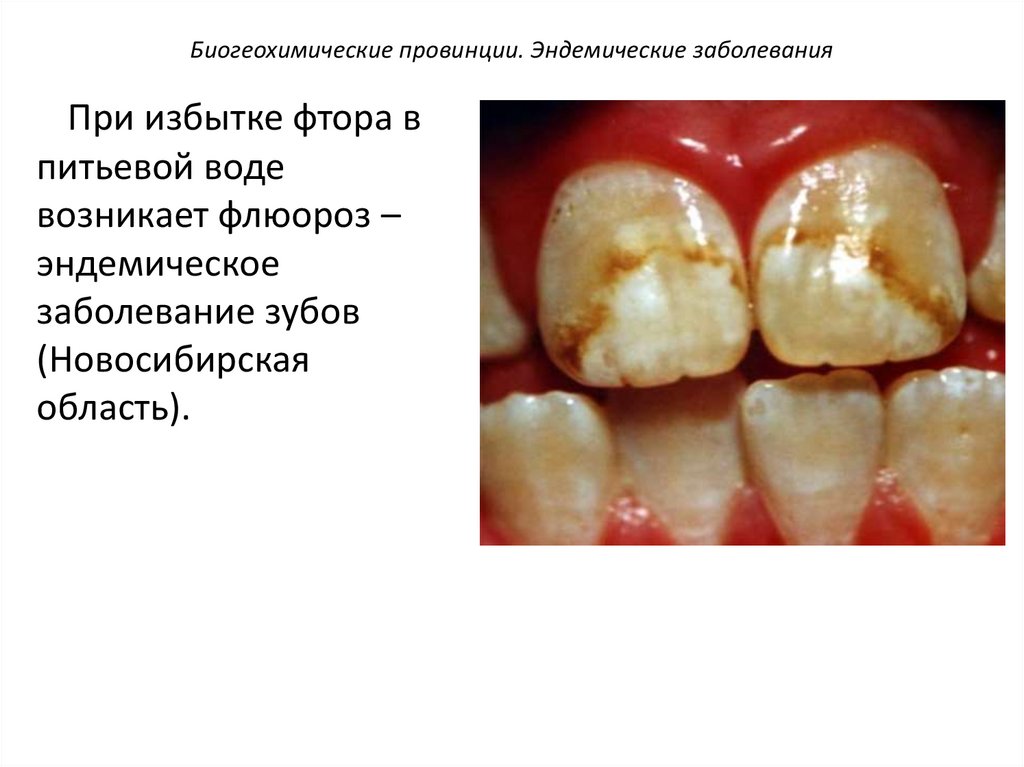
Биогеохимические провинции. Эндемические заболеванияПри избытке фтора в
питьевой воде
возникает флюороз –
эндемическое
заболевание зубов
(Новосибирская
область).
60.
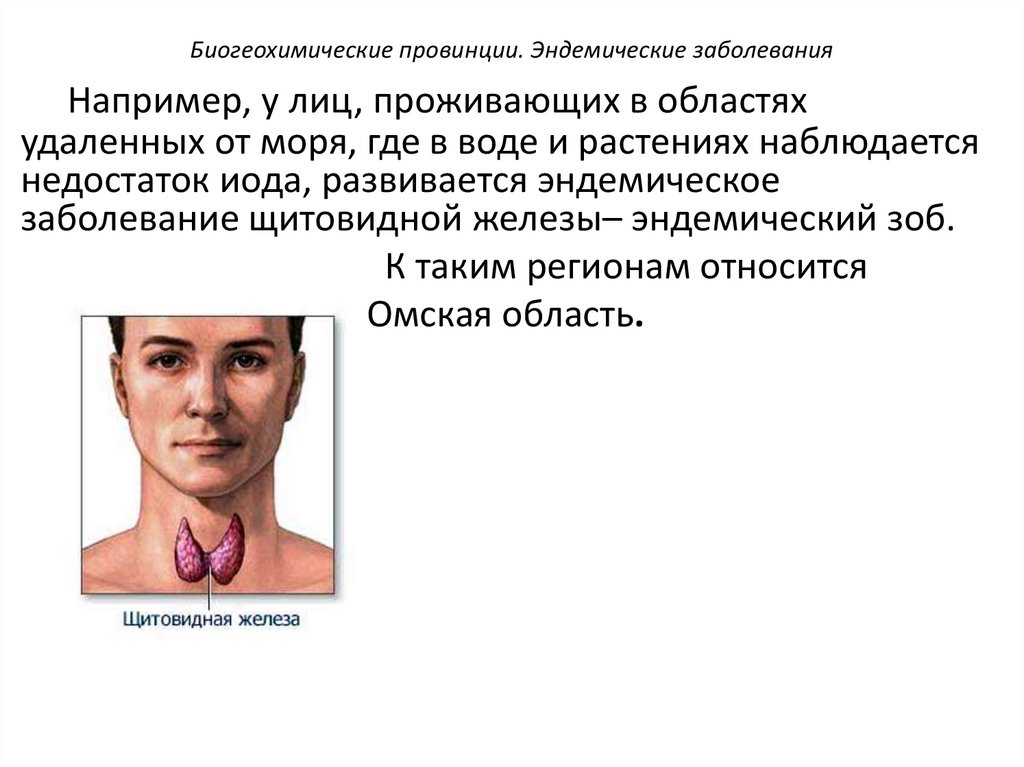
Биогеохимические провинции. Эндемические заболеванияНапример, у лиц, проживающих в областях
удаленных от моря, где в воде и растениях наблюдается
недостаток иода, развивается эндемическое
заболевание щитовидной железы– эндемический зоб.
К таким регионам относится
Омская область.
61.
Биогеохимические провинции. Эндемические заболеванияНа территориях, где в почве и
воде избыток мышьяка, он
накапливается в щитовидной
железе у людей и вызывает
эндемический зоб.
К таким регионам относится
Омская область.
62.
Биогеохимические провинции. Эндемические заболеванияПри избытке ионов стронция
возникает эндемическая
уровская болезнь (Восточной
Сибирь).
В костной ткани происходит вытеснения ионов
кальция ионами стронция, который не способен
выполнять функции ионов кальция. Результатом этого
процесса является возникновение стронциевого
рахита.
63.
Биогеохимические провинции. Эндемические заболеванияИзбыток свинца наблюдается на Алтае, меди – на
южном Урале, кобальта – в Ярославской области.
Таким
образом,
количественное
определение содержания элементов в
природных источниках, органах, тканях в
норме и патологии имеет большое значение
для прогнозирования, диагностики и
лечения различных заболеваний.
64.
ОБЩАЯ ХАРАКТЕРИСТИКАS-ЭЛЕМЕНТОВ
IА группа – ns1
IIА группа – ns2
S элементы легко отдают валентные s ē, т. е.
являются сильными восстановителями, образуют
соединения с ионным типом связи (за исключением
атомов Н).
Большинство природных соединений
хорошо растворимы в Н2О, поэтому ионы мигрируют
в водных средах организма.
H, Na, K, Mg, Ca – жизненно необходимые
элементы организма.
65.
Общая характеристика элементов s-блока1
H
1
Протоны: 1
Нейтроны: 0
Электроны: 1
Водород
Электронная формула 1s1,
наиболее легкий s-элемент.
Содержание в организме ≈10% от
массы сухого остатка (≈7 кг). На
100 атомов Н в организме
человека приходится всего 58
атомов остальных элементов.
66.
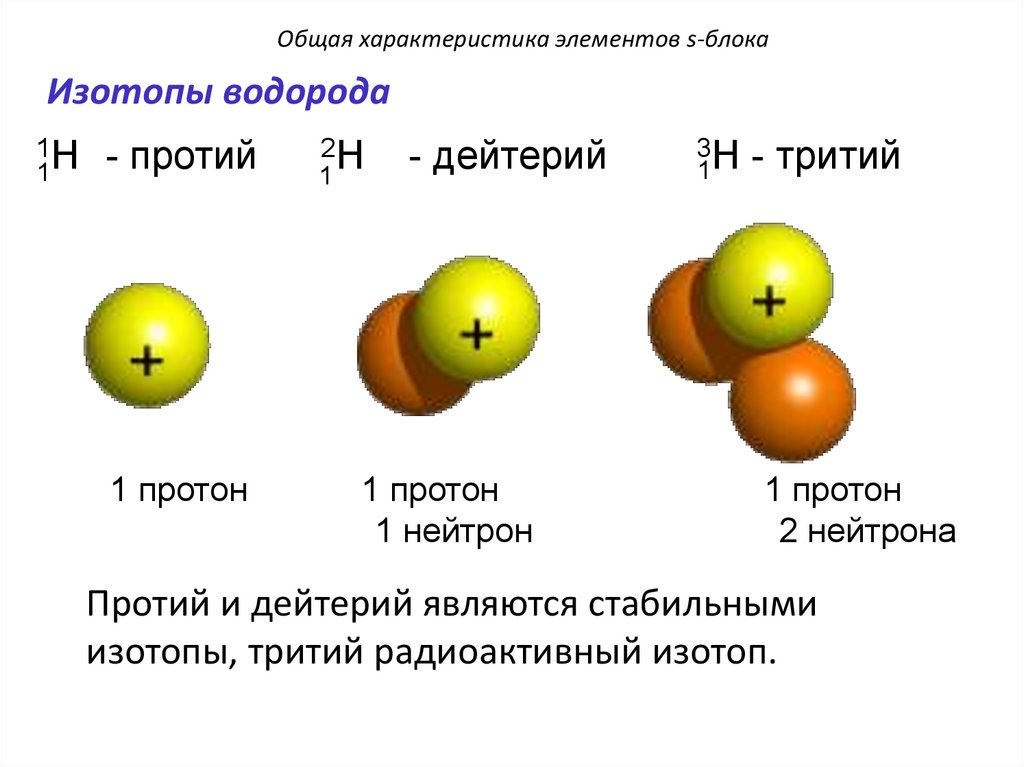
Общая характеристика элементов s-блокаИзотопы водорода
1H
1
- протий
1 протон
2H
1
- дейтерий
1 протон
1 нейтрон
3H - тритий
1
1 протон
2 нейтрона
Протий и дейтерий являются стабильными
изотопы, тритий радиоактивный изотоп.
67.
Общая характеристика элементов s-блокаВодород
Атом образует двухатомную молекулу – Н2 –
самый легкий газ. Малорастворим в воде, но
хорошо растворяется в металлах: Pt, Pd.
68.
Общая характеристика элементов s-блокаИон водорода Н+ 1S0 – протон – соединяется с
другими частицами активно.
Например, с молекулами воды при образовании
донорно-акцепторной связи образует катион
гидроксония:
Н+ + Н2Ö ↔ Н3О+
В желудочном соке катионы оксония оказывают
противомикробное и каталитическое действие.
69.
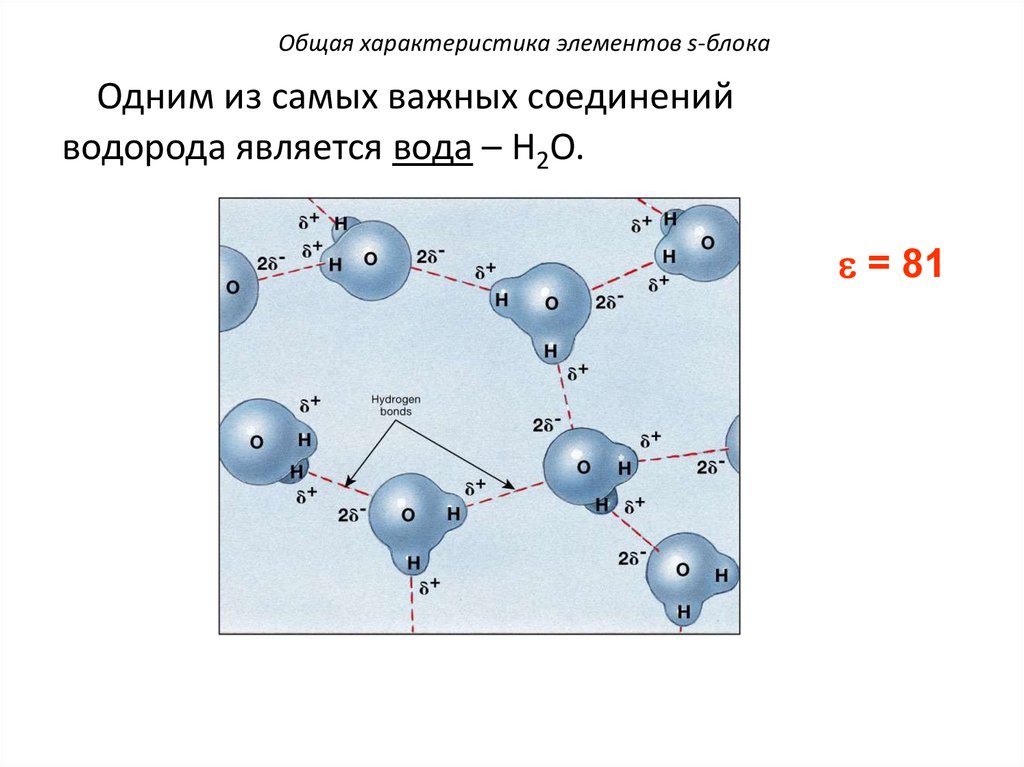
Общая характеристика элементов s-блокаОдним из самых важных соединений
водорода является вода – Н2О.
= 81
Водородные
связи
70.
КРИСТАЛЛИЧЕСКАЯ СТРУКТУРА ЗАМОРОЖЕННОЙ ВОДЫРАЗЛИЧНОГО ПРОИСХОЖДЕНИЯ
магнитные
гравитационные
акустические
электрические
электромагнитные
(колебания компонентов среды
и режимы ее движения)
71.
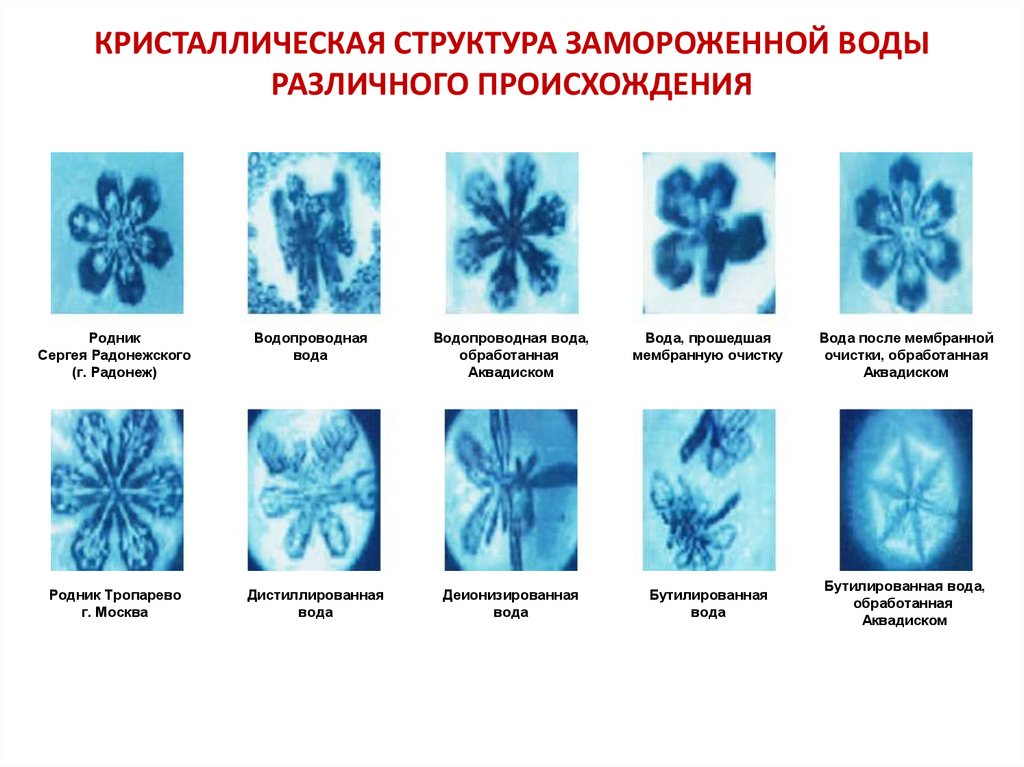
КРИСТАЛЛИЧЕСКАЯ СТРУКТУРА ЗАМОРОЖЕННОЙ ВОДЫРАЗЛИЧНОГО ПРОИСХОЖДЕНИЯ
Родник
Сергея Радонежского
(г. Радонеж)
Водопроводная
вода
Водопроводная вода,
обработанная
Аквадиском
Вода, прошедшая
мембранную очистку
Родник Тропарево
г. Москва
Дистиллированная
вода
Деионизированная
вода
Бутилированная
вода
Вода после мембранной
очистки, обработанная
Аквадиском
Бутилированная вода,
обработанная
Аквадиском
СПб ГМА им. И.И.Мечникова
72.
Общая характеристика элементов s-блокаВсе химические реакции в организме протекают
в водной среде. Поступление воды в организм – это
обязательное условие его существования. Выпитая
человеком вода за 2 часа полностью распределяется
по органам и тканям и поддерживает водносолевой гомеостаз организма.
Часть воды образуется в митохондриях в
процессах окисления, т.н. эндогенная вода.
О20 + 4Н+ + 4 ē = 2Н2О
73.
Общая характеристика элементов s-блокаПри неполном восстановлении О2 образуется
пероксид водорода:
О20 + 2Н+ + 2 ē = Н2О2
Или надпероксидный радикал
О20 + 1 ē = О2-1
Это токсические
вещества для клеточных
мембран.
74.
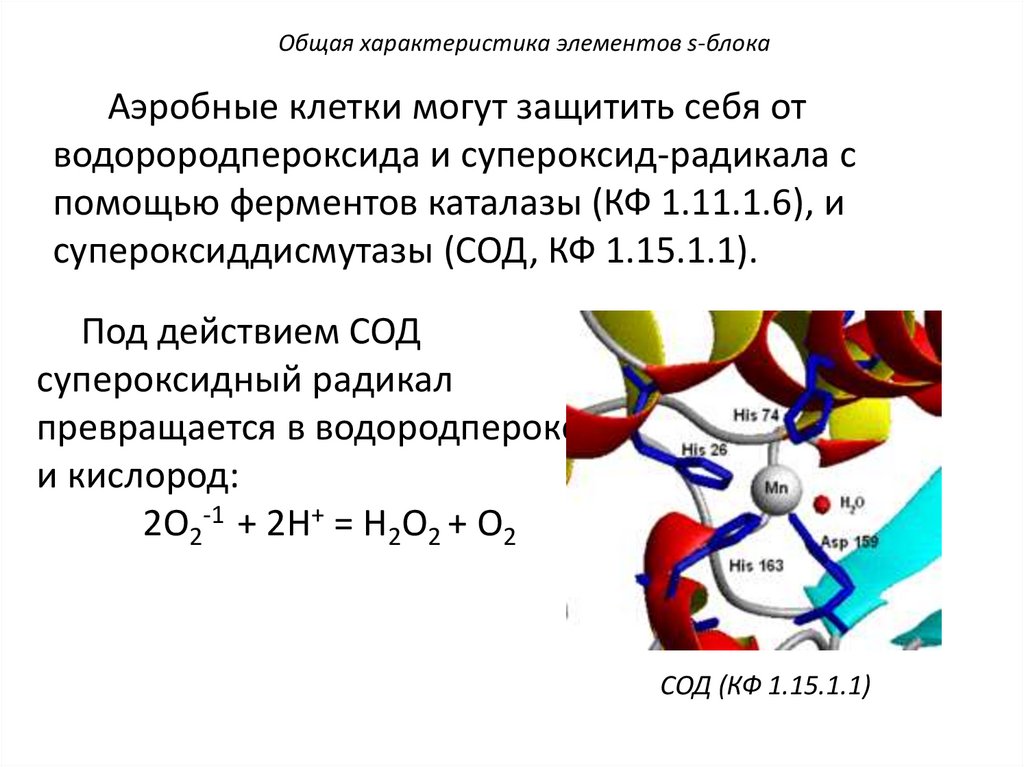
Общая характеристика элементов s-блокаАэробные клетки могут защитить себя от
водорородпероксида и супероксид-радикала с
помощью ферментов каталазы (КФ 1.11.1.6), и
супероксиддисмутазы (СОД, КФ 1.15.1.1).
Под действием СОД
супероксидный радикал
превращается в водородпероксид
и кислород:
2О2-1 + 2H+ = H2О2 + О2
СОД (КФ 1.15.1.1)
75.
Общая характеристика элементов s-блокаПод действием каталазы пероксид водорода
превращается в воду и кислород:
H2О2 = H2О + О2
Освободившийся
кислород принимает
участие в дальнейших
процессах биологического
окисления.
Каталаза (КФ 1.11.1.6)
76.
Общая характеристика элементов s-блокаН2О2 – пероксид водорода –
бесцветная, прозрачная жидкость –
наружное бактерицидное средство.
Действие Н2О2 основано на его окислительной
способности и безвредности продукта его восстановления –
воды.
При обработке ран выделяющийся кислород играет
двойную
роль:
1)
оказывает
противомикробное,
дезодорируещее и депигментирующее действие, убивая
микробные тела; 2) образует пену, способствуя переходу
частиц тканевого распада во взвешенное состояние и
очищению ран.
77.
Общая характеристика элементов s-блокаВ качестве фармакопейного
препарата используется 3%-ный водный
раствор пероксида водорода.
В виде 30%-ного раствора пероксид
водорода применяют при лечении
бородавчатой формы красного плоского
лишая и для удаления бородавок.
78.
s-Элементы I А группыОбщая электронная формула ns1,
валентность I, степень окисления +1.
Li Na K
Cs
Rb
Fr
79.
H1
1s1
Общая характеристика элементов s-блока
1s22s1
Li
3
Na
11
K
19
Rb
37
1s22s22p63s1
Электронная
конфигурация
щелочных металлов
1s22s22p63s23p64s1
1s22s22p63s23p64s23d104p65s1
1s22s22p63s23p64s23d104p65s24d10 5p66s1
1s22s22p63s23p64s23d104p65s24d105p66s24f
Fr
145d106p67s1
87
Cs
55
80.
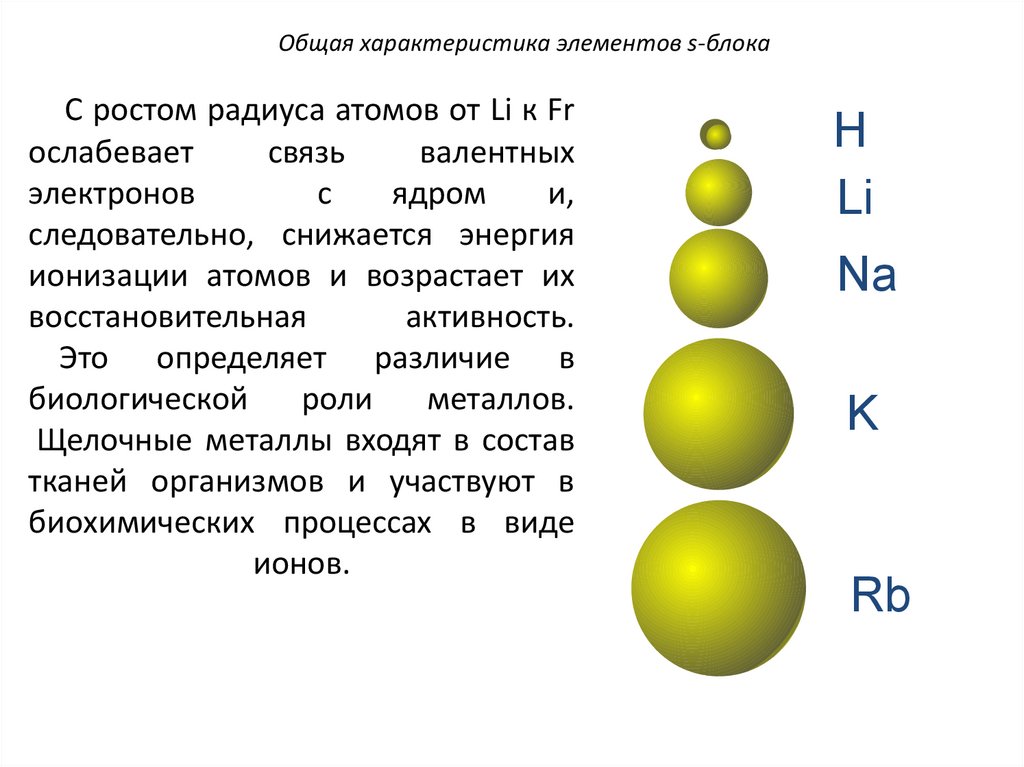
Общая характеристика элементов s-блокаС ростом радиуса атомов от Li к Fr
ослабевает
связь
валентных
электронов
с
ядром
и,
следовательно, снижается энергия
ионизации атомов и возрастает их
восстановительная
активность.
Это определяет различие в
биологической
роли
металлов.
Щелочные металлы входят в состав
тканей организмов и участвуют в
биохимических процессах в виде
ионов.
H
Li
Na
K
Rb
81.
Общая характеристика элементов s-блокаNa+ и Li+ накапливаются во внеклеточной жидкости,
легко гидратируются и являются взаимозаменяемыми
элементами.
K+, Rb+, Cs+ - накапливаются во внутриклеточной
жидкости и являются синергистами.
В тоже время Na+ и К+ являются антагонистами. При
увеличении количества Na+ в организме усиливается
выведение K+ почками, что может привести к
гипокалиемии.
82.
Общая характеристика элементов s-блокаЛитий
11
Li
Содержание лития в
организме человека около 70 мг
11
(10 ммоль).
Элемент второго периода
Литий можно обнаружить в лимфоузлах, щитовидной
железе, сердце, легких, печени, кишечнике, надпочечниках,
плазме крови, а также в малых количествах в других
органах и тканях.
Выводится из организма литий в основном с мочой (до
95%), совсем немного с потом и калом.
Биологическая роль лития как микроэлемента пока до
конца не выяснена.
83.
Общая характеристика элементов s-блокаNa
23
Содержание Na в организме
взрослого человека составляет ≈ 60 г,
из них:
11
44% находятся во внеклеточной
Элемент третьего периода жидкости,
1 валентный электрон 9% - во внутриклеточной жидкости,
остальное количество в костной
ткани, которая вступает донором или
акцептором этих ионов, способствуя
поддержанию постоянства его
концентрации
в крови
С(Na+) ≈ 130 – 155 ммоль/л.
84.
Общая характеристика элементов s-блокаОсновными соединениями Na в организме
являются его растворимые соли – хлориды,
гидрокарбонаты, фосфаты.
Ионы Na+ участвуют в поддержании
осмотического гомеостаза организма, участвуют в
регуляции водного обмена влияют на активность
ферментов.
При изменении содержания натрия в организме
происходит нарушение функций нервной системы,
сердечно-сосудистой системы, кислотно-основного
равновесия, изменения в гладких и скелетных
мышцах.
85.
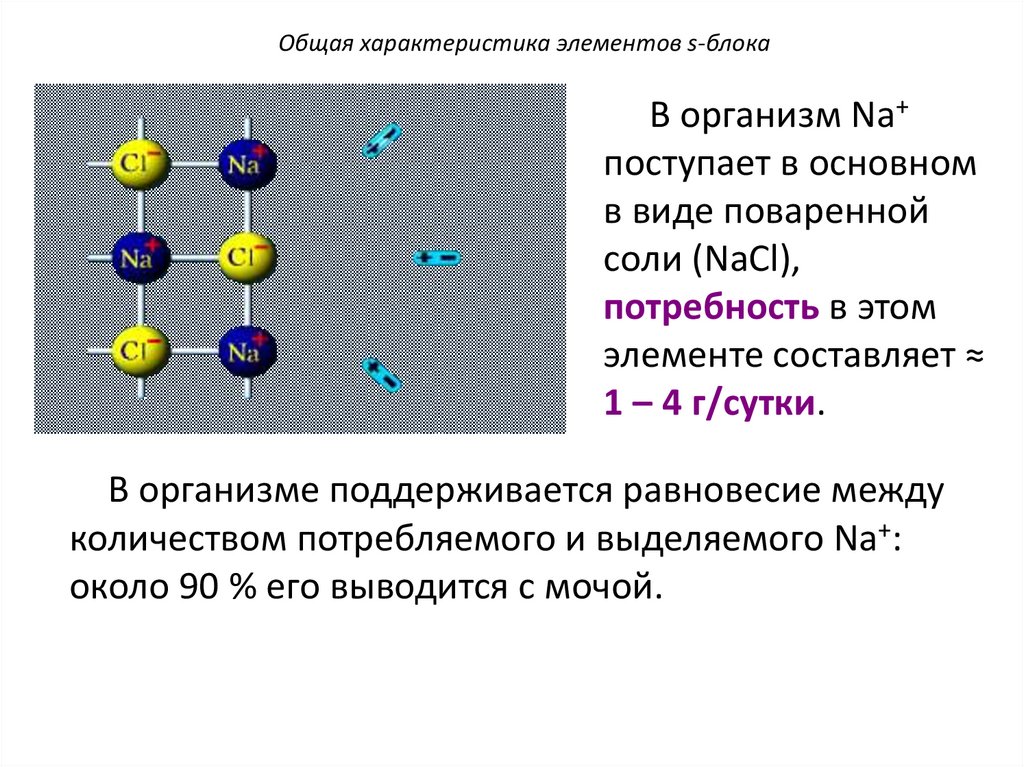
Общая характеристика элементов s-блокаВ организм Na+
поступает в основном
в виде поваренной
соли (NaCl),
потребность в этом
элементе составляет ≈
1 – 4 г/сутки.
В организме поддерживается равновесие между
количеством потребляемого и выделяемого Na+:
около 90 % его выводится с мочой.
86.
Общая характеристика элементов s-блокаВ медицине применяются:
изотонический раствор NaCl
(0,85 – 0,9 %) – внутривенно при
больших потерях крови, для
промывания ран, глаз, для
растворения
лекарственных
препаратов;
гипертонический раствор NaCl
(3 – 10 %)-компрессы, примочки
при лечении гнойных ран, для
промывания
желудка
при
отравлении AgNO3;
87.
Общая характеристика элементов s-блокаРаствор NaHCO3 –
применяется при
заболеваниях,
сопровождающихся
повышенной кислотностью
(ацидоз), при язвенной
болезни желудка.
Для промываний при воспалительных заболеваниях
слизистых.
88.
Общая характеристика элементов s-блокаТорговое наименование:
трисоль
Международное наименование:
натрия гидрокарбонат+натрия
хлорид+калия хлорид (sodium
hydrocarbonate+sodium
chloride+potassium chloride)
Групповая принадлежность:
электролитов баланс
восстанавливающее средство
89.
Общая характеристика элементов s-блокаNa2SO4 ∙10 H2O (глауберова
соль) – слабительное
средство.
Na2B2O7 ∙10H2O
(тетраборат Na) –
антисептическое
средство.
90.
Общая характеристика элементов s-блокаСодержание калия в организме
39
взрослого человека ≈ 160 г. Это
основной внутриклеточный катион –
до 90% от его общего количества
19
содержится во внутриклеточной
Элемент четвертого периода жидкости.
Ионы К+ играют важную роль в
1 валентный электрон
физиологических процессах: в
сокращении мышц, нормальном
функционировании сердца,
проведение нервных импульсов, в
обменных реакциях, являются
активаторами ферментов.
K
91.
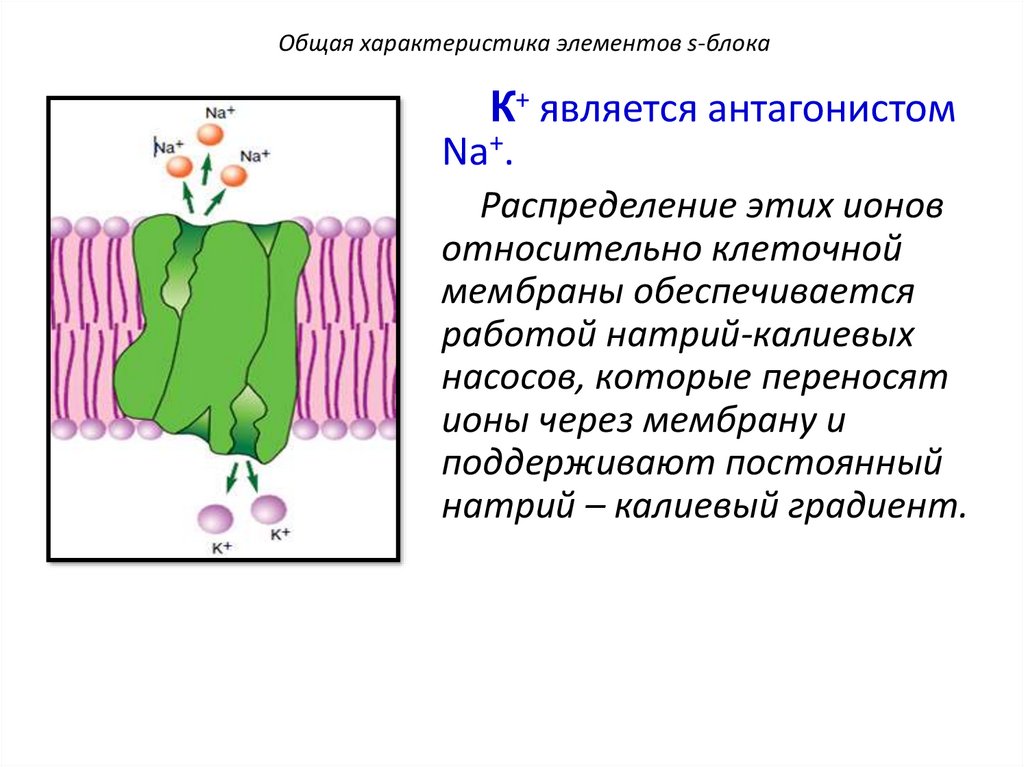
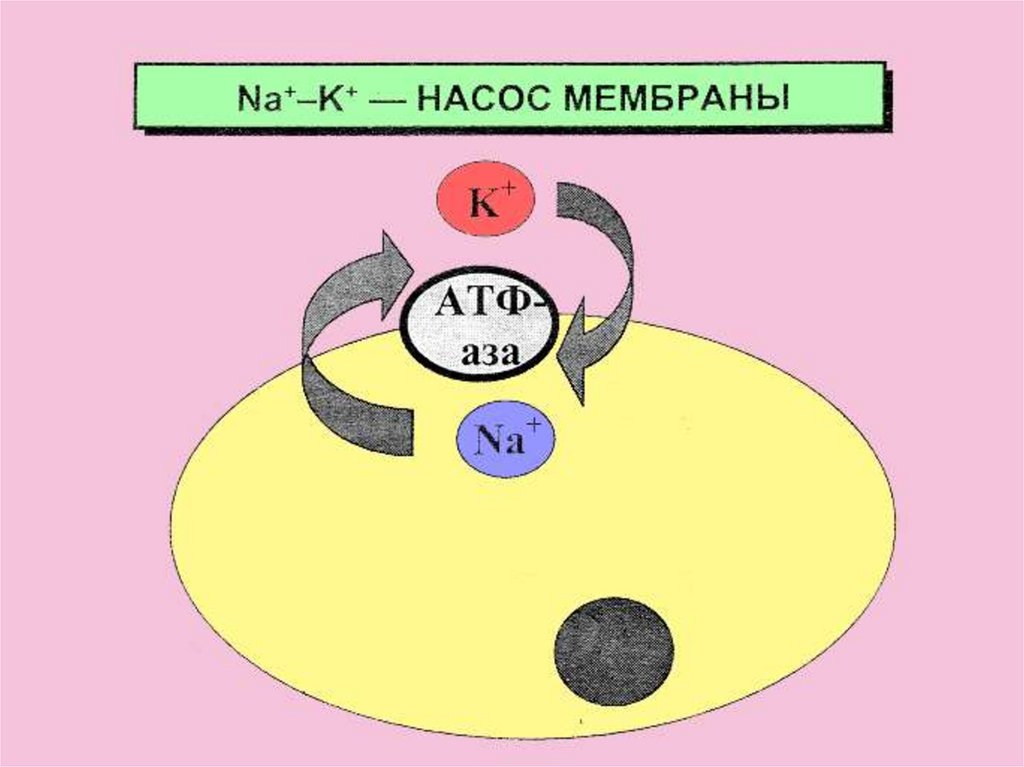
Общая характеристика элементов s-блокаК+ является антагонистом
Na+.
Распределение этих ионов
относительно клеточной
мембраны обеспечивается
работой натрий-калиевых
насосов, которые переносят
ионы через мембрану и
поддерживают постоянный
натрий – калиевый градиент.
92.
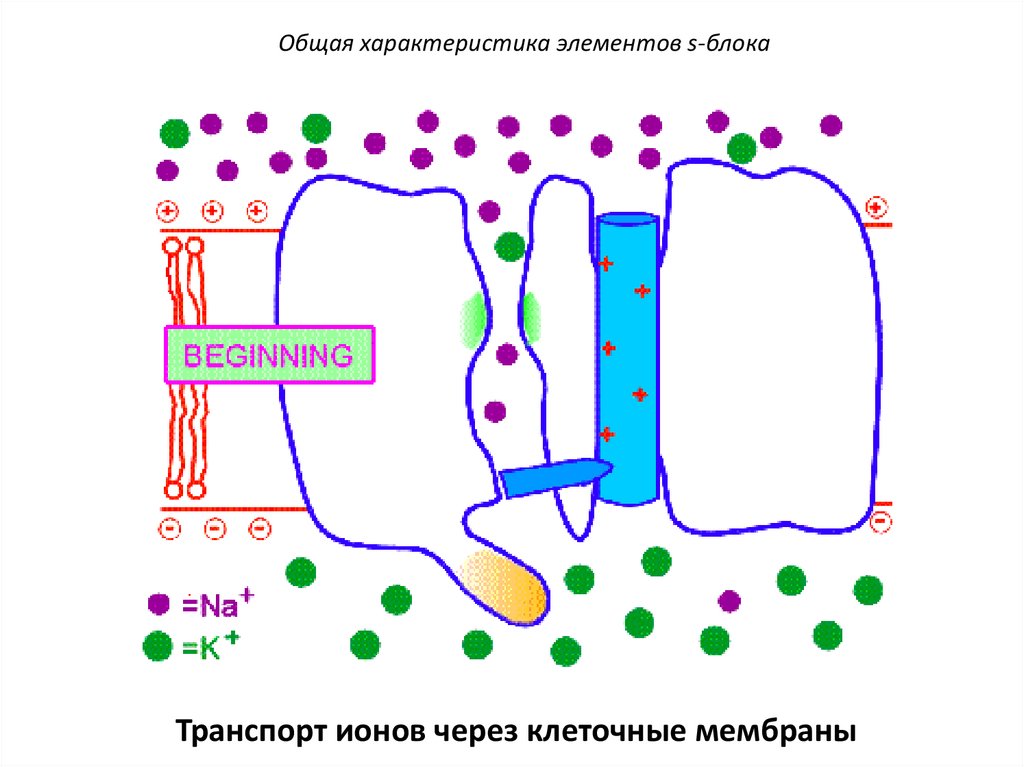
Общая характеристика элементов s-блокаТранспорт ионов через клеточные мембраны
93.
94.
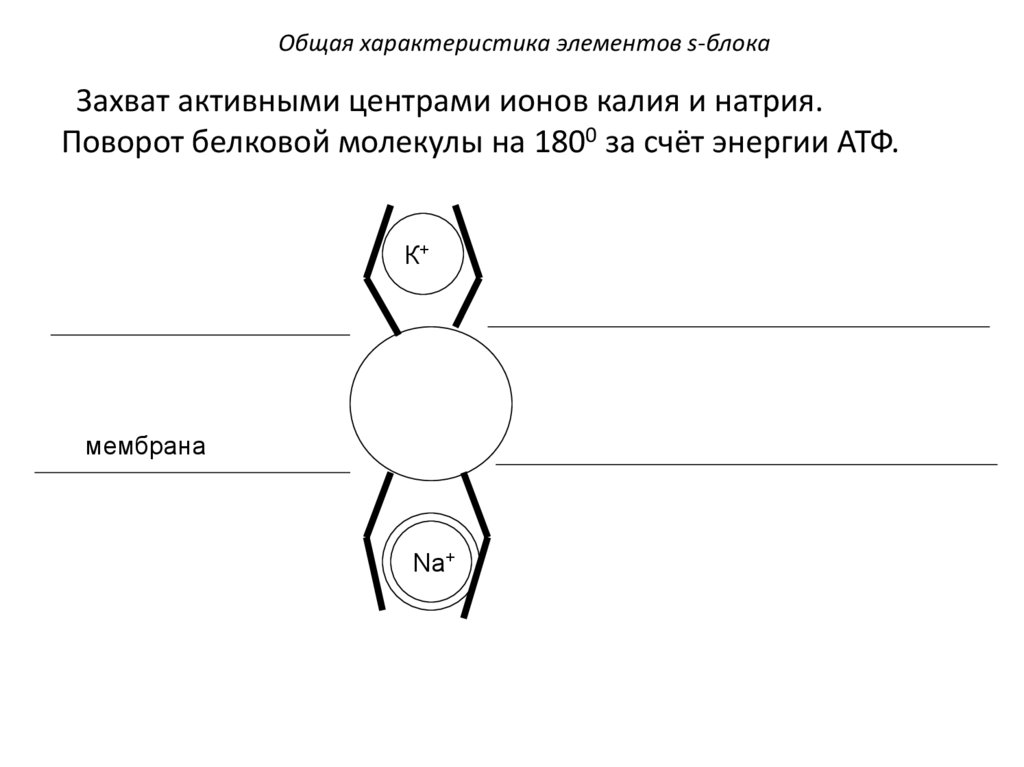
Общая характеристика элементов s-блокаЗахват активными центрами ионов калия и натрия.
Поворот белковой молекулы на 1800 за счёт энергии АТФ.
К+
мембрана
Na+
95.
Общая характеристика элементов s-блокаNa+
мембрана
К+
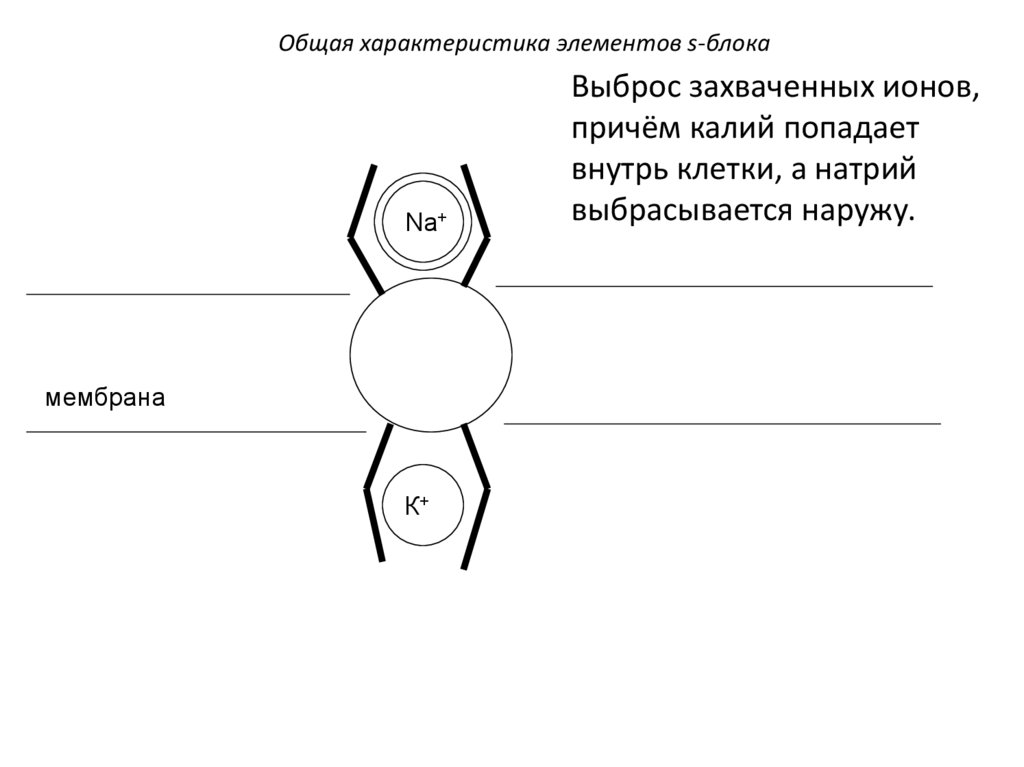
Выброс захваченных ионов,
причём калий попадает
внутрь клетки, а натрий
выбрасывается наружу.
96.
Общая характеристика элементов s-блокаNa+
мембрана
К+
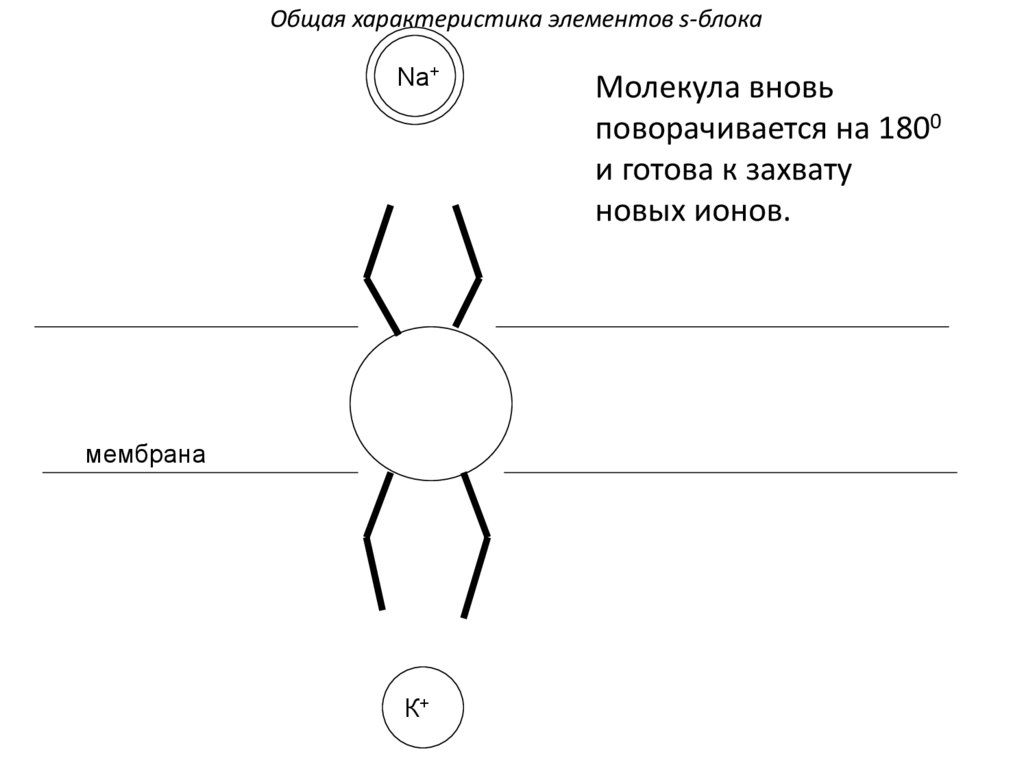
Молекула вновь
поворачивается на 1800
и готова к захвату
новых ионов.
97.
Общая характеристика элементов s-блокаИоны Na+ и К+ принимают участие в биокатализе,
образуя комплексы фермент-катион (К+, Na+) –
субстрат.
Суточное потребление К+
составляет ≈ 2 – 3 г/сутки.
При калиевом истощении
применяют KCl.
98.
Общая характеристика элементов s-блока85.5
Rb
Рубидий и цезий
По содержанию в
организме человека рубидий
37
(10-5%) и цезий (10-4%)
Элемент пятого периода относятся к микроэлементам.
Они постоянно содержатся в
организме, но биологическая
137
роль их еще не выяснена.
55
Cs
Элемент шестого периода
99.
Общая характеристика элементов s-блокаРубидий – синергист калия – активирует те же
самые ферменты, что и калий: пируватфосфокиназу,
альдегиддегидрогеназу и др.
Радиоактивные изотопы:
133
Cs
55
87
Rb
37
используют в радиотерапии
злокачественных опухолей.
100.
Общая характеристика элементов s-блока223
Fr
Франций
Это радиоактивный
химический элемент,
87
полученный искусственным
Элемент седьмого периода путем.
Имеются данные, что франций способен избирательно
накапливаться в опухолях на самых ранних стадиях их
развития.
Эти наблюдения могут оказаться полезными при
диагностике онкологических заболеваний.
101.
s-Элементы IIА группыОбщая электронная формула ns2, валентность II,
степень окисления +2.
Be Mg Ca Sr
Ba Ra
Важную физиологическую роль среди этих
элементов имеют макроэлементы магний и
кальций и микроэлементы стронций и барий.
102.
Общая характеристика элементов s-блокаЭлементы IIА-группы, за исключением бериллия,
обладают выраженными металлическими свойствами.
В виде простых веществ они
представляют собой серебристобелые металлы с высокими
температурами плавления.
Элементы IIА-группы – сильные восстановители,
причем восстановительная активность с увеличением
радиуса атома в ряду Ве - Rа закономерно возрастает.
103.
Общая характеристика элементов s-блокаКак и щелочные металлы, кальций, стронция, барий,
рабий вытесняют водород из воды даже при комнатной
температуре. При этом образуются гидроксиды Э(ОН)2.
Активность взаимодействия с водой в ряду
Са – Sr – Ba - Ra существенно возрастает.
Подобно щелочным металлам щелочноземельные
при высокой температуре окисляются водородом до
гидридов ЭН2.
При нагревании s-элементы IIА-группы
взаимодействуют с азотом, фосфором, углеродом,
галогенами и другими неметаллами.
104.
Общая характеристика элементов s-блокаРазлична биологическая роль этих элементов в
живых организмах.
В отличии от магния ион кальция
является внеклеточным катионом.
При длительном поступлении в
организм избыточных количеств
солей магния наблюдается усиленное
выделение кальция из костной ткани
и некоторых белков.
105.
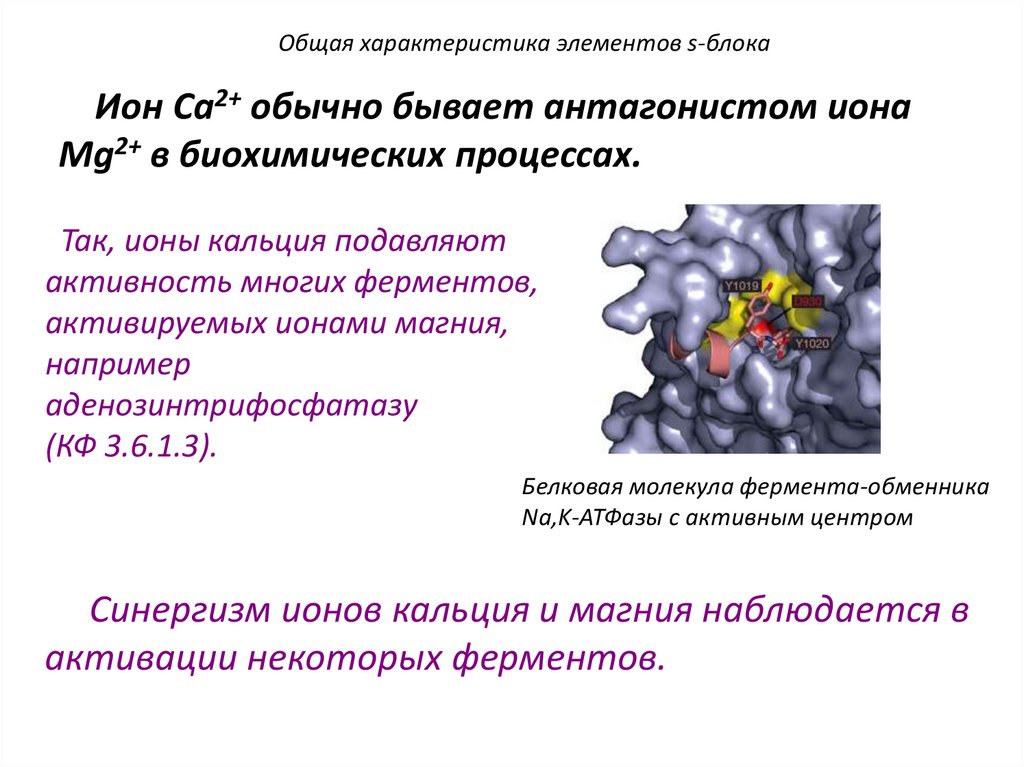
Общая характеристика элементов s-блокаИон Са2+ обычно бывает антагонистом иона
Мg2+ в биохимических процессах.
Так, ионы кальция подавляют
активность многих ферментов,
активируемых ионами магния,
например
аденозинтрифосфатазу
(КФ 3.6.1.3).
Белковая молекула фермента-обменника
Na,K-АТФазы с активным центром
Синергизм ионов кальция и магния наблюдается в
активации некоторых ферментов.
106.
Общая характеристика элементов s-блокаСходство в размерах ионов кальция и стронция
приводит к наличию постоянной примеси стронция
в организме.
Стронций оказывает влияние на процессы в
костной ткани.
Барий играет определенную роль в
функционировании органов зрения.
107.
Общая характеристика элементов s-блокаМагний и бериллий являются антагонистами.
Именно поэтому при отравлении солями бериллия
вводят избыток солей магния.
Вследствие токсичности соединения бериллия в
медицинской практике в качестве лекарственных
средств не применяются.
108.
Общая характеристика элементов s-блока9
4
Be
Элемент второго
периода
Бериллий
Содержания бериллия в
живых организмах составляет
≈10-7%, т.е. он является
примесным
ультрамикроэлементом.
Биологическая роль бериллия изучена
недостаточно. Известно, что соединения бериллия
токсичны и вызывают ряд заболеваний (бериллиевый
рахит).
109.
Общая характеристика элементов s-блокаМагний
Магний формально
относится к макроэлементом.
Общее содержание его в
организме 0,027% (около 20г).
24
12
Mg
Элемент третьего
периода
У взрослого человека суточная потребность в магнии
составляет около 0,7 г.
110.
Общая характеристика элементов s-блокаВ наибольшей степени
магний концентрируется в
дентине и эмали зубов,
костной ткани. Накапливается
он также в поджелудочной
железе, скелетных мышцах,
почках мозге, печени и сердце.
Концентрация ионов магния внутри клеток
примерно в 2,5-3 раза выше, чем во внеклеточных
жидкостях.
111.
Общая характеристика элементов s-блокаИоны магния играют важную биологическую
роль в организме человека.
Вследствие меньшего
радиуса иона и большей энергии
ионизации ион магния образует
более прочные связи, чем ион
кальция, и поэтому является
более активным катализатором
ферментативных процессов.
Гидролиз АТФ проходит при
обязательном избытке ионов
магния.
112.
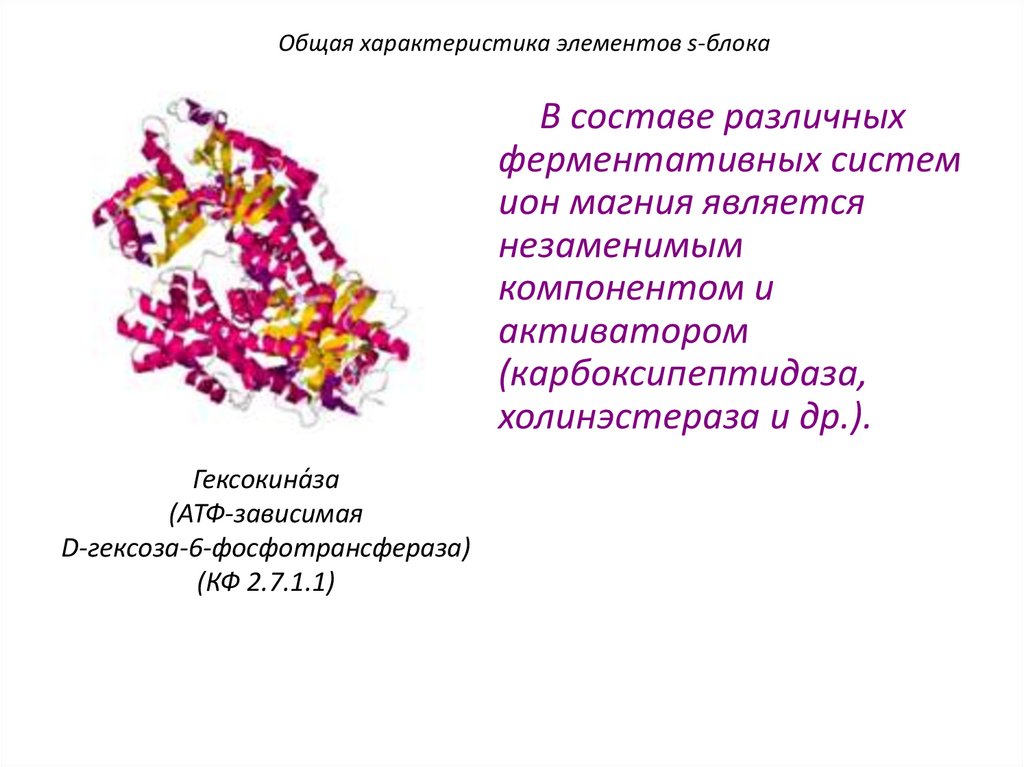
Общая характеристика элементов s-блокаВ составе различных
ферментативных систем
ион магния является
незаменимым
компонентом и
активатором
(карбоксипептидаза,
холинэстераза и др.).
Гексокина́за
(АТФ-зависимая
D-гексоза-6-фосфотрансфераза)
(КФ 2.7.1.1)
113.
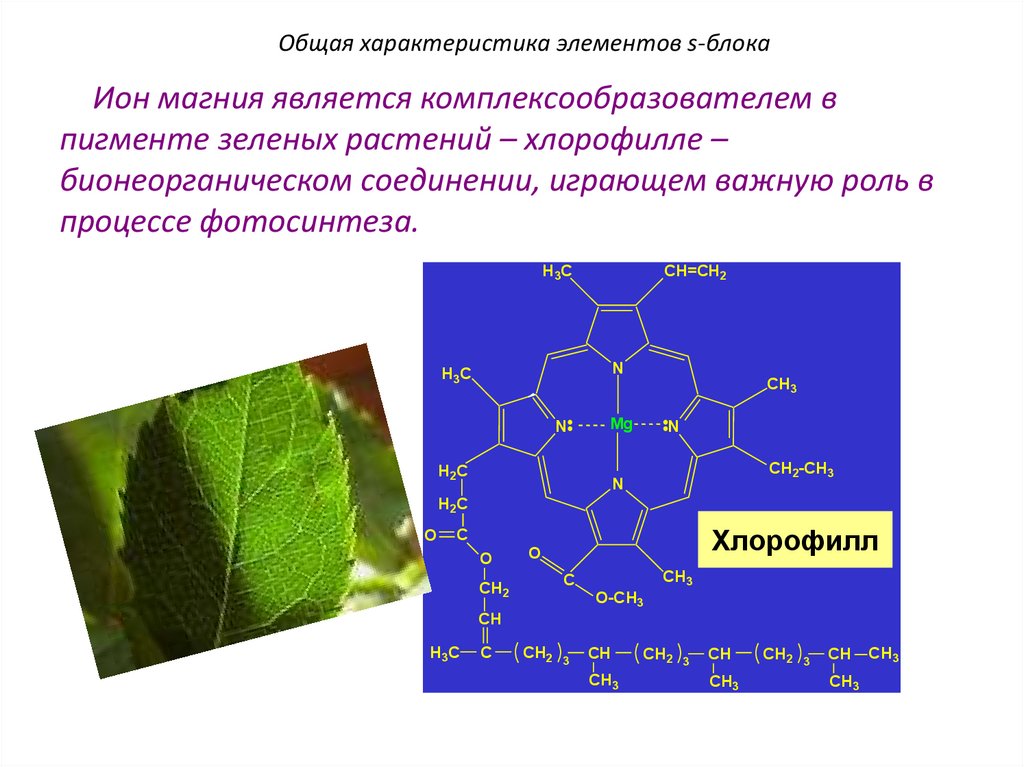
Общая характеристика элементов s-блокаИон магния является комплексообразователем в
пигменте зеленых растений – хлорофилле –
бионеорганическом соединении, играющем важную роль в
процессе фотосинтеза.
H3C
CH=CH2
N
H3C
CH3
N
Mg
H2C
N
CH2-CH3
N
H2C
O
Хлорофилл
C
O
CH2
O
CH3
C
O-CH3
CH
H3C
C
CH2 3
CH
CH3
CH2 3
CH
CH3
CH2 3
CH
CH3
CH3
114.
Общая характеристика элементов s-блокаВ медицине применяются
соединения магния:
Mg(ОН)2·4МgСО3·Н2О - белая
магнезия)- обладает
антацидный и легким
слабительным действием.
115.
Общая характеристика элементов s-блокаМgSО4·7Н2О - (горькая
соль) оказывает
успокаивающее действие на
центральную нервную
систему.
Действие препарата основано на том, что ионы магнии в
зависимости от концентрации блокируют или обеспечивают
нервно-мышечную проводимость, они понижают
возбудимость дыхательного центра, а также угнетают
сосудодвигательный центр, вследствие чего снижают
артериальное давление.
116.
Общая характеристика элементов s-блокаМgSО4· 7Н2О применяют и как
слабительное.
При приеме магния
сульфата из-за плохой
его всасываемости в
просвете кишечника
создается высокое осмотическое давление, что
приводит к диффузии воды в просвете
кишечника. В результате этого происходит
разжижение кишечного содержимого.
117.
Общая характеристика элементов s-блока2МgSiО3·Mg(HSiО3)2 – тальк – применяют в качестве
адсорбирующего и обволакивающего средства.
Это соединение используется
также в качестве компонента
для приготовления
лекарственных форм – паст и
таблеток.
118.
Общая характеристика элементов s-блока40
20
Ca
Кальций
Его электронная
конфигурация:
2.
Ca
[Ar]4s
20
Элемент четвертого
периода
Кальций – макроэлемент, его содержание в
организме около 1,4% (1 кг на 70 кг массы тела).
119.
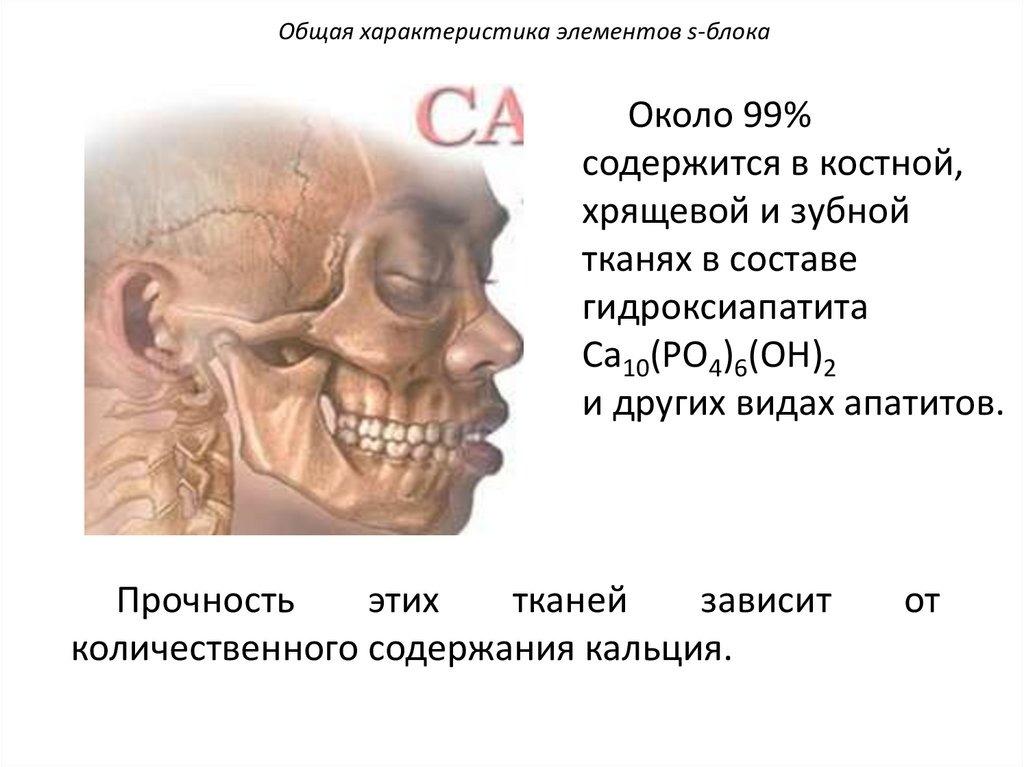
Общая характеристика элементов s-блокаОколо 99%
содержится в костной,
хрящевой и зубной
тканях в составе
гидроксиапатита
Ca10(PO4)6(OH)2
и других видах апатитов.
Прочность
этих
тканей
зависит
количественного содержания кальция.
от
120.
Общая характеристика элементов s-блокаМолекулярная структура
кальций-связывающего
белка S100β
Запас кальция постоянно
обновляется за счет
непрерывной перестройки
костной ткани.
Кальций также содержится
в крови, слюне,
внутриклеточных и
межклеточных жидкостях.
В плазме крови его
содержание составляет около
10 мг на 100 мл, причем 50%
его связано с белками.
121.
Общая характеристика элементов s-блокаИоны кальция принимают участие в передаче
нервных импульсов, сокращении мышц,
свертывании крови.
-
Cl
Являются одними из
немногих
универсальных
регуляторов
жизнедеятельности
клеток, оказывают
влияние на
проницаемость
клеточных мембран.
122.
Общая характеристика элементов s-блокаГемолиз Плазмолиз
Ионы кальция
регулируют кислотноосновное
равновесие, участвуют
в поддержании
постоянства
осмотического
давления крови,
регулируют функцию эндокринных
желез, снижают возбудимость ЦНС.
123.
Общая характеристика элементов s-блокаГрадиент концентраций Са2+
между цитоплазмой и средой на уровне четырех порядков.
Это обеспечивается
связыванием Са2+ в хелатные
соединения специфическими
белками, в частности,
кальмодулином.
Кальций
Кальций
124.
Общая характеристика элементов s-блокаСуточная потребность в кальции для взрослого
человека составляет 0,8–1,1 г.
Биоусвояемость кальция составляет 25-40%. В
организм должен поступать в определенном
соотношении с фосфором. Оптимальным
соотношением этих элементов принято считать 1: 1,5
(Ca : P).
Кальций содержится в
молоке и молочных
продуктах, яйцах, мясе,
овощах и фруктах.
125.
Общая характеристика элементов s-блокаВ медицине используют соединения кальция:
CaCl2 · 6H2O, глюконат и лактат кальция
применяют
при
аллергических
и
кожных
заболеваниях, отравлениях солями свинца, ртути, а
также при кровотечениях.
126.
Общая характеристика элементов s-блокаПолуводный гипс или алебастр CaSO4 ∙ 0,5H2O
применяют при наложении гипсовых повязок:
CaSO4 ∙ 0,5H2O + 1,5H2O = CaSO4 ∙ 2H2O
127.
Общая характеристика элементов s-блока88
38
Sr
Элемент пятого
периода
Стронций
Стронций относится к
примесным микроэлементам. Его
содержание в организме 10-3%.
Концентрируется стронций
главным образом в костях, частично
замещая кальций.
Важную роль играет стронций в процессах
костеобразования (остеогенеза).
128.
Общая характеристика элементов s-блокаОпределение содержания стронция в плазме и
эритроцитах используют для диагностики и
прогнозирования заболеваний лейкозом.
Этот тест связан с тем, что при лейкозах
содержание стронция в плазме крови
уменьшается, а в эритроцитах увеличивается.
Радиоактивные изотопы 89Sr и 90Sr применяют в
лучевой терапии при лечении костных опухолей.
129.
Общая характеристика элементов s-блока137
Ba
56
Элемент шестого
периода
Барий
Барий также является
примесным микроэлементом.
Концентрируется барий
преимущественно в сетчатке глаза.
Барий играет определенную роль в
функционировании органов зрения.
При лейкозах содержание бария в эритроцитах и
плазме крови увеличивается, т. е. количественное
определение бария может служить диагностическим
тестом на заболевание лейкозом.
130.
Общая характеристика элементов s-блокаРадий
Радий относится к примесным
микроэлементам.
Общее содержание его в
организме 10-11-10-12%.
226
88
Ra
Элемент седьмого
периода
Максимально допустимое содержание радия в
организме человека 10-7%.
Концентрируется радий преимущественно в костной
ткани.
131.
ОБЩАЯ ХАРАКТЕРИСТИКАр-ЭЛЕМЕНТОВ
Элементы у которых происходит достройка р-подуровня
внешнего валентного уровня называют р-элементами.
Электронное строение валентного уровня ns2p1-6.
Валентными являются электроны s- и р-подуровней.
p1 p2 p3 p4 p5 p6
К p-блоку относят 30 элементов
III – VIII A-групп периодической
системы - неметаллы и
переходные амфотерные
металлы.
132.
Общая характеристика элементов p-блокаБольшинство р-элементов-неметаллов – биогенные
(исключение – благородные газы, теллур и астат).
Из р-элементов-металлов – к биогенным относят только
алюминий.
р-Элементы имеют много
валентных электронов,
обладающих различной
энергией. Поэтому в
соединениях проявляют
различную степень
окисления.
133.
Общая характеристика элементов p-блокаАктивность неметаллов
Активность неметаллов
В процессе реакции
р-элемент может отдавать и
принимать электроны,
выступая соответственно
восстановителем или
окислителем в зависимости от
свойств элемента, с которым
вступает во взаимодействие.
He
B C N O F Ne
Si P S Cl Ar
Ge As Se Br Kr
Sb Te I Xe
At Rn
инактивные
134.
Общая характеристика элементов p-блокаБольшинство известных на Земле соединений – это
соединения р-элементов. Пять главных
(макробиогенных) р-элементов жизни – О, Р, С, N и S –
это основной строительный материал, из которого
сложены молекулы белков, жиров, углеводов и
нуклеиновых кислот.
Из низкомолекулярных соединений р-элементов
наибольшее значение имеют анионы: СО32-, НСО3-,
С2O42-, СН3СОО-, РО43-, НРO42-, H2PO4-, SO42- и галогенидионы.
135.
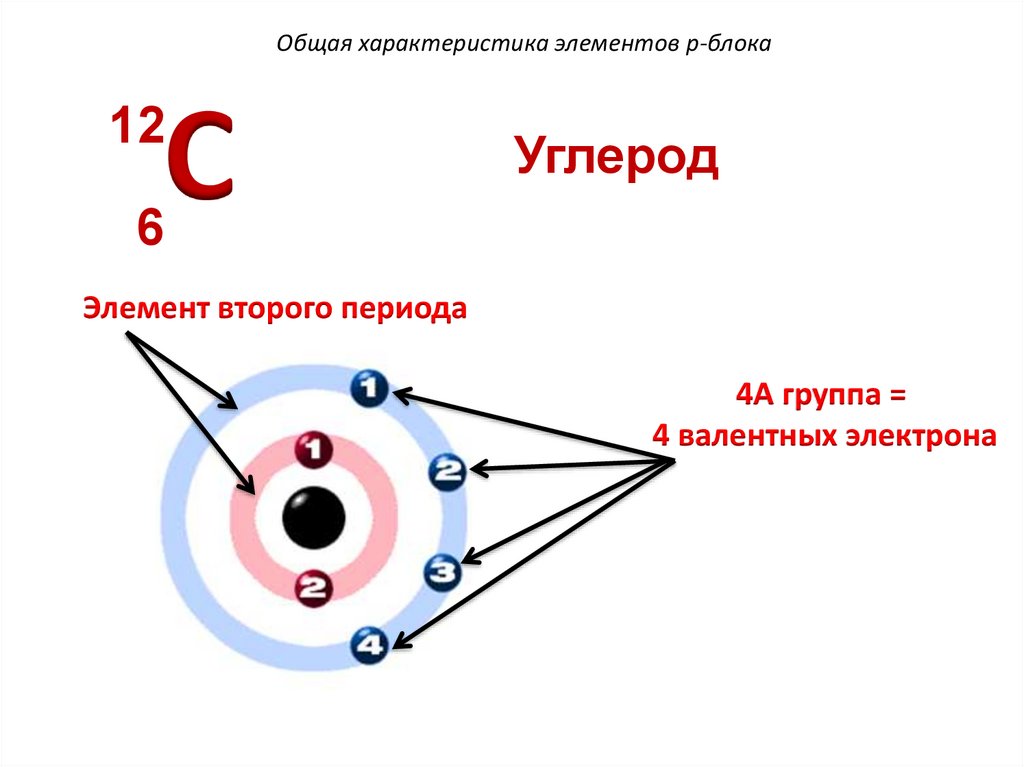
Общая характеристика элементов p-блокаC
12
Углерод
6
Элемент второго периода
4А группа =
4 валентных электрона
136.
Общая характеристика элементов p-блока31
15
P
Фосфор
Это органогенный элемент, входит в
состав всех живых организмов (содержится
в костях, мышцах, нервных тканях, в виде
PO43- входит в состав нуклеиновых кислот).
Содержание фосфора в теле взрослого
человека около 1% (примерно 700 г на 70 кг
массы тела).
137.
Общая характеристика элементов p-блокаВ организме фосфор встречается только в виде
органических и неорганических фосфатов, которые:
Служат структурными компонентами скелета.
Основным минеральным компонентом костной ткани
является фосфат гидроксокальция (гидроксиапатит)
Ca10(PO4)6(OH)2.
Обмен фосфора в организме
связан с обменом кальция: при
увеличении содержания кальция
в крови уменьшается
содержание фосфатов.
138.
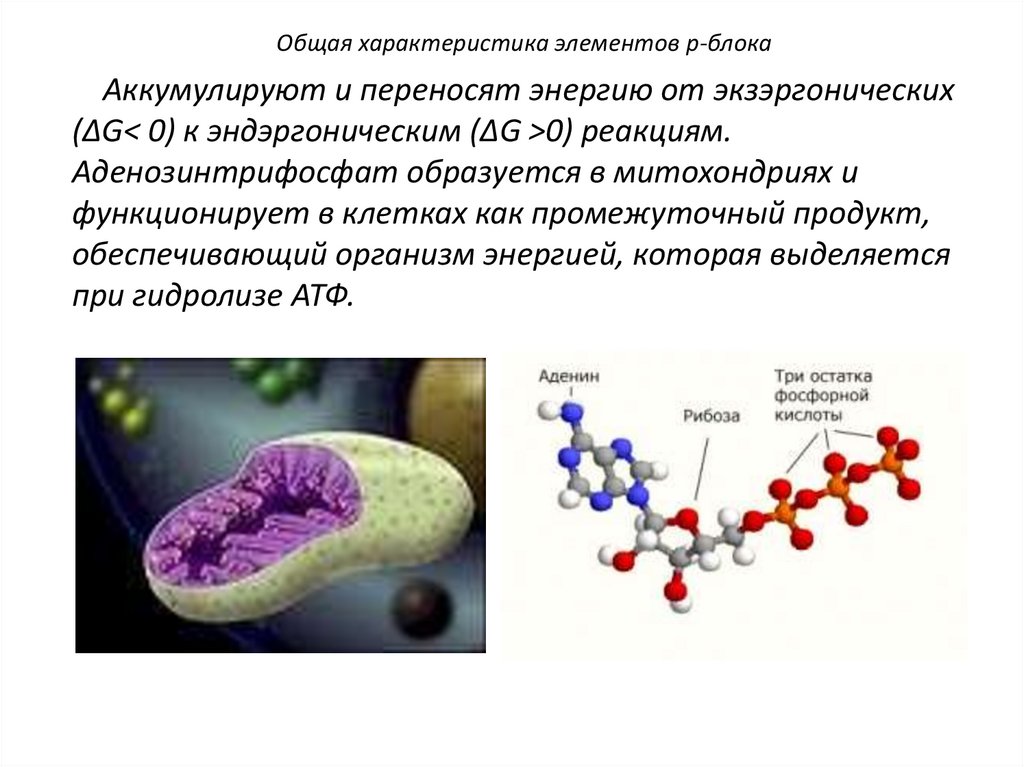
Общая характеристика элементов p-блокаАккумулируют и переносят энергию от экзэргонических
(∆G< 0) к эндэргоническим (∆G >0) реакциям.
Аденозинтрифосфат образуется в митохондриях и
функционирует в клетках как промежуточный продукт,
обеспечивающий организм энергией, которая выделяется
при гидролизе АТФ.
139.
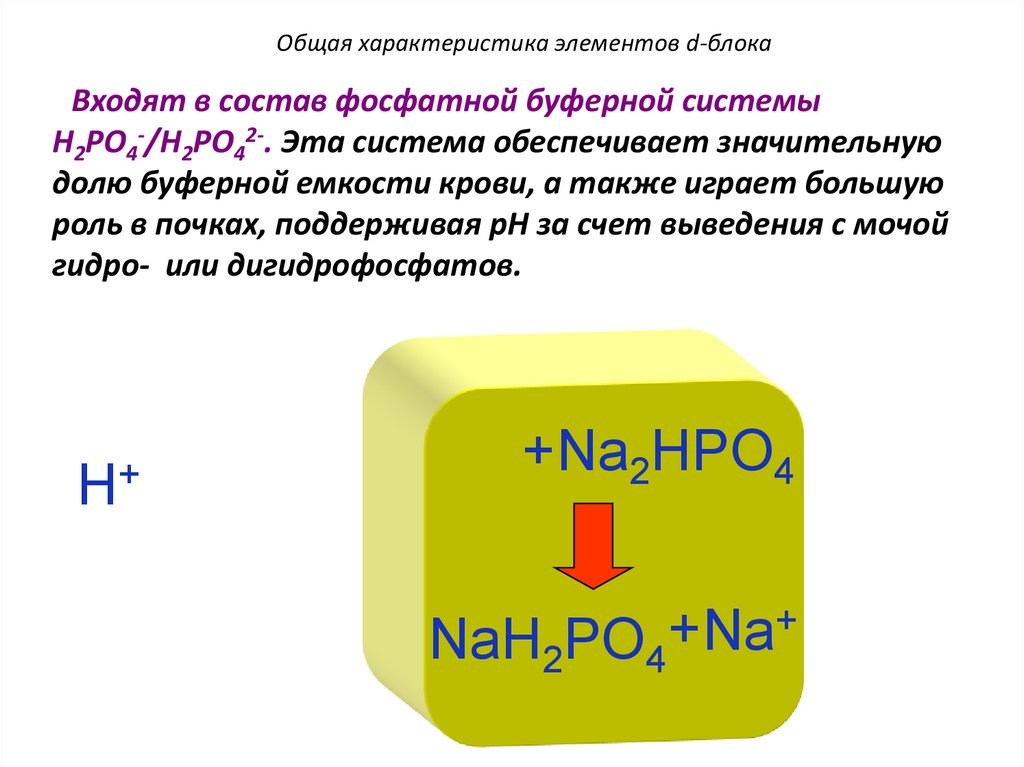
Общая характеристика элементов d-блокаВходят в состав фосфатной буферной системы
H2PO4-/H2PO42-. Эта система обеспечивает значительную
долю буферной емкости крови, а также играет большую
роль в почках, поддерживая pH за счет выведения с мочой
гидро- или дигидрофосфатов.
H+
+Na2HPO4
+
+
Na
NaH2PO4
140.
Общая характеристика элементов p-блокаНекоторые лекарственные препараты применяются в
форме солей фосфорной кислоты – фосфатов.
Дигидрофосфат калия KH2PO4 – при повышенной
кислотности желудочного сока, при отравлении кислотами.
Производные фосфорной
кислоты: фитин,
глицерофосфат кальция,
фосфрен и др. используются
при заболеваниях нервной
системы.
Эфир фосфорной кислоты –
фосфэстрол – применяется при раке
предстательной железы.
141.
ОБЩАЯ ХАРАКТЕРИСТИКА d-ЭЛЕМЕНТОВЭлементы d-блока – это элементы, у которых
происходит достройка d-подуровня предвнешнего
уровня. Они образуют В-группы.
Электронное строение валентного уровня
d-элементов: (n-1)d1-10 ns1-2.
Они расположены между s- и р-элементами,
поэтому
получили
название
«переходные
элементы».
d-Элементы образуют 3 семейства в больших
периодах и включают по 10 элементов.
142.
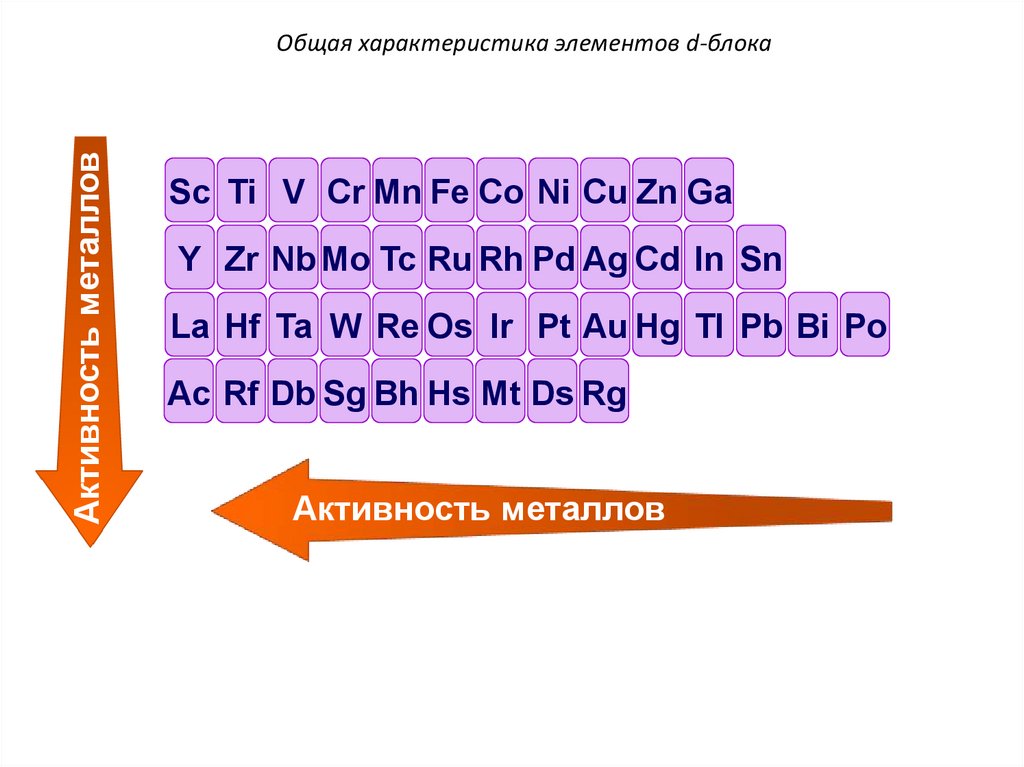
Активность металловОбщая характеристика элементов d-блока
Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga
Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn
La Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po
Ac Rf Db Sg Bh Hs Mt Ds Rg
Активность металлов
143.
Общая характеристика элементов d-блокаОсобенности
d-элементов
определяются
электронным строением их атомов: во внешнем
электронном слое содержится не более
2
s-электронов,
р-подуровень
свободный,
происходит заполнение d-подуровня предвнешнего
уровня.
На внешнем уровне находится большое число
свободных орбиталей.
По химической активности d-элементы весьма
разнообразны. Такие как Sc, Mn, Zn наиболее
химически активны (как щелочноземельные).
d-Элементы проявляют переменную степень
окисления, а, следовательно, для них характерны
реакции окисления-восстановления.
144.
Общая характеристика элементов d-блокаВ организме d-элементы представлены как
микроэлементы, существующие или в виде
гидратированных, гидролизованных ионов; но чаще в
виде бионеорганических комплексов.
Они выступают в качестве сильных
комплексообразователей, что обусловлено наличием в
их атомах свободных орбиталей.
d-Элементы входят в состав ферментов,
гормонов, витаминов и других жизненно важных
соединений.
145.
Общая характеристика элементов d-блокаГормон инсулин - хелат Zn2+ c белком.
146.
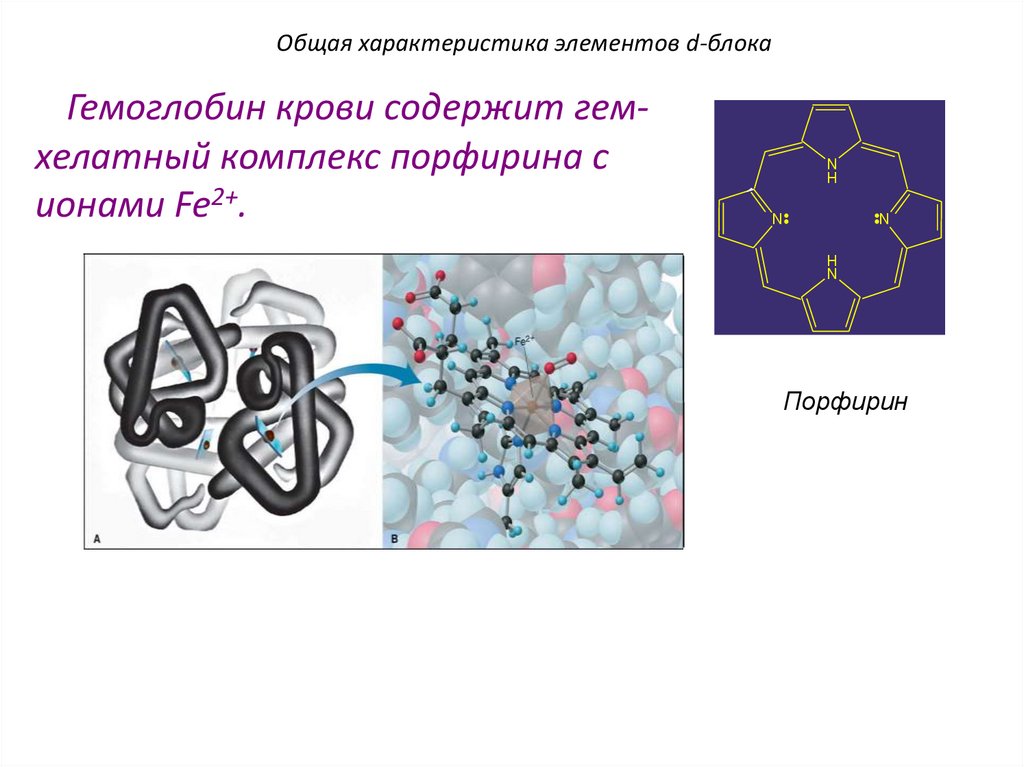
Общая характеристика элементов d-блокаГемоглобин крови содержит гемхелатный комплекс порфирина с
ионами Fe2+.
N
H
N
N
H
N
Порфирин
147.
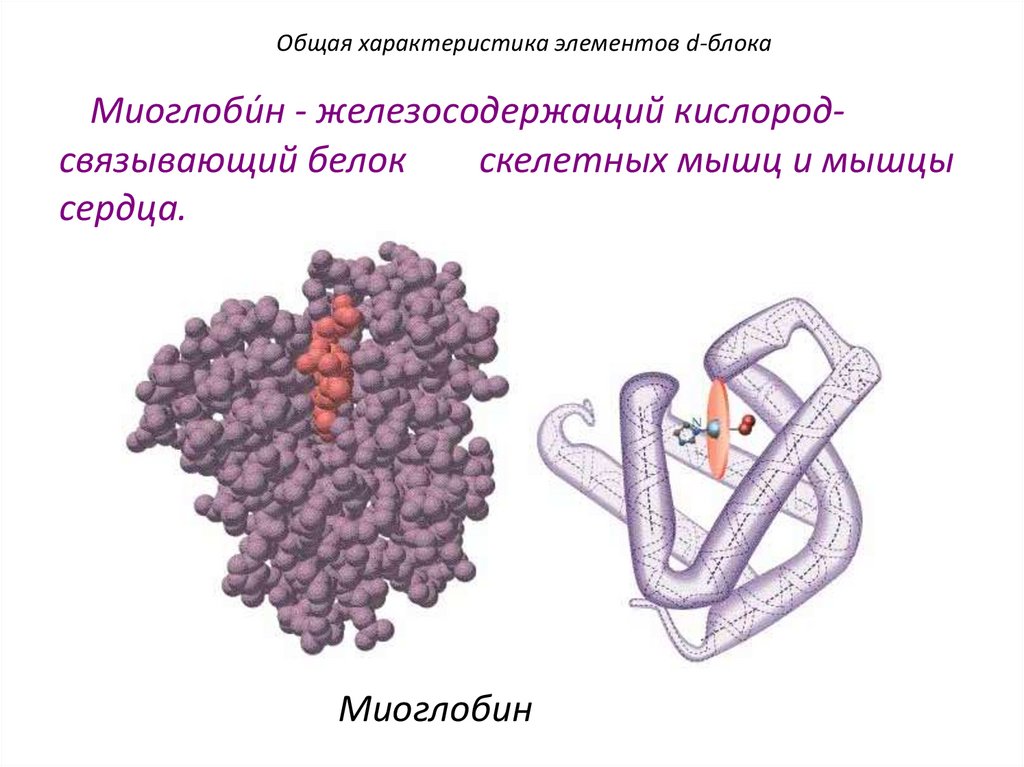
Общая характеристика элементов d-блокаМиоглоби́н - железосодержащий кислородсвязывающий белок
скелетных мышц и мышцы
сердца.
Миоглобин
148.
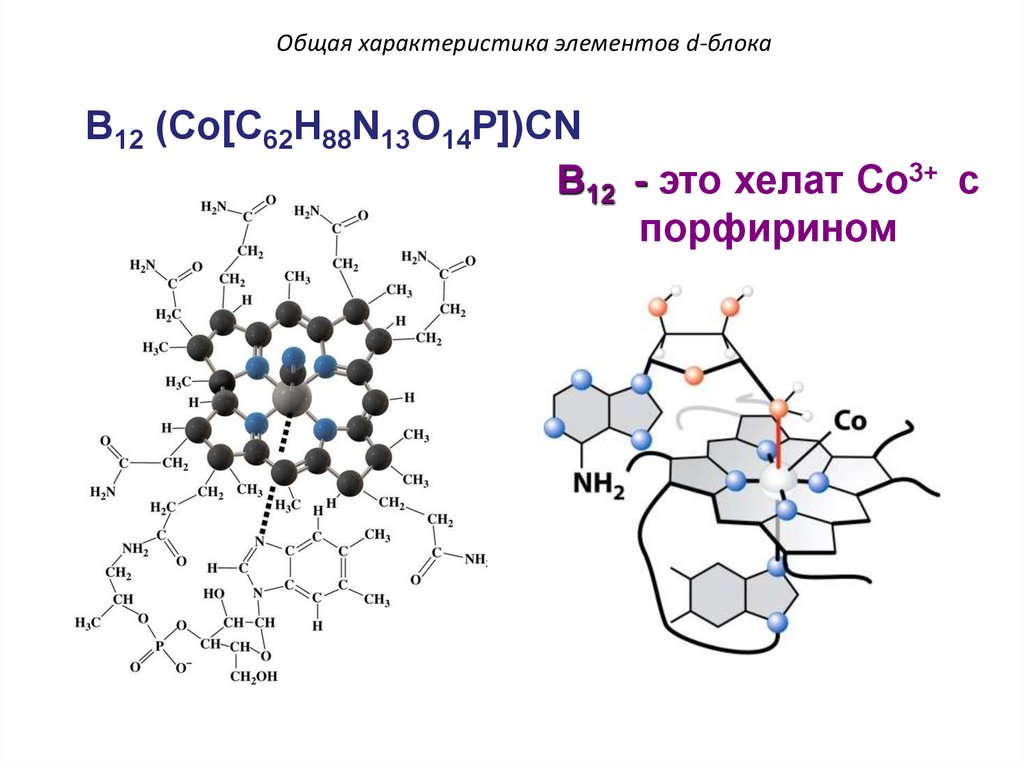
Общая характеристика элементов d-блокаB12 (Co[C62H88N13O14P])CN
B12 - это хелат Co3+ c
порфирином
149.
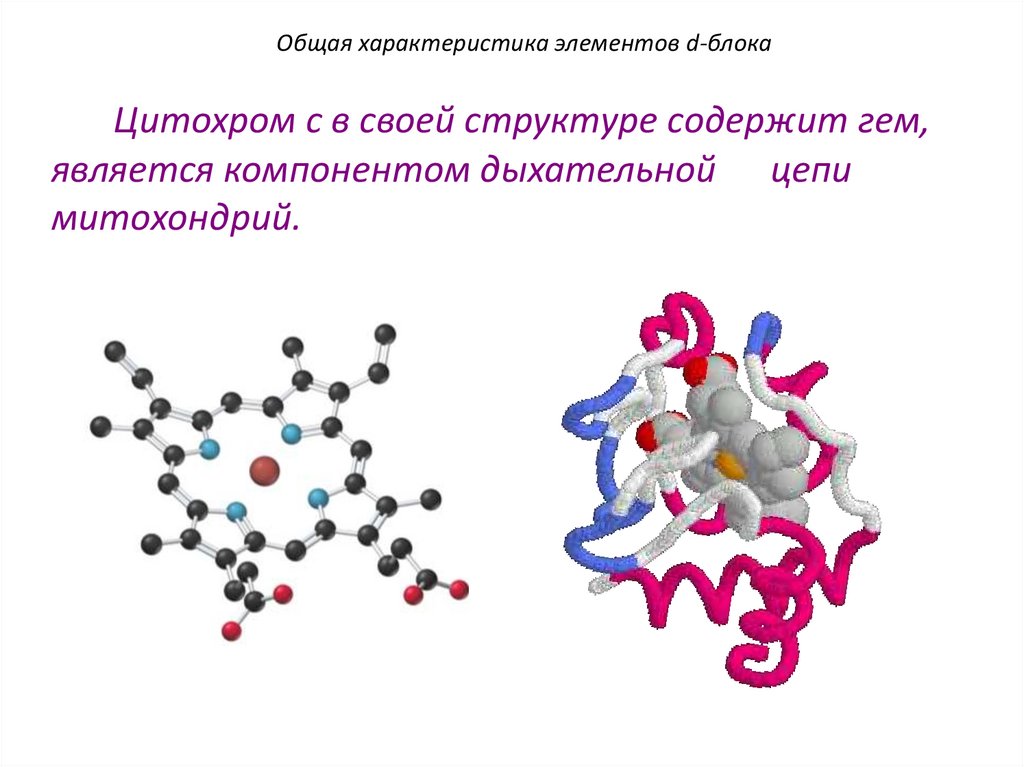
Общая характеристика элементов d-блокаЦитохром с в своей структуре содержит гем,
является компонентом дыхательной цепи
митохондрий.
150.
Общая характеристика элементов d-блокаМеталлоферменты - это
комплексы металлов с
белками.
Карбоксипептидазы относятся к
Zn-металлоферментам.
151.
Общая характеристика элементов d-блокаМодель пространственной структуры цитохром с
оксидазы (на основе PDB 1v54). Атомы меди (розоватые
сферы) и гем (решетчатая модель) в активном центре
фермента.
152.
Благодарю за Вашевнимание!




























































































 biology
biology