Similar presentations:
Изменение числа электронов на внешнем энергетическом уровне
1. ПРОВЕРКА ДОМАШНЕГО ЗАДАНИЯ §31, составить электронно-графические формы записи для: Р, Ca, Br, Al
12.
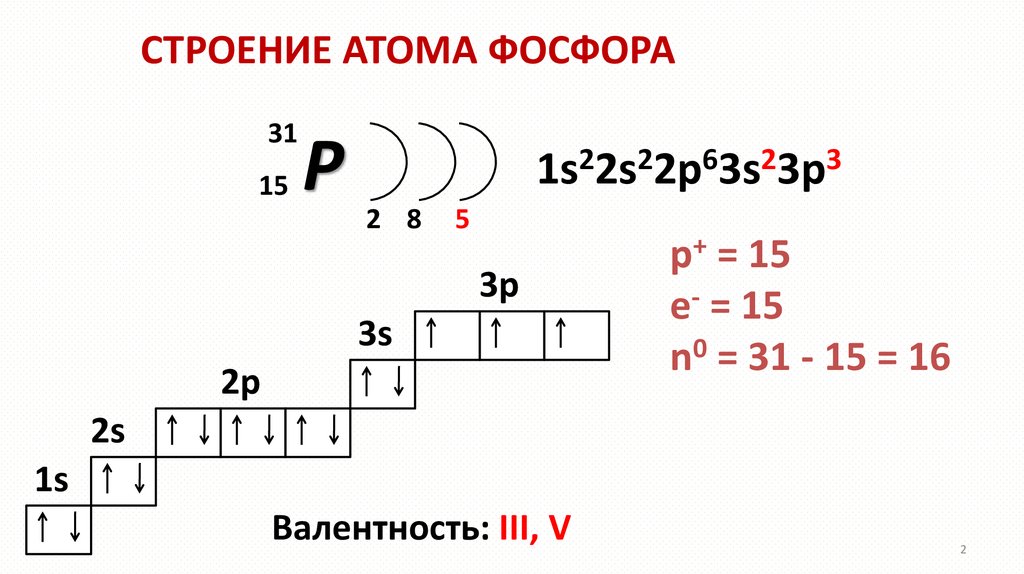
СТРОЕНИЕ АТОМА ФОСФОРА31
15
P
2
2
6
2
3
1s 2s 2p 3s 3p
2 8
5
3p
3s
2p
p+ = 15
e- = 15
n0 = 31 - 15 = 16
2s
1s
Валентность: III, V
2
3.
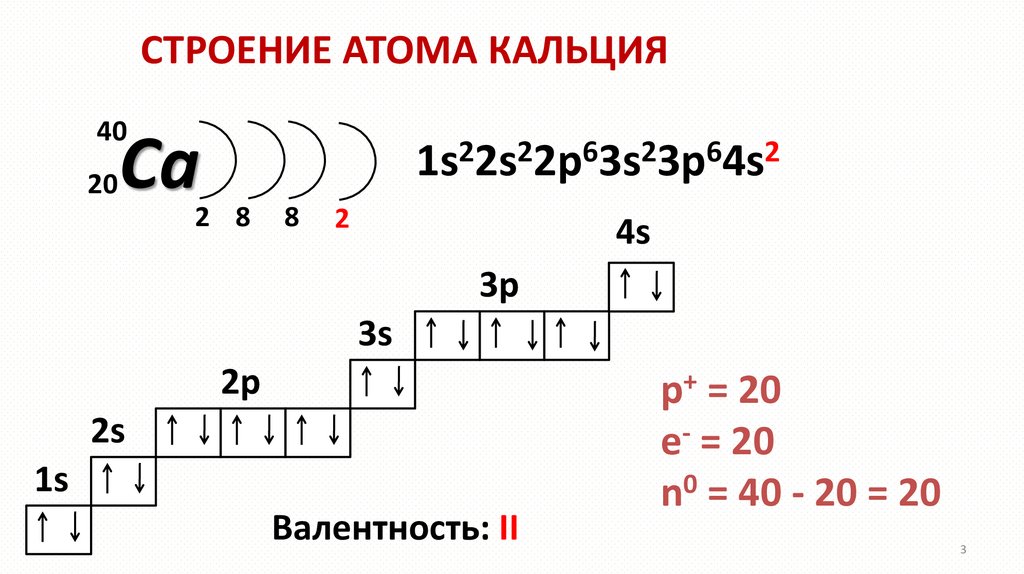
СТРОЕНИЕ АТОМА КАЛЬЦИЯ40
20
Ca
1s22s22p63s23p64s2
2 8
8
2
4s
3p
3s
2p
2s
1s
Валентность: II
p+ = 20
e- = 20
n0 = 40 - 20 = 20
3
4.
СТРОЕНИЕ АТОМА БРОМА4
5.
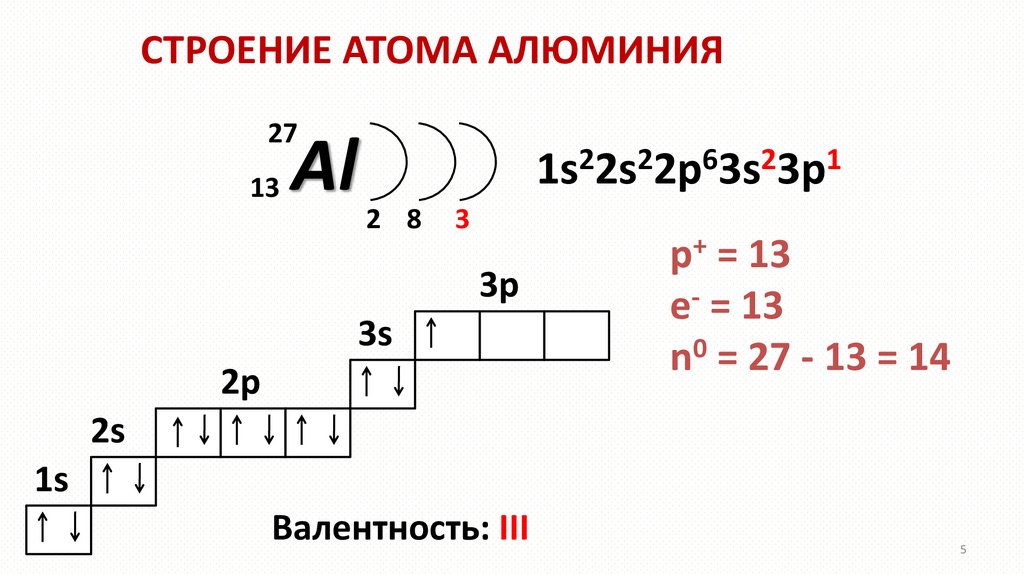
СТРОЕНИЕ АТОМА АЛЮМИНИЯ27
13
Al
2
2
6
2
1
1s 2s 2p 3s 3p
2 8
3
3p
3s
2p
p+ = 13
e- = 13
n0 = 27 - 13 = 14
2s
1s
Валентность: III
5
6. СТРОЕНИЕ АТОМА
Изменение числа электроновна внешнем энергетическом
уровне атомов химических
элементов
учитель химии: Наумова А.А.
7.
73
16
Li
8
2
1
20
O
10
2 6
Ne
28
7
8.
89.
В пределах одной и той же группыВ пределах одного и того же периода
(в главной подгруппе)
металлические свойства ослабевают→,
металлические свойства усиливаются↓,
а неметаллические – усиливаются,
а неметаллические – ослабевают,
так как:
так как:
1) Увеличиваются заряды атомных
ядер;
2) Увеличивается радиус атома;
3) Увеличивается число заполняемых
энергетических уровней;
4) Число электронов на внешнем
уровне постоянно.
1) Увеличиваются заряды атомных
ядер;
2) Уменьшается радиус атома;
3) Число заполняемых энергетических
уровней постоянно;
4) Увеличивается число электронов на
внешнем уровне.
9
10. СПАСИБО ЗА ВНИМАНИЕ! Д/З §32, упр. 3, 4, 5
1011.
Упр. 1. Запишите распределение электронов по энергетическим уровням иона, вкоторый превращается атом кальция, отдавший два электрона. Как называются
внешние слои атома и иона кальция? Каков порядковый номер у этих слоёв?
20Ca )2)8)8)2
-2e- → 20Ca+2 )2)8)8)0
У атома кальция внешний энергетический уровень 4-й, незавершенный,
у иона кальция Ca+2 – 3-й, завершенный (8-электронная устойчивая
конфигурация).
11
12.
Упр. 2.Охарактеризуйте химические элементы литий, бериллий и бор по плану:• порядковый номер;
• положение в периодической системе (номер периода, номер группы, подгруппа);
• число протонов в ядре атома;
• число энергетических уровней;
• общее число электронов;
• число электронов на внешнем энергетическом уровне.
Литий:
•3
• 2-й период,
IА-группа
• 3p+
• 2 ЭУ
• 3e• 1e-(внешн.)
Бериллий:
•4
• 2-й период,
IIА-группа
• 4p+
• 2 ЭУ
• 4e• 2e- (внешн.)
Бор:
•5
• 2-й период,
IIIА-группа
• 5p+
• 2 ЭУ
• 5e• 3e- (внешн.)
12
13.
Упр. 3. Определите количество электронов, которое нужно отдать илиприсоединить для получения завершённого внешнего энергетического уровня
атомам следующих химических элементов: кислород, натрий, хлор, магний.
Кислород расположен в VIА-группе, т.е. имеет 6 внешних электронов.
Для получения завершенного (8-электронного) внешнего (второго) уровня, он
должен забрать 2 электрона.
Натрий расположен в IА-группе, т.е. имеет 1 внешний электрон.
Для получения завершенного (8-электронного) внешнего (второго) уровня, он
должен отдать 1 электрон с третьего уровня.
Хлор расположен в VIIА-группе, т.е. имеет 7 внешних электронов.
Для получения завершенного (8-электронного) внешнего (третьего) уровня, он
должен забрать 1 электрон.
Магний расположен во IIА-группе, т.е. имеет 2 внешних электрона.
Для получения завершенного (8-электронного) внешнего (второго) уровня, он
должен отдать 2 электрона с третьего уровня.
13
14.
Упр. 4. Предложите вариант графического отображения памятки о порядкезаполнения электронных слоёв у атомов № 1—20 в таблице Д. И. Менделеева.
14


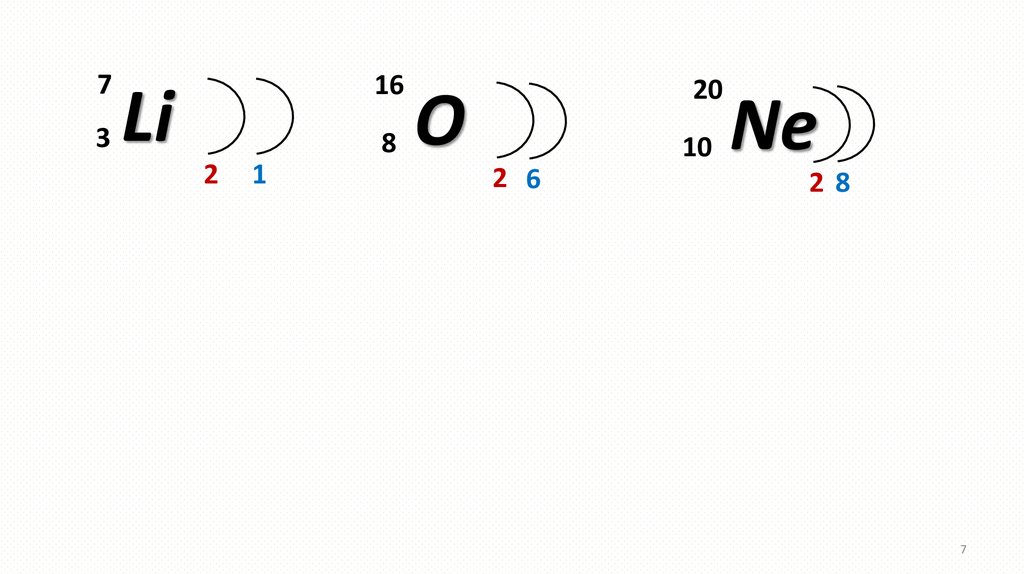





 chemistry
chemistry








