Similar presentations:
Ферменты
1.
Ферменты2.
Ферменты – биологические катализаторы белковой природы.Раздел биохимии, изучающий структуру ферментов и
катализируемые ими реакции, называется энзимологией.
Поскольку ферменты являются белковыми молекулами, они
обладают всеми свойствами, характерными для белков.
3.
Если фермент – сложный белок, то его небелковую часть называюткофактором, или коферментом, а белковую – апоферментом.
Апофермент с коферментом образует активную форму
катализатора – холофермент:
Апофермент + Кофактор (кофермент) = Холофермент
4.
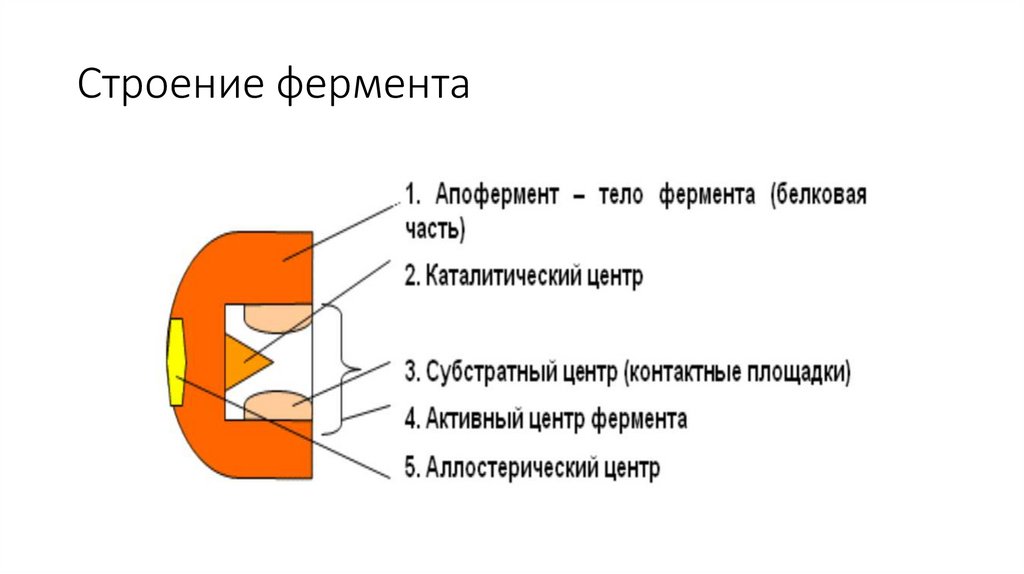
Строение фермента5.
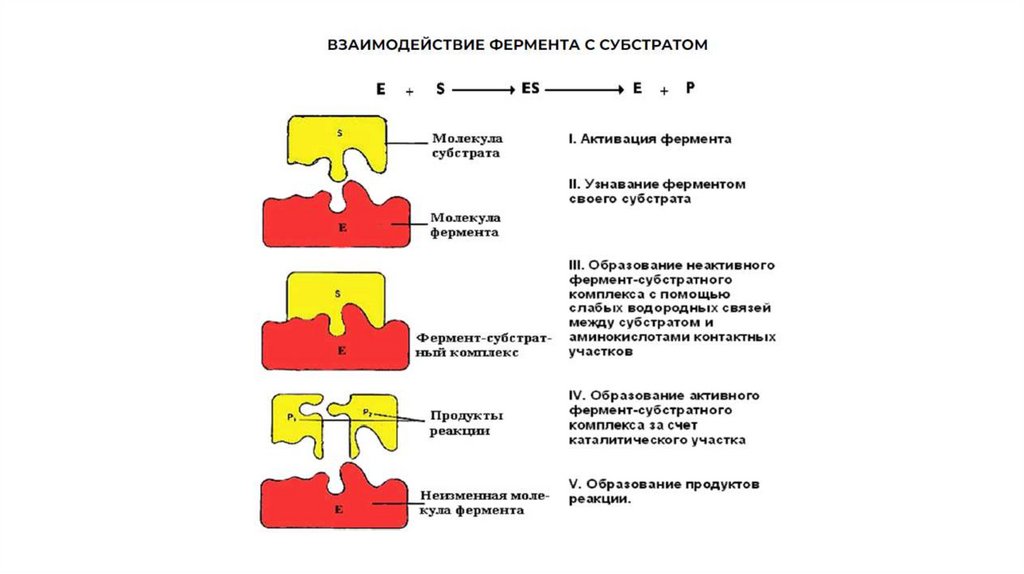
Активный центрАктивный центр - это участок на молекул белка, в котором
происходит взаимодействии фермента с субстратом.
Он формируется на уровне третичной структуры белка,
располагается в углублении, как правило, гидрофобном кармане,
или щели, и таким образом предохраняет субстрат от контакта с
окружающей фермент водной фазой. В активновм центре
присутствуют радикалы аминокислот, сближенные в процессе
формирования третичной структуры и принадлежащие разным
участкам полипептидной цепи белка
6.
Кофакторы ферментовНебелковые составляющие ферментов могут быть представлены:
• Ионами металлов: Zn2+, Mg2+, Fe2+, Cu2+" и т.д. Механизмы
участия ионов металлов в ферментативных реакциях различны.
Металл может являться частью активного центра фермента и
участвовать в катализе. Он может быть связующим звеном между
ферментом и субстратом, может проявлять координирующее
свойство, благодаря которому субстрат оказывается в активном
центре фермента
7.
Коферментами - сложными органическими веществами, в составкоторых часто входят витамины, которые не синтезируется в
организме и должны поступать с пищей.
• Коферменты в свою очередь делят на две группы:
• Органические соединения с низкой молекулярной массой,
обладающие способностью обратимо связываться с
апоферментом, например никотинамидадениндинуклеотид
(NAD+), никотинамидадениндинуклеотидфосфат (NADP+),
кофермент А (HS-КoA), тетрагидрофолиевая кислота (Н4 - фолат);
• Простетические группы - прочно присоединенные к
апоферменту, например флавинадениндинулеотид (FAD),
флавинмононуклеотид (FMN), пиридоксальфосфат (ПФ) и др.
Коферменты принимают участие в связывании и преврашении
субстратов, поэтому в его отсутствие фермент теряет свою
каталитическую активность.
8.
9.
10.
Отличия от небиологическихкатализаторов
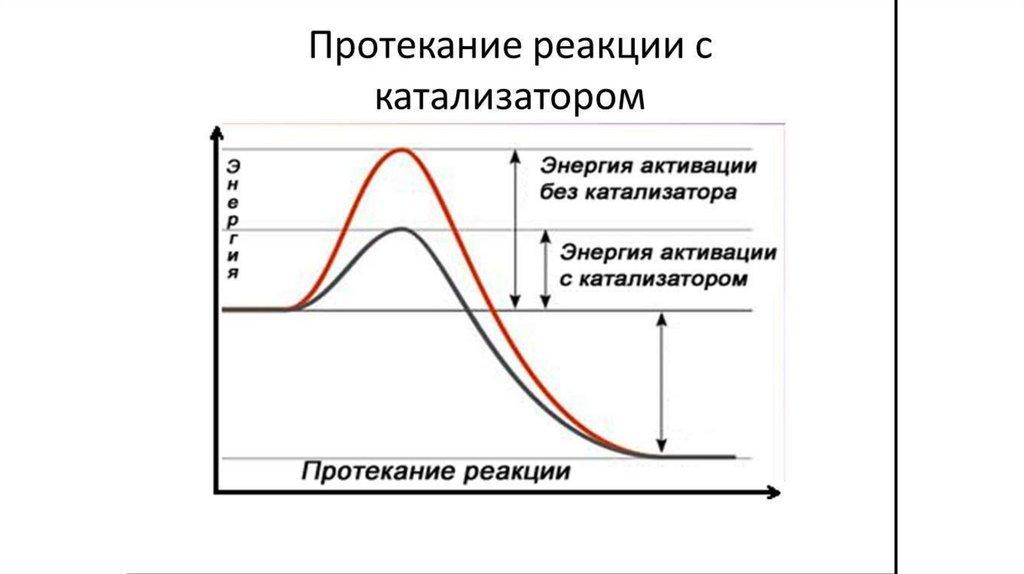
1) Высокая каталитическая эффективность. Большинство
катализируемых ферментами реакций протекает в 108-1014 раз
быстрее, чем некатализируемые реакции.
11.
2) Специфичность действия. Каждый фермент катализирует конкретнуюхимическую реакцию и при этом не происходит образования побочных
продуктов.
3) Для ферментов, как и для всех белков, характерна конформационная
лабильность, способность к небольшим изменениям нативной
конформации вследствие разрыва слабых связей. Конформационная
лабильность лежит в основе регулируемости ферментов.
4) Регулируемость. Активность ферментов в клетке зависит от
количества субстрата и продукта, наличия кофакторов и коферментов, а
также от присутствия различных активаторов и ингибиторов. Таким
образом, в зависимости от условий в клетке может изменяться
каталитическая активность ферментов. Кроме того, ферменты в клетках
подвергаются химической модификации, которая тоже оказывает
влияние на их активность.
5) Способность работать в физиологических условиях: при низких
температурах и атмосферном давлении.
12.
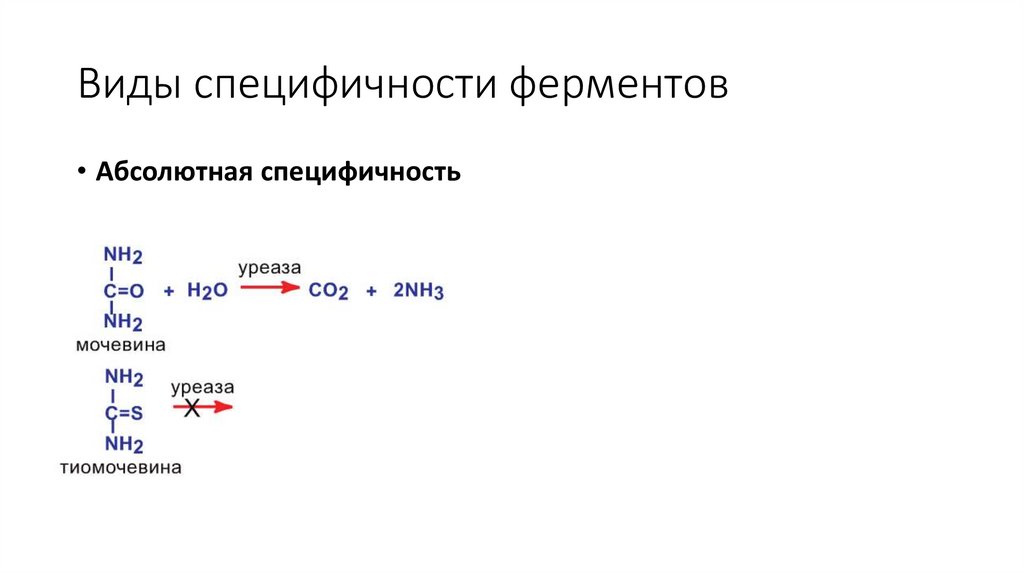
Виды специфичности ферментов• Абсолютная специфичность
13.
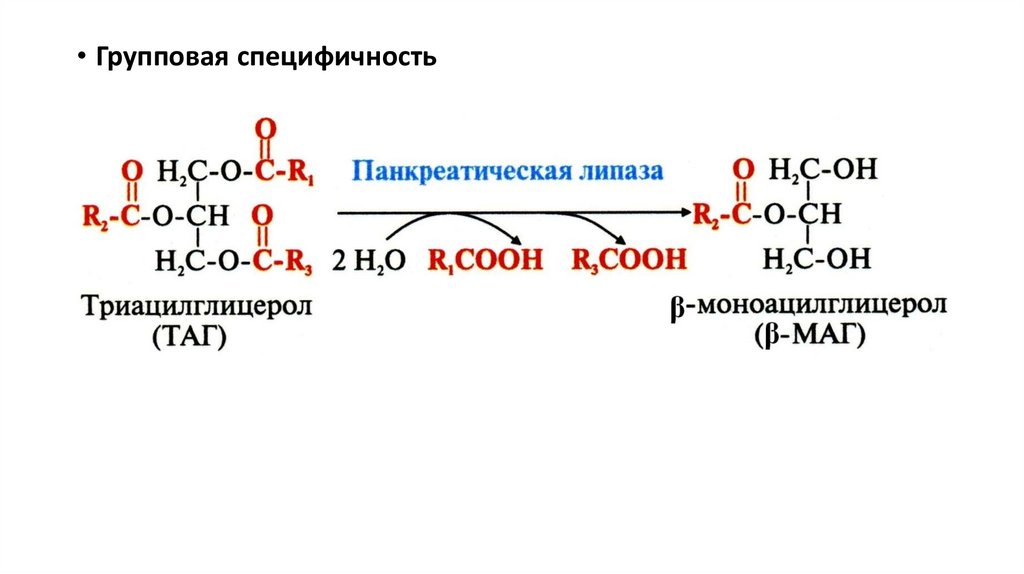
• Групповая специфичность14.
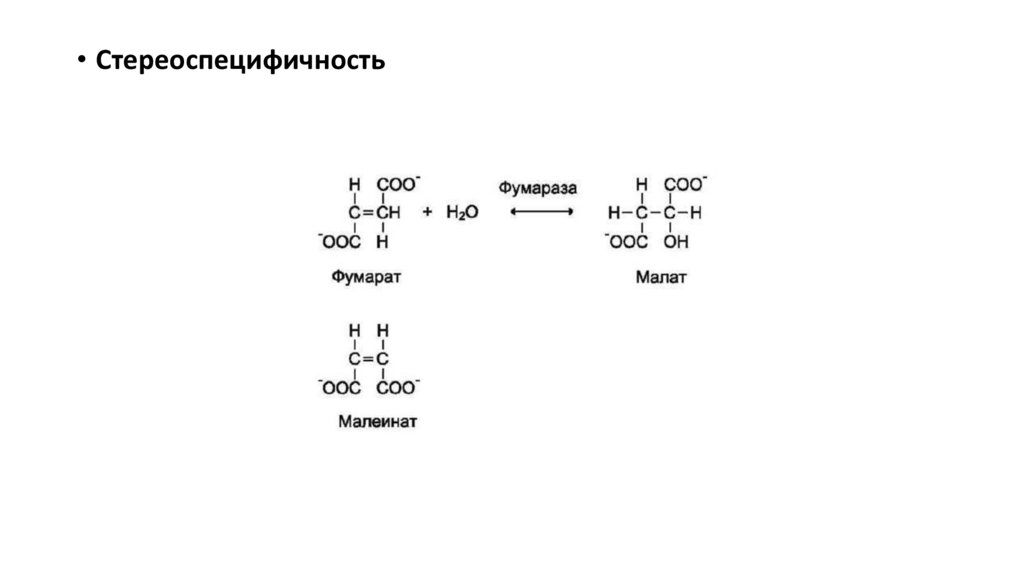
• Стереоспецифичность15.
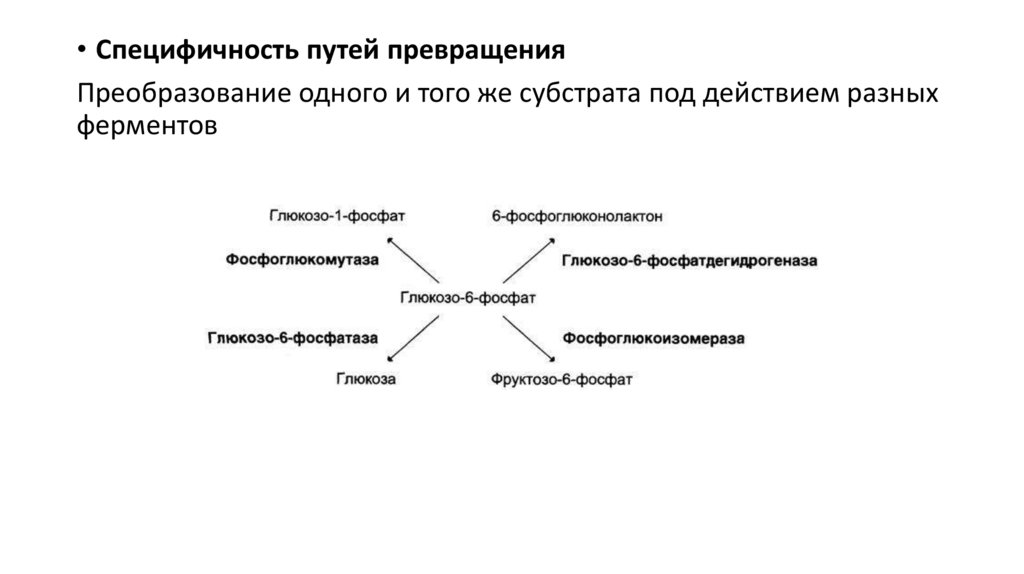
• Специфичность путей превращенияПреобразование одного и того же субстрата под действием разных
ферментов
16.
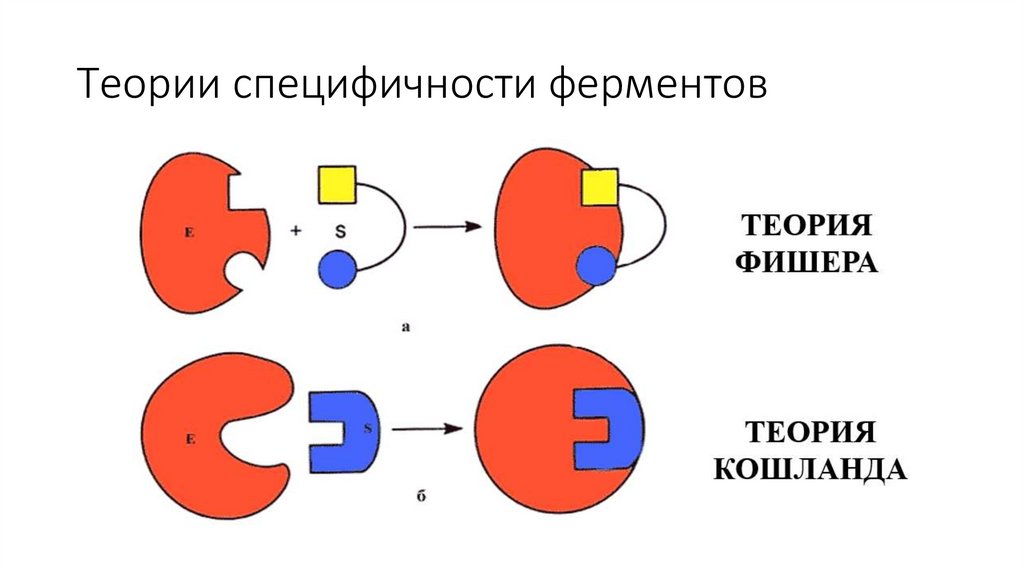
Теории специфичности ферментов17.
Кинетика ферментативных реакцийСкорость метаболических путей зависит от:
• количества фермента
• доступности кофакторов и коферментов
• количества субстрата
• активности фермента
18.
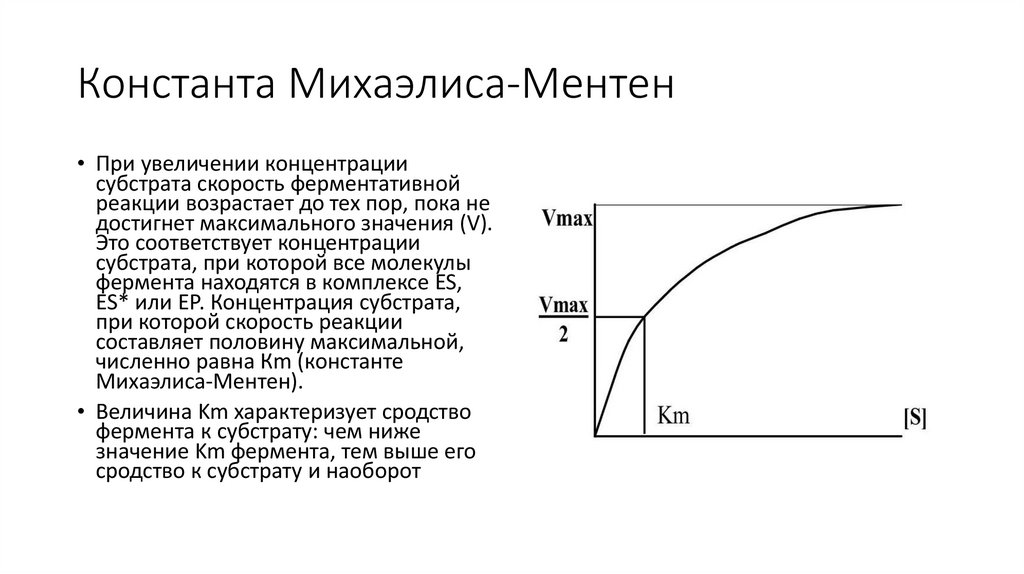
Константа Михаэлиса-Ментен• При увеличении концентрации
субстрата скорость ферментативной
реакции возрастает до тех пор, пока не
достигнет максимального значения (V).
Это соответствует концентрации
субстрата, при которой все молекулы
фермента находятся в комплексе ES,
ES* или ЕР. Концентрация субстрата,
при которой скорость реакции
составляет половину максимальной,
численно равна Кm (константе
Михаэлиса-Ментен).
• Величина Km характеризует сродство
фермента к субстрату: чем ниже
значение Km фермента, тем выше его
сродство к субстрату и наоборот
19.
Принципы измерения активностиферментов
• По скорости убывания количества субстрата реакции
• По скорости возрастания количества продукта реакции
Единица активности фермента: мкмоль субстрата, расщеплённого
за 1 мин в пересчёте на 1 мг белка
20.
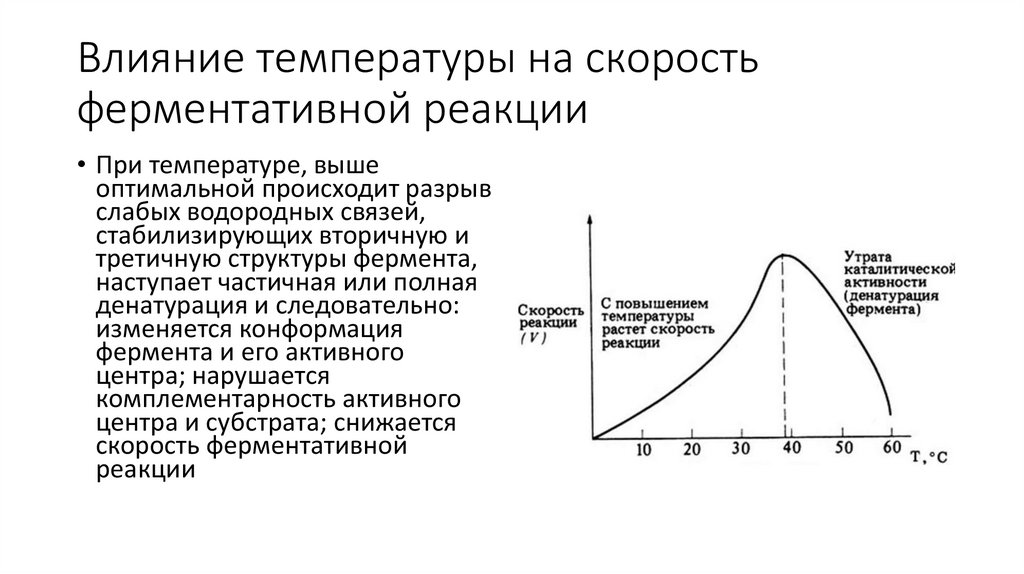
Влияние температуры на скоростьферментативной реакции
• При температуре, выше
оптимальной происходит разрыв
слабых водородных связей,
стабилизирующих вторичную и
третичную структуры фермента,
наступает частичная или полная
денатурация и следовательно:
изменяется конформация
фермента и его активного
центра; нарушается
комплементарность активного
центра и субстрата; снижается
скорость ферментативной
реакции
21.
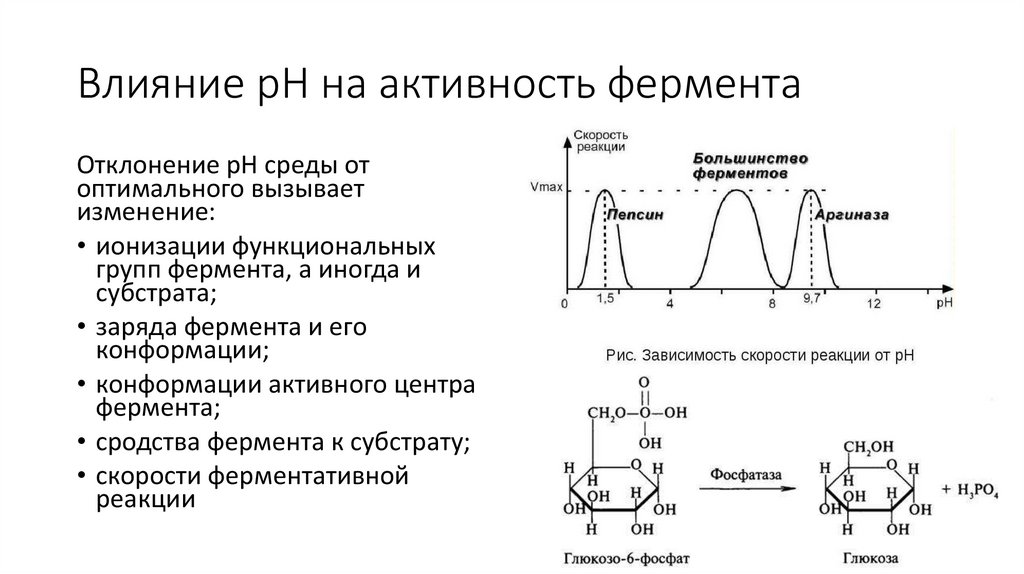
Влияние pH на активность ферментаОтклонение рН среды от
оптимального вызывает
изменение:
• ионизации функциональных
групп фермента, а иногда и
субстрата;
• заряда фермента и его
конформации;
• конформации активного центра
фермента;
• сродства фермента к субстрату;
• скорости ферментативной
реакции
22.
Классификация ферментов1. Оксидоредуктазы
• катализируют ОВР
• используют коферменты НАД+, НАДФ+, ФАД, ФМН
1. Дегидрогензы
2. Оксидазы
3. Оксигеназы
23.
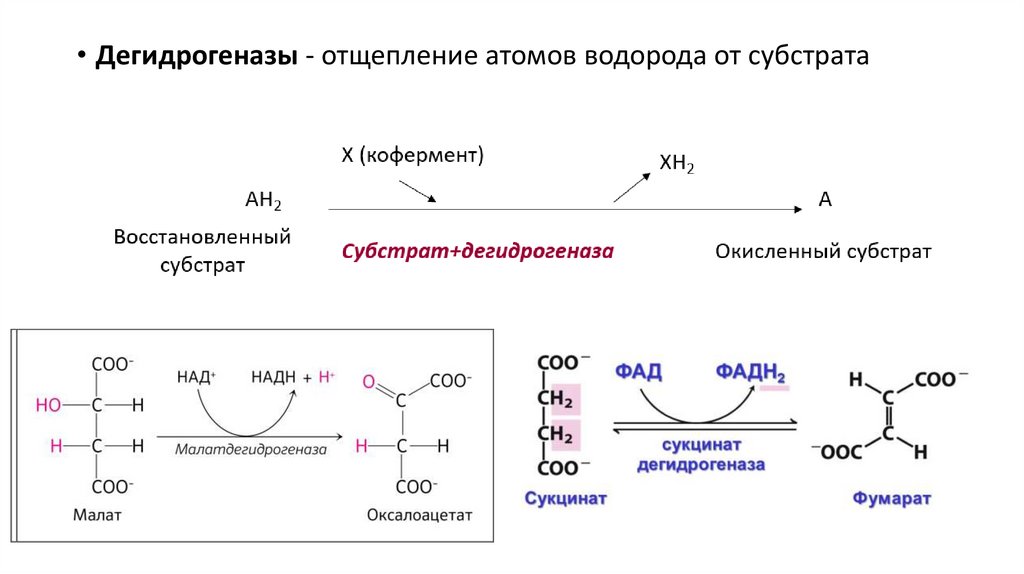
• Дегидрогеназы - отщепление атомов водорода от субстрата24.
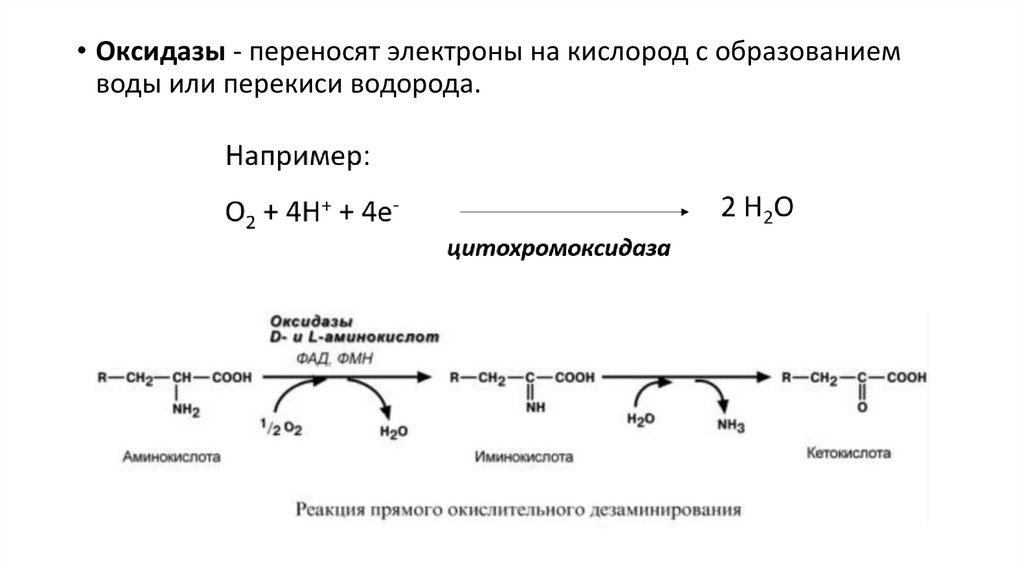
• Оксидазы - переносят электроны на кислород с образованиемводы или перекиси водорода.
25.
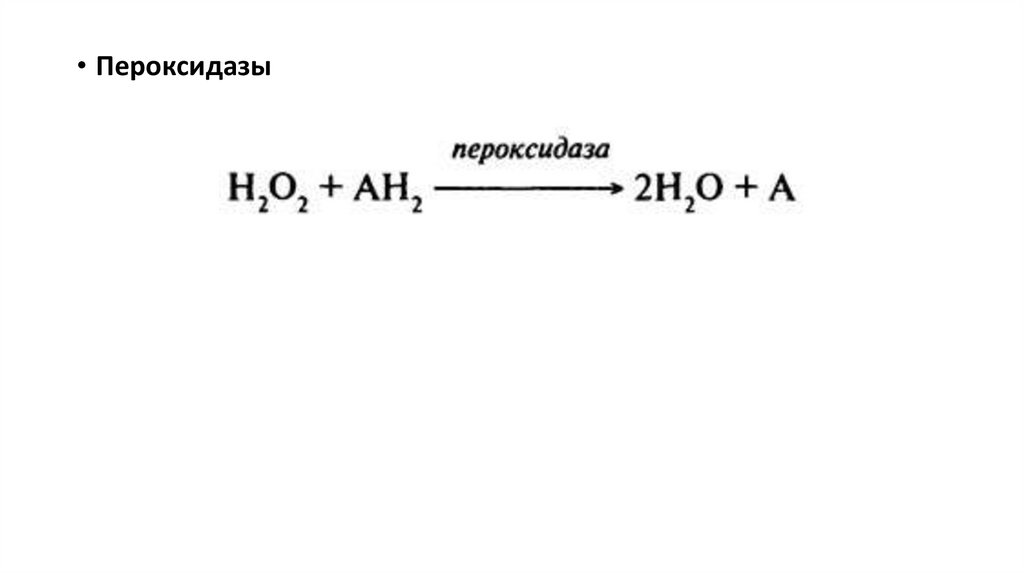
• Пероксидазы26.
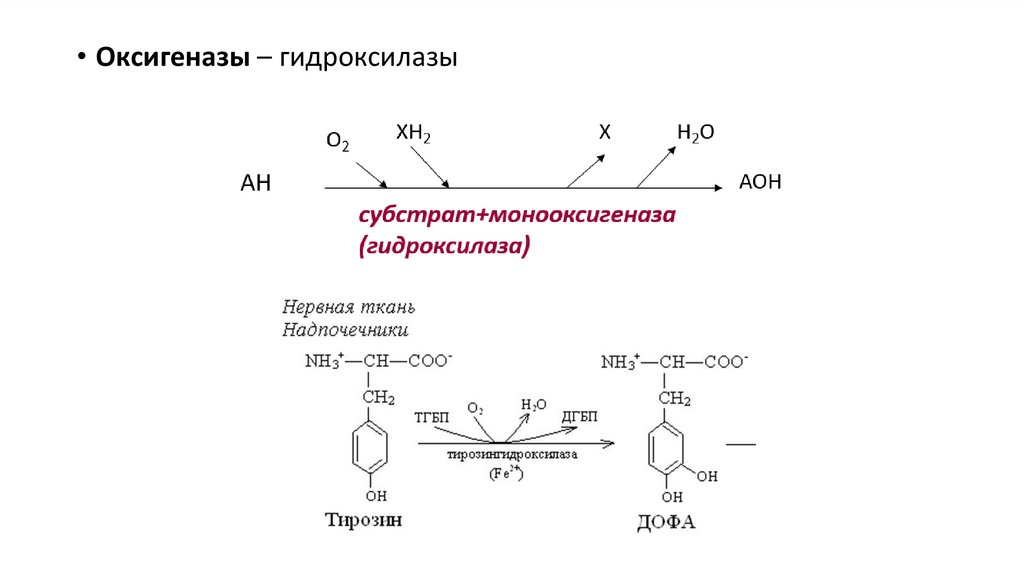
• Оксигеназы – гидроксилазы27.
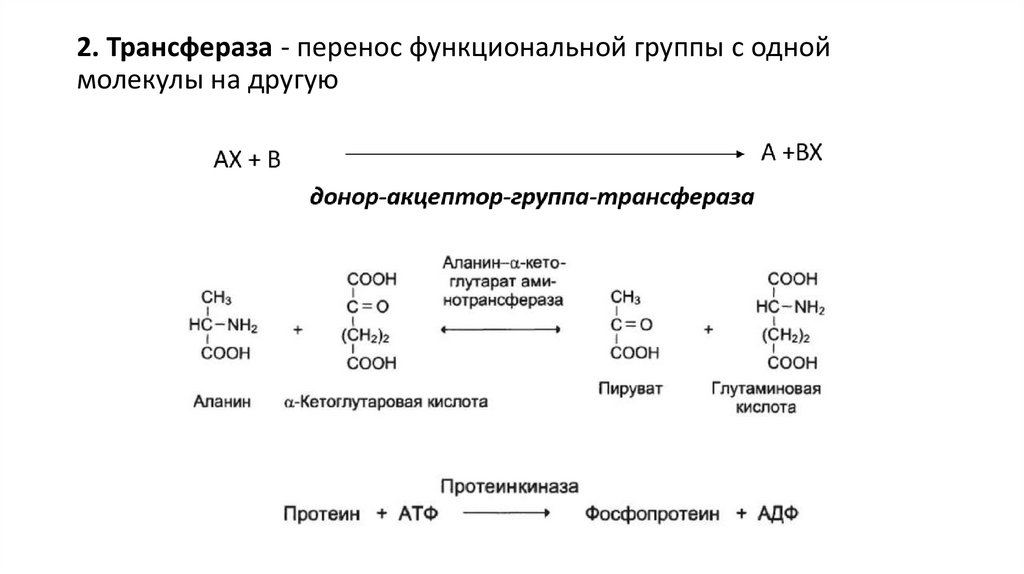
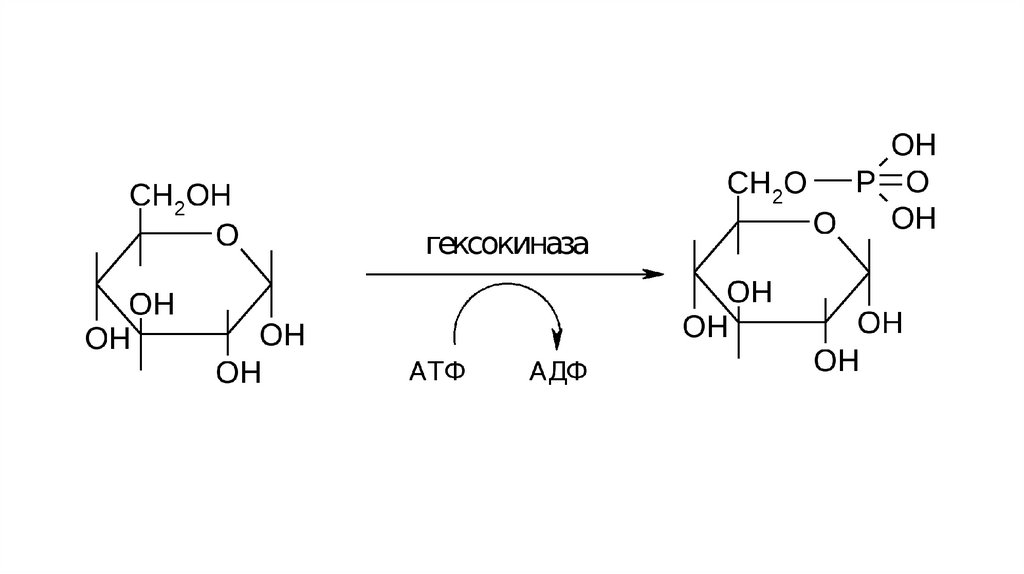
2. Трансфераза - перенос функциональной группы с одноймолекулы на другую
28.
29.
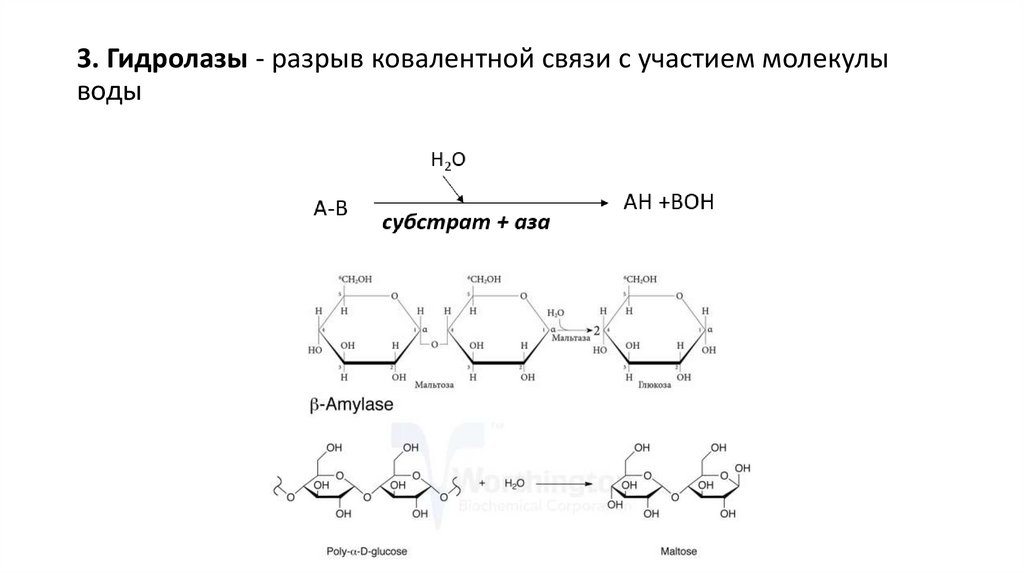
3. Гидролазы - разрыв ковалентной связи с участием молекулыводы
30.
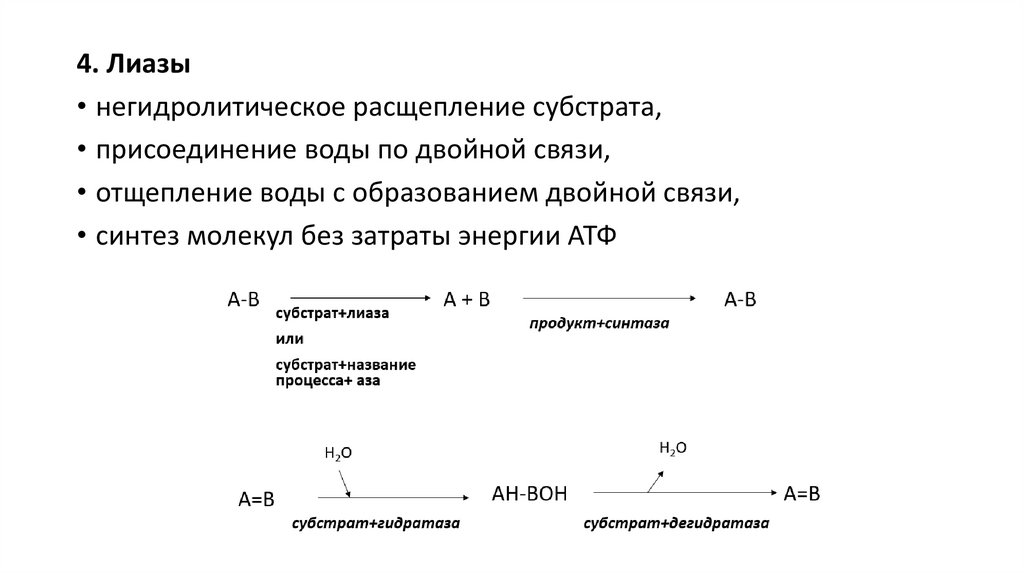
4. Лиазы• негидролитическое расщепление субстрата,
• присоединение воды по двойной связи,
• отщепление воды с образованием двойной связи,
• синтез молекул без затраты энергии АТФ
31.
32.
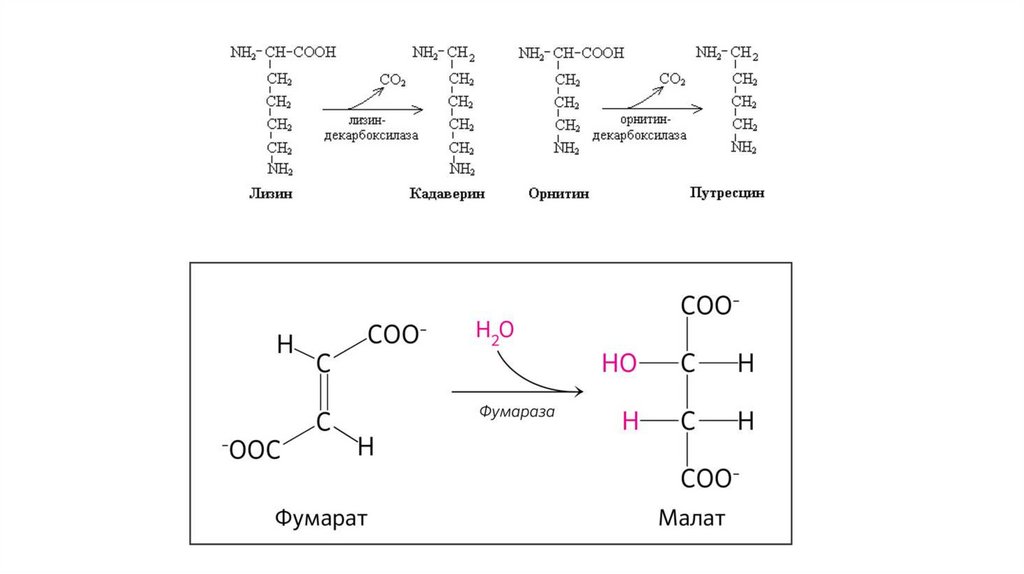
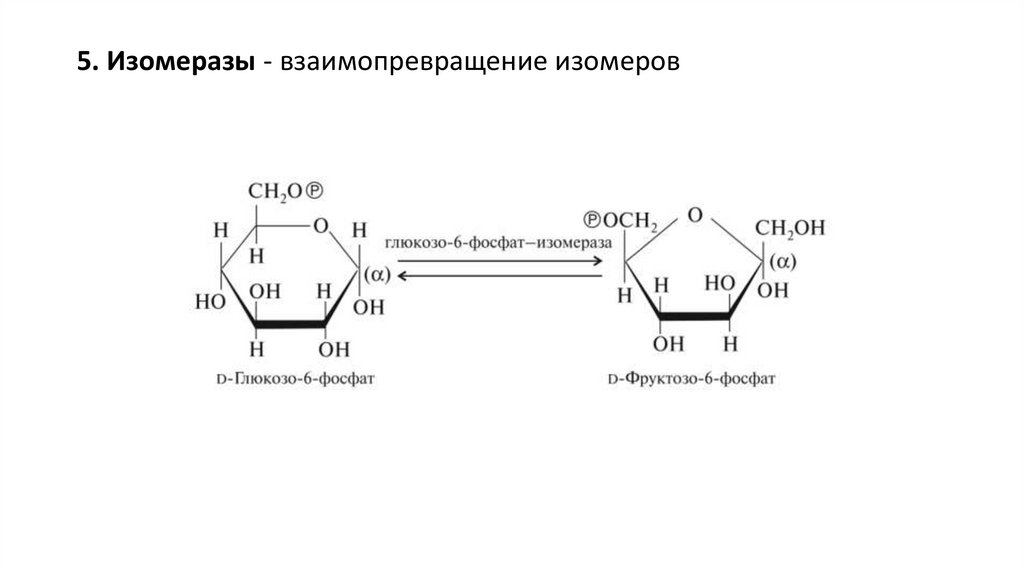
5. Изомеразы - взаимопревращение изомеров33.
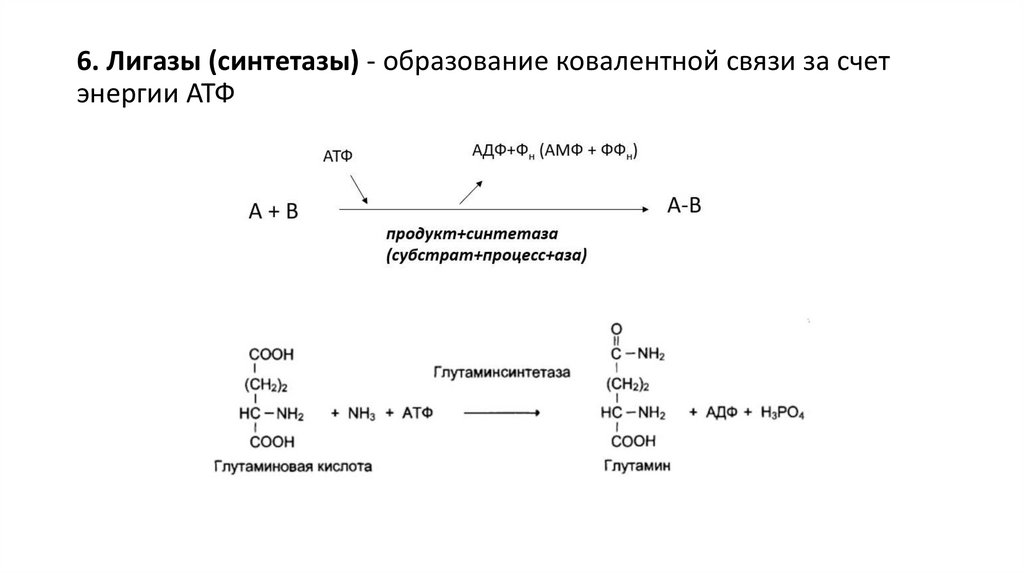
6. Лигазы (синтетазы) - образование ковалентной связи за счетэнергии АТФ












 biology
biology








