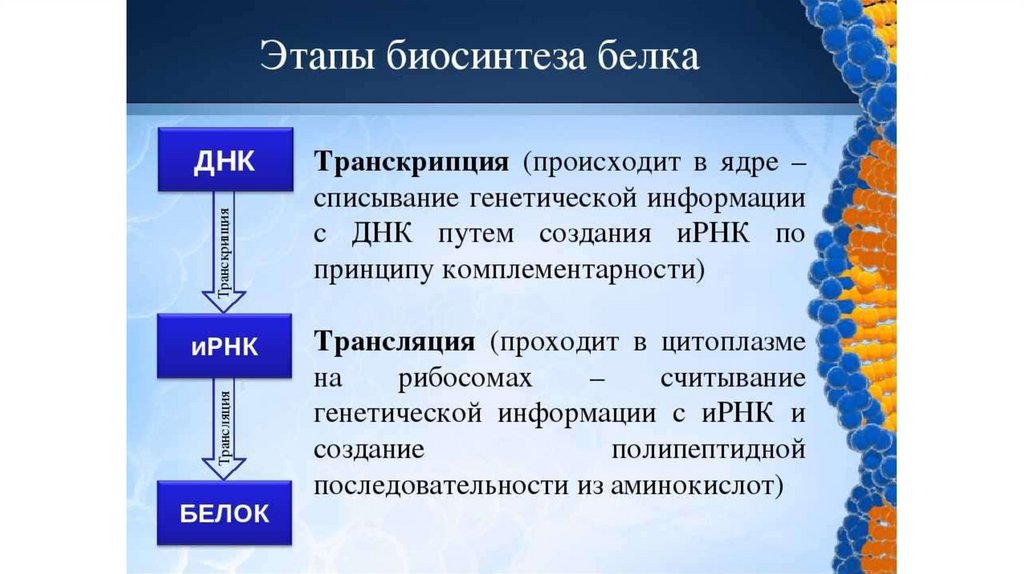
Similar presentations:
Белки
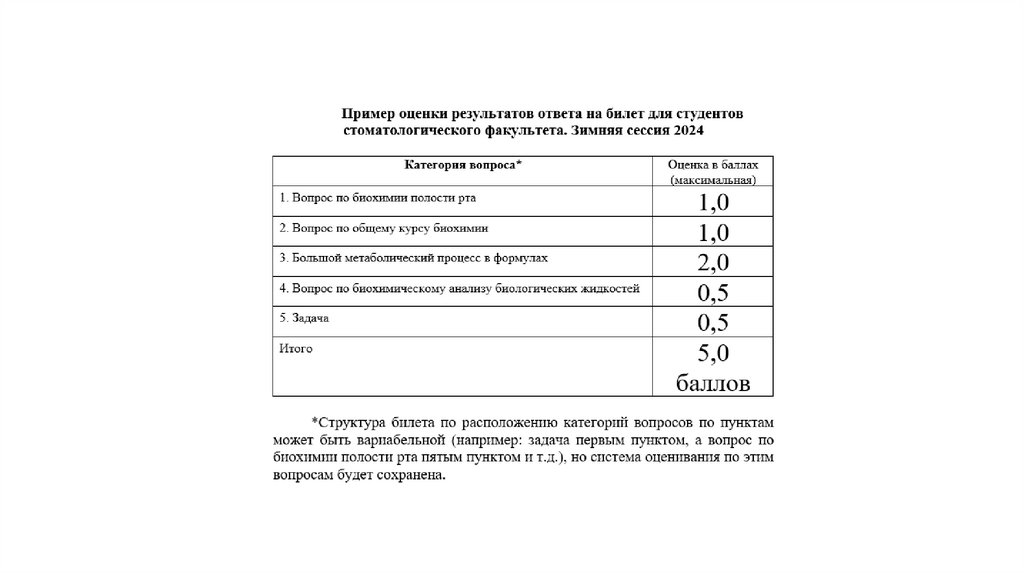
1.
2.
3.
Белки4.
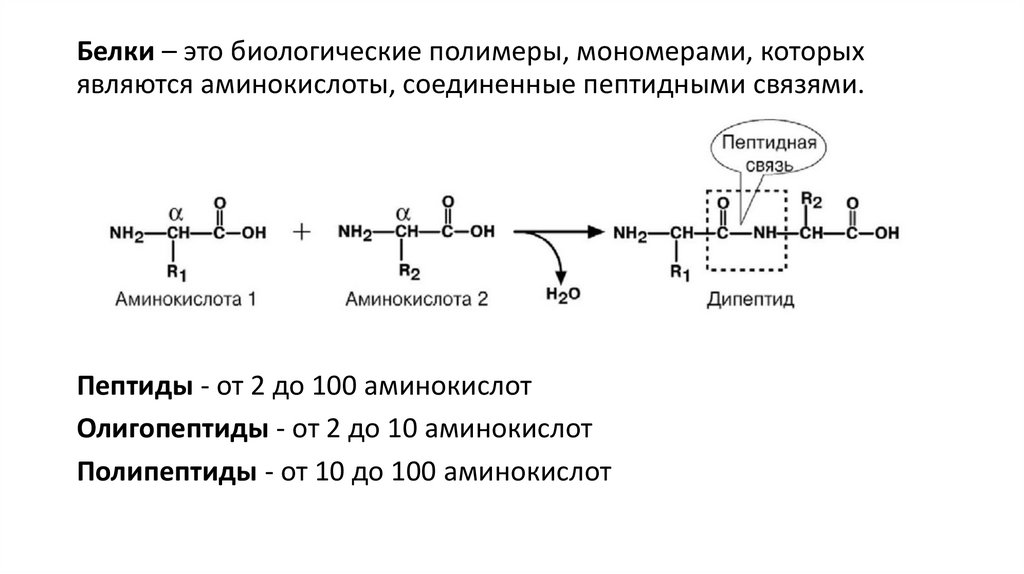
Белки – это биологические полимеры, мономерами, которыхявляются аминокислоты, соединенные пептидными связями.
Пептиды - от 2 до 100 аминокислот
Олигопептиды - от 2 до 10 аминокислот
Полипептиды - от 10 до 100 аминокислот
5.
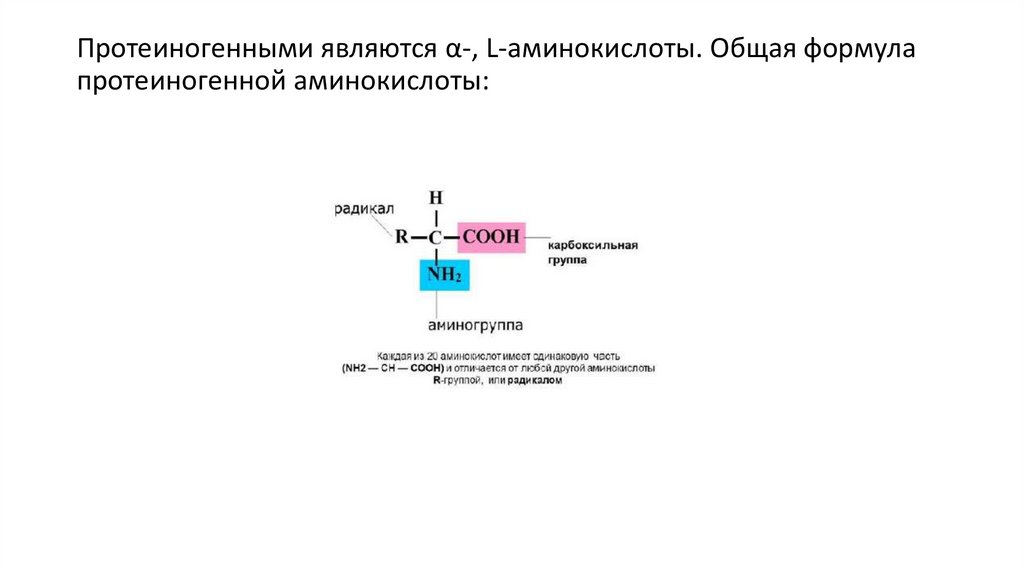
Протеиногенными являются α-, L-аминокислоты. Общая формулапротеиногенной аминокислоты:
6.
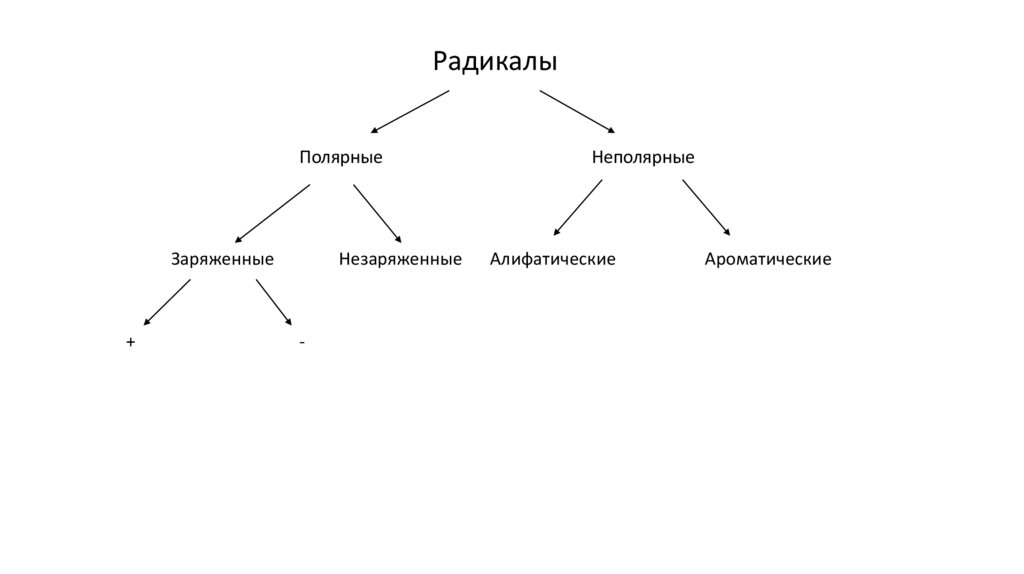
РадикалыПолярные
Заряженные
+
Незаряженные
-
Неполярные
Алифатические
Ароматические
7.
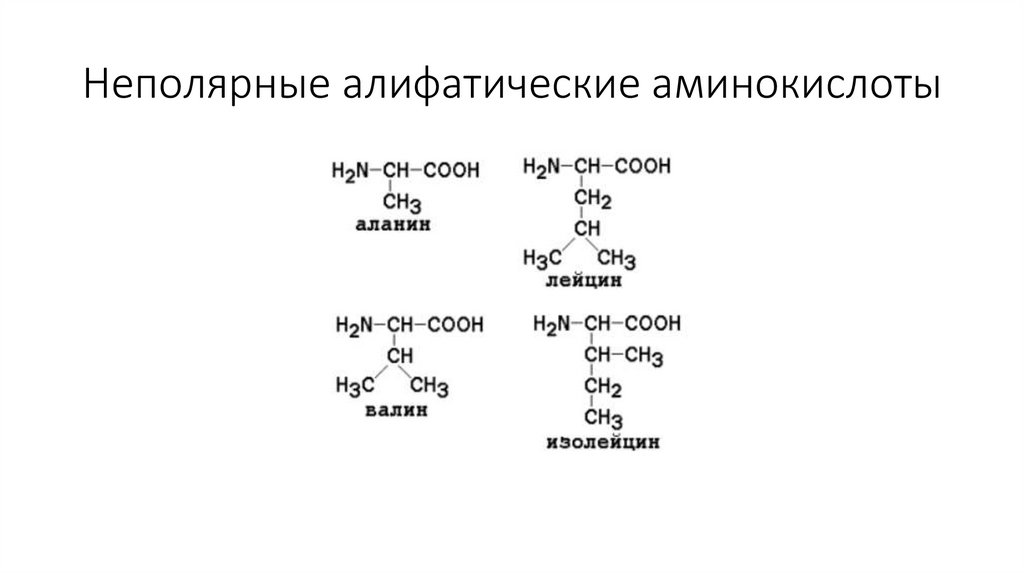
Неполярные алифатические аминокислоты8.
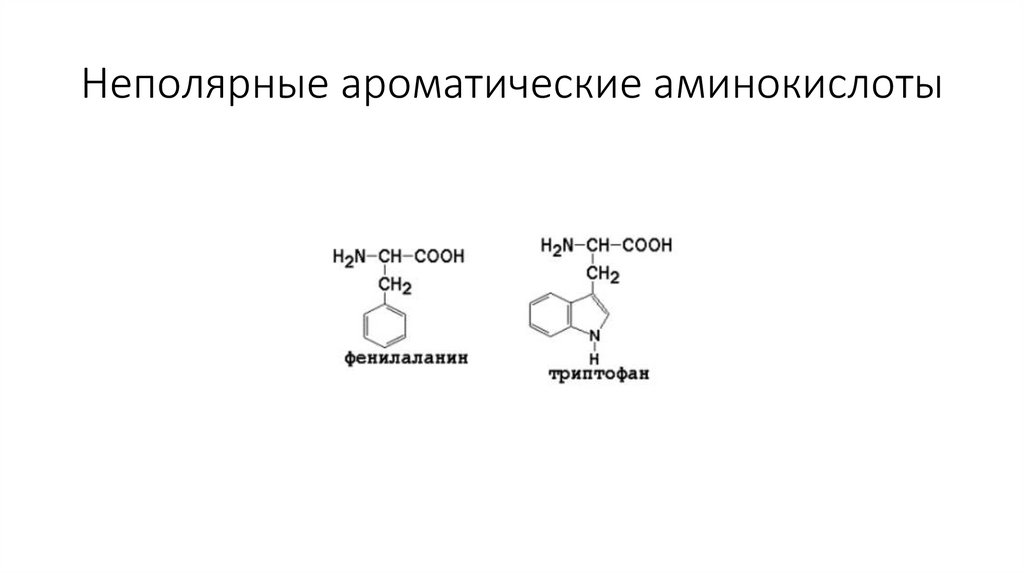
Неполярные ароматические аминокислоты9.
Полярные положительно заряженные аминокислоты10.
Полярные отрицательно заряженные аминокислоты11.
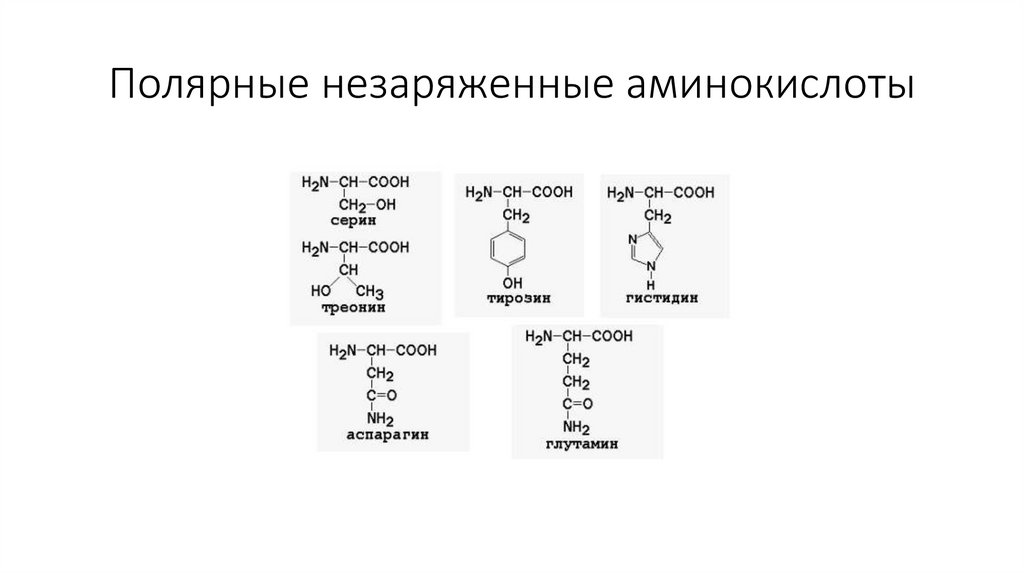
Полярные незаряженные аминокислоты12.
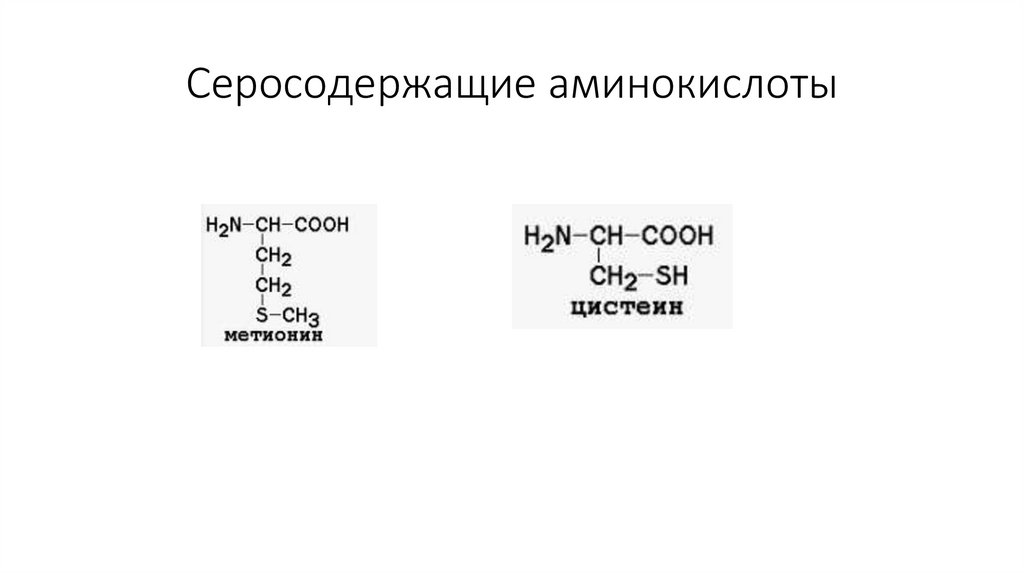
Серосодержащие аминокислоты13.
Просто пролин14.
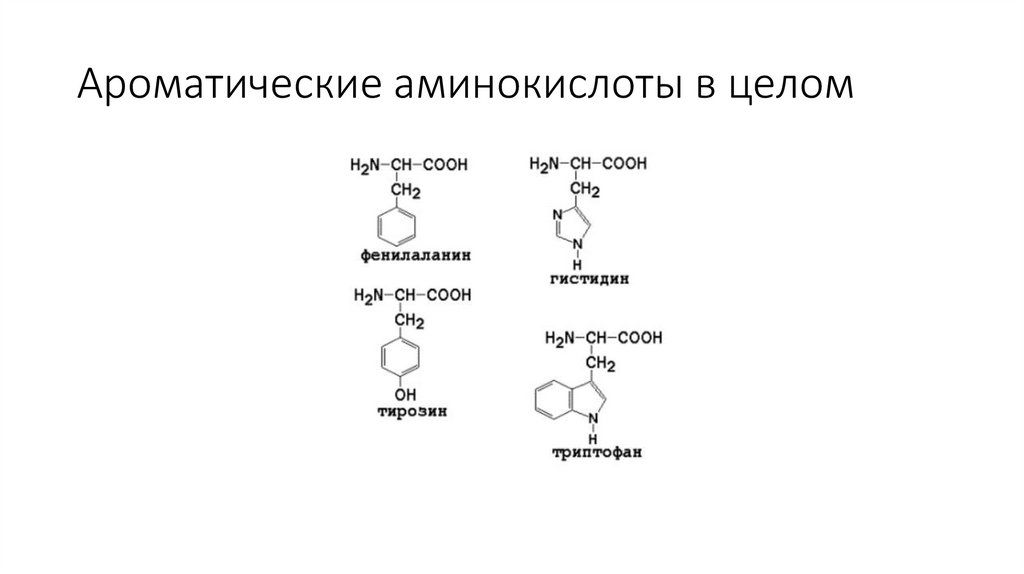
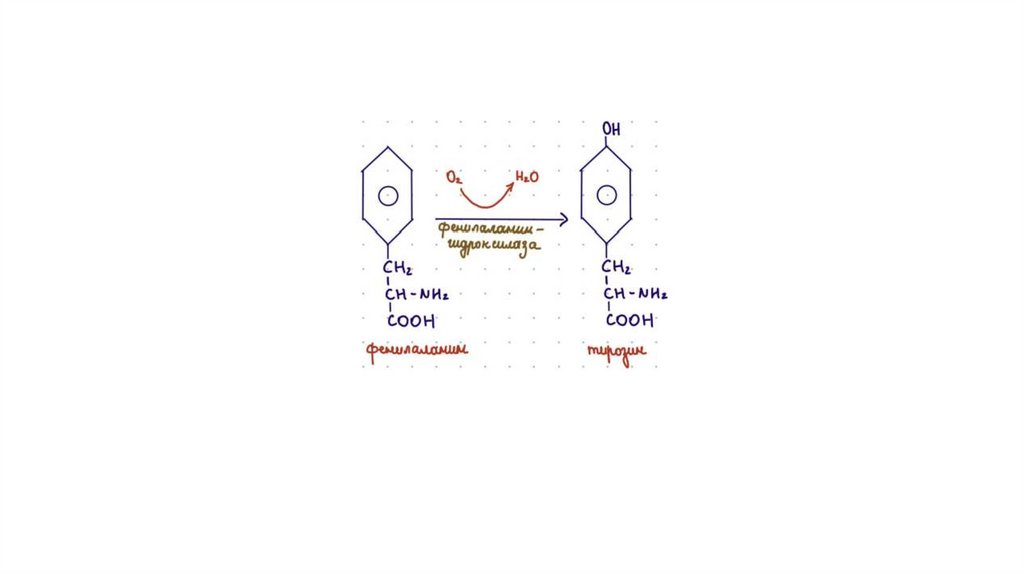
Ароматические аминокислоты в целом15.
16.
17.
Лиза (лизин) метнула (метионин) фен (фенилаланин) в трибуну (триптофан). Трезвый (треонин)лейтенант (лейцин) валялся (валин) в изоляторе (изолейцин)
Все аминокислоты обязательно надо выучить и уметь их писать и составлять пептиды!
Для этого вам помогут приложения на телефон. Просто пишете в магазине приложений
«аминокислоты» и скачиваете то, что больше понравилось.
18.
Растворимость белков в воде зависит от формы,молекулярной массы, величины заряда, соотношения
полярных и неполярных функциональных групп на
поверхности
белка.
Также
растворимость
белка
определяется свойствами растворителя.
Методы выделения белков:
1) Высаливание - основан на различии растворимости
белков при разной концентрации соли в растворе
2) Метод гель-фильтраций - основан на том, что вещества,
отличающиеся молекулярной массой и формой молекул, в
разное время вымываются из хроматографической колонки
3) Метод электрофореза - основан на различной
способности белков передвигаться в электрическом поле
19.
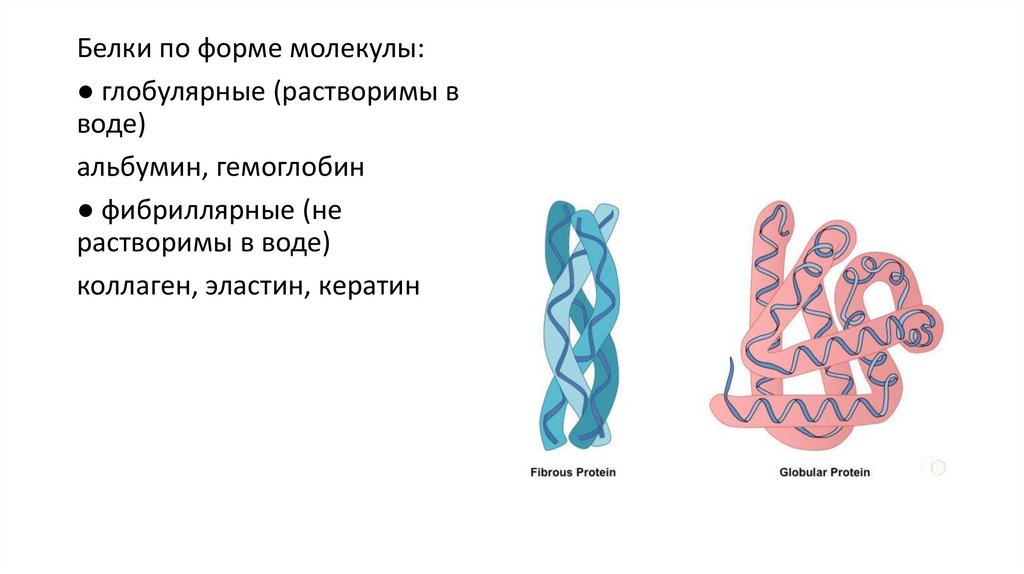
Белки по форме молекулы:● глобулярные (растворимы в
воде)
альбумин, гемоглобин
● фибриллярные (не
растворимы в воде)
коллаген, эластин, кератин
20.
21.
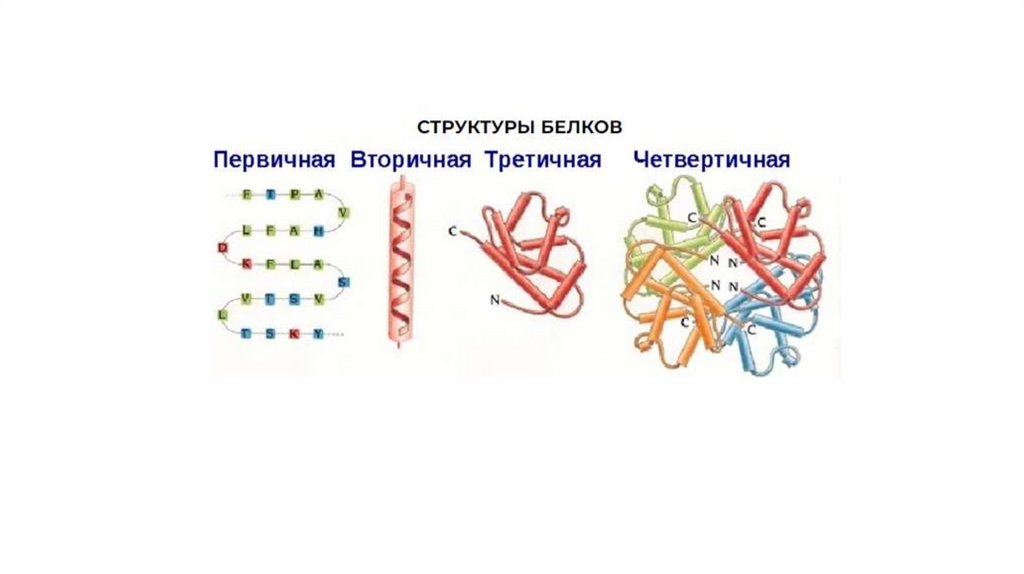
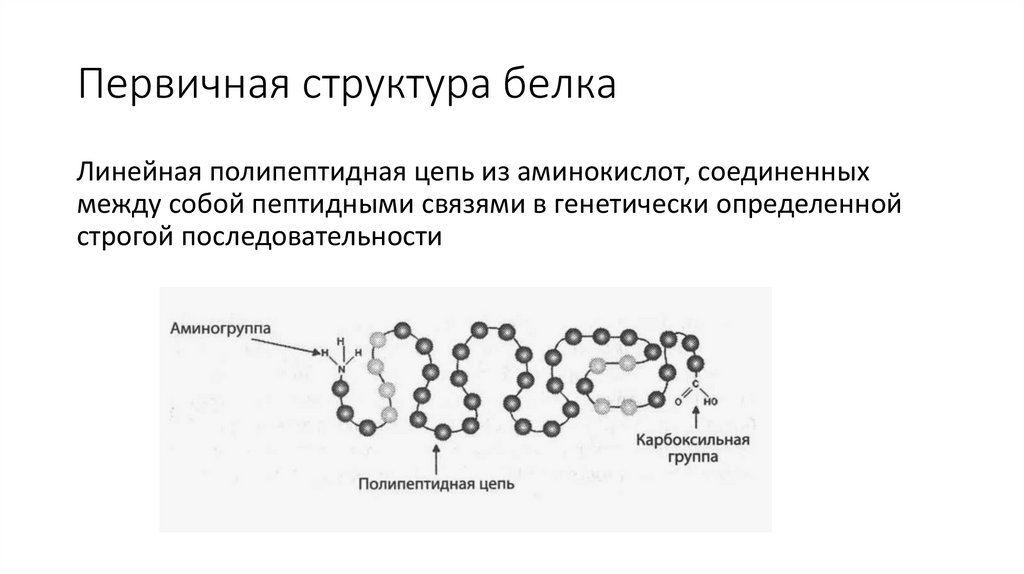
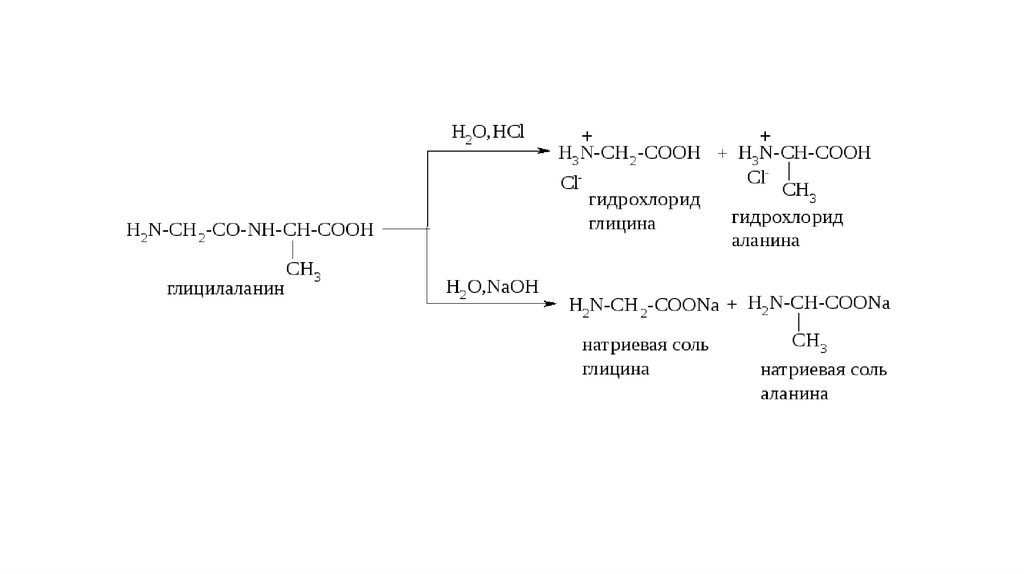
Первичная структура белкаЛинейная полипептидная цепь из аминокислот, соединенных
между собой пептидными связями в генетически определенной
строгой последовательности
22.
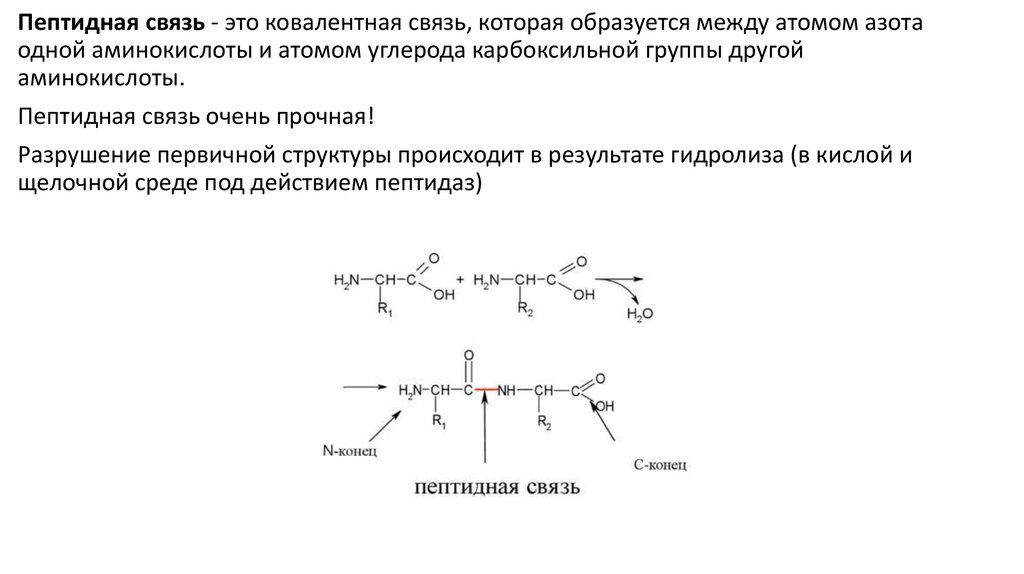
Пептидная связь - это ковалентная связь, которая образуется между атомом азотаодной аминокислоты и атомом углерода карбоксильной группы другой
аминокислоты.
Пептидная связь очень прочная!
Разрушение первичной структуры происходит в результате гидролиза (в кислой и
щелочной среде под действием пептидаз)
23.
24.
25.
Первичная структура уникальна для каждого белка. Информация оней «записана» в структурных генах ДНК. Именно первичная
структура белка определяет все высшие уровни его структурной
организации, и соответственно, его свойства. Так, например,
наличие большого количества объемных радикалов препятствует
формированию регулярной вторичной структуры. Часто
встречающийся в последовательности остаток пролина придает
жесткость полипептидной цепи и заставляет ее принимать
конфигурацию растянутой спирали. В первичной структуре
растворимых белков должно присутствовать большое количество
аминокислот с полярными радикалами.
26.
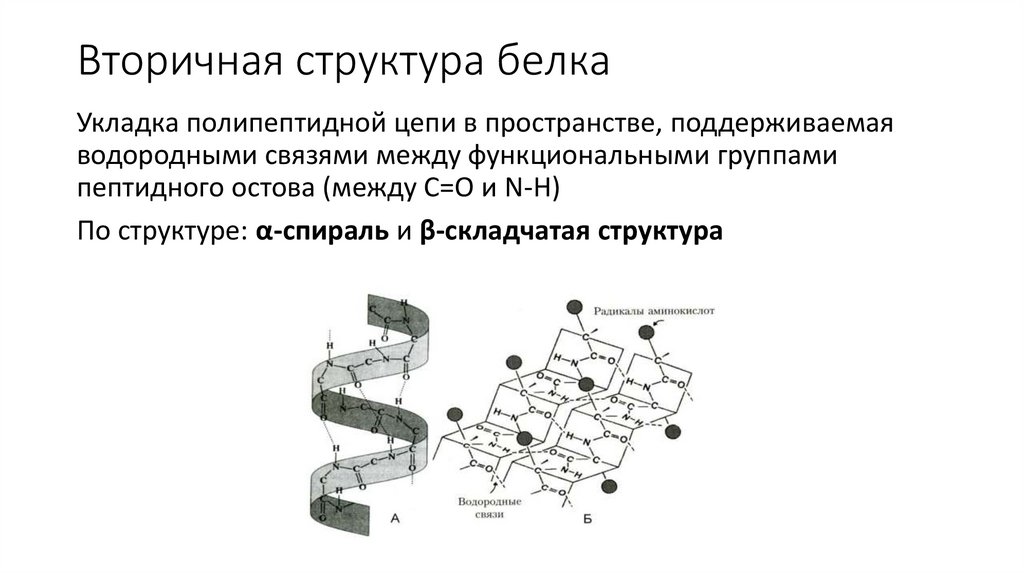
Вторичная структура белкаУкладка полипептидной цепи в пространстве, поддерживаемая
водородными связями между функциональными группами
пептидного остова (между C=O и N-H)
По структуре: α-спираль и β-складчатая структура
27.
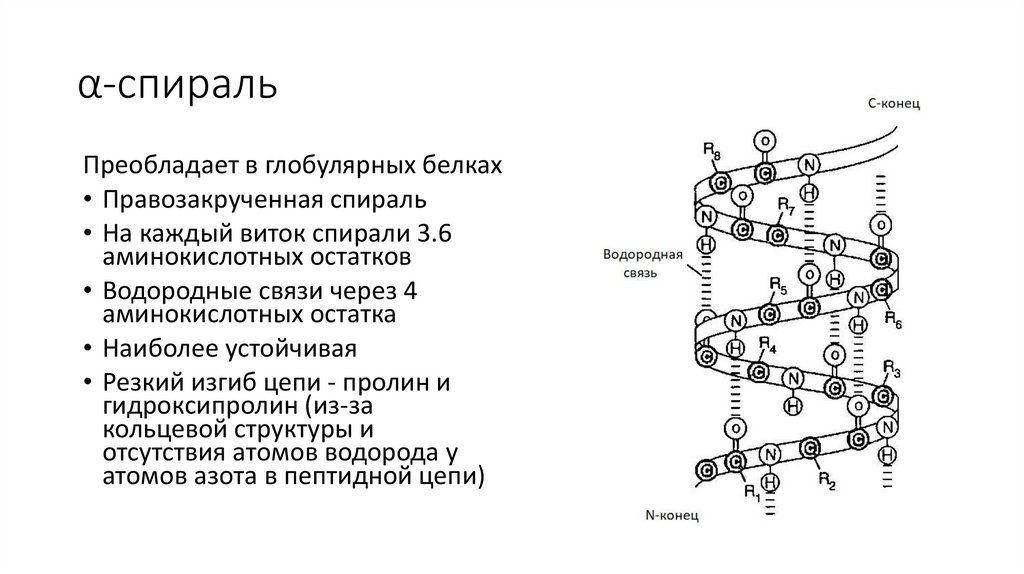
α-спиральПреобладает в глобулярных белках
• Правозакрученная спираль
• На каждый виток спирали 3.6
аминокислотных остатков
• Водородные связи через 4
аминокислотных остатка
• Наиболее устойчивая
• Резкий изгиб цепи - пролин и
гидроксипролин (из-за
кольцевой структуры и
отсутствия атомов водорода у
атомов азота в пептидной цепи)
28.
β-складчатая структура29.
Для выполнения своих функций белки приобретают определеннуюпространственную конформацию, которая называется нативной.
Формирование нативной структуры включает несколько стадий,
которым соответствуют уровни организации белка.
Вторичная структура белков может быть представлена только αспиралями, либо только β-слоями, но значительно чаще одна
молекула белка содержит оба вида вторичной структуры.
30.
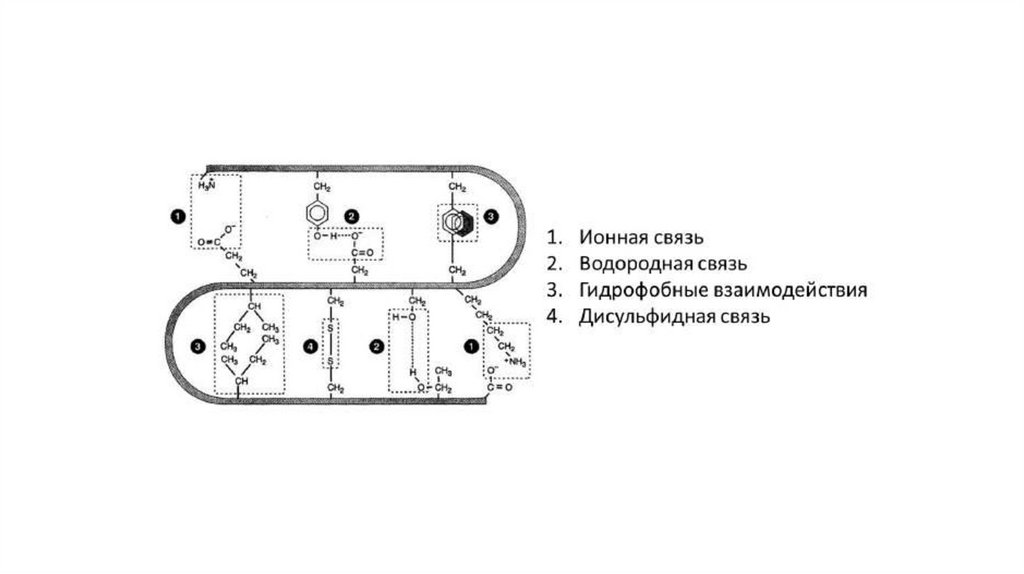
Третичная структура белкаУкладка полипептидной цепи в пространстве, поддерживаемая связями
между удаленными радикалами аминокислот
Связи сильные: ковалентные
● дисульфидные - между SH-группы цистеина
● псевдопептидные - между аминогруппами и карбоксильными диамино- и
дикарбоновых АК)
Связи слабые:
● водородные (полярные) - между 2 полярными незаряженными или между
незаряженным и заряженным радикалами
● ионная - между + и - заряженными радикалами
● Ван-дер-Ваальсовы (неполярные) - между поляризированными атомами
или молекулами
31.
32.
Наиболее распространенный вид третичной структуры – глобула.Для многих белков третичная структура обладает функциональной
активностью и является высшим уровнем организации. Такие
белки называются мономерными, так как содержат только одну
полипептидную цепь.
33.
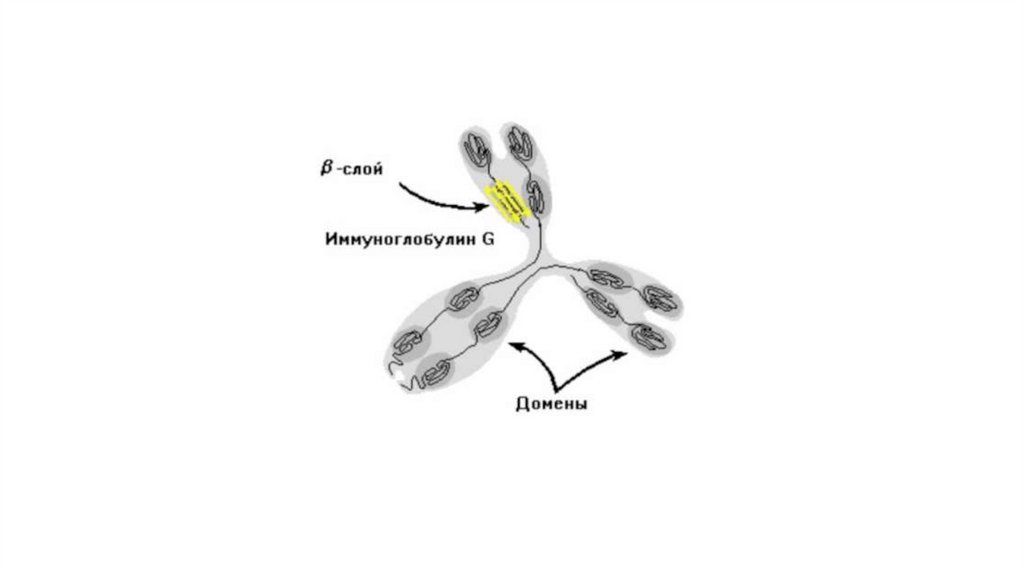
ДоменыДомен – фрагмент полипептидной цепи, которому свойствена
определенная структурная и функциональная автономия. Домены
могут выполнять разные функции и подвергаться свертыванию в
независимые компактные глобулярные структурные единицы,
соединенные между собой гибкими участками внутри белковой
молекулы. Доменная структура характерна для белков, состоящих
более чем из 200 аминокислот.
34.
35.
В состав домена входит несколько элементов регулярнойвторичной структуры: α-спиралей и/или β-слоев. Большие белки,
как правило, содержат несколько доменов, каждый из которых
выполняет определенную функцию.
Сходные домены могут присутствовать в составе различных
белков, выполняющих сходные функции.
Достаточно часто доменам присваивают название в соответствии с
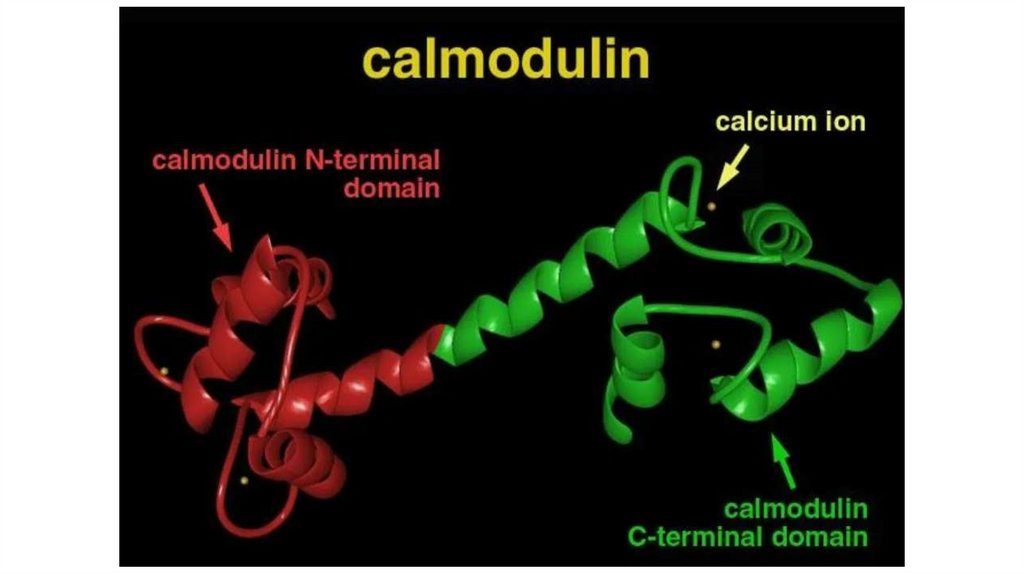
выполняемыми функциям. Например, Ca2+-связывающий домен
кальмодулина, ДНК-связывающие домены факторов транскрипции.
Ферменты могут содержать каталитические и регуляторные
домены.
36.
37.
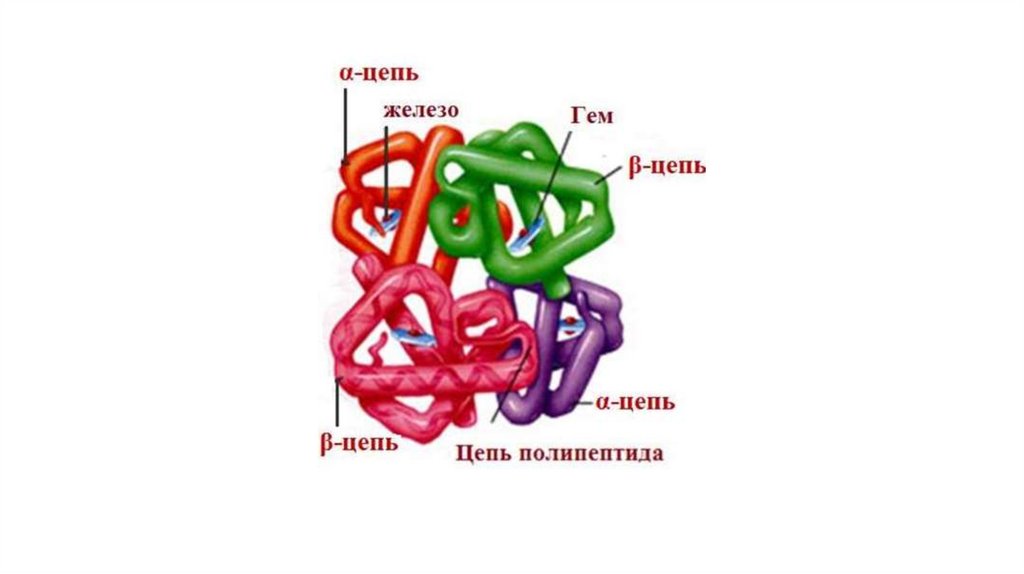
Четвертичная структура белкаЧетвертичная структура белка – это пространственная структура,
сформированная из нескольких полипептидных цепей,
обладающих третичной структурой и образующих функционально
активную молекулу. Отдельные полипептидные цепи в составе
четвертичной структуры называются протомерами или
субъединицами. Четвертичная структура характерна не для всех
белков. Белки, имеющие четвертичную структуру, называются
олигомерными. В поддержании четвертичной структуры участвуют
водородные и ионные связи, а также гидрофобные
взаимодействия.
38.
39.
Физико-химические свойства белковБелки различаются по своим физико-химическим свойствам.
Молекулярная масса белков колеблется от 6000 до 1000000 Д и
выше и зависит от количества аминокислотных остатков в
полипептидной цепи, а для олигомерных белков - от количества
протомеров.
По форме молекул белки делятся на глобулярные и
фибриллярные.
40.
Суммарный заряд белковой молекулы зависит от соотношенияионизированных анионных радикалов Глу и Асп и катионных
радикалов Лиз, Apr и Гис.
Степень ионизации этих радикалов зависит от рН среды. В кислой
среде заряд белков повышается, в щелочной – понижается.
Значение рН, при котором белок не заряжен, называют
"изоэлектрическая точка" и обозначают как pI.
41.
Растворимость белков в воде зависит от формы, молекулярноймассы, величины заряда, соотношения полярных и неполярных
функциональных групп на поверхности белка. Заряженные белки
лучше растворимы, чем белки, находящиеся в изоэлектрической
точке. Заряд способствует гидратации молекулы белка и
препятствует контакту одноимённо заряженных молекул, в
результате растворимость белков увеличивается. Кроме этого,
растворимость белка определяется составом растворителя
42.
Выделение индивидуальных белков из биологического материалаосновано на разнице в их физико-химических свойствах.
Высаливание - метод очистки белков, основанный на различиях в
их растворимости при разной концентрации соли в растворе. Чем
выше растворимость белка, тем большая концентрация соли
необходима для его осаждения. Если белок устойчив к
денатурации, то можно кратковременным нагреванием осадить
остальные белки и выделить белок, оставшийся в растворе.
43.
Метод разделения белков с помощью гель-фильтрации основан натом, что вещества, отличающиеся молекулярной массой и формой
молекул, в разное время вымываются из хроматографической
колонки.
Метод электрофореза основан на различной способности белков
перемещаться в электрическом поле. Белки, имеющие
отрицательный заряд, будут двигаться к положительно
заряженному аноду, а катионные белки - к отрицательно
заряженному катоду. Белки, находящиеся в изоэлектрическом
состоянии, не перемещаются в электрическом поле
44.
Лабильность пространственной структурыбелков
В поддержании пространственной структуры белка значительную роль
играют слабые связи и взаимодействия (ионные, водородные,
гидрофобные), которые легко нарушаются при изменении внешних
условий
В белковой молекуле постоянно происходят небольшие изменения,
которые в целом не нарушают общую структуру белка. Следовательно,
белки обладают конформационной лабильностью, которая
проявляется в склонности к разрыву одних слабых связей и
образованию других. Лабильность структуры белка – это способность
претерпевать конформационные изменения под действием различных
физико-химических факторов, а также при взаимодействии с другими
молекулами. Лабильность пространственной структуры белков играет
важную роль при его функционировании, в частности дает широкие
возможности регуляции активности ферментов.
45.
Денатурация - нарушение третичной и вторичной структуры белка,приводящее к утрате его биологических функций и физико-химических
свойств. При этом не происходит разрушение первичной структуры
белка, образованной прочными пептидными связями.
Денатурацию белка вызывают различные физико-химические факторы,
такие как высокая температура, резкое изменение рН среды,
органические растворители, соли тяжелых металлов, гуанидин хлорид,
мочевина. Эти вещества называют денатурирующими агентами.
Склонность белков к денатурации серьезно затрудняет использование
белковых лекарственных препаратов. Большинство таких лекарств
необходимо хранить в холодильнике, растворять сухие препараты
необходимо в охлажденной кипяченой воде.
Денатурирующие агенты получили широкое применение в
биохимических исследованиях, а также в качестве антисептиков.
46.
Шапероны и фолдингПроцесс формирования пространственной структуры белка в
клетке называется фолдингом и происходит при участии
специализированных белков, шаперонов.
Шапероны ответственны за создание правильной (нативной)
конформации белков в клетке. Они узнают и связываются с
частично развернутыми или неправильно свернутыми белками.
Поскольку количество шаперонов в клетках увеличивается при
повышении температуры, их называют белками теплового шока.
Шапероны достаточно разнообразны и участвуют во многих
внутриклеточных процессах.
47.
Кроме непосредственного участия в фолдинге и в защите клетки отденатурирующих воздействий, шапероны вовлечены в транспорт
белков через биологические мембраны, влияют на
взаимодействие гормонов с рецепторами, играют определенную
роль в канцерогенезе и процессах старения.
Существуют заболевания, связанные с нарушением фолдинга.
Неправильно свернутые, а также частично развернутые белки
содержат на поверхности остатки гидрофобных аминокислот, за
счет которых они приобретают склонность к агрегации. В
результате в клетках или межклеточном пространстве образуются
агрегаты белков, амилоид. Причиной данной группы заболеваний
может быть нарушение работы шаперонов или системы
внутриклеточного протеолиза.
48.
ДЗМинимальное, что необходимо знать:
Формулы аминокислот
Виды пространственных структур белков
Денатурация, ренатурация

























 biology
biology








