Similar presentations:
Физические основы электроники. Общие вопросы, материалы, заряды, энергия
1.
ФИЗИЧЕСКИЕ ОСНОВЫЭЛЕКТРОНИКИ
Тема 1
ОБЩИЕ ВОПРОСЫ, МАТЕРИАЛЫ,
ЗАРЯДЫ, ЭНЕРГИЯ
2.
Общие вопросы электроникиЧто следует знать из курса «Физика»:
Положительное направление тока: от “+” к “-”;
Положительное направление вектора напряженности: от “+” к “-”;
Закон Ома: I = U/R
Закон Джоуля –Ленца: W = UI = U2/R = I2R;
Параллельное соединение конденсаторов: С =С1+С2;
Последовательное соединение конденсаторов: С = С1С2/(С1+С2);
Энергия заряженного конденсатора: Wc = CU2;
Энергия, запасаемая в катушке индуктивности: WL = LI2;
Энергия: Дж, эВ; Мощность: Вт = Дж/с; Работа: Вт.с; кВт.час;
Удельная проводимость g (Ом–1м–1) и удельное сопротивление r (Омм) :
g = 1/r
Полупроводники - широкий класс веществ, характеризующийся
значениями удельной электропроводности g промежуточной между
электропроводностями металлов (108...106) Ом–1м–1 и диэлектриков
(108...10–16) Ом–1м–1.
3.
Внесистемная единица энергии эВ• Для решения задач целесообразно помнить, что
внесистемная единица энергии 1 эВ связана с
единицей 1 Дж следующим образом:
1 эВ = 1 Дж/1e = 1/1,6·10-19 Дж = 0,625·1019 Дж,
где e – заряд электрона; e = 1/1,6·10-19 Кл.
• Можно перевести значение постоянной Больцмана
k и постоянной Планка h из одной системы единиц в
другую:
k = 1,38·10˗23 Дж/К = 1,38·10˗23/1,6·10-19 эВ/К = =
8,625·10˗5 эВ/К;
h = 6,63·10˗34 Дж·с = 6,63·10˗34/1,6·10-19 эВ·с = =4,14·10˗15
эВ·с .
4.
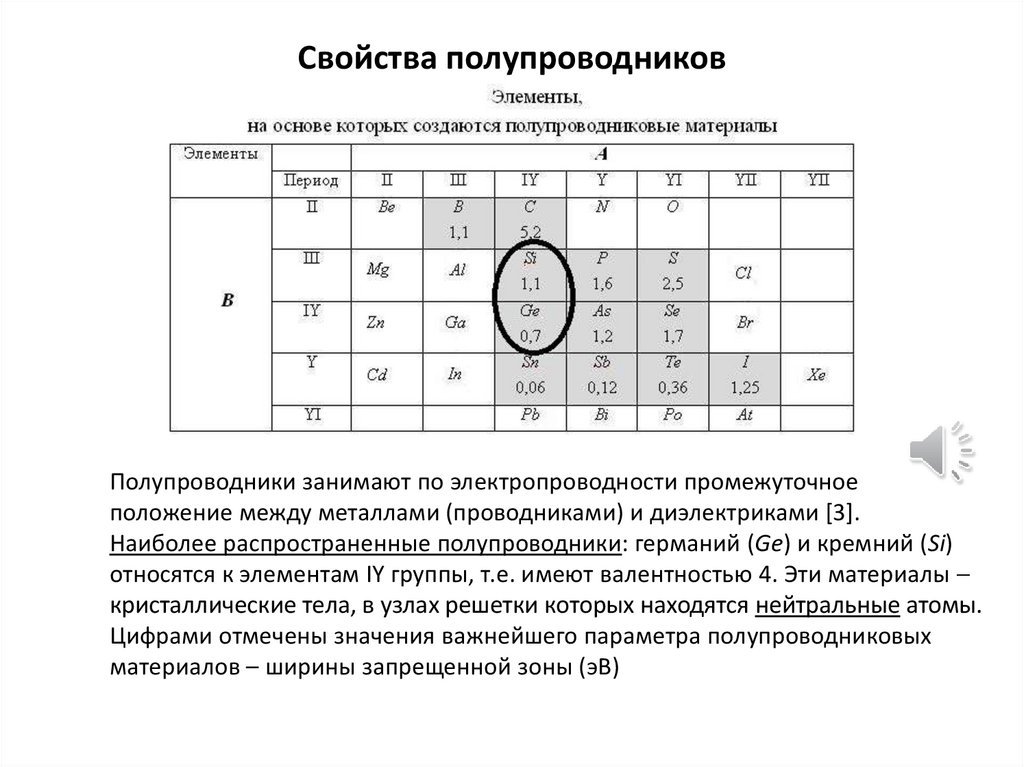
Свойства полупроводниковПолупроводники занимают по электропроводности промежуточное
положение между металлами (проводниками) и диэлектриками [3].
Наиболее распространенные полупроводники: германий (Ge) и кремний (Si)
относятся к элементам IY группы, т.е. имеют валентностью 4. Эти материалы
кристаллические тела, в узлах решетки которых находятся нейтральные атомы.
Цифрами отмечены значения важнейшего параметра полупроводниковых
материалов – ширины запрещенной зоны (эВ)
5.
• 1. Элементы IY группы Периодической системыгерманий (Ge) и кремний (Si)
Атомы этих элементов, имея четыре валентных электрона,
образуют кристаллическую решетку типа ″алмаз″ с ковалентной
связью.
Углерод С6 с решеткой типа ″алмаз″ также обладает
полупроводниковыми свойствами, однако величина ширины
энергии запрещенной зоны у него значительно больше, чем у
германия и кремния, поэтому при комнатных температурах
проводимость алмаза мала (диэлектрик).
Энергия, необходимая для образования свободных носителей
заряда в собственных полупроводниках, называется
Ширина запрещенной зоны DEз
• Кремний DЕз = 1,1 эВ; Германий DЕз = 0,7 эВ
6.
2. Алмазоподобные полупроводники• а) Cоединения типа AIIIBV - cоединения элементов III группы (Al, Ga, In)
с элементами V группы (P, As, Sb) -, например, GaAs, InSb, GaP, InP и т.п.
Атомы III группы имеют по три валентных электрона, а атомы V
группы - по пять, таким образом, в соединении типа AIIIBV среднее число
валентных электронов, приходящихся на один атом - четыре.
За счет частичного перераспределения электронов, атомы А и В в
такой структуре оказываются разноименно заряженными. Поэтому связи
в кристаллах АIIIВV частично ковалентные, частично - ионные.
Ковалентная связь в них преобладает и определяет их структуру, в
результате чего данные кристаллы по многим свойствам являются
аналогами Ge и Si.
• б) Соединения типа АIIВVI - соединения элементов II и VI групп.
К ним относятся соединения типа ZnTe, ZnSe, CdTe, CdS и другие. В
этих соединениях на один атом также в среднем приходится по четыре
валентных электрона, но ионная связь в них более выражена.
7.
• 3. Элементы VI, V групп и их аналоги.Элементы VI группы Те и Se, известны ранее, чем Ge и Si, причем Se
ранее использовался в выпрямителях переменного тока и фотоэлементах.
Элементы V группы As, Sb, Bi - полуметаллы, по свойствам близкие к
полупроводникам. Их аналоги - соединения типа АIVВVI (PbS, PbSe, SnTe,
GeTe и т.п.), имеющие в среднем по 5 электронов на атом, - образуют одну
из важнейших групп полупроводников - приемники ИК излучения.
Соединения элементов VI группы (O, S, Se, Te) c элементами I-IV
групп являются полупроводниковыми структурами. Практически
используются Сu2O (купоросные выпрямители), Вi2Te3 (термоэлементы).
• 4. Соединения элементов VI группы с переходными металлами
Элементы Ti, V, Mn, Fe, Ni, Sm, Eu и другие.
В этих полупроводниках преобладает ионная связь. Большинство из
них обладает различной степенью магнитного упорядочения (магнитные
полупроводники).
• 5. Органические полупроводники.
К ним относятся органические красители, ароматические соединения,
полимеры с сопряженными связями и т.п. Органические полупроводники
существуют в виде монокристаллов, поликристаллических или аморфных
порошков и пленок.
8.
Общие сведения об электронныхоболочках изолированных атомов
Согласно квантовой модели атомов состояние электрона в изолированных атомах
характеризуется четырьмя квантовыми числами.
Главное квантовое число n (n = 1,2,3 ....) определяет порядковый номер разрешенной
оболочки и энергию оболочки (энергетический уровень электрона, который может
находиться на данной оболочке).
Орбитальное квантовое число l (l = 0,1,..., (n – 1)) определяет форму оболочки, момент
количества движения ( момент импульса, механический момент, спин) оболочки и его
проекцию на некоторое направление, например, на направление внешнего магнитного поля,
в зависимости от значения n.
Магнитное квантовое число m (m = 0, ±1, ±2, ... ±l) определяет величину магнитного
момента оболочки и ее проекцию на некоторое направление внешнего поля.
Спиновое квантовое число s (s = ±1/2) выражает собственный момент количества движения
электрона (спин).
В зависимости от порядкового номера элемента в периодической таблице и величины
заряда ядра атомы имеют разное количество электронов на оболочках.
Совокупность электронов, обладающих одним и тем же значением квантового числа n,
образует слой: K-слой - n = 1; L-слой – n = 2; M-слой – n = 3 и т.д.
Электроны в одном слое имеют одно и то же значение энергии E(n), определяемое
величиной n.
9.
Строение электронных оболочекизолированных атомов
В каждом из слоев (K, L, M ...) электроны могут быть в различных состояниях,
т.е. могут образовывать различные электронные оболочки, характеризуемые
орбитальными квантовыми числами: l = 0 - s-оболочка, l = 1 - p-оболочка, l = 2
- d-оболочка, l = 3 - f-оболочка и т.д.
Количество электронов Ne , которые находятся в том или ином слое (n =
сonst), но имеют различные значения l и m, может быть рассчитано с учетом
возможных изменений l и m:
Ne = n2
(1.2)
Из соотношения (1.2) следует, что в произвольном слое со значением n
имеется n2 cостояний с различными значениями энергии электронов.
Учитывая принцип Паули, согласно которому в состоянии с одними и теми же
значениями n, l, m в атоме может быть не более двух электронов (s = +1/2 и s
= –1/2), можно полагать, что число электронов в слое с одним значением n
может быть не более
Nе = N(l, m) = 2n2.
(1.3)
Например, максимальное количество (число) электронов в слое К: Nе = 2; в
слое L: Nе = 8; в слое M: Nе = 18 электронов, в слое N: Nе = 32 электронов.
10.
Строение электронных оболочекреальных атомов группы IV
• Энергетические уровни изолированных атомов описываются:
С (1s22s22p2),
Si (1s22s22p63s23p2), Ge (1s22s22p63s23p63d104s24p2).
.
Графическое изображение изолированных энергетических уровней
атомов C и Si . На оси ординат откладывается значение энергии E
электронов (обычно в эВ), ось абсцисс - безразмерная.
11.
Потенциальная энергиявзаимодействия электрона и ядра
где e - относительная диэлектрическая
проницаемость; r - расстояние от электрона до
ядра; e0 - диэлектрическая постоянная;
е – заряд электрона
Для германия e = 16; кремния e = 12.
Связанный с ядром электрон находится в
потенциальной яме, по мере удаления
электрона от ядра, его энергия возрастает,
оставаясь отрицательной. При удалении
электрона на "бесконечное " расстояние,
энергия взаимодействия ядра и электрона
стремится к нулю.
re(r) - распределение электронной плотности электрона вблизи ядра,
которая характеризует вероятность обнаружения валентного электрона
на 3s-оболочке.
Для ионизации атома (отрыва валентного электрона, находящегося на
уровне 3s1) необходима энергия Wi - энергия ионизации атома (эВ).
12.
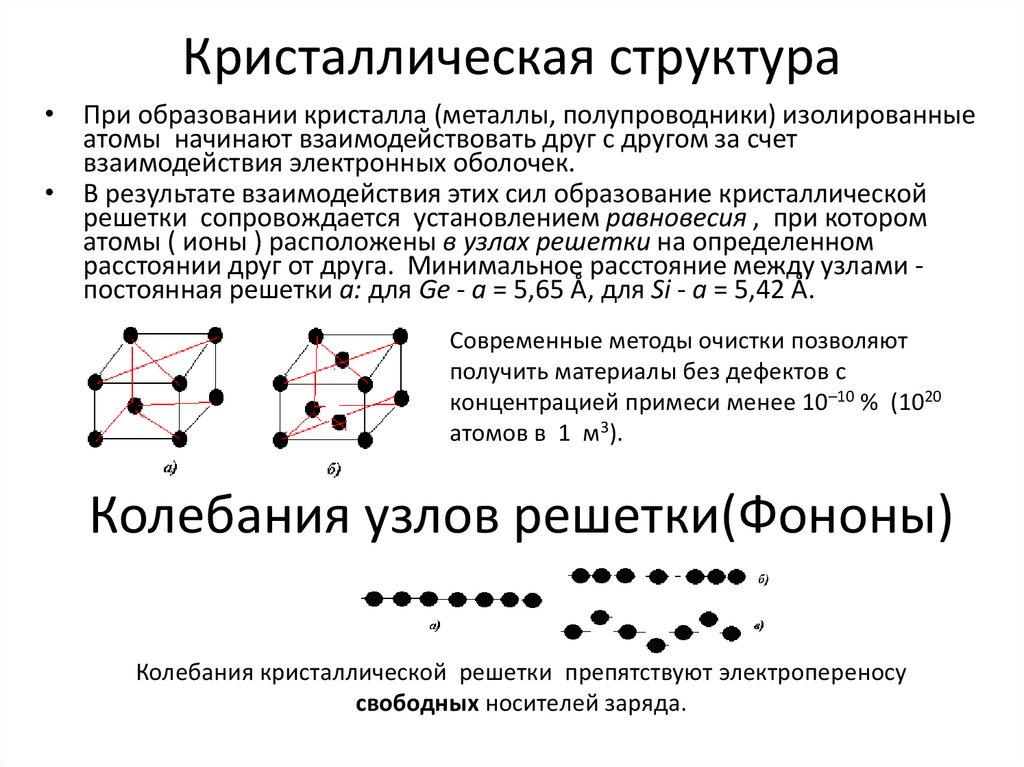
Кристаллическая структура• При образовании кристалла (металлы, полупроводники) изолированные
атомы начинают взаимодействовать друг с другом за счет
взаимодействия электронных оболочек.
• В результате взаимодействия этих сил образование кристаллической
решетки сопровождается установлением равновесия , при котором
атомы ( ионы ) расположены в узлах решетки на определенном
расстоянии друг от друга. Минимальное расстояние между узлами постоянная решетки а: для Ge - a = 5,65 Å, для Si - a = 5,42 Å.
Современные методы очистки позволяют
получить материалы без дефектов с
концентрацией примеси менее 10–10 % (1020
атомов в 1 м3).
Колебания узлов решетки(Фононы)
Колебания кристаллической решетки препятствуют электропереносу
свободных носителей заряда.










 physics
physics








