Similar presentations:
Биохимия. Ферменты
1.
БиохимияКафедра «Биотехнология и технология продуктов
биоорганического синтеза»
Доцент, к.б.н. Суслянок Георгий Михайлович
2.
ФерментыФерменты (энзимы) — это биологические катализаторы белковой
природы.
Ферменты образуются и функционируют в любой живой клетке,
обеспечивая высокую скорость протекания биохимических
процессов. В одной клетке может содержаться до 1000 различных
ферментов, катализирующих всевозможные реакции расщепления
молекул различных веществ, запасания и преобразования
химической энергии, построения из простых соединений
разнообразных макромолекул, входящих в состав клетки.
3.
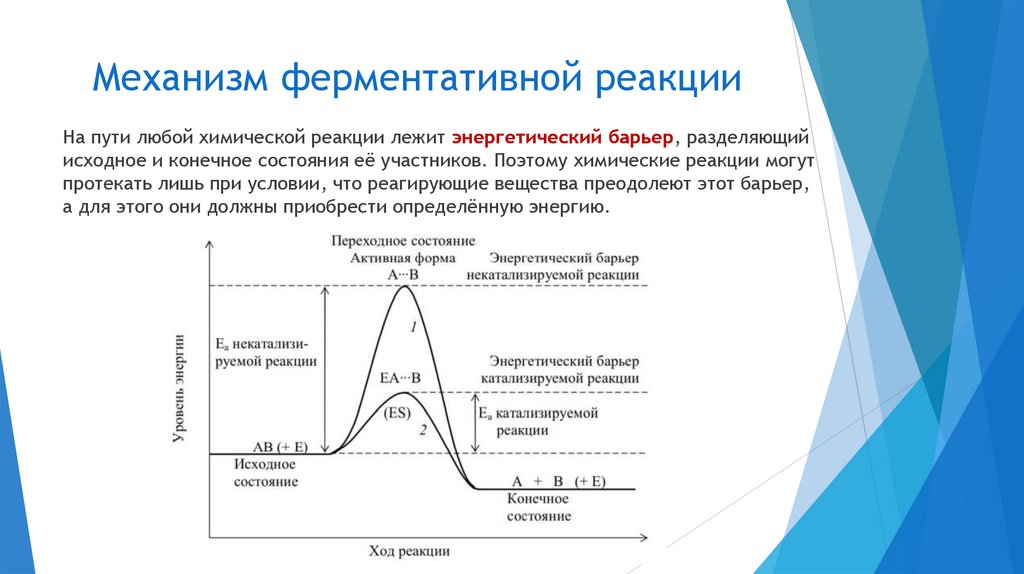
Механизм ферментативной реакцииНа пути любой химической реакции лежит энергетический барьер, разделяющий
исходное и конечное состояния её участников. Поэтому химические реакции могут
протекать лишь при условии, что реагирующие вещества преодолеют этот барьер,
а для этого они должны приобрести определённую энергию.
4.
Преодоление энергетическогопорога реакции
Повысить скорость химической реакции можно двумя путями:
повышением температуры, т. е. ускорением теплового движения
молекул, которое приводит к увеличению доли молекул, обладающих
достаточной энергией для достижения вершины энергетического барьера.
Как правило, повышение температуры на 10 °С вызывает ускорение
химической реакции приблизительно в два раза.
снижением необходимой величины энергии активации путём добавления
катализатора. Именно этот способ и был реализован живой природой за
счёт использования биологических катализаторов — ферментов, т. к.
реакции с их участием не требуют больших дополнительных затрат
энергии.
5.
Общее уравнениеферментативного катализа
Любая ферментативная реакция протекает в два этапа. На первом этапе
молекула фермента Е взаимодействует с молекулой исходного соединения,
называемого субстратом S, в результате чего образуется фермент-субстратный
комплекс ЕS. Затем комплекс ЕS может распадаться на фермент Е и субстрат S
или на фермент Е и продукты реакции Р. Как правило, условия в клетке таковы,
что равновесие биохимических превращений сдвинуто в сторону образования
продуктов реакции. Этот процесс можно описать следующим уравнением,
называемым общим уравнением ферментативного катализа:
Е — фермент
ES — фермент-субстратный комплекс
S — субстрат
P — продукт реакции
6.
Снижение энергии активацииСнижение энергии активации в условиях ферментативного катализа
объясняется тем, что при образовании промежуточного ферментсубстратного комплекса происходит некоторая деформация молекулы
субстрата, вследствие чего в нём ослабевают внутримолекулярные
связи и молекула становится более реакционноспособной. Таким
образом, понижение энергии активации происходит в момент
образования промежуточного соединения фермента с субстратом
вследствие деформации последнего.
Говорят, что фермент направляет реакцию обходным путём.
Фактически он катализирует другую реакцию, для которой требуется
меньшая энергия активации.
7.
Особенности ферментов какбиологических катализаторов
1. Мощная сила каталитического действия.
Снижение катализаторами энергии активации, необходимой для
разложения Н2О2 на воду и кислород
8.
Особенности ферментов какбиологических катализаторов
(продолжение)
2. Специфичность действия.
Небиологические катализаторы универсальные,
а ферменты — высокоспецифичные катализаторы.
Представление о необходимости строгого структурного соответствия друг
другу участников образования промежуточного комплекса ЕS нашло
отражение в образном выражении Э. Г. Фишера о том, что активный центр
фермента соответствует своему субстрату как ключ — замку.
9.
Особенности ферментов какбиологических катализаторов
(продолжение)
Д. Кошландом было высказано предположение, что строгое структурное
соответствие активного центра фермента субстрату возникает лишь в момент
их взаимодействия. Пока фермент находится в изоляции от субстрата, его
активный центр лишь приблизительно комплементарен субстрату, полная же
комплементарность возникает лишь при образовании промежуточного
комплекса ES. Это положение было подтверждено экспериментально и
получило название теории индуцированного (лат. “inductio” — возбуждение)
соответствия, согласно которой активный центр фермента соответствует
субстрату также как резиновая перчатка — кисти руки.
10.
Особенности ферментов какбиологических катализаторов
(продолжение)
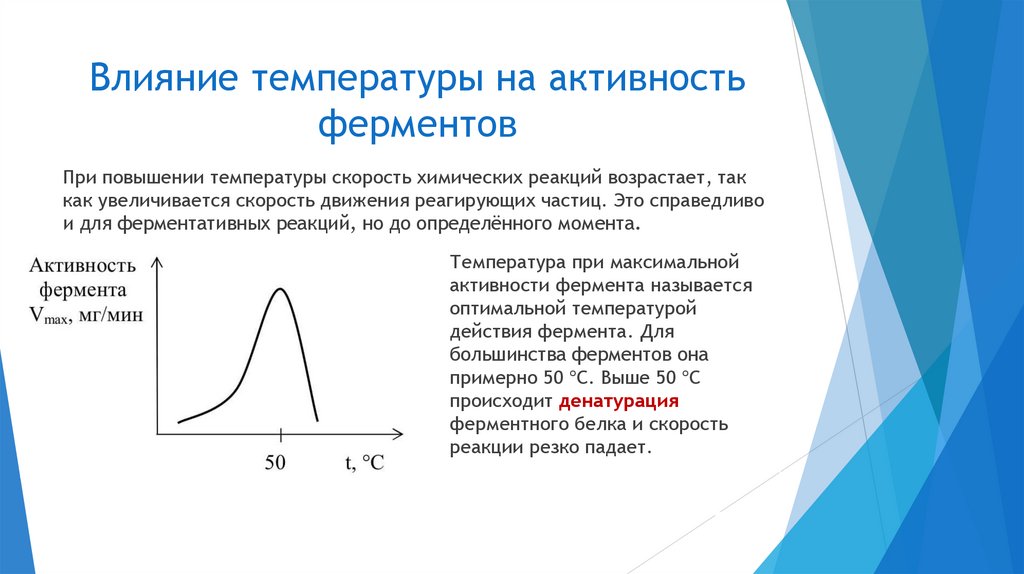
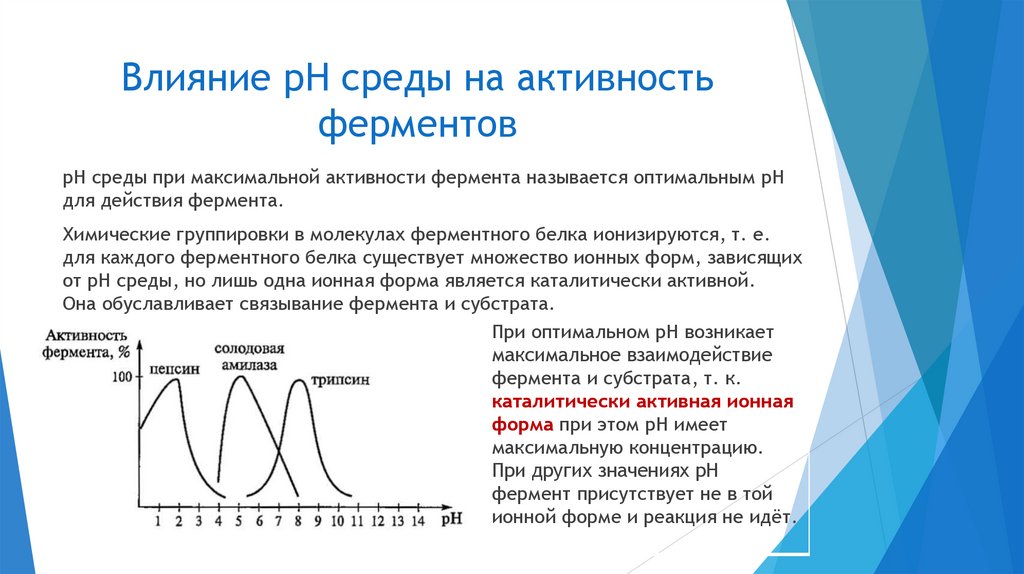
3. Лабильность (неустойчивость).
На активность фермента влияют:
температура
pH среды
химические вещества, присутствующие в среде
11.
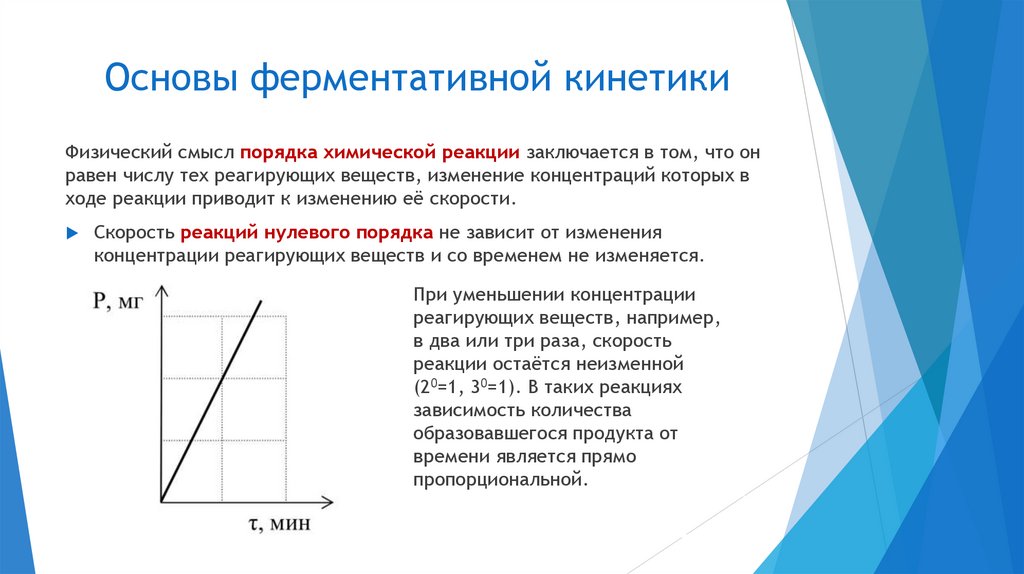
Основы ферментативной кинетикиФизический смысл порядка химической реакции заключается в том, что он
равен числу тех реагирующих веществ, изменение концентраций которых в
ходе реакции приводит к изменению её скорости.
Скорость реакций нулевого порядка не зависит от изменения
концентрации реагирующих веществ и со временем не изменяется.
При уменьшении концентрации
реагирующих веществ, например,
в два или три раза, скорость
реакции остаётся неизменной
(20=1, 30=1). В таких реакциях
зависимость количества
образовавшегося продукта от
времени является прямо
пропорциональной.
12.
Основы ферментативной кинетики(продолжение)
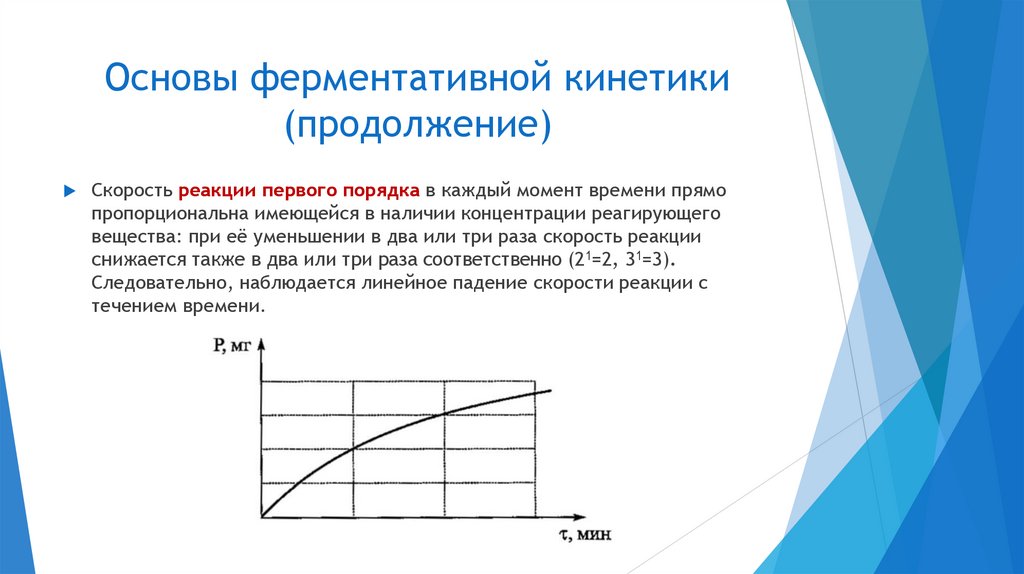
Скорость реакции первого порядка в каждый момент времени прямо
пропорциональна имеющейся в наличии концентрации реагирующего
вещества: при её уменьшении в два или три раза скорость реакции
снижается также в два или три раза соответственно (21=2, 31=3).
Следовательно, наблюдается линейное падение скорости реакции с
течением времени.
13.
Основы ферментативной кинетики(продолжение)
В случае реакций второго порядка при уменьшении концентраций
реагирующих веществ в два или три раза скорость реакции
снижается соответственно в четыре или девять раз (22=4, 32=9). В
этом случае наблюдается квадратичное падение скорости реакции
с течением времени.
Ферментативные реакции в начале своего протекания являются
реакциями нулевого порядка, а затем они приобретают характер
реакций первого или второго порядка. Т.е. ферментативные реакции
представляют собой реакции смешанного порядка, поэтому их ход
во времени не может быть описан одним математическим
уравнением.
14.
Факторы, замедляющие скоростьферментативной реакции
Уменьшение концентрации субстрата, который расходуется в ходе
реакции.
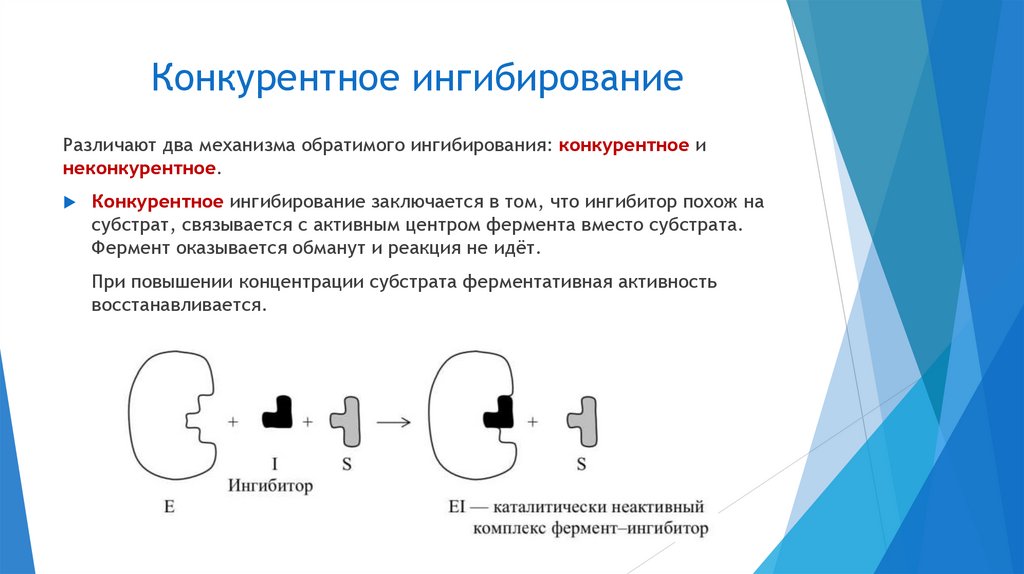
Специфическое торможение продуктами реакции, которые являются
ингибиторами фермента, катализирующего данную реакцию.
Неспецифическое торможение по закону действующих масс.
Частичная тепловая инактивация фермента в ходе реакции.
15.
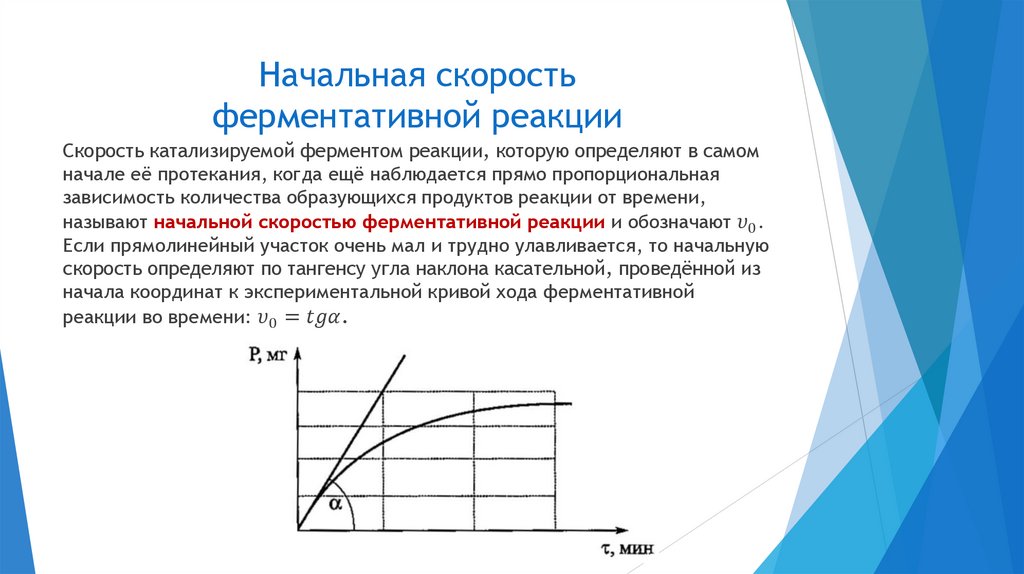
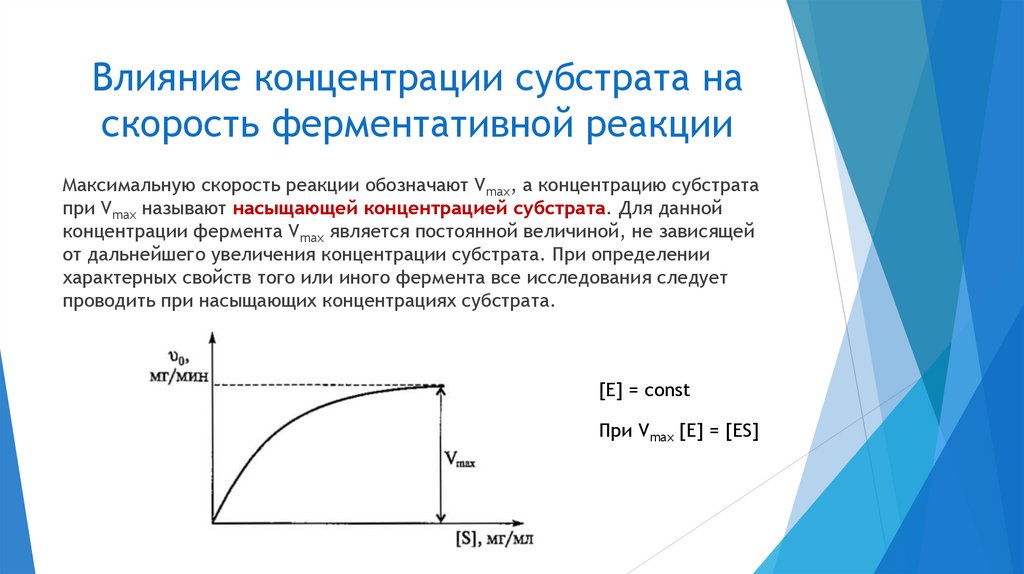
Начальная скоростьферментативной реакции
Скорость катализируемой ферментом реакции, которую определяют в самом
начале её протекания, когда ещё наблюдается прямо пропорциональная
зависимость количества образующихся продуктов реакции от времени,
называют начальной скоростью ферментативной реакции и обозначают















































 chemistry
chemistry








