Similar presentations:
Химия s-элементов. Лекция 12
1.
Лекция 12Химия s-элементов
Рассматриваемые вопросы:
1. Элементы главных подгрупп I и II групп
2. Свойства атомов s-элементов
3. Кристаллические решетки металлов
4. Свойства простых веществ — щелочных и щелочноземельных
металлов
5. Распространенность s-элементов в природе
6. Получение ЩМ и ЩЗМ
7. Свойства соединений s-элементов
8. Водород — особый элемент
9. Изотопы водорода. Свойства атомарного водорода.
10. Получение и свойства водорода. Образование химической
связи.
11. Водородная связь.
12. Пероксид водорода — строение, свойства.
2.
Вопросы к коллоквиуму «Химия элементов»s-элементы
1. Положение s-элементов в ПСХЭ. Валентные электроны и валентные
орбитали. Общая электронная конфигурация элементов 1 и 2 группы.
Изменение в подгруппе радиусов, энергий ионизации, сродства к электрону и
электроотрицательности. Щелочные и щелочноземельные металлы, магний,
бериллий: изменение кислотно-основных свойств их гидроксидов в подгруппе
и периоде. Чем объясняется амфотерность бериллия и его соединений?
2. Особенности химии лития. Приведите не менее четырех примеров реакций,
отличающих свойства лития и его соединений от свойств соединений других
элементов 1А-подгруппы. Качественные реакции на катион лития.
3. Химические свойства s-металлов: сгорание, взаимодействие неметаллами,
водой, кислотами, спиртами. Получение. Распознавание соединений sэлементов по окраске пламени. Почему данное распознавание возможно для
соединений s-элементов?
4. Взаимодействуют ли между собой гидроксиды бериллия и калия, магния и
натрия? Почему? Приведите пример возможной реакции.
Качественные реакции на катион натрия.
Качественные реакции на катион магния.
Качественные реакции на катионы щелочноземельных металлов.
5. Оксиды и гидроксиды щелочных и щелочноземельных металлов:
получение, характер свойства. Отношение к нагреванию. Качественные
реакции на катион аммония.
3.
Элементы главных подгрупп I и II групп —s-элементы
S-элементы — это элементы, у которых
заполняются внешние s-оболочки:
IA-группа — ns1- H, Li, Na, K, Rb, Cs, Fr
IIA-группа — ns2- Be, Mg, Ca, Sr, Ba, Ra
4.
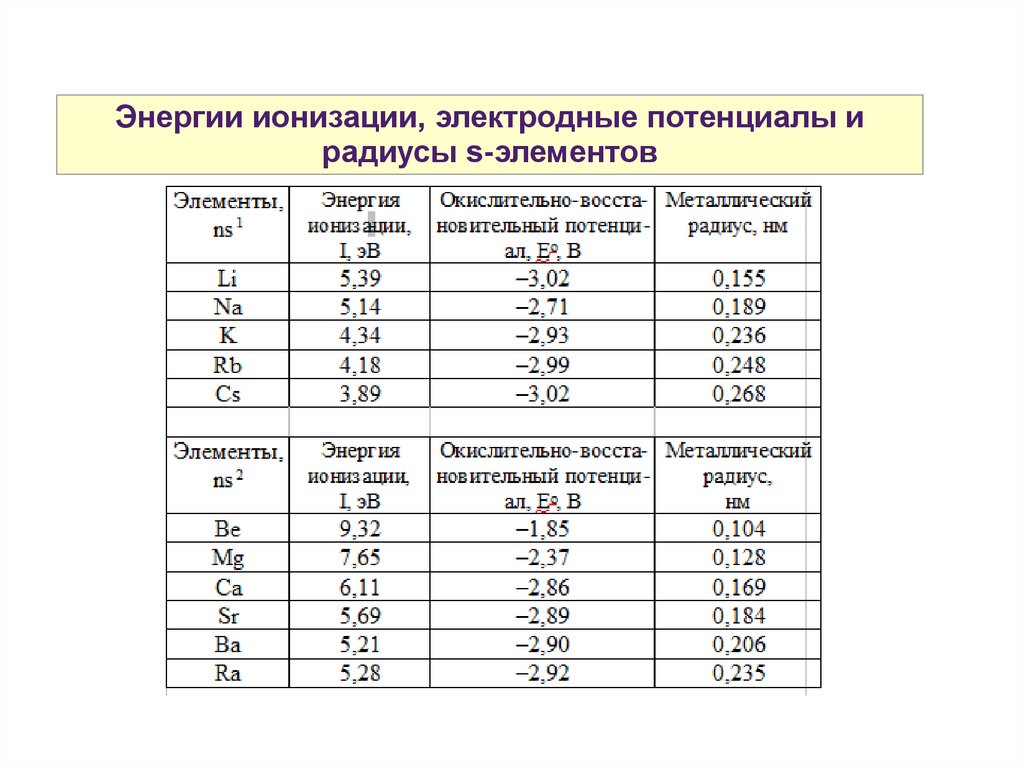
Энергии ионизации, электродные потенциалы ирадиусы s-элементов
5.
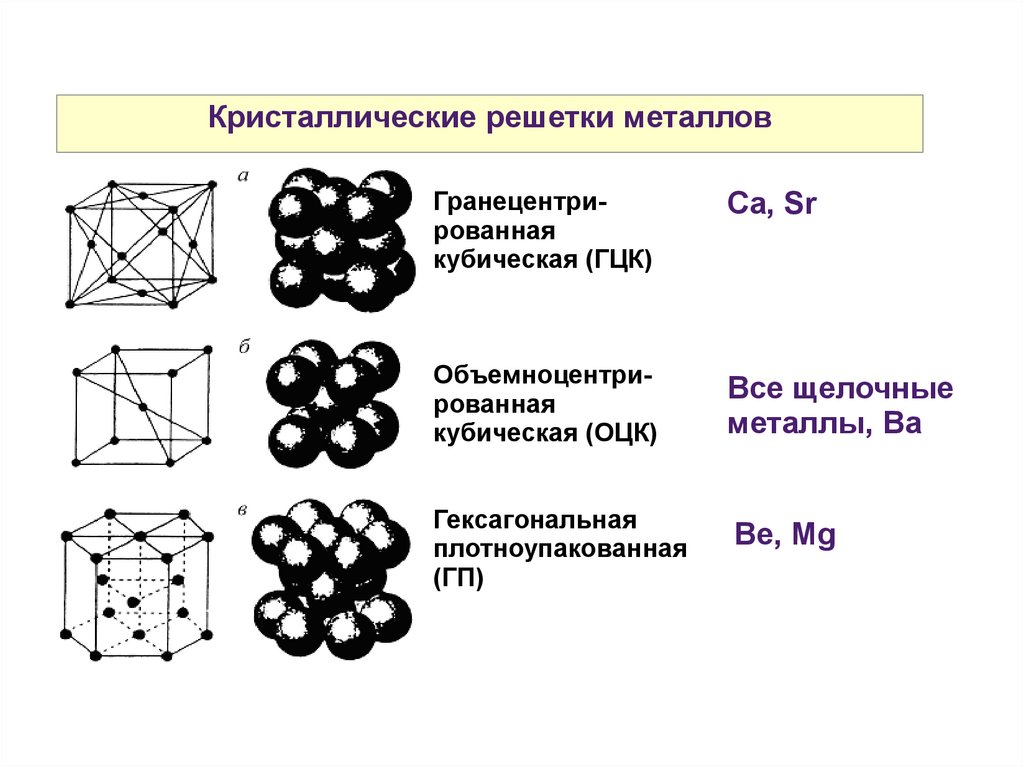
Кристаллические решетки металловГранецентрированная
кубическая (ГЦК)
Ca, Sr
Объемноцентрированная
кубическая (ОЦК)
Все щелочные
металлы, Ba
Гексагональная
плотноупакованная
(ГП)
Be, Mg
6.
Щелочные металлы — простые веществаЛитий
tºплав = 181°C
ρ = 0,53 г/см3
Натрий
tºплав = 98°C
ρ = 0,97 г/см3
Калий
tºплав = 64°C
ρ = 0,86 г/см3
Рубидий
tºплав = 39°C
Ρ = 1,53 г/см3
Цезий
tºплав = 28°C
Ρ = 1,87 г/см3
7.
Щелочноземельные металлы — простые веществаБериллий
tºплав = 1278°C
Ρ = 1,85 г/см3
Магний
tºплав = 649°C
Ρ = 1,74 г/см3
Барий
tºплав = 729°C
Ρ = 3,59 г/см3
Кальций
tºплав = 839°C
Ρ = 1,55 г/см3
Стронций
tºплав = 769°C
Ρ = 2,54 г/см3
Радий
tºплав = 973°C
Ρ = 5,5 г/см3
8.
Химические свойства s-металлов1. На свежем разрезе поверхность блестящая, при нахождении а
воздухе быстро тускнеет.
2. Горят в атмосфере воздуха, образуя оксиды одного или
нескольких типов: IA-группа — Me2O, Me2O2, MeO2; IIA-группа — MeO,
MeO2.
9.
Химические свойства s-металлов3. Оксиды натрия и др. ЩМ, могут быть получены только при нагревании
смеси пероксида кислорода (гидроксида или нитрата Ме) с избытком
металла в отсутствие кислорода:
4. Все, за исключением Be, при нагревании взаимодействуют с сухим H2
образуя гидриды. Связь в гидридах близка к ионной.
Ионные гидриды при попадании в воду бурно и необратимо
гидролизуются с выделением H2. Это единственный случай, когда
гидролиз протекает ка ОВР:
Гидриды s-металлов имеют ионное строение, высокие t°пл, называются
,
2
солеподобными
из-за сходства с галогенидами. Их расплавы являются
электролитами.
10.
Химические свойства s-металлов5. Все металлы подгруппы взаимодействуют с Hal2, S, P образуя
соответственно галогениды, сульфиды, фосфиды.
С N2 и С при обычных условиях или небольшом нагревании
реагируют только Li и Na. Остальные – только в электрическом
разряде. N2,
Фосфиды, нитриды и карбиды ЩМ и ЩЗМ реагируют с водой и кислотами
без изменения степеней окисления атомов: необратимый гидролиз
11.
Химические свойства s-металлов6.
12.
Химические свойства s-металлов7. С обычными минеральными и органическими кислотами все
s-металлы реагируют бурно, щелочные - со взрывом, образуя соли и
вытесняя H2.
8. HNO3 восстанавливают до N2 и NH4NO3
H2SO4 c ω > 50% - до S и H2S
13.
Химические свойства s-металлов9. Взаимодействие со щелочами для типичных металлов не
характерно, но бериллий – единственный из них амфотерный металл –
медленно реагирует с горячими концентрированными растворами
щелочей или с расплавами:
Элементы второго периода каждой группы, как правило, отличаются по
свойствам от остальных элементов. Поэтому свойства элементов
лития и бериллия, а так же их соединений, имеют некоторые
особенности.
14.
Химические свойства s-металлов10. Соединения IIA подгруппы – гидроксиды, карбонаты – термически
неустойчивы, IA подгруппы (кроме Li) – плавятся без разложения.
Нитраты термически неустойчивы всегда, но разлагаются при
нагревании в соответствии с разными схемами.
Соединения Li ведут себя подобно соединениям Mg (диагональное
сходство в ПСХЭ)
15.
Химические свойства s-металлов11. Оксиды и гидроксиды ЩМ, ЩЗМ и Mg имеют ярко выраженный
основный характер: образуют только катионные производные:
взаимодействуют с веществами кислотной и амфотерной природы с
образованием солей:
Оксиды ЩМ и ЩЗМ растворяются в воде с образованием сильных
оснований – щелочей:
Оксид магния растворяется только в горячей воде, оксид бериллия в
воде нерастворим.
16.
Особенности химии литияLi — труднее всех окисляется, единственный дает оксид.
Ион Li+ имеет R min, поэтому обладает максимальным
поляризующим действием, в воде наиболее гидратирован.
Соединения лития менее термически устойчивы, чем аналогичные
соединения других ЩМ.
17.
Особенности химии литияРяд солей лития имеет небольшую растворимость LiF, Li2CO3, Li3PO4
Только у лития есть непрочные комплексы.
Только литий при об. усл. реагирует с N2.
Li используется в производстве легких алюминиевых сплавов.
Соли лития используются в ХИТ.
LiOH (M=24 г/моль) на ед. массы — лучший поглотитель СО2.
Работы по разделению изотопов лития
и
были засекречены.
18.
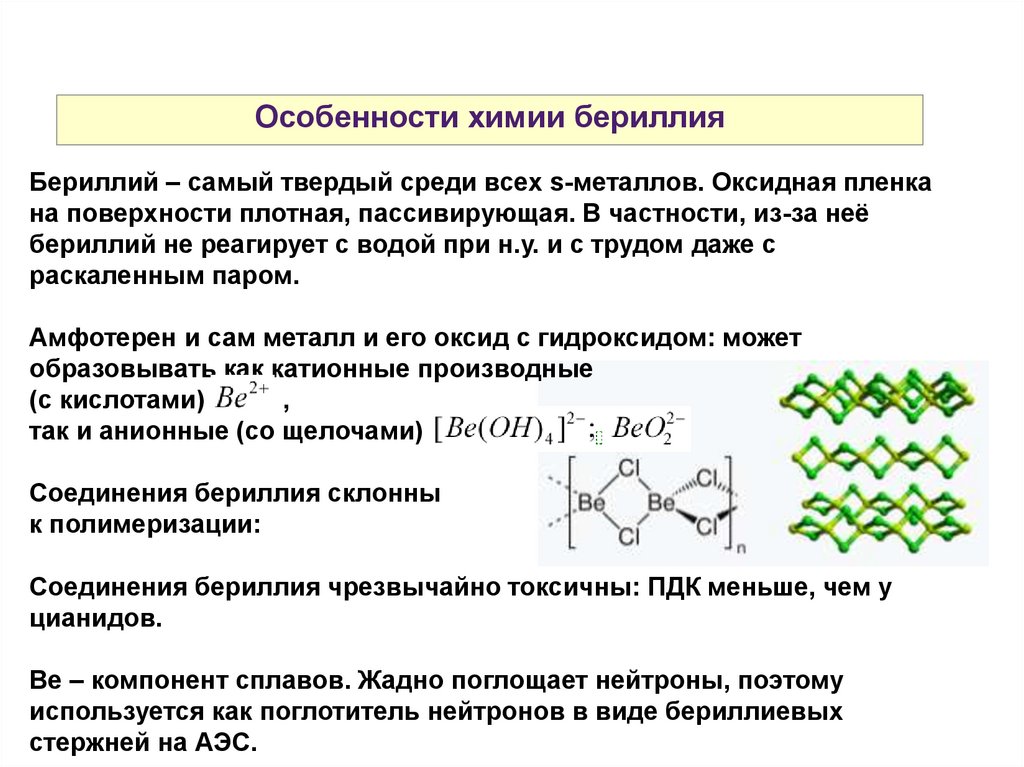
Особенности химии бериллияБериллий – самый твердый среди всех s-металлов. Оксидная пленка
на поверхности плотная, пассивирующая. В частности, из-за неё
бериллий не реагирует с водой при н.у. и с трудом даже с
раскаленным паром.
Амфотерен и сам металл и его оксид с гидроксидом: может
образовывать как катионные производные
(с кислотами)
,
так и анионные (со щелочами) .
Соединения бериллия склонны
к полимеризации:
Соединения бериллия чрезвычайно токсичны: ПДК меньше, чем у
цианидов.
Be – компонент сплавов. Жадно поглощает нейтроны, поэтому
используется как поглотитель нейтронов в виде бериллиевых
стержней на АЭС.
19.
Наиболее распространенные соединения элементовIA группы
NaOH — едкий натр, каустическая сода.
Мировое производство ≈ 25 млн.т.
электролиз
2NaCl + 2H2O
=> 2NaOH + H2 + Cl2
Na2CO3 – сода. Получают методом Сольве:
1) NaCl + NH3 + CO2 + H2O => NH4Cl + NaHCO3↓
2) 2NaHCO3 => Na2CO3 + CO2 + H2O - кальцинирование
NaOH, Na2CO3 – нейтрализация промышленных стоков, моющие,
чистящие средства.
Na – восстановитель в ряде процессов (Na–термия), контур
охлаждения ядерного реактора.
Сs – в производстве фотоэлементов.
KCl, KNO3 – минеральные удобрения
20.
Распространенность в природе s-металловВ природе встречаются исключительно в виде
соединений!
Сподумен
LiAl(Si2O6)
Галит NaCl
Сильвинит КCl
А также карналлит KCl·MgCl2·6H2O , лунный камень
K[AlSi3O8], глауберова соль Na2SO4 · 10H2O и многие
другие.
21.
Распространенность в природе s-металловРубидий и цезий — рассеянные элементы, не образуют
самостоятельных минералов, а входят в минералы в
виде примесей.
Основные минералы пегматит,
поллуцит..
22.
Распространенность в природе s-металловБериллий → бериллы: изумруд, аквамарин, морганит,
гелиодор и др...
Изумруд
Be3Al2Si6O18
Аквамарин
Be3Al2Si6O18
Гелиодор
Be3Al2Si6O18
23.
Распространенность в природе s-металловЦелестин
SrSO4
Стронцианит
SrCO3
Барит
ВaSO4
Витерит
ВaСO3
24.
Распространенность в природе s-металловMg2+
Ca2+
Na+
и другие...
K+
25.
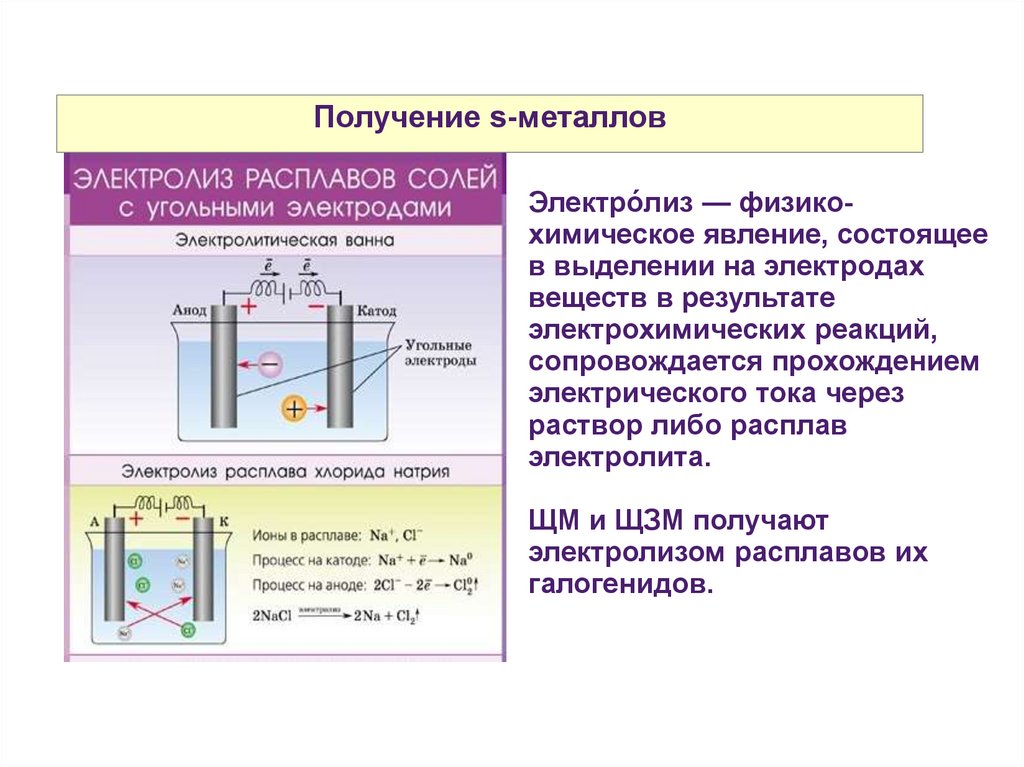
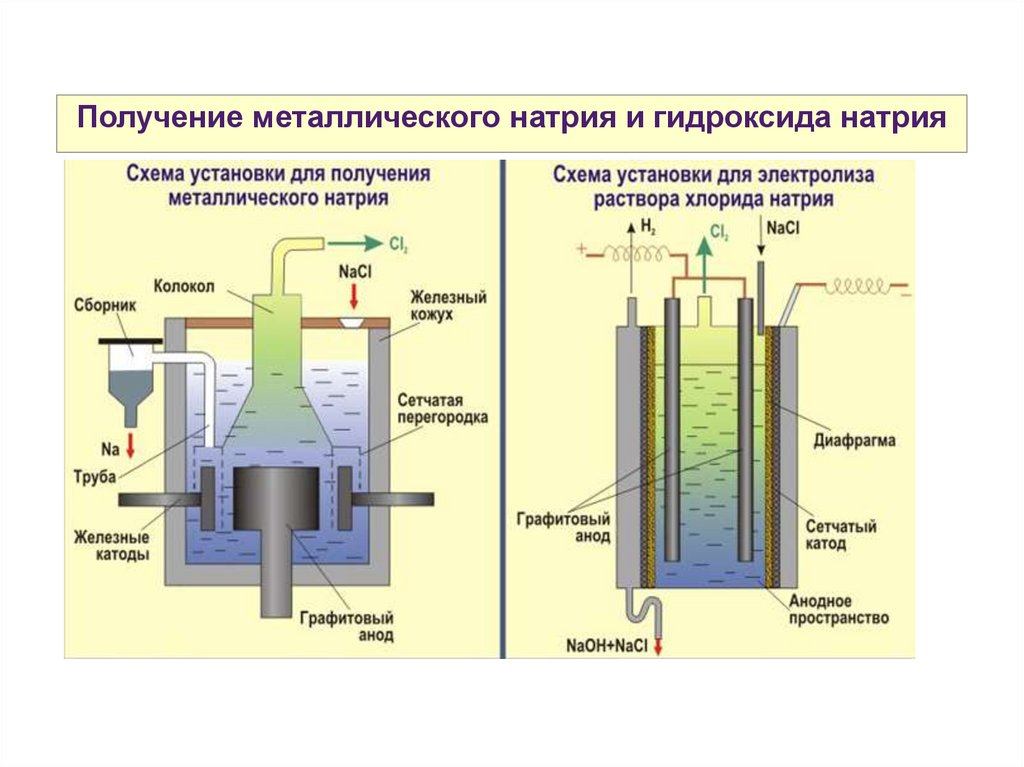
Получение s-металловЭлектро́лиз — физикохимическое явление, состоящее
в выделении на электродах
веществ в результате
электрохимических реакций,
сопровождается прохождением
электрического тока через
раствор либо расплав
электролита.
ЩМ и ЩЗМ получают
электролизом расплавов их
галогенидов.
26.
Получение металлического натрия и гидроксида натрия27.
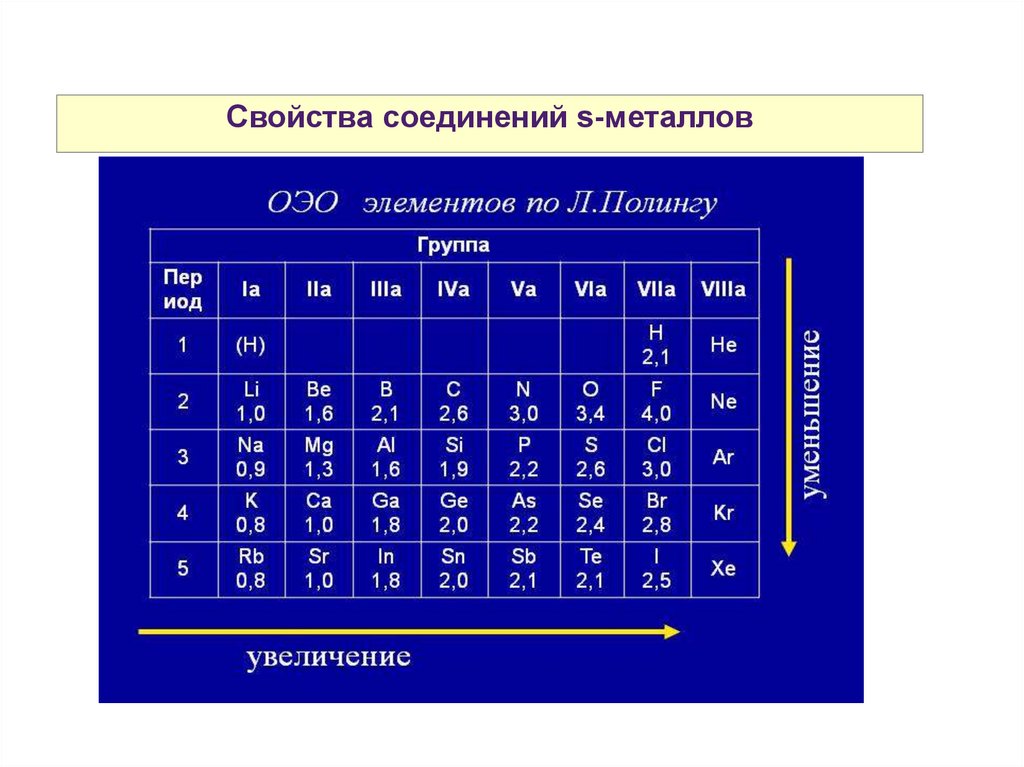
Свойства соединений s-металлов28.
Свойства соединений s-металловВследствие низких значение EI атомы ЩМ и ЩЗМ и их
соединения легко ионизуются и при внесении в пламя
окрашивают его в разные цвета.
29.
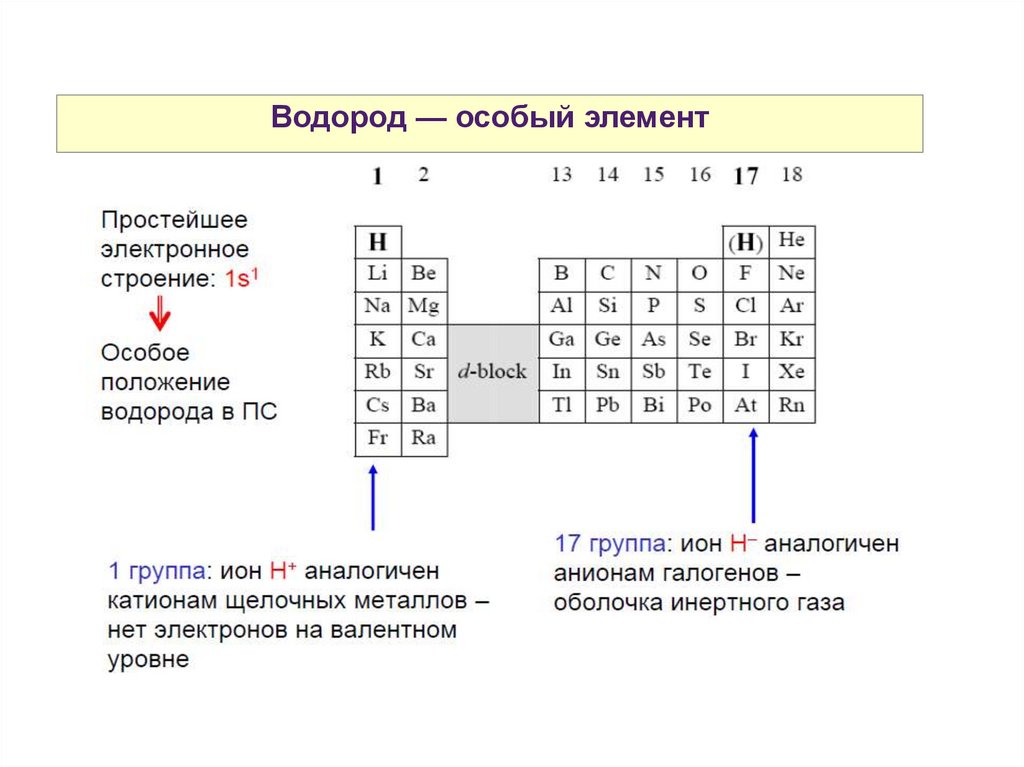
Водород — особый элемент30.
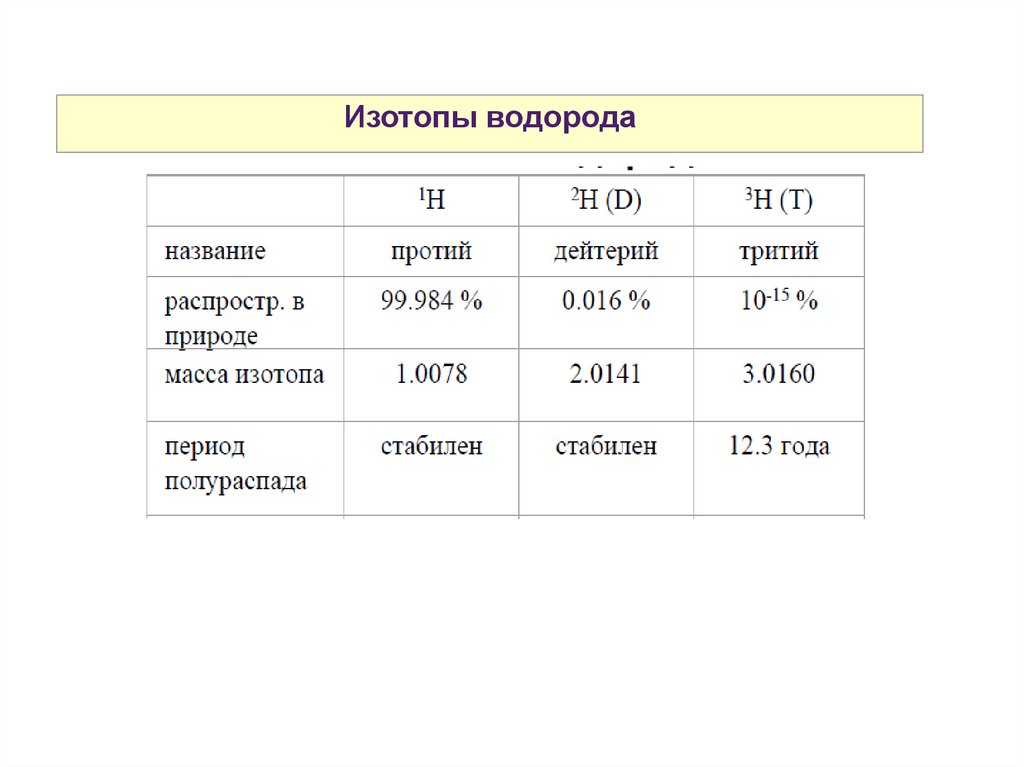
Изотопы водорода31.
Изотопы водорода32.
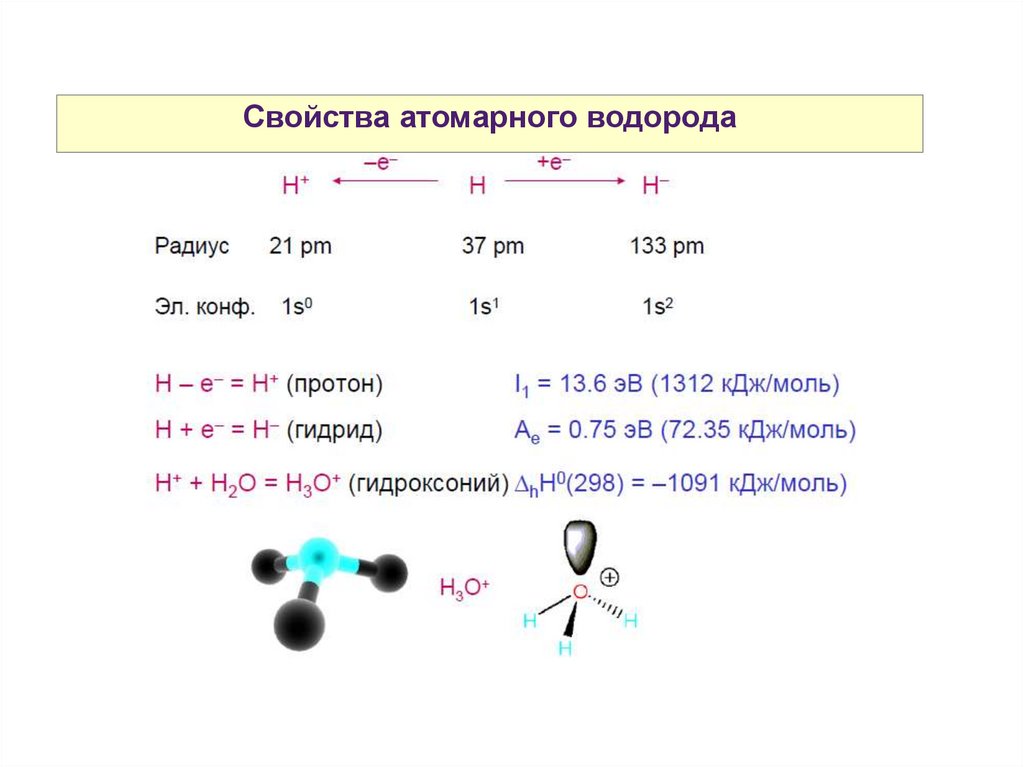
Свойства атомарного водорода33.
Получение и свойства водорода34.
Получение и свойства водорода35.
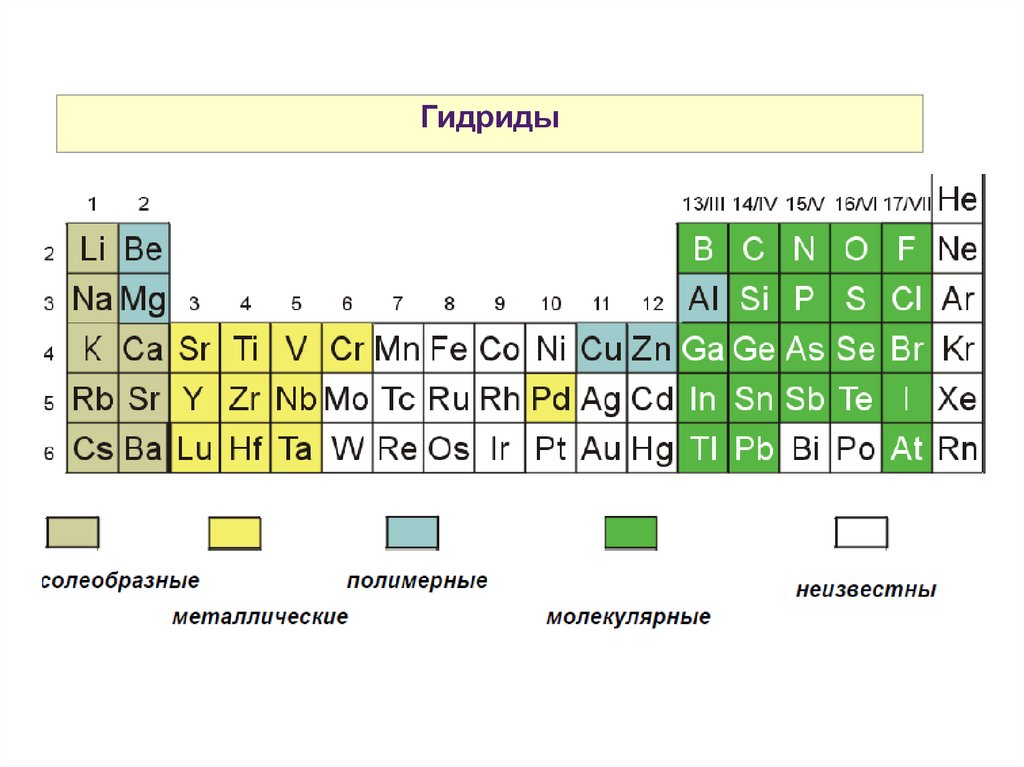
Гидриды36.
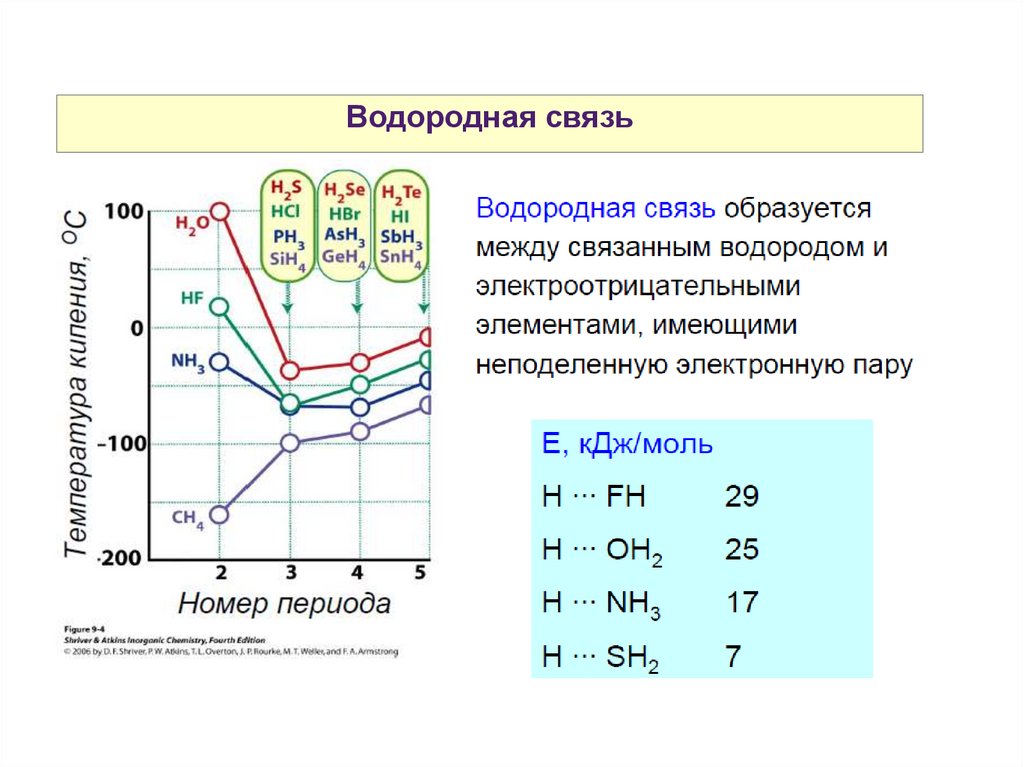
Водородная связь37.
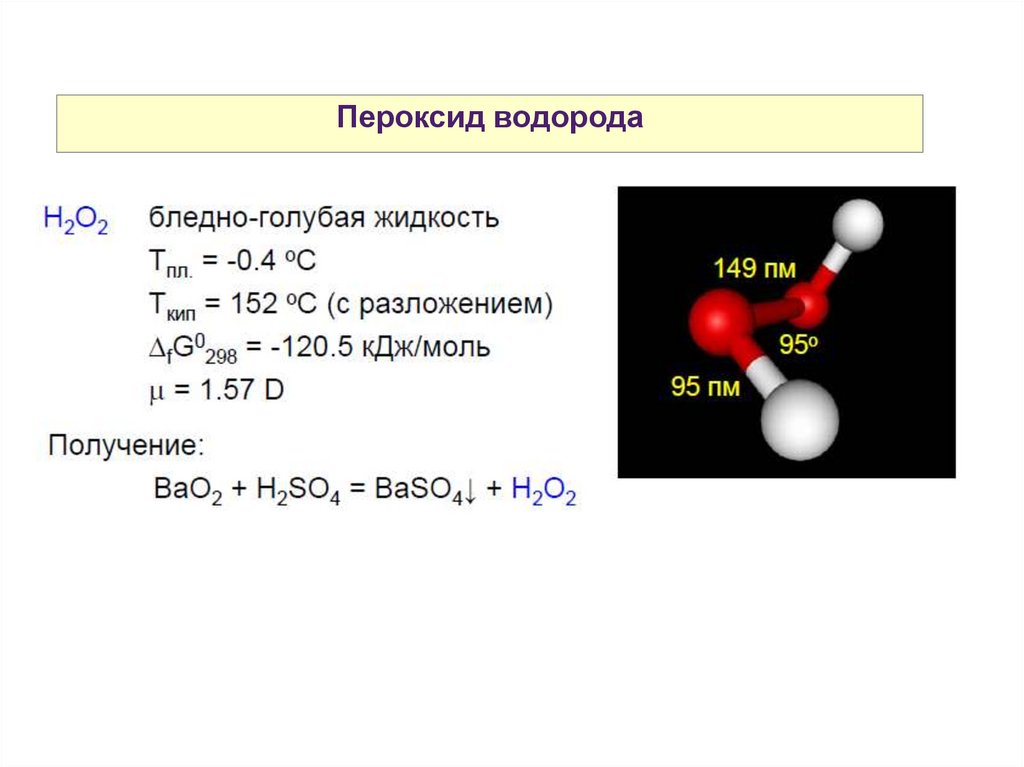
Пероксид водорода38.
Пероксид водорода39.
Спасибоза внимание!



























 chemistry
chemistry








